不可分型流感嗜血桿菌脂肽P4誘導氣道上皮細胞分泌黏蛋白的機制
, , ,,
(1.南華大學附屬第一醫院急診科,衡陽 421001;2.南華大學附屬第二醫院急診科)
·基礎醫學·
不可分型流感嗜血桿菌脂肽P4誘導氣道上皮細胞分泌黏蛋白的機制
王劍1,李旎2*,李晶2,周定耕2,王彪2
(1.南華大學附屬第一醫院急診科,衡陽 421001;2.南華大學附屬第二醫院急診科)
目的研究不可分型流感嗜血桿菌脂肽P4誘導氣道上皮細胞分泌黏蛋白MUC5AC的作用及機制。方法培養人氣道上皮細胞NCI-H292,用不同濃度的P4孵育細胞,檢測粘蛋白5AC(MUC5AC)的分泌及mRNA表達、ROS的產生及腫瘤壞死因子α轉化酶(TACE)的活性;分析Duox1 p47phox和P67phox亞基亞細胞轉位和表皮生長因子受體(EGFR)的磷酸化。結果0、30、50和100 ng/mL P4作用NCI-H292細胞24 h后,可誘導其分泌MUC5AC并表達其mRNA,并促進p47phox和P67phox亞基轉位至細胞膜、增高細胞內ROS的含量,同時可上調TACE的酶活性及誘導EGFR磷酸化。NADPH氧化酶抑制劑可抑制ROS產生;而ROS抑制劑處理則可降低TACE的酶活性;沉默TACE表達后可抑制EGFR磷酸化,而EGFR抑制劑處理可降低MUC5AC分泌。結論P4經Duox1/ROS/TACE/ EGFR誘導人NCI-H292細胞分泌MUC5AC。
不可分型流感嗜血桿菌; 脂肽P4; 表皮生長因子受體; 腫瘤壞死因子α轉化酶; 粘蛋白5AC
不可分型流感嗜血桿菌(nontypeableHaemophilus,NTHi)是定植于鼻咽和后口咽上呼吸道的一種無莢膜革蘭陰性多形桿菌,當機體免疫力降低時,寄居于兒童鼻咽部的NTHi可通過咽鼓管到達中耳,導致急性中耳炎[1]。而成人則可引起慢性支氣管炎以及COPD急性發作[2]。因此,開展NTHi的致病機制研究,對防治NTHi的相關疾病或并發癥具有重要意義。NTHi缺乏莢膜,細菌的脂蛋白在NTHi的致病過程中發揮重要作用。P4蛋白是幾乎存在于所有流感嗜血桿菌菌株中(含NTHi)高度保守的一種外膜蛋白。研究表明,P4蛋白錨定于外膜上,并在NTHi的致病過程中發揮重要作用[3]。NTHi感染后,最顯著的特征是誘導呼吸道上皮細胞過度分泌黏液。在氣道黏液中,黏蛋白5AC (MUC5AC)是主要的分泌型黏蛋白,由杯狀細胞分泌,它主要存在于氣道表面上皮細胞層,在器官與主支氣管中表達較多,而在細支氣管(<1mm)以及肺上皮細胞中無表達[4]。黏蛋白作為固有免疫系統的一道非特異性屏障,在維持氣道功能等方面發揮重要作用[5]。但在某些病理條件,黏液的過度分泌可引起呼吸道管腔阻塞、引發嚴重的氣流受限,從而導致呼吸道反復感染[6]。研究證實,NTHi感染機體后可上調氣道上皮細胞分泌MUC5AC,從而參與與支氣管哮喘和COPD急性發作。但這些研究多局限于以NTHi為整體作為研究對象,而對于NTHi菌體上的外膜蛋白在MUC5AC的分泌中發揮何種作用目前尚不明確。本研究旨在觀察NTHi膜脂蛋白P4對MUC5AC分泌有無影響,并初步探討其機制。
1 材料與方法
1.1主要實驗材料NTHi脂肽P4購自德國Microcollections ,MUC5AC ELISA檢測試劑盒購自R&D Systems。鼠抗人表皮生長因子受體(EGFR)抗體(磷酸化及非磷酸化)購自Cell signaling。Apocynin、AG1478購自Calbiochem。二亞苯基碘(DPI)、N-乙酰-半胱氨酸(NAC)、2′,7′-二氯二氫熒光黃二乙酸酯(H2DCFDA)以及腫瘤壞死因子α轉化酶(TACE)抑制劑TAPI購自Sigma-Adrich。TACE活性檢測試劑盒購自Anaspec。鼠抗人p47phox及兔抗人p67phox抗體,鼠抗人β-actin抗體以及HRP標記兔抗鼠IgG抗體購自Santa Cruz,Duox1和TACE siRNA由廣州RiboBio Co.Ltd合成。
1.2細胞培養人氣道上皮細胞NCI-H292 (ATCC,Manassas,VA)采用含有10%胎牛血清,1%葡萄糖,1%谷氨酰胺,100 U/mL青霉素和100 μg/mL鏈霉素的RPMI-1640基中,置于含5% CO2的恒溫培養箱中37℃條件下培養。
1.3實時定量PCR 采用GE公司提供的試劑盒提取細胞總RNA(RNA Spin Mini RNAisolation kits,Buckkinghamshire,UK),隨后獲取1μg RNA將其逆轉錄為cDNA。將cDNA、SYBR Green Master Mix、引物等反應體系置于實時定量PCR儀(Chromo4,Bio-Rad)上對基因進行擴增。擴增條件為:95 ℃ 5 min,隨后進入40個循環:95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s。本文所用的引物為:5′-CCTTCGACGGACAGAGCTAC-3′(正向)和5′-TCTCGGTGACAACACGAAAG -3′(反向);GAPDH:5′-CAATGACCCCTTCATTGACC-3′ (正向)和5′-GATCTCGCT CCTGGAAGATG-3′。根據靶基因與內參GAPDH的ΔCt值計算MUC5AC的相對表達倍數。
1.4 ELISA 細胞處理結束后,獲取NCI-H292細胞測定其分泌至培養上清中的MUC5AC濃度,其檢測方法按照試劑盒提供的雙抗體夾心法進行,最后根據標準曲線計算MUC5AC的總量。
1.5 Western blot 按照參考文獻提供的方法提取細胞膜蛋白[7],即,將細胞重懸浮于含有蛋白酶抑制劑的relaxation buffer 中(100 mM KCl、3 mM NaCl、3.5 mM MgCl2、1 mM EGTA、10 mM Hepes、0.5 mM phenylmethylsulfonyl fluoride)。經超聲破碎后,4 ℃ 600×g 離心10 min以去除細胞核即未破碎細胞.獲取上清液后4 ℃100,000×g超速離心30 min,繼續用relaxation buffer 重懸浮沉淀并充分震蕩后再次4 ℃100,000×g超速離心30 min,上清即為細胞膜成分。細胞總蛋白的提取按參考文獻提供的方法進行[8]。所獲取的膜蛋白或總蛋白通過測定其濃度后,獲取50 μg蛋白在12%濃度的分離膠中進行SDS-PAGE,電泳結束后將其轉印至硝酸纖維素膜上,并用5%牛血清白蛋白室溫封閉2 h,最后分別加入相應一抗以及二抗,化學發光、顯影(Amersham Bioscience,NJ,USA)。
1.6分子探針檢測ROS產生NCI-H292細胞處理完畢后,PBS洗滌1次,隨后加入H2DCFDA染液(5 μmol/L)室溫下避光孵育30min,每隔10min輕微震蕩1次,使探針和細胞充分作用。孵育結束后800 rpm離心洗滌3次以去除未結合的殘余的探針。在熒光酶標儀(Synergy HT,Bio-Tec)下測定細胞內的熒光強度,并計算其熒光相對強度(激發波長485 nm,發射波長530 nm)。
1.7轉染與RNA干擾將約105個NCI-H292細胞接種于6孔板中過夜培養。隨后按照廠家提供的實驗步驟加入終濃度為10nmol/L的Lipofectamine RNAiMax (Invitrogen) 試劑將siRNA轉染至細胞中。本研究所用的siRNA按照參考文獻提供的序列合成[7],其中Duox1的干擾序列為:5′-GGACUUAUCCUGGCUAGAGTT-3′(正義鏈)和5′-CUCUAGCCAGGAUAAGUCCTG-3′(反義鏈);TACE的干擾序列為:5′-GGUUUUAAAGGCUAUGGAATT-3′(正義鏈)和5′-UUCCAUAGCCUUUAAAACCTG-3′(反義鏈)。
1.8 TACE活性分析采用熒光共振能量轉移法間接測定TACE的酶活性,其步驟按照試劑盒的方法進行。在該試劑盒中提供了一種底物QXLTM520/ 5-FAM,TACE能特異性切割該底物,從而使熒光分子5-FAM無法被QXLTM520淬滅,其熒光強度與TACE的活性成正比,通過測定器熒光強度間接測定TACE的活性(激發波長490nm,發射波長520nm),結果以相對活性表示。
1.9統計學方法所有計量資料以均數±標準差表示,并使用GraphPad Prizm 6.0統計軟件(San Diego,CA)分析數據,組間比較采用單因素方差分析,P<0.05為差異具有統計學意義。
2 結 果
2.1 NTHi P4對NCI-H292細胞分泌表達MUC5AC的影響ELISA結果顯示,陽性對照組采用5 ng/mL LPS處理后,MUC5AC分泌水平較高。而用不同濃度脂肽P4處理后,隨著P4濃度的遞增,MUC5AC分泌水平逐漸增多,當P4濃度為100 ng/mL時,MUC5AC高達(439.65±18.57)ng/mL(圖1A)。實時定量PCR也顯示:不同濃度的P4脂肽處理細胞后,對MUC5AC mRNA的誘導情況有所不同,隨著P4濃度的遞增,MUC5AC mRNA的表達水平逐漸增多(圖1B)。

圖1 不同濃度P4誘導NCI-H292細胞表達分泌MUC5AC的影響A:細胞分泌MUC5AC蛋白;B:細胞表達mRNA。與陰性對照組(0 ng/mL)相比,*P<0.05,**:P<0.01。
2.2 Duox1/ROS參與MUC5AC分泌圖2A所示,30~50 ng/mL P4處理后可顯著誘導提高細胞內ROS水平(圖2A),也可明顯促進NOX酶體(催化ROS產生的關鍵酶)的p47phox和p67phox亞基從細胞漿轉位至細胞膜(圖2B),表明P4可激活NOX。而采用1mmol/L NOX抑制劑(抑制NOX酶體組裝)Apocynin處理后,可顯著抑制p47phox和p67phox的轉位以及ROS的產生(圖2A、B)。而采用siRNA干擾Duox1(NOX亞型)表達后,NCI-H292細胞中ROS的水平明顯減少(圖2C),同時伴有MUC5AC的降低(圖2D),表明P4誘導ROS產生以及MUC5AC分泌與激活NOX家族中Duox1有關。此外,采用ROS抑制劑NAC預處理細胞后,發現MUC5AC的分泌顯著降低(圖2E),表明MUC5AC分泌受ROS調控。
2.3 P4經ROS增強TACE活性用不同濃度P4處理NCI-H292細胞30 min后,結果顯示,隨著P4濃度的遞增,TACE的酶活性逐漸增高,當P4濃度為100 ng/mL時,TACE的酶活性增加了2.51倍(圖3A)。而采用siRNA干擾Duox1表達后,TACE的酶活性明顯降低(圖3B)。此外,采用不同濃度ROS抑制劑NAC預處后也得到了類似的結果(圖3C)。而采用TACE siRNA處理后,可明顯抑制P4誘導MUC5AC的分泌(圖3D)。
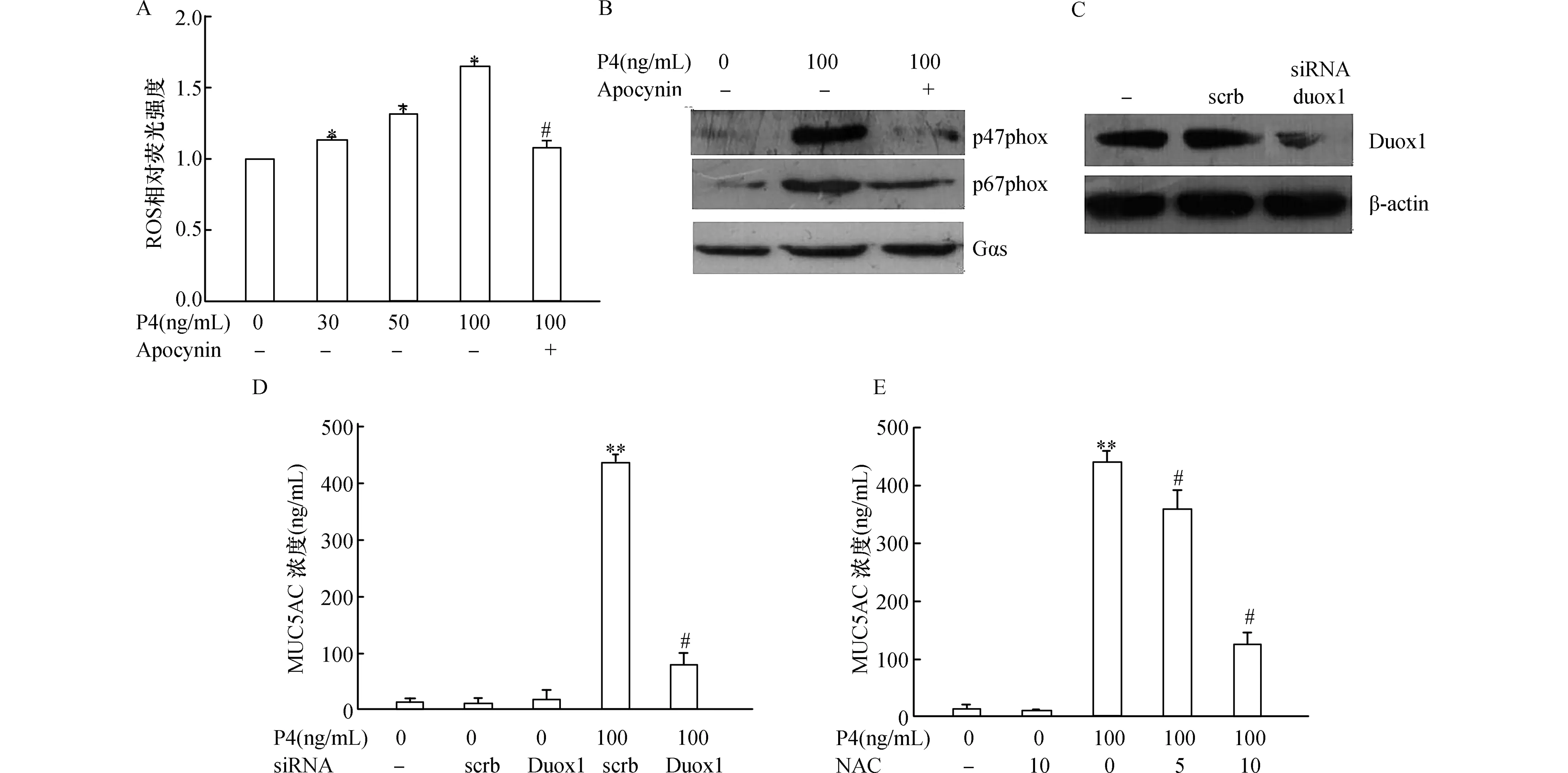
圖2 Duox1/ROS通路在介導MUC5AC分泌中的影響A:Apocynin對P4處理后ROS含量的影響。與0 ng/mL P4組相比,*:P<0.05,與100 ng/mL P4組相比,#:P<0.05;B:P4對NCI-H292細胞膜上p47phox和P67phox表達的影響,同時采用Gα蛋白(Gαs)作為內參;C:干擾Duox1表達后對ROS或MUC5AC分泌的影響,與對照siRNA(scrambled siRNA,scrb)組相比,*:P<0.05,**:P<0.01;Duoxi siRNA(D)或ROS抑制劑NAC(E)對MUC5AC分泌的影響。與0 ng/mL P4組相比,**:P<0.01,與100 ng/mL P4組相比,#:P<0.05。
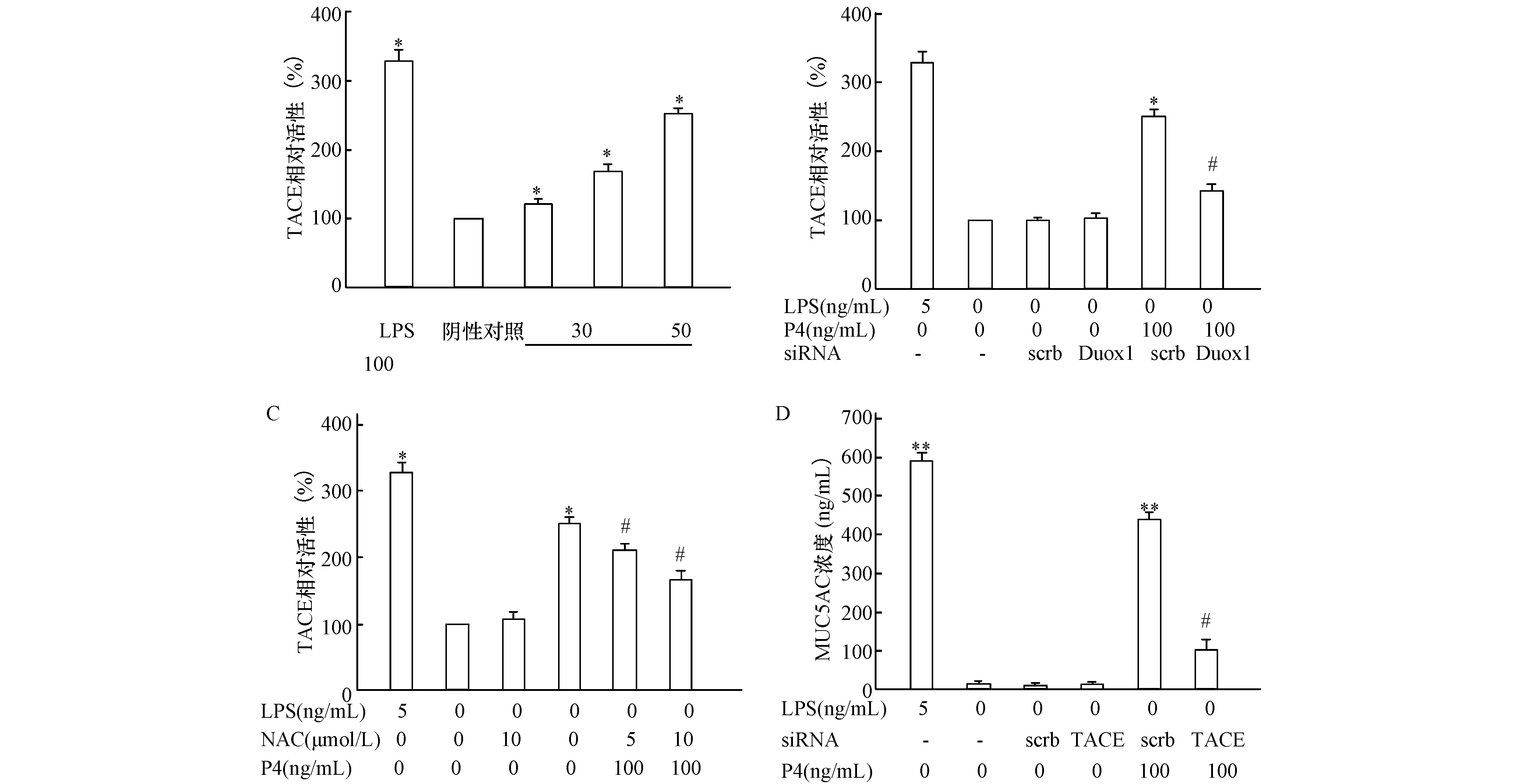
圖3 P4經ROS/TACE誘導MUC5AC分泌A:不同濃度P4對細胞上清中TACE酶活性的影響。與陰性對照組(0 ng/mL)相比,*:P<0.05;B:NCI-H292細胞轉染Duox1 siRNA后對TACE酶活性變化的影響。與scrb組相比,*:P<0.05,與100 ng/mL P4+scrb組相比,#:P<0.05;C:不同濃度ROS抑制劑NAC對TACE的酶活性的影響,與陰性對照組(0 ng/mL)相比,*:P<0.05;與100 ng/mL P4組相比,#:P<0.05。D:轉染TACE siRNA后對TACE酶活性變化的影響。與scrb組相比,**:P<0.01,與100 ng/mL P4+scrb組相比,#:P<0.05。
2.4 P4誘導MUC5AC分泌與EGFR激活有關不同濃度P4刺激鼻黏膜細胞0~1 h,細胞內磷酸化EGFR含量顯著增多,30~60 min后達到峰值。而采用10 μmol/L TACE抑制劑TAPI處理后,EGFR磷酸化水平明顯受到抑制(圖4A),而采用5 μg/mL EGFR中和抗體預處理細胞30 min后,結果發現可顯著下調MUC5AC的水平(圖4B),此外,EGFR 抑制劑AG-1478處理(10 μmol/L)也得到了類似結果(圖4C),以上結果表明EGFR的激活與MUC5AC分泌有關。

圖4 P4誘導MUC5AC分泌與EGFR激活有關A:P4刺激對EGFR的磷酸化的影響;B:EGFR中和抗體對細胞上清中MUC5AC含量的影響。與0 ng/mL P4組相比,**:P<0.01,與100 ng/mL P4組相比,#:P<0.05。C:EGFR抑制劑AG-1478對MUC5AC分泌的影響。與0 ng/mL P4組相比,**:P<0.01,與100 ng/mL P4組相比,#:P<0.05。
3 討 論
研究NTHi與宿主免疫系統相互作用,直接采用活菌感染細胞或提取其細胞膜成分作用于細胞更真實接近體內的實際情況,而本研究采用P4脂肽代替,其主要原因有兩方面:第一,NTHi在細胞培養基內生長速度和細胞生長速度不一致,難以控制感染復數。第二,提取細胞膜成分時,涉及到NTHi的培養和去垢劑使用等多個環節,大大增加了內毒素污染的幾率[9]。而氣道上皮細胞本身對內毒素非常敏感,一旦膜脂蛋白中混有內毒素,很難用常規手段去除[9]。由于細菌膜脂蛋白發揮免疫刺激活性主要取決于其N末端的Pam3-Cys結構而非氨基酸序列,而基于其N端通用結構人工合成的P4具有幾乎所有膜脂蛋白的致炎活性[10],因此可作為NTHi膜脂蛋白的替代品而被本研究所采用。
調控MUC5AC分泌的分子眾多,但不同的刺激因素所激活的信號通路有所不同。EGFR是一種跨膜型酪氨酸激酶,分子量170 KD。其胞外區可與多種配體結合,隨后可由單體轉化為二聚體,其胞內區具有激酶活性,可誘導下游多種底物磷酸化。本研究也證實,NCI-H292細胞在靜息狀態下,EGFR磷酸化水平極低,而給予100 ng/mL P4作用30 min后即可誘導EGFR磷酸化,并持續至2h以上。隨后采用EGFR激酶抑制劑AG1478處理,或者采用EGFR特異性中和抗體封閉其受體表位后,MUC5AC的產生均受到明顯抑制。這說明EGFR信號通路參與了P4作用后MUC5AC的表達,且該過程依賴于配體和EGFR的結合。
EGFR與相應的配體(如TGF-α)結合后,可活化其胞內區域促進MUC5AC分泌。研究表明,香煙提取物、革蘭陰性細菌的LPS都是通過這種機制激活EGFR誘導黏蛋白MUC5AC表達上調[11]。EGFR常見的配體分子包括雙向調節蛋白、表皮調節素、肝素結合生長因子和TGF-α等。在這一過程中,TACE發揮了關鍵作用。TACE屬于金屬水解蛋白家族的膜結合型整合素樣金屬蛋白酶,它可促進前體TGF-α分子的成熟,后者隨后可與EGFR通過配體—受體相互作用而誘導EGFR磷酸化[12]。本研究當中,我們也發現P4作用NCI-H292細胞30min后即可增高TACE的酶活性,而采用TACE siRNA處理后,可明顯抑制P4誘導MUC5AC的分泌,此外,TACE抑制劑TAPI處理后也能抑制EGFR的磷酸化,這表明P4通過TACE/EGFR促進MUC5AC的分泌。
本研究證實,P4處理后30min后,即可顯著上調細胞內ROS的水平,采用ROS抑制劑處理后,TACE活性明顯降低,這表明TACE上游的激活有賴于ROS的產生。而ROS的產生又受NOX家族蛋白Duox的調控。Duox由一個膜結合細胞色素b558,gp91phox和p22phox以及4個胞漿成分p47phox,p67phox,p40phox和Rac1/2組成,其中gp91phox是其催化核心部分,有研究表明,Duox1在LPS誘導的MUC5AC分泌中發揮重要作用[13]。本研究也發現,P4處理NCI-H292細胞后可促進Duox1的裝配,即p47phox和p67phox轉位至細胞膜上,從與gp91phox等而形成具有催化功能的酶復合體。而采用siRNA沉默其表達,或采用抑制NOX酶體組裝的抑制劑Apocynin處理后,ROS的分泌以及MUC5AC的產生明顯減少,以上結果表明P4誘導MUC5AC的分泌受Duox1/ROS/TACE通路的調控。
總之,本研究證實P4可誘導氣道上皮細胞分泌MUC5AC。這表明NTHi感染后,可能通過促進MUC5AC的過度分泌而加重某些阻塞性疾病的病情。若氣道內炎癥狀態持續存在,黏液合成進一步增多,隨后又有利于病原菌定植,從而形成惡性循環,加速病情惡化[14]。既然P4脂肽在NTHi中發揮重要作用,同時P4也具備了良好的免疫原性與抗原性,并且在疫苗的研制當中體現出了良好的效果[15],從這種意義上講,以P4為分子靶標的藥物開發,有望為NTHi感染后的防控提供新的思路。
[1] Collins S,Litt DJ,Flynn S,et al.Neonatal invasive Haemophilus influenzae disease in England and Wales:epidemiology,clinical characteristics,and outcome[J].Clin Infect Dis,2015,60(12):1786-1792.
[2] Finney LJ,Ritchie A,Pollard E,et al.Lower airway colonization and inflammatory response in COPD:a focus on Haemophilus influenzae[J].Int J Chron Obstruct Pulmon Dis,2014,9:1119-1132.
[3] Su YC,Mukherjee O,Singh B,et al.Haemophilus influenzae P4 interacts with extracellular matrix proteins promoting adhesion and serum resistance[J].J Infect Dis,2016,213(2):314-323.
[4] Roy MG,Livraghi-Butrico A,Fletcher AA,et al.Muc5b is required for airway defence[J].Nature,2014,505(7483):412-416.
[5] Plotkowski MC,Bajolet-Laudinat O,Puchelle E.Cellular and molecular mechanisms of bacterial adhesion to respiratory mucosa[J].Eur Respir J,1993,6(6):903-916.
[6] Chillappagari S,Preuss J,Licht S,et al.Altered protease and antiprotease balance during a COPD exacerbation contributes to mucus obstruction[J].Respir Res,2015,16(1):85.
[7] Shao MX,Nadel JA.Dual oxidase 1-dependent MUC5AC mucin expression in cultured human airway epithelial cells[J].Proc Natl Acad Sci U S A,2005,102(3):767-772.
[8] Dickinson JD,Alevy Y,Malvin NP,et al.IL13 activates autophagy to regulate secretion in airway epithelial cells[J].Autophagy,2016,12(2):397-409.
[9] Magalhaes PO,Lopes AM,Mazzola PG,et al.Methods of endotoxin removal from biological preparations:a review[J].J Pharm Pharm Sci,2007,10(3):388-404.
[10] Green BA,Baranyi E,Reilly TJ,et al.Certain site-directed,nonenzymatically active mutants of the Haemophilus influenzae P4 lipoprotein are able to elicit bactericidal antibodies[J].Infect Immun,2005,73(7):4454-4457.
[11] Zhang Y,Zhu M,Yang Z,et al.The human Cathelicidin LL-37 induces MUC5AC mucin production by airway epithelial cells via TACE-TGF-alpha-EGFR pathway[J].Exp Lung Res,2014,40(7):333-342.
[12] Lisi S,D’Amore M,Sisto M.ADAM17 at the interface between inflammation and autoimmunity[J].Immunol Lett,2014,162(1 Pt A):159-169.
[13] Li W,Yan F,Zhou H,et al.P.aeruginosa lipopolysaccharide-induced MUC5AC and CLCA3 expression is partly through Duox1 in vitro and in vivo[J].PLoS One,2013,8(5):e63945.
[14] Schamberger AC,Staab-Weijnitz CA,Mise-Racek N,et al.Cigarette smoke alters primary human bronchial epithelial cell differentiation at the air-liquid interface[J].Sci Rep,2015,5:8163.
[15] Hotomi M,Ikeda Y,Suzumoto M,et al.A recombinant P4 protein of Haemophilus influenzae induces specific immune responses biologically active against nasopharyngeal colonization in mice after intranasal immunization[J].Vaccine,2005,23(10):1294-1300.
NontypeableHaemophiluslipopeptideP4inducesthesecretionofMUC5ACinairwayepithelialcells
WANG Jian,LI Ni,LI Jing,et al
(DepartmentofEmergencySurgery,TheFirstAffiliatedHospital,UniversityofSouthChina,Hengyang421001,HunanChina)
ObjectiveTo underly the mechanism of the effect ofNontypeableHaemophiluslipopeptideP4 on the secretion of MUC5AC in airway epithelial cells.MethodsHuman airway epithelial cell line NCI-H292 was incubated with different concentration of P4.The concentrations of secreted MUC5AC and the expression of MUC5AC mRNA,the production of reactive oxygen species (ROS) and the enzymatic activity of tumor necrosis factor-α converting enzyme (TACE) were tested.The cell membrane localization of p47phoxand P67phoxsubunits of Duox1 and the phosphorylation of epidermal growth factor receptor (EGFR) were anylized.Results30,50 and 100 ng/mL of P4 increased the expression and secretion of MUC5AC after 24 h of incubation In addition,P4 could induce the p47phox和P67phoxtranslocation from cytosol to plasma membrane and upregulate the intracellular ROS lever.Moreover,P4 could also promote the enzymatic activity of TACE and phosphorylation of EGFR.Pretreatment of the NADPH oxidase inhibitor significantly abrogated the ROS level,and ROS inhibitor could further decrease the enzymic activity of TACE,while silence of TACE could inhibit P4-induced EGFR phosphorylation.Furthermore,the EGFR inhibitor treatment could decrese the MUC5AC secretion.ConclusionP4 induces the expression and secretion of MUC5AC via Duox1/ROS/TACE/ EGFR signaling pathway in NCI-H292 cells.
nontypeable haemophilus; P4; epithelial growth factor receptor; tumor necrosis factor-α converting enzyme; MUC5AC
10.15972/j.cnki.43-1509/r.2017.04.003
2017-03-23;
2017-06-12
國家自然科學基金(編號:31500156);湖南省衛生廳科研基金(B2014-054).
*通訊作者,E-mail:lini1283@163.com.
R56
A
秦旭平)

