野菊花抗腫瘤活性部位篩選研究
,,,, ,,,,*
(1.南華大學藥物藥理研究所,湖南 衡陽 421001;2.湖南省分子靶標新藥研究協同創新中心)
·基礎醫學·
野菊花抗腫瘤活性部位篩選研究
全文婕1,史曉欣1,2,熊潤德1,張開2,喻翠云1,2,賀冬秀1,2*
(1.南華大學藥物藥理研究所,湖南 衡陽 421001;2.湖南省分子靶標新藥研究協同創新中心)
目的篩選野菊花的抗腫瘤活性部位并初步探討其機制。方法利用形態觀察、CCK-8、Hoechst染色和劃痕實驗評價野菊花總提取物(CIE)及其石油醚部位(PEE)、乙酸乙酯部位(EAE)、正丁醇部位提取物(NAE)對人肺癌細胞A549、人慢性骨髓性白血病細胞K562、人乳腺癌細胞MCF-7和人肝癌細胞HepG2的抗腫瘤活性。結果CIE及PEE、EAE、NAE>150 μg/mL對A549、K562和MCF-7細胞形態影響明顯且CIE及PEE、EAE、NAE(150~250 μg/mL)對上述三種細胞增殖抑制作用呈量效相關性,PEE對MCF-7細胞抑制效果最顯著;EAE對MCF-7細胞的誘導凋亡作用和遷移抑制作用相對較好。結論野菊花具有抗腫瘤活性,抗腫瘤活性較強的部位為石油醚和乙酸乙酯部位,其抗腫瘤機制可能與抑制細胞增殖、遷移和誘導細胞凋亡有關,這為進一步研究開發野菊花提供基礎。
野菊花; 腫瘤細胞; 抗腫瘤活性; 抗腫瘤活性部位
野菊花為菊科植物野菊(Chrysanthemum indicum L.)的干燥頭狀花序,別名為野黃菊花、苦薏、山菊花、甘菊花。中國藥典記載,野菊花性苦、辛、微寒,具有清熱解毒,瀉火平肝之功效。有學者認為在中醫辨證論治的指導下,野菊花可用于治療熱毒內盛所致的胰腺癌、鼻咽癌、肝癌、淋巴瘤和肺癌等[1]。現代藥理學研究證實,野菊花具有廣譜抗菌、消炎、抗病毒、抗腫瘤、抗衰老和增強免疫等多種藥理活性[2-3],有良好的臨床應用價值和研發潛力。國內研究發現,野菊花提取物能抑制髓原白血病細胞HL60和成骨肉瘤Saos-2等細胞增殖[4-5],同時可聯合順鉑誘導人骨肉瘤MG-63細胞凋亡[6]。近年研究還發現,野菊花不同極性部位提取物的藥理活性不同[7-8]。有關野菊花抗腫瘤作用報道少,對野菊花抗腫瘤活性部位的篩選也鮮有研究。因此,本文通過形態觀察法、CCK-8法、Hoechst染色和劃痕實驗評價野菊花不同極性部位提取物對人肺癌細胞株A549、人慢性骨髓性白血病細胞株K562、人乳腺癌細胞株MCF-7和人肝癌細胞株HepG2的抗腫瘤活性,并篩選出野菊花的最佳抗腫瘤活性部位,為進一步開發野菊花奠定基礎。
1 材料與方法
1.1藥材與試劑野菊花購自湖南省長沙市藥材公司;Gibco DMEM培養基購自美國Thermo Fisher科技公司;胎牛血清(FBS)、胰酶細胞消化液、青鏈霉素雙抗和CCK-8 試劑盒均購自浙江天杭生物公司;MTT購自美國Amresco生物公司;Hoechst 33342 染色試劑盒購于萬類生物科技公司;其它實驗試劑均為國產分析純。
1.2方法
1.2.1 野菊花總提取物(chrysanthemum indicum extract,CIE)、石油醚部位 (Petroleum ether extract,PEE)、乙酸乙酯部位(Ethyl acetate extract,EAE)、正丁醇部位提取物(N-butyl alcohol extract,NAE) 的制備 野菊花干燥,粉碎成粉,過40目藥篩。野菊花粉先以15倍量的70%乙醇浸泡65 ℃加熱回流提取1次、后以12倍量的70%乙醇提取1次,每次2 h。合并兩次濾液,減壓濃縮,冷凍干燥得野菊花總提物CIE。CIE加適量水使之分散,依次用石油醚、乙酸乙酯、正丁醇(水飽和)萃取,所得萃取物分別減壓蒸干,凍干得野菊花PEE、EAE及NAE。CIE、PEE、EAE及NAE以DMSO復溶制成0.1 g/mL(以提取物計)原液,0.22 μm濾膜過濾除菌,4 ℃避光密封保存備用。
1.2.2 細胞培養 采用DMEM+10%FBS+100 U/mL青鏈霉素雙抗培養基,置37 ℃、5% CO2、飽和濕度條件下培養,觀察細胞處于對數生長期即用于實驗。
1.2.3 倒置熒光顯微鏡觀察細胞形態 取對數生長期的各腫瘤細胞,制成濃度1.5×105個/mL懸液接種至6孔板,每孔2 mL。 培養24 h后加藥處理,使CIE、PEE、EAE及NAE的終濃度為150 μg/mL。繼續培養24 h,倒置熒光顯微鏡觀察。
1.2.4 CCK-8法評價細胞增殖抑制作用 取對數生長期的各腫瘤細胞,制成濃度5×105個/mL懸液接種至96孔板,每孔100 μL。CIE、PEE、EAE及NAE制備5個濃度: 250、200、150、100、50 μg/mL,同時設陰性對照組和空白對照組,每組復孔5個。培養24 h后加藥,藥物處理24 h,每孔加入CCK-8試劑 20 μL,孵育4 h,水平搖床振蕩10 min,酶標儀450 nm波長測定OD值。實驗平行3次,根據公式計算細胞增殖抑制率(Cell Inhibition Rate, IR):
1.2.5 Hoechst染色法觀察MCF-7細胞凋亡 取MCF-7細胞按1.2.3中方案接種并培養。PEE、EAE及NAE制備2個濃度: 150、50 μg/mL。加藥繼續培養24 h后取出,PBS洗滌細胞,4%多聚甲醛固定并使用Hoechst染色試劑染色5 min,再次洗滌,置熒光倒置顯微鏡下觀察。
1.2.6 劃痕實驗評價MCF-7細胞遷移 取MCF-7細胞制成濃度為3×105個/mL懸液,每孔2 mL接種至6孔板,培養至細胞鋪滿孔底面積的80%~90%,用200 μL移液槍頭在孔底均勻劃線,PBS洗凈細胞碎片,加入含PEE、EAE或NAE 50 μg/mL的低血清濃度培養基(2%FBS),培養24 h后PBS洗滌細胞,4%多聚甲醛固定,置熒光倒置顯微鏡下觀察。
1.3統計學分析各組實驗數據采用均數±標準差表示, SPSS 18.0 統計軟件進行統計學分析, 各實驗組結果與陰性對照組的比較采用t檢驗,P<0.05為差異具有顯著性。
2 結 果
2.1 CIE、PEE、EAE和NAE對各腫瘤細胞形態的影響A549、MCF-7和K562細胞經CIE處理后細胞皺縮、破碎,密度降低,但HepG2細胞經CIE處理后,細胞形態和密度變化不明顯。由圖1可見, A549、MCF-7和K562經由PEE和EAE處理24 h后均出現明顯的皺縮、破碎、胞體暗淡、邊緣粗糙、數目稀少等情況;而由NAE處理24 h后的三種細胞形態與密度較陰性對照組變化不大。
2.2 CIE、PEE、EAE及NAE對各腫瘤細胞增殖抑制作用
2.2.1 CIE對A549、K562、MCF-7和HepG2細胞的作用 如圖 2 所示,與陰性對照相比,CIE在150~250 μg/mL濃度范圍對A549、K562和MCF-7細胞增殖均有抑制作用,差異具有統計學意義(P<0.05);其中, CIE對MCF-7細胞增殖抑制作用最強但不呈濃度相關性;對A549及K562細胞增殖抑制強度次之并呈現較好的濃度相關性。CIE對HepG2細胞無增殖抑制效果,反而呈與劑量相關的促增殖作用。

圖1 野菊花PEE、EAE、NAE對腫瘤細胞形態的影響(24 h,100×)

圖2 CIE對腫瘤細胞增殖抑制作(24 h后與陰性對照組相比,*P<0.05,n=3)
2.2.2 PEE、EAE及NAE對A549、K562和MCF-7細胞的作用 如圖3所示,與陰性對照相比, 濃度為50~250 μg/mL的PEE與EAE對MCF-7和K562細胞增殖呈劑量依賴性強抑制作用,差異具有統計學意義(P<0.05),而對A549細胞的作用較弱;NAE對A549及K562細胞的抑制效果不明顯,對MCF-7細胞具有一定的增殖抑制作用,但其強度明顯弱于PEE和EAE,且非濃度依賴。
2.3 PEE、EAE及NAE對MCF-7細胞凋亡的影響
MCF-7細胞經過兩個不同濃度PEE、EAE和 NAE處理后的Hoechst33342染色結果如圖4所示。與50 μg/mL處理組相比,100 μg/mL PEE、EAE處理后的MCF-7細胞密度明顯變小,形成致密濃染的細胞核數目更多。結果表明,PEE、EAE對MCF-7細胞有一定的凋亡誘導作用。

圖3 PEE、EAE及NAE對腫瘤細胞的增殖抑制作用 24 h后與陰性對照組相比,*P<0.05,n=3A:對A549細胞增殖抑作用;B:對K562細胞增殖抑制作用;C:對MCF-7細胞增殖抑制作用
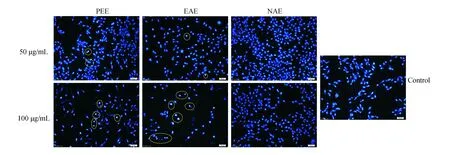
圖4 PEE、EAE及NAE對MCF-7細胞的凋亡誘導作用(24 h,Hoechst染色,100×)
2.4 PEE、EAE及NAE對MCF-7細胞遷移的影響MCF-7細胞經PEE、EAE及NAE處理24 h后,細胞向劃痕空白部位遷移情況如圖5所示。與陰性對照相比,EAE處理組細胞向劃痕空白處遷移數目極少,而其它處理組均有較多細胞遷移;提示EAE對MCF-7細胞的遷移的抑制效果最好,而PEE和NAE作用次之。
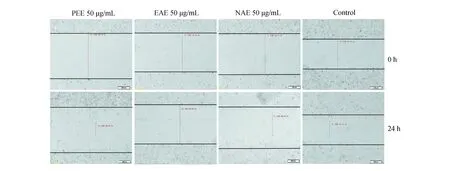
圖5 PEE、EAE及NAE對MCF-7細胞遷移的影響(24 h,40×)
3 討 論
野菊花提取實驗選擇乙醇為提取溶劑的原因在于,乙醇提取效果好,易于回收和處理,且更加安全低毒[9]。采用單因素輪換法對影響野菊花提取物的提取效率的因素(乙醇水溶液的濃度、加入料液比例、提取時間和提取次數等)進行優化,加入12倍量的70%乙醇(考慮干燥藥材粉末需吸水溶脹,第一次加入15倍量),65 ℃提取2次,每次2h,提取效果較好,所得CIE產物相對較高,方法亦較為簡便經濟。
CIE對HepG2細胞增殖不抑反促,很可能由于CIE中含有對HepG2細胞產生營養和促進生長作用的某些成分,而并不含能對其產生抑制作用的成分;或產生抑制作用的成分尚達不到有效濃度。另外,三個極性部位中僅有NAE對MCF-7細胞的作用不呈濃度依賴,因此我們推測,CIE對MCF-7細胞作用沒有濃度相關性,可能與存在于NAE中的某些成分的作用有關。
本研究結果顯示野菊花抗腫瘤活性較強的部位為石油醚(PEE)和乙酸乙酯部位(EAE),這與文獻報道野菊花的乙酸乙酯部位提取物具有逆轉腫瘤多藥耐藥性的作用相一致[10]。已有研究證明,野菊花醇提物的石油醚和乙酸乙酯萃取部位主要含萜類及黃酮類化合物[11];且萜類及黃酮類化合物的抗腫瘤作用近來已有諸多報道,如從野菊花中分離得到的三萜類能抑制小鼠皮膚腫瘤的活性[12],黃酮類成分芹菜素通過抑制STAT3信號誘導乳腺癌細胞凋亡[13],木犀草素具有一定的抗乳腺癌活性[14]。本文推測,野菊花中的抗腫瘤的活性成分可能為萜類、黃酮和脂類生物堿。本研究為后期分離獲得單個或一系列抗腫瘤活性的單體化合物提供研究方向。
[1] 蘇永華,樊逸夫. 野菊花的抗癌功效[N]. 上海中醫藥報,2013-8-9(004).
[2] 劉遠俊,王雙平,溫娜,等.野菊花提取物活性及機理研究進展[J].廣西中醫藥, 2015,6 (38):11-13.
[3] 李國棟,陳園園,王盼,等. 野菊花中萜類和黃酮類化合物保肝作用研究[J]. 中草藥, 2013, 44(24):3510-3514.
[4] 金沈銳,祝彼得,秦旭華.野菊花注射液對人腫瘤細胞SMMC7721、PC3、HL60增殖的影響[J].中藥藥理與臨床,2005,21(3):39-40.
[5] 魏強強,殷明,鄔亞華,等.3種植物總黃酮對人成骨肉瘤Saos-2細胞系作用的研究[J].中成藥,2013,35(7):1363-1367.
[6] 施劍明,殷嫦嫦,殷明,等.野菊花總黃酮聯合順鉑對人骨肉瘤MG-63細胞抑制作用[J].中成藥,2014,36(10):2013-2017.
[7] Yoshikawa M, Morikawa T, Toguchida I, et al.Medicinal flowers. II. Inhibitors of nitric oxide production and absolute stereostructures of five new germacrane-type sesquiterpenes, kikkanols D, D monoacetate, E, F, and F monoacetate from the flowers of Chrysanthemum indicum L[J].Chem Pharm Bull,2000,48(5):651-656.
[8] 戴勝.野菊花保肝活性成分的分離、鑒定及初步分析[D].安徽:安徽醫科大學,2013.
[9] 陳菡.野菊花總黃酮的提取及萃取精制研究[D].浙江:浙江大學,2012.
[10] 劉愛旗,夏璐.CCK-8法與MTT法檢測兔成纖維細胞活性的比較研究[J].中國醫學創新,2013,10(2):12-13.
[11] 許文婷. 野菊花逆轉腫瘤多藥耐藥性的硏究[D].陜西: 陜西師范大學,2015.
[12] 劉磊磊.中草藥野菊花和款冬花及草藥煙管頭草中倍半萜和其他成分研究[D].甘肅: 蘭州大學,2011.
[13] 陳凱,屈亞楠.野菊花活性成分及應用的研究進展[J].安徽化工,2014,10(1): 10-13.
[14] Seo HS, Ku JM, Choi HS, et al. Induction of caspase-dependent apoptosis by apigenin by inhibiting STAT3 signaling in HER2-overexpressing MDA-MB-453 breast cancer cells[J]. Anticancer Res, 2014, 34(6): 2869-2882.
[15] Sui JQ, Xie KP, Xie M. Inhibitory effect of luteolin on the proliferation of human breast cancer cell lines induced by epidermal growth factor[J]. Acta Physiol Sin, 2016, 68(1):27-34.
ScreeningofantitumoractivefractionsofChrysanthemumIndicum
QUAN Wenjie, SHI Xiaoxin, XIONG Runde, et al
(InstituteofPharmacy&Pharmacology,UniversityofSouthChina,Hengyang421001,Hunan,China)
ObjectiveTo evaluate the antitumor activity and screen the antitumor activity fractions of Chrysanthemum Indicum.MethodsMorphological observation,CCK-8,Hoechst nuclei staining and wound healing assay were used to evaluate the antitumor activity of CIE,PEE,EAE and NAE in tumor cells including human lung cancer cells (A549), human erythroleukemia cells (K562), human breast cancer cells (MCF-7), and human liver cancer cells (HepG2).ResultsShrinkage and fragmentation of cells could be seen obviously under the fluorescent inverted microscope when A549, K562 and MCF-7 cells were treated with CIE,PEE,EAE,NAE when their concentrations were above 150μg/mL. The proliferation of A549,K562 and MCF-7 cells can be inhibited by CIE,PEE,EAE,NAE in a dose-dependent manner in the concentration from 150μg/mL to 250μg/mL, PEE showed the best inhibition effects in MCF-7. EAE showed the best apoptosis-inducing effect in MCF-7, and did the best in resisting MCF-7 cell migration .ConclusionChrysanthemum indicum has antitumor activity and its mechanism might be associated with induction of apoptosis and inhibition of migration; the antitumor activity sites were the petroleum ether and ethyl acetate fractions, which provides the basis for further study in single compounds isolation.
Chrysanthemum indicum; tumor cells; antitumor activity; screening of antitumor activity fractions
10.15972/j.cnki.43-1509/r.2017.03.007
2016-12-31;
2017-03-23
湖南省中醫藥科研計劃重點項目(201412);湖南省教育廳科學研究項目(16K079).
*通訊作者,E-mail:1025165380@qq.com.
R961
A
蔣湘蓮)

