三種因素對海水生物流化床啟動期間營養鹽去除及amoA基因表達的影響
宋協法, 王學超, 董登攀
(中國海洋大學,山東 青島 266003)
三種因素對海水生物流化床啟動期間營養鹽去除及amoA基因表達的影響
宋協法, 王學超, 董登攀
(中國海洋大學,山東 青島 266003)
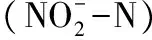
循環水養殖;生物流化床;生物過濾功能啟動;營養鹽;功能基因
生物濾池作為封閉式循環水養殖系統的核心單元,是控制養殖用水質量、維持養殖系統穩定運行的關鍵[1]。常見的生物過濾器有浸沒式生物過濾器、滴流式生物過濾器、生物轉盤、生物轉筒、念珠式生物過濾器、生物流化床等,其中生物流化床由于其能提供良好的傳質效果、較高的TAN處理效率、相對較小的占地面積以及巨大的比表面積等,被認為是最先進的生物反應器類型之一[2-3]。生物流化床作為一種新型高效的生物濾器,已廣泛應用于美國等發達國家養殖企業的循環水養殖系統中[3-5]。國內外學者針對生物流化床開展了一系列研究。Iván等[3]、張海耿等[6]和朱興一[7]均將生物流化床應用于羅非魚循環水系統,評價其對含氮廢物的去除效果,結果均顯示其可有效凈化養殖水體,出水水質符合羅非魚養殖需求。
生物過濾器啟動過程的快慢,啟動完成后系統的處理效果及穩定性,不僅直接關系到養殖成本高低,也是循環水養殖成功的前提和必要條件。柳瑤等[8]以實驗室規模的旋轉式生物流化床為研究對象,采用自然生物過濾功能啟動法,探究海水與淡水生物濾池過濾功能的啟動。張海耿等[9]將流化床應用于小型鱘魚循環水養殖系統,探討自然生物過濾功能啟動方式和添加微生態制劑方式下該濾器的生物過濾功能啟動時間及運行效果。但是,目前對海水生物流化床生物過濾功能啟動的影響因素及穩定性的研究還存在不足。溫度、膨脹率和初始總氨氮(TAN)濃度是生物流化床運行期間的重要參數,pH、溶氧(DO)和鹽度(SAL)也是維持水體理化性質的重要保證,生物流化床運行參數不同,微生物生存的環境以及生長的快慢也會不同,生物過濾功能的啟動過程也可能不同。因此,研究生物流化床生物過濾功能的啟動和微生物功能基因表達有助于擴大生物流化床的應用范圍,提高生物過濾功能的啟動以及提高水處理效率。
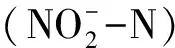
1 材料與方法
1.1 模擬養殖污水處理系統
實驗室規模的生物流化床海水養殖廢水處理系統由水泵、養殖池、生物流化床、沉淀池及溫控設備組成(圖1)。其中,床體高度134 cm,床體直徑19 cm,進水管直徑2 cm,出水管直徑10 cm,布水腔底部直徑29 cm。
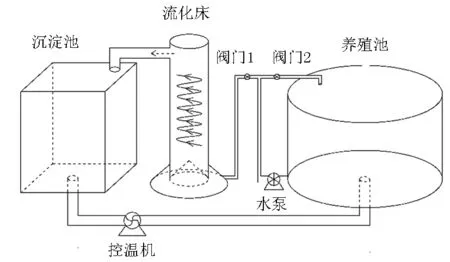
圖1 養殖污水處理系統
1.2 試驗材料
1.2.1 濾料
石英砂是國外最常采用的生物流化床填料[4],實驗選擇的石英砂粒徑0.35~0.65 mm,密度286 kg/m3,在生物流化床中的填充高度40 cm,體積約11 L,填充率30%。
1.2.2 人工配置海水養殖廢水
本試驗的養殖廢水通過從魚池中收集的殘餌糞便進行配置。殘餌糞便取自山東東方海洋科技股份有限公司的大西洋鮭循環水養殖系統,經自然風干后于烘箱內65 ℃烘干12 h,烘干后的殘餌糞便使用研磨機粉碎;配水時取500 g溶于少量水后發酵3 d,經300目篩絹過濾,將浸出液倒入體積約75 L的水桶中混勻,棄去殘渣,測定水質指標后按照比例用來自青島近海沙濾海水的凈海水稀釋作為試驗用水[10]。
1.3 試驗設計
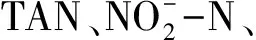
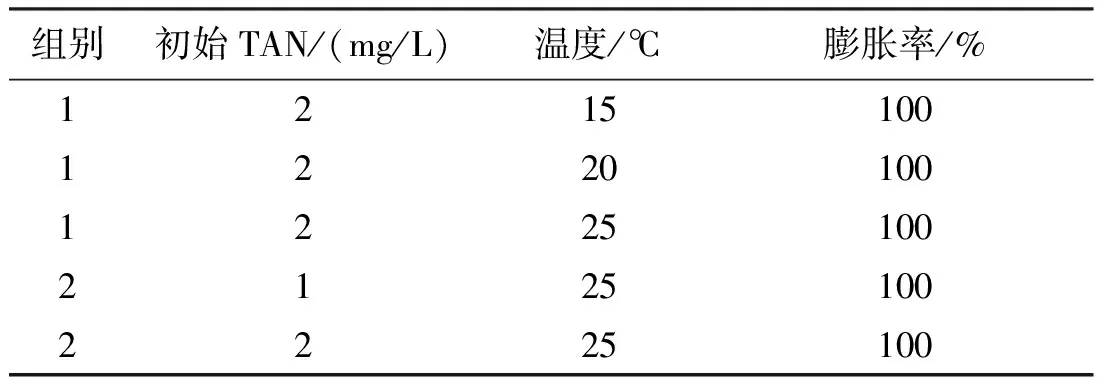
表1 試驗參數設置表
1.4 試驗指標與分析方法
1.4.1 樣品采集
在生物流化床運行期間,每天在流化床床體、養殖池及蓄水池取水樣。水樣取出后及時測定營養鹽濃度。每10 d在無菌條件下在流化床上、中、下3個取樣點采集石英砂樣品,混勻后凍存于-80 ℃冰箱中。
1.4.2 水質測定方法
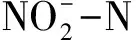
TAN的去除效果用去除率A來表示:
A=100%×(Ct—C0)/C0
(1)
式中:A—TAN去除率,%;C0—TAN初始質量濃度,mg/L;Ct—t時溶液中的TAN質量濃度,mg/L。
1.4.3 DNA提取和PCR擴增
在生物流化床運行期間,每10 d在流化床的上、中、下3個取樣點采集石英砂樣品,混勻后凍存于-80℃冰箱中。樣品DNA的提取采用Fast DNA SPIN Kit for soil (MP Biomedicals,Illkirch,France) 按照操作說明進行提取,提取后的DNA通過核酸蛋白檢測儀(NANODROP2000,Thermo,USA)測量核酸的濃度及純度。以amoA-1F(5’-GGG GTT TCT ACT GGT GGT)和amoA-2R(5’-CCC CTC KGS AAA GCC TTC TTC)[11]為引物擴增amoA基因片段,片段長度491bp。反應程序為:95℃預變性5 min;35個循環包括94℃變性30 s,58℃退火 45 s,72℃延伸 45 s;72℃延伸10 min。
1.4.4 實時熒光定量PCR標準品的制備
將純化好的PCR產物與T-載體(TAKARA)連接,參照相關文獻[12]制備標準品。
1.4.5 實時熒光定量PCR
采用特異性引物amoA-1F和aomA-2R對氨氧化細菌(Ammonium-oxidizing bacteria,AOB)的amoA功能基因進行qRT-PCR擴增。反應在Mastercycler ep realplex 實時定量PCR儀(Eppendorf,Germany)上進行,采用試劑盒(SYBR?Premix Ex Taq kit,TaKaRa,Japan)進行反應,每個反應做3個重復,反應體系見表2。

表2 PCR反應體系
實時定量的程序為:95 ℃ 900 s;95 ℃ 15 s,63 ℃ 30 s,72 ℃ 30 s,40個循環。熔解曲線程序:95 ℃ 15 s,63 ℃ 15 s,15 min,95 ℃ 15 s。
2 結果
2.1 溫度對營養鹽去除率及功能基因表達的影響
不同溫度下的TAN去除率變化趨勢類似,呈現先逐漸升高的趨勢(圖2)。在15℃、20℃和25℃處理下,TAN去除率分別在第23天、17天和17天達到90%。相對于20和25℃兩個處理,在溫度為15℃時TAN去除率在前10 d內增長緩慢并伴有小幅波動,且達到穩定所需要的時間最長。
隨著試驗的進行,3種溫度處理下氨氧化細菌amoA的數量均呈上升趨勢(圖3)。在同次取樣時間點下,氨氧化細菌amoA的數量隨著溫度的升高而升高。結合不同溫度下TAN去除率的變化,發現在整個實驗過程中氨氧化細菌amoA基因數量的變化與TAN去除率的變化相一致。

圖2 不同溫度對生物流化床TAN去除率和質量濃度變化的影響
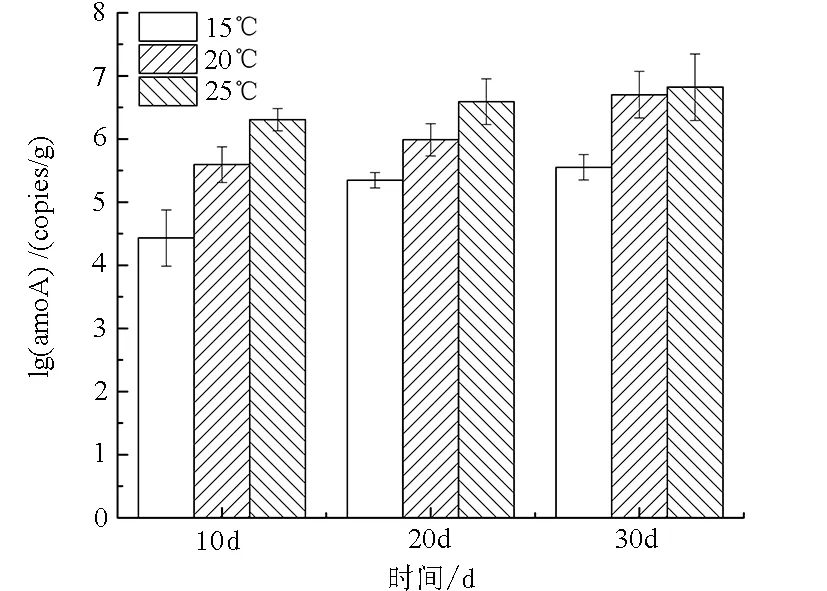
圖3 不同溫度對生物流化床內amoA基因數量變化的影響
Fig.3 The effect of different temperatures on the amount of amoA gene in cyclo-bio fluidized sand biofilters
2.2 不同初始TAN濃度處理下生物流化床的生物過濾功能啟動情況
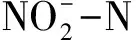
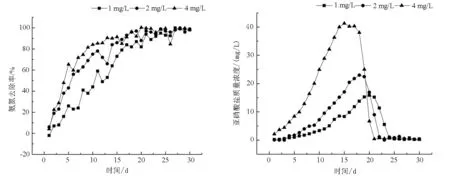
圖4 生物流化床中不同TAN濃度對TAN去除率和濃度變化的影響
Fig.4 The effect of different ammonia concentrations on the removal effeiency of ammonia and the concetration of nitrate in cyclo-bio fluidized sand biofilters
如圖5所示,隨著試驗的進行,3種初始TAN濃度下AOB的amoA數量均隨著時間增長而增多,在相同的時間下,AOBamoA的數量隨著初始TAN濃度的升高而升高。結合在不同TAN初始濃度下TAN去除率的變化,發現在整個實驗過程中氨氧化細菌的amoA基因數量與TAN去除率有相似的變化趨勢。
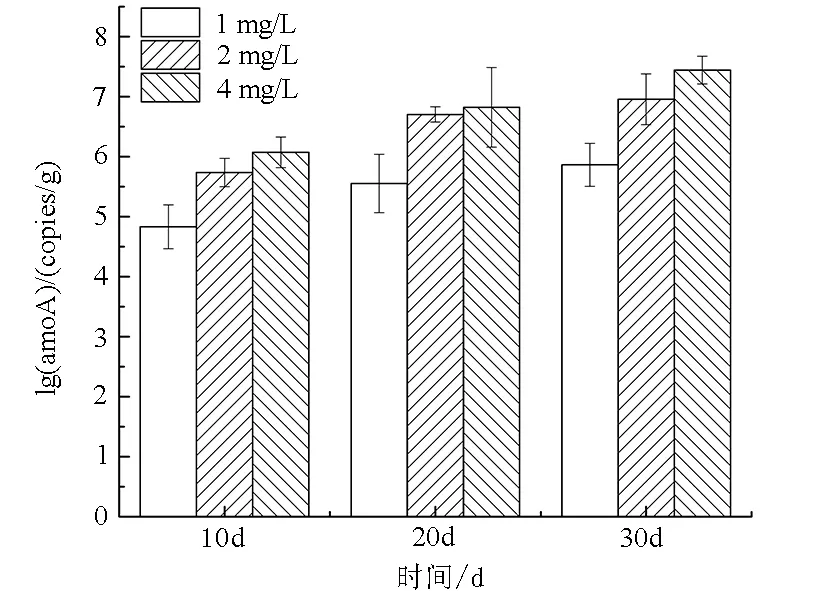
圖5 不同TAN濃度對生物流化床內amoA 基因數量變化的影響
Fig.5 The effect of different ammonia concentrations on the amount of amoA gene in cyclo-bio fluidized sand biofilters
2.3 不同膨脹率下生物流化床的生物過濾功能啟動情況
如圖6所示,在膨脹率為100%和150%時,TAN去除率的變化趨勢相似;在膨脹率為50%時,TAN去除率增長較慢,并且最后TAN去除率只達到了80%,其他兩個膨脹率下TAN去除率均達到了100%。膨脹率為100%和150%時,TAN去除率達到90%分別需要13 d和12 d,到達穩定的時間分別為20 d和19 d,差別不明顯。
如圖7所示,從整體趨勢來看,3種膨脹率下AOBamoA數量均隨著時間增長而增多,在相同的時間下AOBamoA數量隨著膨脹率的升高而升高。結合不同膨脹率下TAN去除率的變化發現,在整個實驗過程中,AOBamoA基因數量與TAN去除率的變化呈相似趨勢。
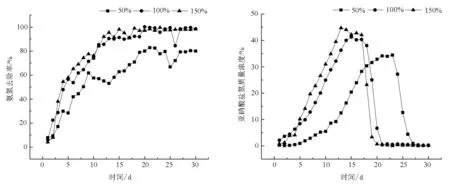
圖6 生物流化床中不同膨脹率對和TAN去除率的影響
Fig.6 The effect of different expansion rates on the removal effciency of ammonia and the concentration of nirate in eyclo-bio fluidized sand biofilters
3 討論
3.1 溫度對營養鹽去除率及功能基因表達的影響
硝化細菌是生物硝化脫氨中起主要作用的微生物,直接影響硝化效果和生物脫氨效率。環境溫度對硝化細菌的生長影響較大,大多數硝化細菌適宜生長的溫度為10℃~38 ℃,當溫度低于10 ℃時,硝化細菌的活性較低,TAN的轉化會受到影響[13]。高于20 ℃時硝化細菌的活性較高,但高于38℃時硝化作用會消失[14]。因此,選取合適的反應溫度是提高生物濾器硝化脫氮效率的重要前提。
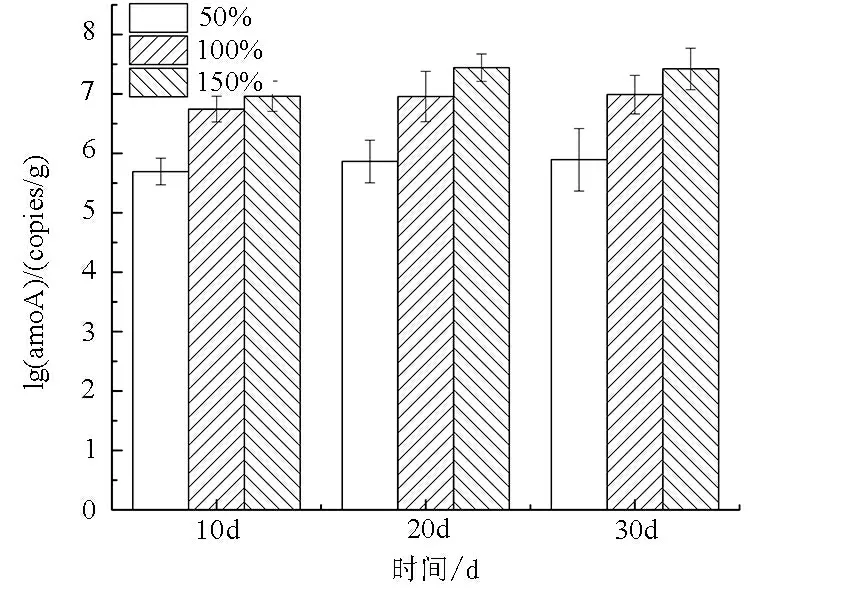
圖7 不同膨脹率對生物流化床內amoA 基因數量變化的影響
Fig.7 The effect of different expansion rates on the amount of amoA gene in cyclo-bio fluidized sand biofilters
生物濾器是循環水養殖的重要環節,生物濾器上附著硝化細菌,尤其是AOB直接決定其處理效率的高低[17]。本研究發現,隨著溫度的升高生物流化床內AOBamoA數量呈增長趨勢,在25℃下菌群密度最大,說明多數AOB是嗜溫菌,在一定范圍內,隨著溫度的升高,AOB的生長速率升高、活性增強,表現為生物流化床對TAN的良好去除效果。該研究與竇娜莎[18]的研究結果相似,其發現曝氣生物濾池內AOB菌群密度隨溫度升高而增大,與污染物的去除率變化趨勢一致。
3.2 初始TAN濃度對營養鹽去除率及功能基因表達的影響
TAN濃度本身會影響硝化反應,被認為是設計和管理生物濾器最重要的影響因素[19]。本實驗研究發現,隨著初始TAN濃度的升高,TAN去除率的增速也加快,在初始TAN濃度為4 mg/L時,系統達到TAN近似完全去除所用時間最短。朱興一[7]研究發現隨TAN濃度的增加,TAN去除率逐漸上升,當進水TAN濃度為10 mg/L時,TAN的去除率達到最大值。有研究指出,當TAN濃度超過3 mg/L時,積累的TAN會抑制硝化反應[20]。但本試驗發現,在實驗室規模循環水系統下,當初始TAN濃度提高到4 mg/L時,仍然能保持較好的TAN去除率。原因可能是:一方面,本實驗選用的生物流化床填料具有巨大的比表面積,能夠達到較高的水處理效率;另一方面,實驗室規模循環水系統容積較小,在相同的時間內循環的次數較多。
本研究發現初始TAN濃度升高,amoA基因數量有較明顯的增加。Mota等[21]和楊小麗等[22]的研究也發現隨著TAN濃度的增加,amoA基因數量增多,氨氧化細菌比例隨之增大。
3.3 膨脹率對海營養鹽去除率及功能基因表達的影響
膨脹率是生物流化床特有的操作參數。膨脹率不同,水流流速不同,也就導致單位體積TAN的轉換率(VTR)不同。這與生物濾器中的水力停留時間(HRT)對營養鹽處理的原理相似。適宜的膨脹率能保持濾料與底物的充分接觸,為濾料表面的微生物提供充足溶氧和營養物質,從而對營養鹽保持較好的去除效果[23]。因此,選取適宜的膨脹率是生物流化床乃至循環水系統穩定運行的關鍵。本研究發現在選取50%、100%和150%膨脹率參數下,生物流化床均顯示出良好的硝化性能,但在膨脹率為150%時TAN去除率比100%時的提升不大,但仍有較好的硝化性能。原因可能是在膨脹率150%時,濾料在啟動過程中有一定的流失[4]。柳瑤等[8]研究旋轉式生物流化床啟動時發現污水處理效率隨膨脹率增大而提高,膨脹率為100%時處理效率最高。Pujol等[24]也認為適當提高流速會對硝化作用有積極的促進作用。本研究同時發現,在膨脹率為100%和150%時,amoA基因數量無明顯差異,可能原因是在生物流化床啟動期間,TAN濃度保持不變,amoA基因數量也隨著生物流化床的啟動逐漸達到穩定。
4 結論
本試驗條件下,在水溫為25 ℃時生物流化床掛膜完成所需時間最短,為23 d,并且amoA基因數量增速最快。在初始TAN濃度為4 mg/L時生物流化床掛膜完成所需時間最短,為21d,amoA基因數量也會隨著初始TAN濃度升高而增加。在膨脹率為100%和150%時生物流化床啟動完成所需時間無明顯差異,但明顯短于膨脹率為50%時的生物流化床啟動完成所需的時間。在膨脹率為100%和150%時,amoA基因數量無明顯差異。
□
[1] LIU H,CHE X,ZHANG Y. Performance of sequencing microbead biofilters in a recirculating aquaculture system[J]. Aquacultural Engineering,2013,52(52): 80-86.
[2] TSUKUDA S,CHRISTIANSON L,KOLB A,et al. Heterotrophic denitrification of aquaculture effluent using fluidized sand biofilters[J]. Aquacultural Engineering,2015,64:49-59.
[4] SUMMERFELT S T. Design and management of conventional fluidized-sand biofilters[J]. Aquacultural Engineering,2006,34(3):275-302.
[5] SUMMERFELT S T,WILTON G,ROBERTS D,et al. Developments in recirculating systems for Arctic char culture in North America[J]. Aquacultural Engineering,2004,30(1/2): 31-71.
[6] 張海耿,張宇雷,張業韡,等.循環水養殖系統中流化床水處理性能及硝化動力學分析[J].環境工程學報,2014,8(11):4743-4751.
[7] 朱興一.三相生物流化床循環水高密度養殖尼羅羅非魚的研究[D].杭州:浙江大學,2006.
[8] 柳瑤,宋協法,雷霽霖,等.循環水養殖旋轉式生物流化床生物過濾功能[J].農業工程學報,2015,31(3): 249-254.
[9] 張海耿,張宇雷,宋紅橋.低溫工況下流化床生物濾器的啟動方式實驗[J].水處理技術,2015(1): 94-98.
[10] 張延青,陳江萍,沈加正,等.海水曝氣生物濾器污染物沿程轉化規律的研究[J].中國環境科學,2011,31(11): 1808-1814.
[11] ROTTHAUWE J H,WITZEL K P,LIESACK W. The ammonia monooxygenase structural geneamoAas a functional marker: molecular fine-scale analysis of natural ammonia-oxidizing populations.[J]. Applied & Environmental Microbiology,1997,63(12): 4704-4712.
[12] 李麗,趙成萍,李宏,等.質粒制備絕對定量PCR標準曲線方法的建立[J].農業生物技術學報,2011,19(6): 1157-1162.
[13] 張雷,苗月,姜安璽.耐低溫硝化細菌固定化技術及脫氮效果[J].化工進展,2010,29(8): 1567-1570.
[14] ELDEAN A,RAMADAN K. Removal of ammonia and phenol from industrial waste water[J]. Eleventh International Water Technology Conference,2007,11:949-971.
[15] 王春榮,王寶貞,王琳. 溫度及氨氮負荷對曝氣生物濾池硝化作用的影響[J]. 城市環境與城市生態,2004(4):24-27.
[16] 山形陽一,梅志平.循環過濾設備的維護和管理[J].水產科技情報,1991(2): 58-60.
[17] 宋協法,黃志濤,彭磊.封閉循環水產養殖系統中三種生物濾池除TAN效果的比較[J]. 漁業現代化,2007,34(1): 1-4.
[18] 竇娜莎.曝氣生物濾池處理城市污水的效能與微生物特性研究[D]. 青島:中國海洋大學,2013.
[19] CHEN S,LING J,BLANCHETON J P. Nitrification kinetics of biofilm as affected by water quality factors[J]. Aquacultural Engineering,2006,34(3): 179-197.
[20] CARRERA J,VICENT T,LAFUENTE J. Effect of influent COD/N ratio on biological nitrogen removal (BNR) from high-strength ammonium industrial wastewater[J]. Process Biochemistry,2004,39(12): 2035-2041.
[21] PENGTHAMKEERATI P,MOTAVALLI P P,KREMER R J. Soil microbial activity and functional diversity changed by compaction,poultry litter and cropping in a claypan soil[J].Applied Soil Ecology,2011,48(1): 71-80.
[22] 楊小麗,王世和,盧寧. 一體式MBR控制膜污染的最佳曝氣強度及影響因素[J]. 水處理技術,2006,32(5): 17-19.
[23] 張海耿,張宇雷,張業韡,等. 循環水養殖系統中流化床生物濾器凈水效果影響因素[J]. 環境工程學報,2013,7(10):3849-3855.
[24] PUJOL R,LEMMEL H,GOUSAILLES M. A keypoint of nitrification in an upflow biofiltration reactor[J]. Water Science & Technology,1998,38(3): 43-49.
EffectofthethreefactorsonnutrientremovalandexpressionofamoAgeneduringthestart-upperiodofseawatercyclo-biofluidizedsandbiofilters
SONGXiefa,WANGXuechao,DONGDengpan
(OceanUniversityofChina,Qingdao266003,China)
Under laboratory scale,with the cyclo-bio fluidized sand biofilter (CB-FSB) as the research object,the changes of the removal performance of ammonia-nitrogen and the nitrite-nitrogen,and the amount ofamoAgene during the start-up period of cyclo-bio fluidized sand biofilter (CB-FSB) under different initial ammonia-nitrogen concentrations,water temperatures and filter expansion rates were studied in this paper. The experimental results showed that the time required for the start-up of cyclo-bio fluidized sand biofilter (CB-FSB) was shortened with the increasing of water temperature. The time required for the start-up of CB-FSB were 27,25,and 23 days at 15℃,20℃ and 25 ℃,respectively. The time required for the start-up of CB-FSB was shortened with the increasing of the initial ammonia nitrogen concentration. The time required for the start-up of CB-FSB were 24,22,21 days at 1 mg/L,2 mg/L and 4 mg/L,respectively. There was no significant difference between 100% and 150% filter expansion rates for the start-up of CB-FSB,which was 21 days and 20 days,respectively. They were better than that with 50% expansion rate. The time required for the start-up of CB-FSB with 50% expansion rate was 27 days. The amount ofamoAgene was related to the change of nitrite-nitrogen removal rate and increased with the increasing of initial ammonia-nitrogen concentration. The amount ofamoAgene reached the peak at 4mg/L of ammonia-nitrogen concentration,which was 2.76 × 107copies/g.
recirculating aquaculture;stat-up of cyclo-bio fluidized sand biofilters;nutrient salt;function gene
10.3969/j.issn.1007-9580.2017.06.005
2017-09-04
國家科技支撐計劃項目(2011BAD13B04)
宋協法(1964—),男,教授,博士,研究方向:設施漁業和養殖污水處理。E-mail:yuchuan@ouc.edu.cn
S959
A
1007-9580(2017)06-024-06

