缺血性腦血管病患者代謝綜合征與顱內外動脈狹窄的相關性研究
張 旭,常 穎,劉松巖
(吉林大學中日聯誼醫院 神經內一科,吉林 長春130033)
缺血性腦血管病患者代謝綜合征與顱內外動脈狹窄的相關性研究
張 旭,常 穎,劉松巖*
(吉林大學中日聯誼醫院 神經內一科,吉林 長春130033)
代謝綜合征(MetS)是多種代謝成分異常聚集的病理狀態,它涉及多個器官組織并受遺傳與環境等多種因素的影響,主要包括腹型肥胖、高血壓及血糖血脂代謝異常[1]。隨著超聲、影像學檢查的發展,缺血性腦血管病(ICVD)患者顱內外動脈的檢查更為普及,其狹窄率的檢出也逐漸提高,而動脈狹窄正是此類疾病重要的危險因素[2]。目前,關于MetS與血管狹窄相關性的研究主要集中在冠狀動脈上,而在顱內外動脈狹窄(ICAS/ECAS)方面的研究較少且部分結論存有爭議[3-6]。因此,本研究旨在通過探討ICVD患者MetS及其各個組分與ICAS/ ECAS的關系,為腦血管病的預防及治療提供指導。
1 資料與方法
1.1 研究對象
搜集2012年1月到2014年5月因ICVD于吉林大學中日聯誼醫院神經內科住院的缺血性腦血管病患者共221例,均通過頸部血管彩超、經顱多普勒超聲或頭頸部MRA、CTA檢查判斷顱內外動脈情況,將所有患者分為顱內動脈狹窄組(共104例,占47%,其中男80例、女24例)、顱外動脈狹窄組(共42例,占19%,其中男27例、女15例)及無狹窄組(共75例,占34%,其中男57例、女18例);另將所有患者分別分為顱內動脈狹窄組(共104例)及非顱內動脈狹窄組(共117例)、顱外動脈狹窄組(共42例)及非顱外動脈狹窄組(共179例)、MetS組(共109例,其中男78例、女31例)及非MS組(共112例,其中男86例、女26例)。
1.2 方法
搜集上述患者的多項指標,包括年齡、MetS、高血壓史、糖尿病史、冠心病史、腦卒中病史、腹型肥胖、甘油三酯(TG)、總膽固醇(TC)、高低密度脂蛋白膽固醇(HDL-C/LDL-C)、脂蛋白a(Lpa)、apoB/A1比值及吸煙飲酒史,并計算每位患者的Essen卒中風險評分;排除其他代謝性疾病、長期應用激素及降脂藥物、外傷、腫瘤、腦血管畸形、血管炎、腦栓塞等病的患者。MetS診斷采用IDF 標準[7]。
1.3 統計學處理
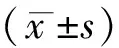
2 結果
2.1 無狹窄組及顱內、外狹窄組患者各項危險因素的比較
χ2檢驗中修正后的檢驗水準為0.017。結果顯示ECAS組年齡顯著升高(P<0.05),ICAS組腹型肥胖發生率較高(P<0.017),血管狹窄組冠心病發病率均較高(P<0.017),ICAS組MetS發病率偏高,但僅與無狹窄組相比差異顯著(P=0.003)。(表1~4)。

表1 各組年齡兩兩比較P值
aP<0.05,差異具有顯著性。

表2 各組腹型肥胖兩兩比較P值
dP<0.017,差異具有顯著性。

表3 各組冠心病史兩兩比較P值
cP<0.017,差異具有顯著性。

表4 各組MetS兩兩比較P值
bP<0.017,差異具有顯著性。
2.2 MetS與顱內外動脈狹窄的相關性
以MetS為自變量,分別以顱內外動脈狹窄為因變量行Logistic 回歸分析,調整性別、年齡、冠心病病史、腦梗塞病史、TC、LDL-C、Lpa、apoB/A1比值、吸煙飲酒史后,MetS與ICAS相關(P=0.004)、與ECAS不相關(P=0.282),TC與ECAS相關(P=0.039)。在上述基礎上加入MetS各個組分,MetS作為整體與ICAS無相關性(P=0.989),其組分中腹型肥胖(P=0.009)及HDL-C(P=0.047)與ICAS相關;MetS作為整體與ECAS無相關性(P=0.301),其中腹型肥胖(P=0.018)、年齡(P=0.038)及TC(P=0.032)與ECAS相關。
2.3 MetS組與非MetS組Essen評分及apoB/A1比值的比較
對以上兩組患者的Essen評分進行秩和檢驗,結果示Z=-3.149,P=0.002,由于MetS組平均秩次124.26大于非MetS組的98.10,故MetS組評分明顯高于非MetS組,差異具有統計學意義;對以上兩組患者的apoB/A1比值(0.94±0.30,0.80±0.23)進行T檢驗,結果示MetS組比值高于非MetS組,P<0.001,差異具有統計學意義。
3 討論
ICAS是缺血性腦卒中的重要危險因素[2],動脈硬化是導致血管狹窄的主要原因。目前,我國非心源性腦卒中患者中MetS的發病率較高[8],肥胖是其始動因素,將導致胰島素抵抗,通過破壞血管中多種細胞水平上的胰島素信號傳導來發揮其促動脈硬化作用。同時,高血壓對血管壁的機械應力、高血糖對細胞代謝的擾亂、高血脂對血管內皮的損傷及動脈粥樣斑塊的形成均協同促進了動脈硬化的進展。因此,以胰島素抵抗為中心環節的MetS通過其單因素的獨立作用及多因素的聯合作用促進動脈硬化發生發展進而影響顱內外血管、導致管腔狹窄[2-4,6,9]。
本研究結果顯示:①ICAS組MetS的發生率偏高,而即便在無臨床癥狀的ICAS人群中MetS的發生率仍較高[5]。但因ECAS組MetS發生率無顯著升高且ICAS組肥胖率顯著高于其他兩組,故考慮MetS的作用可能受其組分的影響。血管狹窄組冠心病發病率同樣較高,這進一步證實心腦血管疾病的發生發展存在共同的發病機理及影響因素。②進一步行Logistic 回歸,結果提示在ICVD患者中MetS非ICAS的獨立危險因素,其風險來自于它的各個組分,已有多項研究結果[3,4]支持此觀點。至于Anxin Wang等的研究顯示MetS是ICAS的獨立危險因素,其研究對象為無心腦血管疾病史且無臨床癥狀的普通人群[5],與本研究的研究對象不同。MetS與ICAS有一定相關性是由多種因素決定的,考慮原因可能如下:顱內動脈對MetS等引起的氧化應激易感性更高[4];與顱外動脈相比,顱內動脈包含更高活性的抗氧化劑,但隨著年齡的增加,顱內動脈抗氧化劑的濃度及保護性作用明顯降低[10,11];已有研究顯示,apoB/A1是缺血性卒中及ICAS的預測因子,在亞洲的腦卒中患者中,此比值可能是ICAS的生物標志物[2,12]。因此項比值在MetS中較高[13]且升高與ICAS相關,故推測這也可能是MetS與ICAS存在相關性的原因,而本研究中MetS組apoB/A1顯著高于非MetS組也支持上述觀點;另外,代謝紊亂和胰島素抵抗可能通過影響顱內動脈的彈性來降低其緩沖功能,故與不穩固的顱外動脈硬化性斑塊相比,顱內斑塊經常是穩固并富含纖維素的,這可能更易導致狹窄的發生。因此,顱內血管動脈硬化的性質與顱外動脈硬化是不同的[3]。③加入MetS各個組分后,腹型肥胖與ECAS呈負相關,間接支持上述結果,即肥胖者更易發生ICAS且二者之間呈正相關。而年齡與ECAS呈正相關亦與本研究中顱外狹窄組年齡顯著升高相符,高齡可能是顱外血管狹窄的獨立標志[14]。另外,加入MetS各個組分前后TC與ECAS均相關,考慮可能與本研究結果中提示的顱外狹窄組總膽固醇水平相對升高有關,具體原因仍有待進一步研究。因各組年齡、TC兩兩比較差異不完全有統計學意義,考慮可能與本研究中顱外狹窄組樣本量較少有關。其次,不同的統計建模方法及危險因素的種類、定義(包括進一步納入高脂血癥、高血壓、糖尿病家族史,日常運動量,吸煙飲酒史定量及時間,BMI,脂聯素水平,同型半胱氨酸水平,PPARs基因,MetS定義標準等)均可能影響統計結果[6,9]。另外,人種、飲食習慣、基因多態性、環境因素、納入排除標準及其他暫不能確定因素也是我們要考慮的原因。④MetS組Essen評分明顯高于非MetS組,提示MetS患者未來發生嚴重腦血管病的風險較高。因顱內動脈狹窄的進展與臨床卒中的復發相關[15],因此伴有MetS的顱內動脈狹窄患者可能有較差的預后及較高的死亡率[14]。
合并MetS的急性非心源性腦卒中患者可能發生更大范圍的梗塞及顱內動脈狹窄[8]。另外,即便不依賴于其他的危險因素,MetS多因素的聚集也增加了顱內無癥狀性病灶的發生[16],且在早期無臨床證據支持的頸動脈硬化起始與進展過程中起到了重要作用[6]。因此,需對MetS患者加以重視并有針對性的采取相應的干預措施,以期能夠預防ICVD的發生發展并改善此類患者的預后。
[1]Liu L,Miura K,Fujiyoshi A,et al.Impact of metabolic syndrome on the risk of cardiovascular disease mortality in the United States and in Japan[J].Am J Cardiol,2014,113(1):84.
[2]Park J H,Hong K S,Lee J,et al.Deep subcortical infarct burden in relation to apolipoprotein B/AI ratio in patients with intracranial atherosclerotic stenosis[J].Eur J Neurol,2013,20(4):671.
[3]Park J H,Kwon H M,Roh J K.Metabolic syndrome is more associated with intracranial atherosclerosis than extracranial atherosclerosis[J].Eur J Neurol,2007,14(4):379.
[4]Ovbiagele B.Association of the metabolic syndrome with intracranial atherosclerotic stroke[J].Neurology,2006,66(3):459.
[5]Wang A,Li Z,Luo Y,et al.Asymptomatic Intracranial Arterial Stenosis and Metabolic Syndrome:The APAC Study[J].PLoS One,2014,9(12):e113205.
[6]Jung J M,Young K D,Han C,et al.Metabolic syndrome and early carotid atherosclerosis in the elderly[J].J Atheroscler Thromb,2014,21(5):435.
[7]Alberti K G,Zimmet P,Shaw J.The metabolic syndrome--a new worldwide definition[J].Lancet,2005,366(9491):1059.
[8]Zhang Z,Xiao M,Ye Z,et al.Noncardiogenic Stroke Patients with Metabolic Syndrome Have More Border-zone Infarction and Intracranial Artery Stenosis[J].J Stroke Cerebrovasc Dis,2015,24(3):629.
[9]Seo M H,Rhee E J,Park S E,et al.Metabolic syndrome criteria as predictors of subclinical atherosclerosis based on the coronary calcium score[J].Korean J Intern Med,2015,30(1):73.
[10]Ford E S,Mokdad A H,Giles W H,et al.The metabolic syndrome and antioxidant concentrations:findings from the Third National Health and Nutrition Examination Survey[J].Diabetes,2003,52(9):2346.
[11]D'Armiento F P,Bianchi A,de Nigris F,et al.Age-related effects on atherogenesis and scavenger enzymes of intracranial and extracranial arteries in men without classic risk factors for atherosclerosis[J].Stroke,2001,32(11):2472.
[12]Park J H,Hong K S,Lee E J,et al.High levels of apolipoprotein B/AI ratio are associated with intracranial atherosclerotic stenosis[J].Stroke,2011,42(11):3040.
[13]Sierra-Johnson J,Somers V K,Kuniyoshi F H,et al.Comparison of apolipoprotein-B/apolipoprotein-AI in subjects with versus without the metabolic syndrome[J].Am J Cardiol,2006,98(10):1369.
[14]Lei C,Wu B,Liu M,et al.Risk Factors and Clinical Outcomes Associated with Intracranial and Extracranial Atherosclerotic Stenosis Acute Ischemic Stroke[J].J Stroke Cerebrovasc Dis,2014,23(5):1112.
[15]Kwon S U,Hong K S,Kang D W,et al.Efficacy and safety of combination antiplatelet therapies in patients with symptomatic intracranial atherosclerotic stenosis[J].Stroke,2011,42(10):2883.
[16]Bokura H,Yamaguchi S,Iijima K,et al.Metabolic syndrome is associated with silent ischemic brain lesions[J].Stroke,2008,39(5):1607.
吉林省科技發展計劃項目(20150101139JC)
*通訊作者
1007-4287(2017)12-2148-03
2017-02-15)

