N- 乙酰半胱氨酸對帕金森病模型大鼠黑質氧化應激相關指標的影響
徐佳莉 劉 斌 胡馨月 董亞楠 崔 穎
華北理工大學附屬醫院神經內一科,河北 唐山 063000
·論著科研之窗·
N- 乙酰半胱氨酸對帕金森病模型大鼠黑質氧化應激相關指標的影響
徐佳莉 劉 斌△胡馨月 董亞楠 崔 穎
華北理工大學附屬醫院神經內一科,河北 唐山 063000
目的觀察抗氧化劑N- 乙酰半胱氨酸(N- acetylcysteine,NAC)對帕金森病(Parkinson's disease,PD)模型大鼠黑質氧化應激相關指標的影響。方法36只健康雄性SD大鼠隨機分為假手術組(sham組)、帕金森病模型組(PD組)和抗氧化劑NAC組(NAC組),每組又分為模型制備成功后4 d和8 d兩個亞組,每個亞組6只。采用頸背部皮下注射魚藤酮制作帕金森病大鼠模型,微量酶標法檢測大鼠黑質谷胱甘肽(GSH)、谷胱甘肽過氧化物酶(GSH- Px)、超氧化物歧化酶(SOD)和丙二醛(MDA)的含量。結果(1)與sham組相比,PD組各時間點大鼠黑質中GSH、GSH- Px、SOD含量降低(均P<0.01),8 d組低于4 d組(均P<0.05);與PD組相比,NAC組大鼠黑質中GSH、GSH- Px、SOD含量增多(均P<0.01),8 d組高于4 d組(均P<0.05)。(2)與sham組相比,PD組大鼠黑質中MDA含量增多(均P<0.01),8 d組高于4 d組(P<0.05);與PD組相比,NAC組大鼠黑質中MDA含量降低(均P<0.01),8 d組低于4 d組(P<0.05)。結論N- 乙酰半胱氨酸可減輕帕金森病模型大鼠的氧化應激損傷,具有神經保護作用。
帕金森病;N- 乙酰半胱氨酸;氧化應激;谷胱甘肽;谷胱甘肽過氧化物酶;超氧化物歧化酶;丙二醛;黑質
帕金森病(Parkinson’s disease,PD)是以黑質多巴胺能神經元進行性退變和路易小體形成為主要病理特征的一種常見于中老年人的慢性進行性神經系統退行性疾病[1],目前帕金森病的發病機制尚未完全闡明,但有證據顯示氧化應激在PD的發病中起關鍵作用[2- 3],所以針對PD抗氧化治療的研究越來越受重視。N- 乙酰半胱氨酸(N- acetylcysteine,NAC)是一種含巰基的硫醇類復合物,為臨床常用的祛痰劑,還用于對急性乙酰氨基酚中毒的解毒治療。隨著對該藥認識的不斷深入,發現 NAC是一種新型的氧自由基清除劑,具有抗氧化清除氧自由基,抗細胞凋亡等作用[4- 5]。本研究采用頸背部皮下注射魚藤酮制備帕金森病模型大鼠,觀察帕金森病模型大鼠黑質中谷胱甘肽(glutathione,GSH)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH- PX)、超氧化物歧化酶(superoxide dismutase,SOD)及丙二醛(malonaldehyde,MDA)含量的變化及N- 乙酰半胱氨酸對其變化的影響,探討N- 乙酰半胱氨酸對帕金森病的神經保護作用。
1 材料與方法
1.1實驗動物及分組健康雄性Sprague- Dawley(SD)大鼠36只,鼠齡3~4個月,體質量250~300 g,購于北京華阜康生物科技股份有限公司,合格證號SCXK(京)2015- 0038。在華北理工大學屏障環境動物實驗室自由進食喂養,室溫(23±2)℃,相對濕度45%~55%,每日光照12 h,飼養2周熟悉環境后進入實驗。實驗大鼠隨機分為假手術組(sham組)、帕金森病模型組(PD組)和抗氧化劑NAC組(NAC組),每組又分為模型制備成功后4 d和8 d兩個亞組,每個亞組6只。
1.2主要試劑及儀器魚藤酮、葵花油購于北京博奧森生物工程有限公司。NAC購于日本MBL公司。谷胱甘肽、谷胱甘肽過氧化物酶、超氧化物歧化酶及丙二醛試劑盒購于南京建成科技股份有限公司。腦立體定位儀購于日本Narishige公司。NANODROP 2000超微量分光光度計購于美國Thermo公司。
1.3帕金森病模型制備采用頸背部皮下注射魚藤酮制備帕金森病大鼠模型[6]。魚藤酮以葵花油配制成2 mg/mL的乳液,充分震蕩混勻后避光保存,PD組及NAC組大鼠稱體質量后每只大鼠每日給予魚藤酮2 mg/kg頸背部皮下注射,假手術組每日頸背部皮下注射等量葵花油,待模型制備成功后停止注射。以出現行為學改變作為判定模型成功的指標[7],選擇得分2~6分者作為實驗大鼠。
1.4給藥方法NAC組,待模型制備成功后,麻醉大鼠,將大鼠俯臥位固定于立體定位儀上,切開頭皮,分離皮下組織,蘸少量3%雙氧水擦試顱骨以充分暴露前囟的“十字交叉”骨性結構。側腦室立體定位:以前囟點為中心,旁開1.5 mm,向后囟方向0.8 mm,用20 mL注射器針頭緩慢鈍性鉆孔,有明顯穿透感后拔出。用已固定好位置的裝有NAC 5 μL的微量進樣器緩慢注射,進針深度達3.5 mm,在5 min內勻速緩慢注完,留針5 min后緩慢拔針。假手術組和PD組大鼠進行側腦室注射生理鹽水5 μL。術后連續3 d腹腔注射青霉素8萬U/d預防感染。
1.5微量酶標法用10%水合氯醛(0.3 mL/100g)對大鼠進行深度麻醉,快速斷頭取腦,在冰臺上分離出新鮮黑質,用4 ℃ PBS沖洗除去殘余血液,在干冰上用濾紙拭干,立即置于-80 ℃超低溫冰箱。取組織塊用4 ℃預冷的PBS漂洗,除去血液,濾紙拭干,準確稱質量,放入到冰上的15 mL的離心管內,用眼科小剪盡快剪碎組織塊,按重量(g):體積(mL)=1:9的比例,加入4 ℃預冷的生理鹽水,組織勻漿器充分勻漿,3 000 r/min,4 ℃離心15 min,將離心好的勻漿取上清棄下面沉淀。谷胱甘肽、谷胱甘肽過氧化物酶、超氧化物歧化酶及丙二醛測定的具體操作步驟嚴格按照說明書進行。
2 結果
與sham組相比,PD組各時間點大鼠黑質中GSH、GSH- Px、SOD含量降低(均P<0.01),8 d組低于4 d組(均P<0.05);與PD組相比,NAC組大鼠黑質中GSH、GSH- Px、SOD含量增多(均P<0.01),8 d組高于4 d組(均P<0.05)。與sham組相比,PD組大鼠黑質中MDA含量增多(均P<0.01),8 d組高于4 d組(P<0.05);與PD組相比,NAC組大鼠黑質中MDA含量降低(均P<0.01),8 d組低于4 d組(P<0.05)。見表1、2和圖1、2。
表1 各組大鼠黑質GSH、GSH- Px檢測結果
注:與sham組比較,*P<0.01;與PD組比較,△P<0.01;與4 d亞組比較,☆P<0.05,☆☆P<0.01
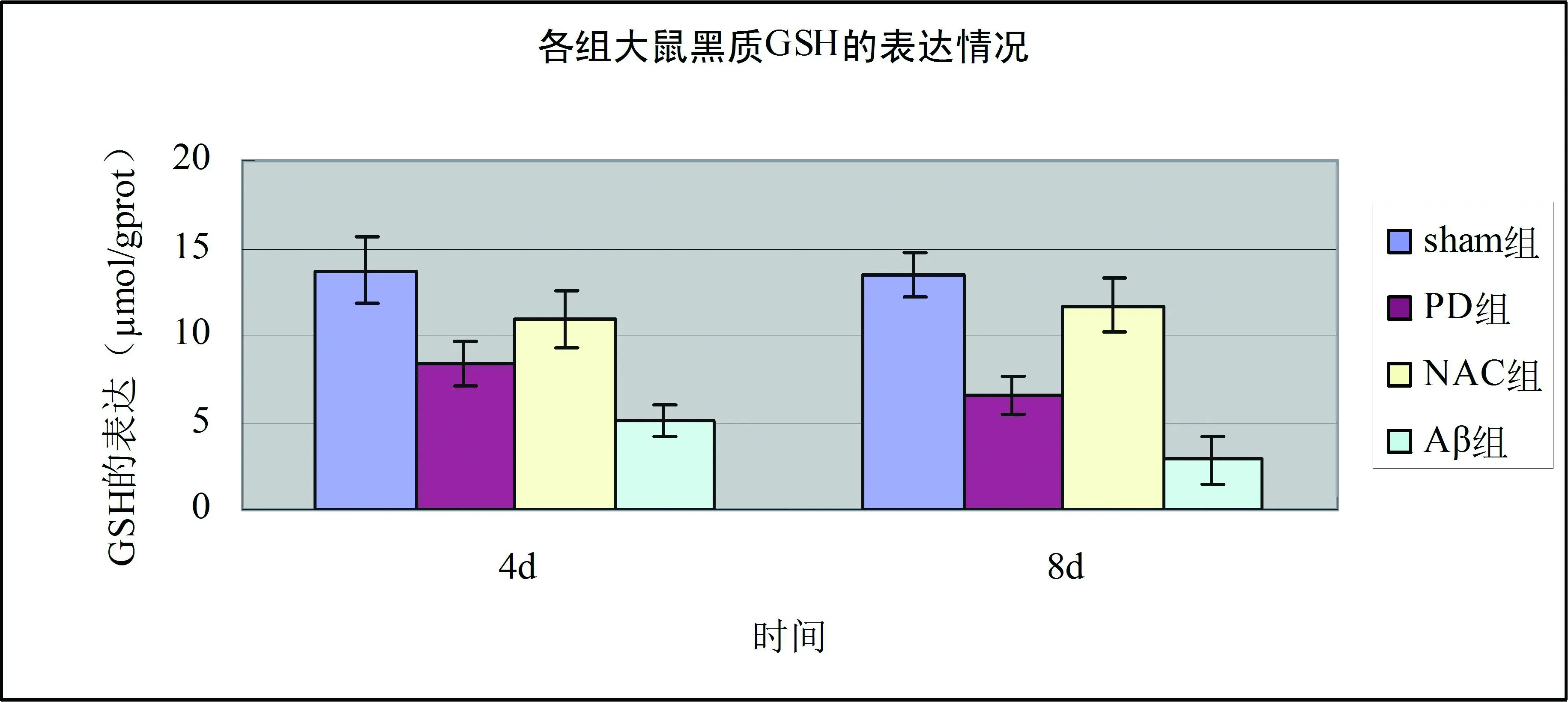
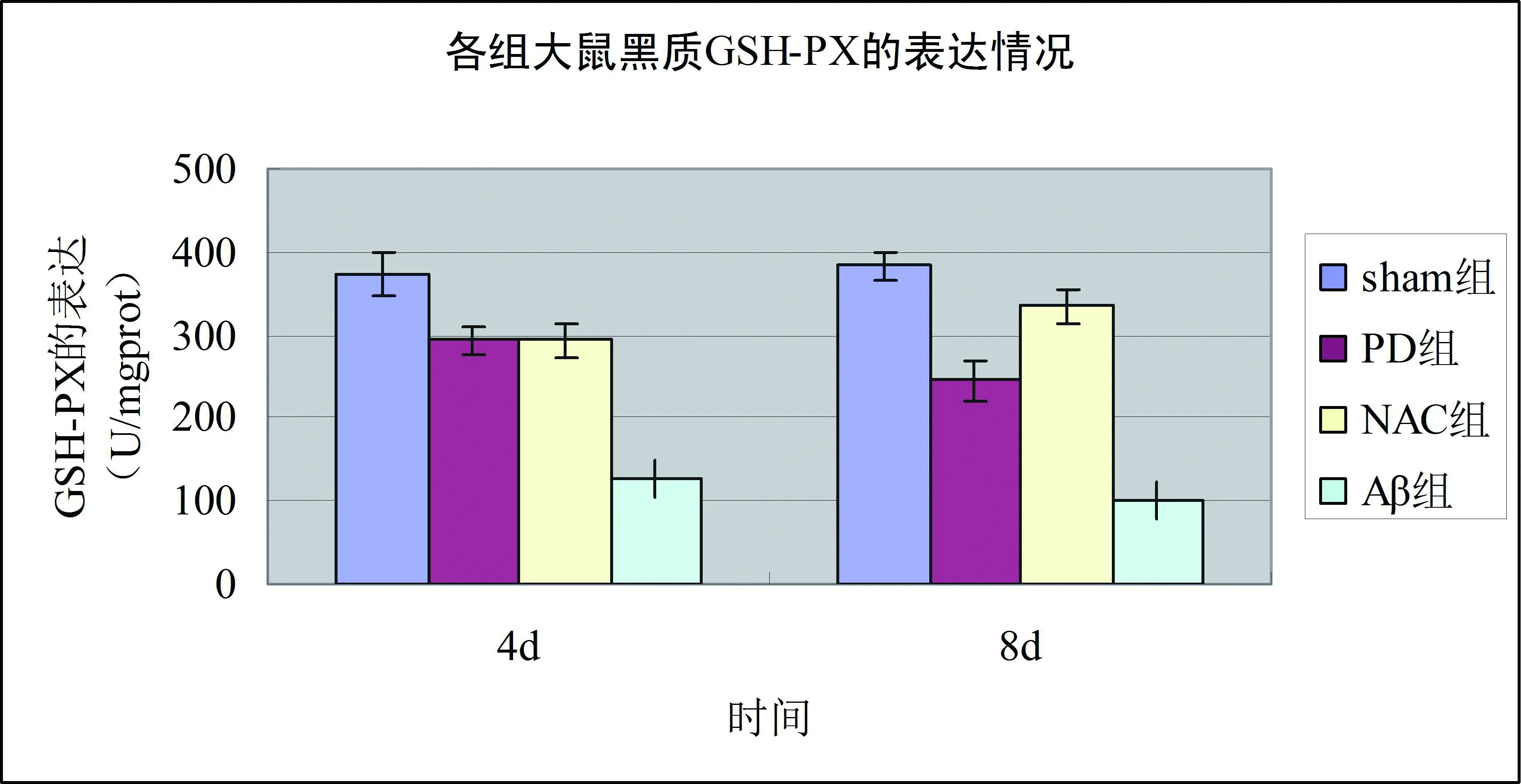
圖1 各組大鼠黑質GSH、GSH- Px檢測結果
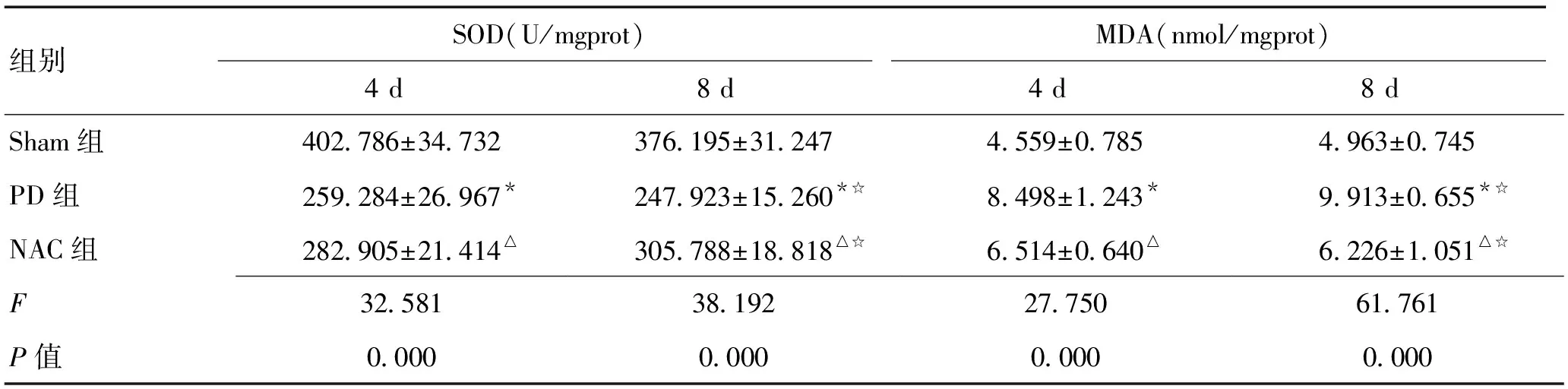
組別SOD(U/mgprot)MDA(nmol/mgprot)4d8d4d8dSham組402786±34732376195±312474559±07854963±0745PD組259284±26967*247923±15260*☆8498±1243*9913±0655*☆NAC組282905±21414△305788±18818△☆6514±0640△6226±1051△☆F32581381922775061761P值0000000000000000
注:與Sham組比較,*P<0.01;與PD組比較,△P<0.01;與4 d亞組比較,☆P<0.05,☆☆P<0.01
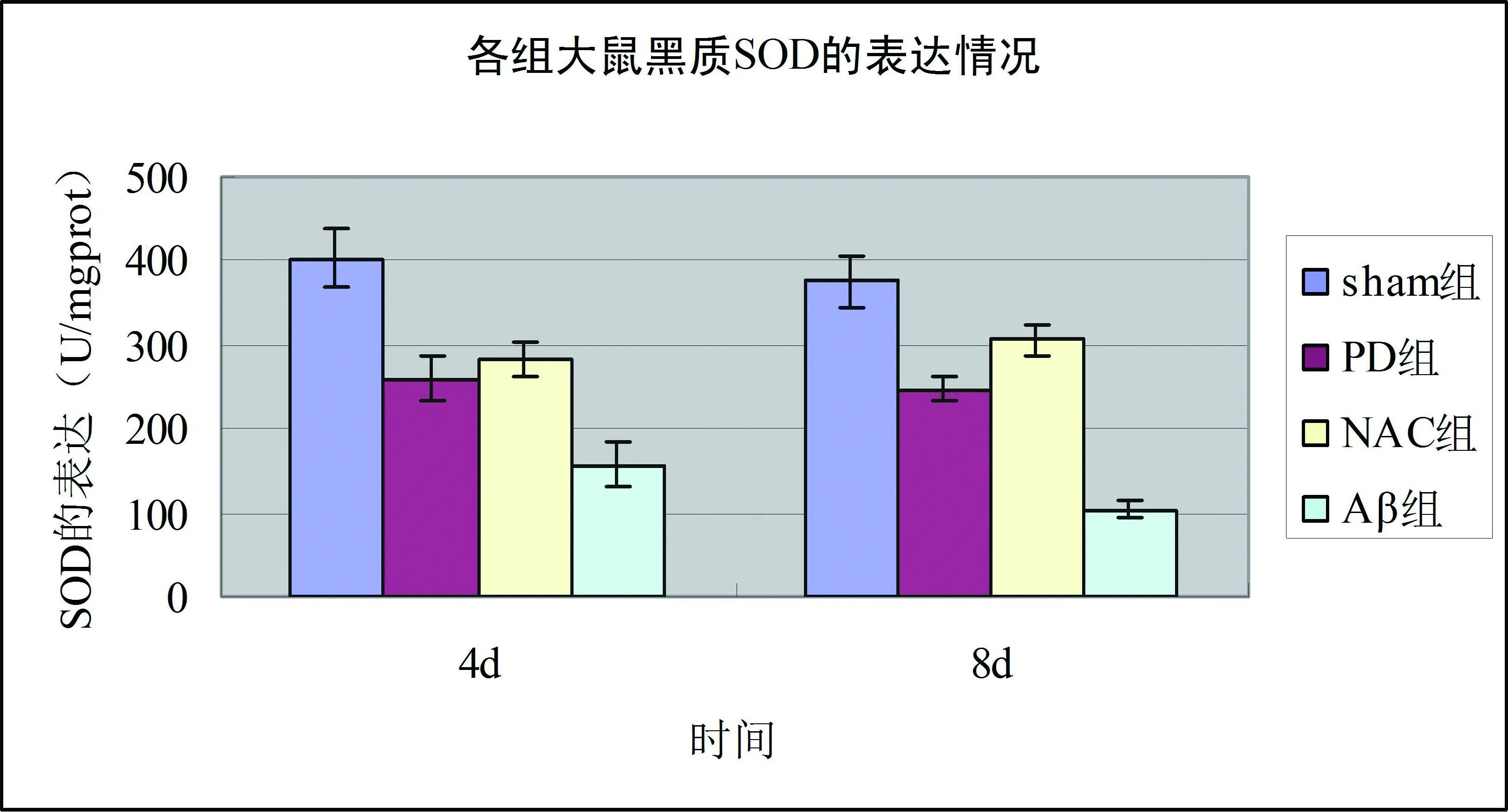

圖2 各組大鼠黑質SOD、MDA檢測結果
3 討論
氧化應激是體內產生的活性氧族超過了內源性抗氧化系統的一種失平衡狀態[8],過多的氧自由基和過氧化合物超過了機體自身的抗氧化能力,導致了蛋白及脂質的氧化損傷及細胞損傷。研究表明,氧化應激在PD的發病機制中發揮著關鍵作用[9- 10]。谷胱甘肽(GSH)是機體內抗氧化系統最主要的成員,谷胱甘肽過氧化物酶(GSH- PX)是在抗氧化防御系統中起重要作用的一類功能蛋白質,它能夠清除多種過氧化物并保護組織細胞免受過氧化損傷[11- 12]。超氧化物歧化酶(SOD)是一類能夠將超氧陰離子催化為過氧化氫和氧氣的金屬結合酶,是機體重要的抗氧化酶之一,其活性反映機體對氧自由基清除能力的高低[13]。丙二醛(MDA)是脂質過氧化反應的產物,也是常用的反映氧化應激水平的指標之一,測定MDA的含量可以間接反映抗氧化酶功能[14]。N- 乙酰半胱氨酸(N- acetylcysteine,NAC)是一種含巰基化合物,它能夠促進谷胱甘肽(GSH)的合成,提高組織內GSH含量,增強組織的抗自由基能力,是一種強有力的抗氧化劑[15]。基于NAC的抗氧化作用,本實驗選擇NAC作為抗氧化劑。實驗結果顯示,PD組大鼠黑質中GSH、GSH- Px、SOD表達降低,且隨時間延長有下降趨勢,MDA表達增多,隨時間延長有上升趨勢,說明PD模型大鼠的氧化應激水平增加,氧化應激在PD 的發病中具有重要作用。與PD組相比,NAC組大鼠黑質中GSH、GSH- Px、SOD表達增多,且隨時間延長有上升趨勢,MDA表達降低,隨時間延長有下降趨勢,說明N- 乙酰半胱氨酸可減輕帕金森病模型大鼠氧化應激損傷,具有神經保護作用。這為臨床上對PD患者進行抗氧化治療提供了理論依據。
[1] 中華醫學會神經病學分會帕金森病及運動障礙學組.中國帕金森病治療指南[J].中華神經科雜志,2014,47(6):428- 433.
[2] Romuk EB,Szczurek W,Nowak PG,et al.Effects of Propofol on the Liver Oxidative- Antioxidant Balance in a Rat Model of arkinson's Disease[J].Adv Clin Exp Med,2016,25(5):815- 820.
[3] Jiang T,Sun Q,Chen S.Oxidative stress:A major pathogenesis and potential therapeutic target of antioxidative agents in Parkinson's disease and Alzheimer's disease[J].Prog Neurobiol,2016,147:1- 19.
[4] Rushworth GF,Megson IL.Existing and potential therapeutic uses for N- acetylcysteine:the need for conversion to intracellular glutathione for an- tioxidant benefits[J].Pharmacol Ther,2014,141(2):150- 159.
[5] Lee YM,Park SH,Shin DI,et al.Oxidative modification of peroxiredoxinis associated with drug- induced apoptotic signaling in experimental models of Parkinson disease[J].Biol Chem,2008,283(15):9 986- 9 998.
[6] Zhang ZN,Zhang JS,Xiang J,et al.Subcutaneous rotenone rat model of Parkinson's disease:Dose exploration study[J].Brain Res,2017,1 655:104- 113.
[7] 陳忻,張楠,趙暉,等.魚藤酮致帕金森病大鼠行為學與黑質病理損傷的關系[J].中國神經精神疾病雜志,2008,34(4):232- 234.
[8] Ock CY,Kim EH,Choi DJ,et al.8- Hydroxydeoxyguan- osine:not mere biomarker for oxidative stress,but remedy for oxidative stress- implicated gastrointestinal diseases[J].World J Gastroenterol,2012,18(4):302- 308.
[9] Schapira AH,Jenner P.Etiology and pathogenesis of Parkinson’s disease[J].Mov Disord,2010,26:1 049- 1 055.
[10] Lu C,Wei Y,Hu R,et al.Transcranial Direct Current Stimulation Ameliorates Behavioral Deficits and Reduces Oxidative Stress in 1- Methyl- 4- Phenyl- 1,2,3,6- Tetrahydropyridine Induced Mouse Model of Parkinson’s Disease[J].Neuromodulation,2015,18(6):442- 446.
[11] 于揚,魏景艷.谷胱甘肽過氧化物酶及其合成機制[J].生物物理學報,2013,29(10):724- 737.
[12] 陳東萬,曹紅元,嚴家川,等.帕金森病患者血清氧化應激標志物的變化特點[J].現代生物醫學進展,2015,34(15):6 671- 6 674.
[13] 張笑天,鄭曉瑛.氧化自由基清除劑超氧化物歧化酶與疾病[J].中國公共衛生,2014 ,30(10):1 349- 1 352.
[14] Wang SG,Xu Y,Xie H,et al.AstragalosideⅣ prevents lipopolysaccharide induced injury in H9C2 Cardiomyocytes[J].Chin J Nat Med,2015,13(2):127- 132.
[15] Elbini Dhouib I,Jallouli M,Annabi A,et al.A minireview on N- acetylcysteine:An old drug with new approaches[J].Life Sci,2016,151:359- 363.
EffectsofN-acetylcysteineontheoxidativestresscorrelationindexinsubstantianigraofParkinson'sdiseasemodelrats
XUJiali,LIUBin,HUXinyue,DONGYanan,CUIYing
DepartmentofNeurologyFirst,theAffiliatedHospitalofNorthChinaUniversityofScienceandTechnology,Tangshan063000,China
ObjectiveTo observe the effects of N- acetylcysteine on the oxidative stress correlation index in substantia nigra of Parkinson's disease model rats.Methods36 SD rats were randomly divided into sham- operated group(sham group),PD model group(PD group) and antioxidant NAC group (NAC group),Each group was divided into 4 days and 8 days subgroups after the success of model preparation.PD rat model was established by injecting rotenone in subcutaneous.The content of SOD,GSH,GSH- Px and MDA in the substantia nigra were detected by Micro- enzyme.Results(1)Compared with the sham group ,the content of GSH,GSH- Px and SOD in the PD group were significantly reduced (allP<0.01),and in the 8 d group was lower than that in the 4 d group(allP<0.05);Compared with the PD group,the content of GSH,GSH- Px and SOD in NAC group was increased (allP<0.05),and in the 8 d group was higher than that in the 4 d group (allP<0.05).(2)Compared with the sham group,the content of MDA in the PD group was significantly increased (allP<0.05),and in the 8 d group was higher than that in the 4 d group (P<0.05).Conclusionwith the PD group,the content of MDA in NAC group was significantlydecreased (allP<0.05),and in the 8 d group was lower than that in the 4 d group (P<0.05).Conclusions N- acetylcysteine can attenuate oxidative stress injury in Parkinson's disease model rats,and has a protective effect on the nerve.
Parkinson's disease;N- acetylcysteine;Oxidative stress;Glutathione;Glutathione peroxidase;Superoxide dismutase;Malonaldehyde;Substantia nigra
10.3969/j.issn.1673- 5110.2017.20.002
河北省醫學科學研究重點課題(編號:20130064)
△通信作者:劉斌,碩士,主任醫師,教授,研究生導師。 Email:liubintsh@126.com
R- 332
A
1673- 5110(2017)20- 0006- 04
(收稿2017- 01- 23)
關慧

