小麥分子伴侶TaTCP22基因克隆及特性分析
胡曉薇+田原+喬夢+付金梅+張小紅+閔東紅
摘要: 非生物脅迫可引起蛋白的功能紊亂,維持蛋白的功能構象和阻止非天然蛋白的聚合,對于細胞存活很關鍵。伴侶素可以幫助蛋白質在脅迫條件下復性,在植物抵抗非生物脅迫中扮演著非常重要的角色。為分析伴侶素TaTCP22的分子特性,解析伴侶素的脅迫響應機制,以小麥的cDNA為模板擴增得到TaTCP22 ,利用生物信息學方法分析小麥TaTCP22 的分子特性,使用MEGA5對小麥TaTCP22蛋白序列及其同源序列進行多序列比對分析并構建同源物種間的系統進化樹;利用GSDS和PHYRE2在線工具分別對小麥TaTCP22 基因結構和三級結構進行分析;從Phytozome數據庫中獲取小麥TaTCP22 上游2 000 bp序列作為啟動子,用PLACE數據庫對小麥TaTCP22 啟動子的順式作用元件進行分析;利用實時熒光定量PCR檢測TaTCP22 在不同組織及在脫落酸(abscisic acid,簡稱ABA)、聚乙二醇(polyethylene glycol,簡稱PEG)、水楊酸(salicylicacid,簡稱SA)、氯化鈉(NaCl)、低溫脅迫處理下的表達量;利用In-Fusion技術構建TaTCP22 -16318GFP載體,采用PEG介導法將外源基因轉到小麥原生質體中,在激光共聚焦顯微鏡下觀察基因定位情況。小麥TaTCP22 全長1 643 bp,基因編碼區包含UTR區和13個內含子以及13個外顯子;啟動子元件分析表明,TaTCP22 包含多種逆境脅迫應答元件;亞細胞定位結果表明,TaTCP22蛋白主要定位在細胞核、細胞膜和細胞質中;實時熒光定量PCR結果顯示,TaTCP22在不同組織中的表達水平不同;TaTCP22 對于多種非生物脅迫均有不同程度的響應,說明TaTCP22 可能參與了多種脅迫應答途徑。
關鍵詞: 小麥;分子伴侶;TCP-1;脅迫響應;亞細胞定位
中圖分類號: Q785;S512.101 文獻標志碼: A
文章編號:1002-1302(2017)22-0027-05
小麥是主要的糧食作物之一,其生長發育、產量及品質受到干旱、低溫、鹽和病蟲害等生物和非生物脅迫的極大限制。僅鹽害就影響約20%的灌溉農業[1],因此揭示小麥抗逆的分子機制,對提高小麥產量和品質有重要意義。非生物脅迫通常造成蛋白質功能紊亂,維持蛋白質的功能結構域和阻止與非功能蛋白質聚合是細胞在非生物脅迫下存活的關鍵。熱激蛋白/分子伴侶是一類在細胞中幫助其他蛋白折疊、組裝、運輸、降解的蛋白質,在非生物脅迫下,可幫助其他蛋白質復性。熱激蛋白/分子伴侶可分為5類:HSP70家族、伴侶素(HSP60)、HSP90家族、Hsp100/Clp家族、小分子熱休克蛋白家族[2-3]。TCP-1屬于伴侶素(HSP60)家族,伴侶素廣泛存在于生物界,被分為2類:GroE(Ⅰ型)和伴侶素CCT(Ⅱ型)[4]。Ⅰ型是在細菌、線粒體、葉綠體中發現的,Ⅱ型是在古細菌和真核生物的細胞質中發現的[5]。CCT是一種廣泛存在于細胞漿中的異型寡聚蛋白,在肌動蛋白、微管蛋白的組裝和折疊中發揮重要的作用,具有相同的雙環背靠背垛疊結構(back to back stacked rings),由14~18個亞基組成,每個亞基的分子量約為60 ku。真核細胞的CCT由2個花托樣結構構成,只有少數蛋白是與CCT結合的天然底物[6]。除哺乳動物睪丸中發現的一種組織特異性亞基類型CCTζ-2外,所有生物的CCT都由8個相同的亞基(α、β、γ、δ、ε、ζ、η、θ)構成[7]。Yamada等從紅樹林cDNA中克隆BsCCTα轉化的大腸桿菌能增強對鹽和滲透脅迫的忍耐性[8]。前期研究主要集中在CCT伴侶素的結構、功能及作用底物方面,且在動物中的研究較多,而對CCT在植物體中響應脅迫的功能研究較少。本研究從小麥中克隆到1個伴侶素基因TaTCP22,并對小麥TaTCP22 的生物學特性以及參與非生物脅迫的應答機制進行研究,為闡述CCT提高小麥抗逆性的分子機制提供理論依據。
1 材料方法
1.1 試驗材料
小麥輪選987種子由西北農林科技大學小麥育種課題組提供。16318 GFP載體由筆者所在實驗室保存。小麥播種在土中(蛭石、泥炭土體積比=1 ∶ 1),在溫室適宜的條件中生長2周,取出后用蒸餾水將根沖洗干凈,置于濾紙上進行干燥處理,將干燥后的整株放入液氮中冷凍10 min后取出并迅速保存到 -80 ℃ 冰箱中準備提取RNA。
1.2 方法
1.2.1 基因TaTCP22 的全長克隆
利用美國國立生物技術信息中心(NCBI)網站的相關程序對測序結果進行比對,找出小麥TaTCP22 基因的全長序列,利用DNAMAN設計正向引物5′-ATGGGCGGCCCAGGC-3′和反向引物5′-TTAAGGCTTGAGAGCAATCG-3′。以小麥cDNA為模板進行PCR擴增,擴增片段總長為828 bp,反應程序為95 ℃ 5 min;95 ℃ 45 s,60 ℃ 45 s,72 ℃ 1 min,30個循環;72 ℃ 10 min。對PCR產物進行瓊脂糖凝膠電泳,并利用DNA純化回收試劑盒(TaKaRa)進行膠回收。用Zero Back Fast Ligation Kit(TIANGEN) pZeroBack/blunt載體快速連接膠回收產物,利用熱激法將連接產物轉入大腸桿菌DH5α中,然后進行菌液PCR陽性鑒定,對陽性菌液進行測序,將其中正確的保菌備用。
1.2.2 進化樹和基因蛋白序列分析
根據小麥TaTCP22蛋白序列進行同源性搜索,下載與小麥TaTCP22蛋白序列相似度>50%的其他物種蛋白序列。使用MEGA5對TaTCP22蛋白序列進行多序列比對分析,將分析結果使用鄰接法生成系統進化樹,其中Bootstrap值設為1 000。endprint
1.2.3 基因結構和三級結構預測
根據GSDS(http://gsds.cbi.pku.edu.cn/)在線工具對基因的結構進行分析,制作小麥TaTCP22 基因外顯子-內含子結構示意圖。利用PHYRE2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page. cgi?id=index)在線工具對基因的三級結構進行預測。
1.2.4 啟動子順式作用元件分析
從基因組數據庫Phytozome(http://www.phytozome.net/search.php)中選取基因起始密碼子上游2 000 bp序列作為啟動子區,利用植物順式作用元件數據庫PLACE26.0(http://www.dna.affrc.go.jp/PLACE/)分析基因的順式作用元件。
1.2.5 亞細胞定位
利用In-Fusion技術構建TaTCP22 -16318GFP載體,利用聚乙二醇(PEG)誘導轉化法將外源基因轉到小麥原生質體中,25 ℃培養18 h,在激光共聚焦顯微鏡下觀察其定位情況。
1.2.6 組織特異性及表達模式分析
分別取小麥品種輪選987的根、莖、葉、雌蕊、雄蕊、穎殼、胚性愈傷組織為試驗材料,液氮速凍保存。對生長2周的小麥幼苗分別進行脫落酸 (ABA,200 μmol/L)和水楊酸(SA,1 mmol/L)、干旱(6% PEG)、低溫(4 ℃)、NaCl(200 mmol/L)處理,并分別于處理后0、1、2、4、 8、12、24、48 h取樣,液氮速凍后保存于-80 ℃冰箱備用。
用TRIzol試劑盒(北京康為世紀生物科技有限公司)提取總RNA,分別利用小麥不同組織和5種脅迫下的總RNA為模板,以SYBR Green染料法進行實時熒光定量PCR。用實時熒光定量PCR儀(Bio-Rad CFX96)進行PCR擴增,反應體系如下:2×Taq PCR Master Mix(含熒光染料)12.5 μL、10 μmol/L 引物各 1 μL、ddH2O 7.5 μL、cDNA模板3 μL。反應條件為95 ℃ 3 min;95 ℃ 10 s,58 ℃ 20 s,72 ℃ 30 s,40個 循環。PCR引物序列為F:5′-AGCCTGACCGCATCCTATTA- 3′,R:5′-AGCGACTTTGGCCTGAACT-3′。以小麥β-actin基因為內標,其引物序列為β-actin-F:5′-CTCCCTCACAA CAACCGC-3′和β-actin-R:5′-TACCAGGAACTTCCATA CCAAC-3′。采用2-ΔΔCT法計算基因表達量。
2 結果與分析
2.1 TaTCP22 的特性分析
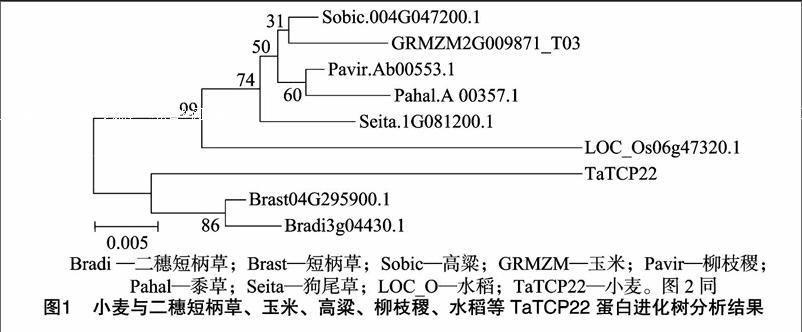
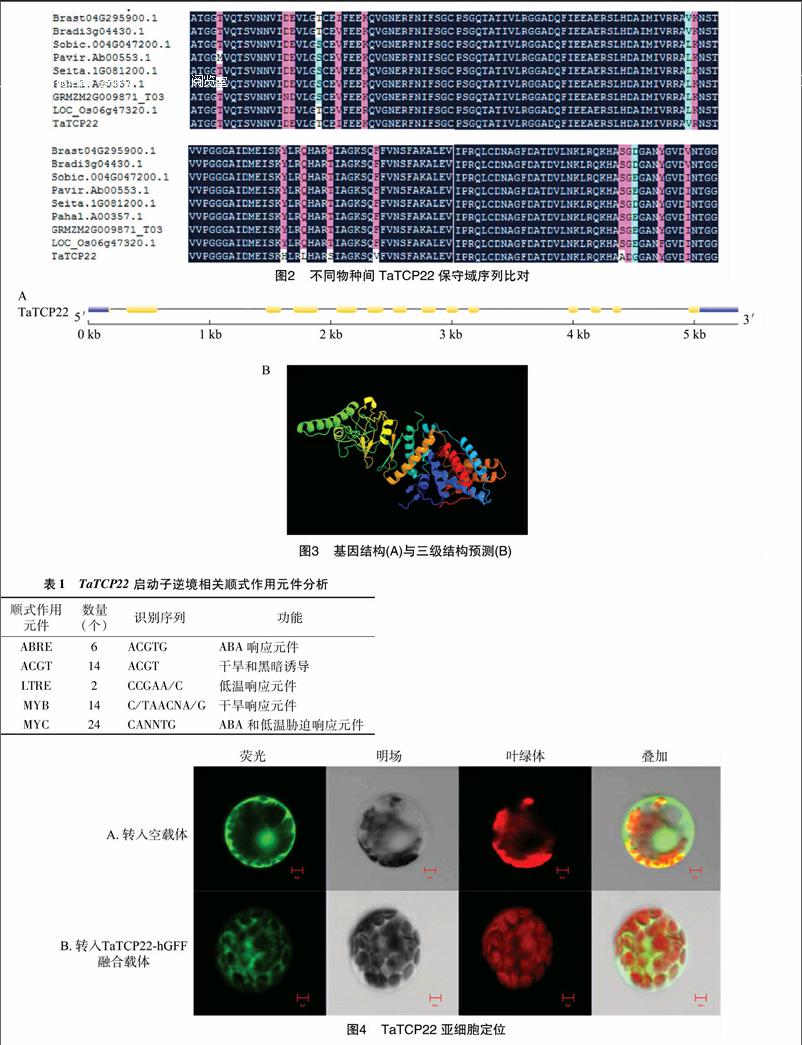
小麥TaTCP22 全長1 674 bp,編碼557個氨基酸,其對應蛋白的分子量為60.0 ku,等電點為9.13。氨基酸序列分析發現,小麥TaTCP22蛋白包含1個Porin3保守域,屬于Porin3轉錄因子家族第一大類。運用MEGA5軟件對TaTCP22蛋白及其他物種中的同源蛋白做系統進化樹分析(圖1)。用DNAMAN分析二穗短柄草、玉米、高粱、柳枝稷、水稻等作物的蛋白保守域,圖2結果顯示,小麥TaTCP22與短柄草親緣關系最近,親緣關系越近,蛋白結構越相似。
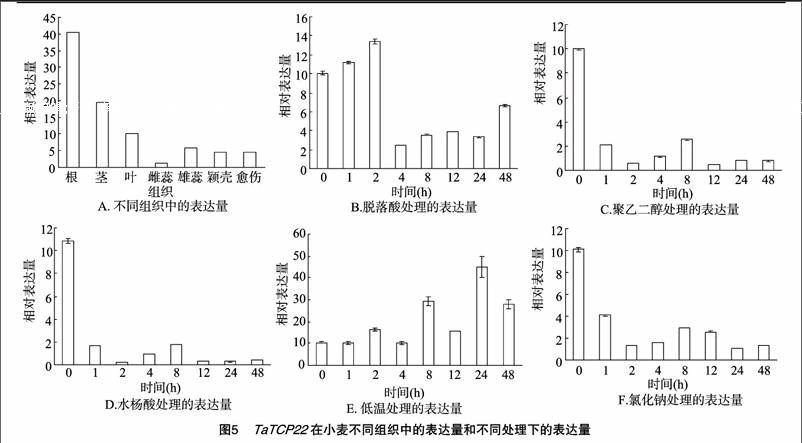
從Phytozome基因組數據庫中獲得基因組序列和編碼序列(coding sequence,簡稱CDS),對小麥TaTCP22外顯子-內含子結構進行分析。圖3結果表明,該基因編碼區包含非編碼區(untranslated region,簡稱UTR)和13個內含子以及13個外顯子;對該蛋白的三級結構進行分析發現,小麥TaTCP22 三級結構預測的可信度為100%,包含18個α螺旋結構和19個β折疊結構。
2.2 啟動子順式作用元件分析
用PLACE在線工具分析小麥TaTCP22 啟動子順式作用元件,結果(表1)發現,該啟動子區域中包含ABRE、ACGT、LTRE、MYB、MYC等逆境相關的順式作用元件[9],其中MYC元件數量最多,為24個,其次為ACGT。據報道,這些元件在植物處于ABA、低溫、干旱等脅迫響應中發揮作用[10-11]。
2.3 亞細胞定位
將TaTCP22與GFP蛋白融合的TaTCP22-hGFP融合表達載體和GFP空載體分別轉入小麥原生質體中,在激光共聚焦顯微鏡下進行觀察,結果顯示,在轉入空載體的小麥原生質體整個細胞中可見明亮的綠色熒光(圖4-A),轉入 TaTCP22-hGFP融合表達載體的小麥原生質體主要在細胞膜、細胞質和細胞核中可見綠色熒光(圖4-B)。結果說明小麥TaTCP22主要分布在細胞膜、細胞質和細胞核中。
2.4 表達模式分析
TaTCP22 在小麥組織中的特異性表達分析結果(圖5-A)顯示,TaTCP22 基因在根、莖、葉、雌蕊、雄蕊、穎殼、愈傷中都有表達,根中表達量最高,說明TaTCP22 主要在根中發揮作用。莖、葉中的表達量次之,雄蕊、愈傷和穎殼的表達量相似,雌蕊中表達量最少。
迄今為止,不同物種中鑒定出的大部分TaTCP22 基因參與[CM(25]了對生物和非生物逆境的響應。通過熒光定量PCR檢測
ABA(200 μmol/L)和SA(1 mmol/L)、干旱(6% PEG)、低溫(4 ℃)、NaCl(200 mmol/L)等不同脅迫處理下TaTCP22 基因的表達量,圖5結果表明,PEG、SA、NaCl處理下TaTCP22 基因的表達量下調;4 ℃低溫處理下,TaTCP22 在處理2 h后被誘導表達,2 h后表達量波動變化,24 h時表達量達到最大值。ABA處理下,TaTCP22 表達量在處理2 h達到最大值,之后都低于正常水平。上述結果表明,TaTCP22 基因的表達,受ABA、SA、干旱、低溫和NaCl的誘導,在ABA、干旱、NaCl處理下的表達模式有些相似。endprint
3 討論
TCP-1廣泛存在于真核及原核生物中,是一個典型的分子伴侶,受多種生物逆境和非生物逆境的誘導[12]。真核細胞中雙環背對背堆疊的多聚體分子伴侶素(chaperonin)TRiC/CCT是最為復雜的分子伴侶,可以幫助5%~10%的胞質蛋白進行折疊[13-15],包括許多重要的結構和調節蛋白,如細胞骨架組成的微管蛋白和肌動蛋白、細胞周期調控蛋白CDC20和CDH1[16-17]。
TRiC/CCT蛋白質的折疊是依賴ATP[18-19]進行的。本研究中的TaTCP22 編碼557個氨基酸,其保守域C端和N端包含β折疊結構,其頂端結構域包含1個螺旋突出結構域;赤道結構域形成1個環形接口,包含參與核苷酸表達的大部分殘基,可與ATP結合并有微弱的ATP酶活性;中間區域形成的頂端表面口袋與核苷酸結合。CCT底物蛋白別構后形成單鏈,進入CCT中間內腔,與頂端結構域結合,形成復合物,該復合物與ATP結合后,可依賴ATP水解釋放的能量改變CCT頂端結構螺旋突出結構域的構象,并帶動環內構象的改變,完成蛋白質的折疊與組裝[7,20]。
目前關于植物分子伴侶功能特性的研究是有限的,當植物遭受脅迫時,植物體內的酶和結構蛋白發生結構和功能的改變,因此細胞可在應激條件下維持蛋白質功能結構的構象,防止非天然蛋白質的聚集使得細胞在應激條件下的存活顯得尤為重要[21]。為維持細胞間的穩態,sHsp、Hsp70可維持蛋白質的功能構象,阻止在脅迫下對細胞存活非常重要的蛋白質的聚合,Hsp60、Hsp70和Hsp90可維持非天然蛋白的復性。當聚合形成一些變性蛋白和錯誤折疊蛋白時,Hsp100/Clp蛋白可溶解錯誤蛋白,重新折疊形成有功能的蛋白,或通過蛋白酶降解這些蛋白[22]。本研究中,TaTCP22 基因在ABA和 4 ℃ 低溫處理下被誘導表達,可能參與了維持一些非天然蛋白質復性的過程,推測其參與了脅迫應答。在啤酒酵母屬中,CCTα在低溫條件下,mRNA和蛋白的表達水平都提高了[23],這與本試驗研究結果一致;將4 ℃條件下的酵母細胞轉移至10 ℃條件下,其蛋白表達水平也明顯提高,表明CCTα蛋白對于初期從低溫恢復轉至高溫生長條件非常重要,與其他熱激蛋白從高溫恢復一致,猜測本試驗中的TaTCP22 基因也有相似的功能。植物對干旱的脅迫響應分為ABA依賴和ABA不依賴2種途徑,TaTCP22 基因對干旱表現為負調控,對ABA表現為正調控,說明該基因在干旱脅迫下不依賴ABA的信號途徑。因此推測該基因可能參與了低溫調控和非依賴ABA的干旱調控,在小麥適應非生物脅迫中起作用,為研究小麥的抗逆機制提供了幫助。
[HS2][HT8.5H]參考文獻:
[1] Suarez C,Cardinale M,Ratering S,et al. Plant growth-promoting effects of Hartmannibacter diazotrophicus on summer barley (Hordeum vulgare L.) under salt stress[J]. Applied Soil Ecology,2015,95:23-30.
[2]Boston R S,Viitanen P V,Vierling E. Molecular chaperones and protein folding in plants[J]. Plant Molecular Biology,1996,32(1/2):191-222.
[3]Wang J,Martin E,Gonzales V,et al. Differential regulation of small heat shock proteins in transgenic mouse models of neurodegenerative diseases[J]. Neurobiol Aqing,2008,29:586-597.
[4]Kubota H,Hynes G,Willison K. The Chaperonin containing t-complex polypeptide-1(TCP-1)[J]. The FEBS Journal,1995,230(1):3-16.
[5]Ranson N A,White H E,Saibil H R. Chaperonins[J]. Biochemical Journal,1998,333:233-242.
[6]Ursic D,Sedbrook J C,Himmel K L,et al. The essential yeast TCP1 protein affects actin and microtubules[J]. Molecular Biology of the Cell,1994,5(10):1065-1080.
[7]Valpuesta J M,Martin-Benito J,Gomez-Puertas P,et al. Structure and function of a protein folding machine:the eukaryotic cytosolic chaperonin CCT[J]. Febs Letters,2002,529(1):11-16.
[8]Yamada A,Sekiguchi M,Mimura T,et al. The role of plant CCT alpha in salt- and osmotic-stress tolerance[J]. Plant and Cell Physiology,2002,43(9):1043-1048.
[9]Baker S S,Wilhelm K S,Thomashow M F. The 5′-region of Arabidopsis-thaliana cor15a has cis-acting elements that confer cold-,drought- and ABA-regulated gene-expression[J]. Plant Molecular Biology,1994,24(5):701-713.endprint
[10] Urao T,Yamaguchishinozaki K,Urao S,et al. An Arabidopsis myb homolog is induced by dehydration stress and its gene-product binds to the conserved MYB recognition sequence[J]. Plant Cell,1993,5(11):1529-1539.
[11]Abe H,Urao T,Ito T,Seki M,et al. Arabidopsis AtMYC2 (bHLH) and AtMYB2 (MYB) function as transcriptional activators in abscisic acid signaling[J]. Plant Cell,2003,15(1):63-78.
[12]Lopez T,Dalton K,Frydman J. The mechanism and function of group Ⅱ chaperonins[J]. Journal of Molecular Biology,2015,427(18):2919-2930.
[13]Yam A Y,Xia Y,Lin H T J,et al. Defining the TRiC/CCT interactome links chaperonin function to stabilization of newly made proteins with complex topologies[J]. Nature Structural and Molecular Biology,2008(15):1255-1262.
[14]Liang X H,Shen W,Sun H,et al. TCP1 complex proteins interact with phosphorothioate oligonucleotides and can co-localize in oligonucleotide-induced nuclear bodies in mammalian cells[J]. Nucleic Acids Res,2014,42(12):7819-7832.[HJ1.7mm]
[15]Wang S Q,Zhang W J,Yang K L,et al. Isolation and characterization of a novel Dehalobacter species strain TCP1 that reductively dechlorinates 2,4,6-trichlorophenol[J]. Biodegradation,2014,25(2):313-323.
[16]Yaffe M B,Farr G W,Miklos D,et al. TCP1 complex is a molecular chaperone in tubulin biogenesis[J]. Nature,1992,358:245-248.
[17]Vinh D B,Drubin D G. A yeast TCP-1-like protein is required for actin function in vivo[J]. Proc Natl Acad Sci U S A,1994,91(19):9116-9120.[HJ1.75mm]
[18]Frydman J,Nimmesgern E,Erdjument-Bromage H,et al. Function in protein folding of TRiC,a cytosolic ring complex containing TCP-1 and structurally related subunits[J]. EMBO J,1992,11(13):4767-4778.
[19]Spiess C,Meyer A S,Reissmann S,et al. Mechanism of the eukaryotic chaperonin:protein folding in the chamber of secrets[J]. Trends in Cell Biology,2004,14(11):598-604.
[20]Llorca O,Martin-Benito J,Grantham J,et al. The ‘sequential allosteric ring mechanism in the eukaryotic chaperonin-assisted folding of actin and tubulin[J]. EMBO Journal,2001,20(15):3893-4323.
[21]Wang W X,Vinocur B,Shoseyov O,et al. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response[J]. Trends in Plant Science,2004,9(5):244-252.
[22]Ben-Zvi A P,Goloubinoff P. Review:Mechanisms of disaggregation and refolding of stable protein aggregates by molecular chaperones[J]. Journal of Structural Biology,2001,135(2):84-93.
[23]Somer L,Shmulman O,Dror T,et al. The eukaryote chaperonin CCT is a cold shock protein in Saccharomyces cerevisiae[J]. Cell Stress & Chaperones,2002,7(1):47-54.endprint

