金堂黑山羊FSH信號調節對下丘腦基因表達譜的影響
曹 冶,趙素君,謝 晶,王秋實,廖黨金
(1.四川省畜牧科學研究院,四川 成都 610066;2.動物遺傳育種四川省重點實驗室,四川 成都 610066)
金堂黑山羊FSH信號調節對下丘腦基因表達譜的影響
曹 冶1,2,趙素君1,2,謝 晶1, 2,王秋實1,2,廖黨金1,2
(1.四川省畜牧科學研究院,四川 成都 610066;2.動物遺傳育種四川省重點實驗室,四川 成都 610066)
【目的】本研究旨在搞清楚金堂黑山羊FSH信號調節機制的作用模式。【方法】將10只生殖周期相同的健康空懷的金堂黑山羊成年母羊隨機分成2組,一組為對照組,一組為試驗組。在發情后的第2天對試驗組金堂黑山羊進行FSH肌肉注射100IU,并在注射24 h后,摘取金堂黑山羊的下丘腦;對照組發情后的第3天摘取下丘腦,分別提取他們的總RNA,進行表達譜測序。【結果】經測序分析:對照組和試驗組分別得到有效序列26004442和25041098條;經統計分析后,得到歸一化序列25338808和24413890條,與山羊基因組的符合率分別達85.31 %和85.32 %。比對后發現152個基因出現顯著性差異表達,其中117個基因上調了表達,35個基因下調了表達。GO功能分類發現1個生物學過程出現了顯著性差異。KEGG功能分類沒發現調節途徑發生了顯著性改變。結果顯示FSH信號通過負反饋調節的方式對下丘腦進行調節,除了少量的基因表達隨著FSH信號強度的變化外,其主要的生物學過程,調節途徑均無顯著性變化,這說明FSH信號的負向調節要輕微很多。【結論】FSH信號通過負反饋調節的方式對下丘腦進行調節,相比正向調節,FSH信號的負向調節要輕微很多。
金堂黑山羊;FSH信號;下丘腦;基因表達譜
【研究意義】金堂黑山羊屬我國優良的地方黑山羊品種。它們的繁殖力顯著高于其他一些山羊品種,據報道金堂黑山羊的產羔數達2.40,大大高于世界上其它優秀山羊品種(波爾山羊2.00,南江黃羊2.10)[1]。動物繁殖力與FSH信號通路緊密相關,搞清楚金堂黑山羊FSH信號通路的調節機制,對合理利用其高繁殖性能具有極其重要的意義。【前人研究進展】在前期研究中,發現金堂黑山羊的繁殖器官中有2條FSHR同時表達,通過形成異源二聚體顯著增加了FSH信號強度,促進了排卵,從而形成高繁殖力。基于以上研究,我們發現動物高繁殖力的主要控制因素在于FSH信號通路。然而FSH是由腦垂體分泌的激素,經血液循環進入靶器官,進行生殖調節,在此過程中,會受到較多的因素(如FSH劑量、FSH受體表達、FSH與受體結合,結合后下游因子作用等)影響,這些因素疊加起來進一步影響動物排卵。以上發現表明動物對FSH信號通路的調節存在著一定的調節機制,可能是受研究手段的限制,到目前為止,尚未見報道。下丘腦是動物性腺軸的重要一環,它通過釋放促性腺釋放激素來啟動動物垂體分泌垂體激素,垂體激素作用于性腺啟動排卵機制,同時啟動性腺分泌性激素來優化生殖內環境,從而啟動動物生殖,性腺軸不僅正向調節動物排卵,同時也負反饋調節上游激素的分泌等[2-3],到目前其負反饋調節機制并不明朗。【本研究切入點】本研究通過改變金堂黑山羊的FSH信號強度,來測定下丘腦基因表達譜的變化。【擬解決的關鍵問題】通過本次研究為徹底搞清楚FSH信號的調節機制打下堅實基礎。
1 材料與方法
1.1 實驗動物
在金堂黑山羊原種場隨機選取年齡在3~5歲,體重30~40 kg,營養良好、前3胎產仔數在2個以上的健康空懷的金堂黑山羊成年母羊10只作為試驗用羊,供試羊在欄內散放飼養,自由采食、飲水。實驗前,觀察發情情況,連續觀察30 d。
1.2 主要試劑
Trizol為Invetrogen公司(美國)產品,FSH購自于寧波激素一廠,化學試劑除注明外,均為國產分析純。
1.3 FSH處理
將10只試驗用羊隨機分成2組,每組5只羊。一組為對照組,不進行FSH注射。另一組為試驗組。在發情后的第2天對試驗組金堂黑山羊進行FSH肌肉注射,注射劑量為100 IU,并在注射24 h后,摘取金堂黑山羊的卵巢。同時在對照組發情后的第3天摘取卵巢。卵巢液氮速凍后在-80 ℃條件下保存,用于基因表達譜分析。
1.4 總 RNA 提取
用Trizol試劑提取卵巢總RNA。提取步驟按照操作說明進行。將提取的卵巢總RNA送上海美吉生物有限公司進行表達譜測序分析。將得到的數據進行質控分析,包括A/T/G/C堿基含量分布統計、堿基質量分布分析、飽和度分析、冗余序列分析以及基因覆蓋度分析,從而確定表達譜測序分析的質量。
1.5 GO(Gene Ontology)功能分類和KEGG PATHWAY代謝途徑分析
將測得的基因表達譜用軟件Goatools (https://github.com/tanghaibao/GOatools) 進行GO功能富集分析,使用Fisher精確檢驗。為控制計算的假陽性率,使用多重檢驗方法(Bonferroni)對P值進行了校正,通常情況下,當經過校正的P值(P_fdr)≤0.05時,認為此GO功能存在顯著富集情況[4]。
將測得的基因表達譜用KOBAS(http://kobas.cbi.pku.edu.cn/home.do ) 進行KEGG PATHWAY 富集分析,使用Fisher 精確檢驗進行計算。為控制計算假陽性率,采用BH(FDR) 方法進行多重檢驗,經過校正的P值(Corrected P-Value)以0.05 為閾值,滿足此條件的KEGG 通路定義為在差異表達基因中顯著富集的KEGG 通路[5]。
2 結果與分析
2.1 基因表達
本研究采用RNA-seq技術對2組經不同FSH處理的金堂黑山羊下丘腦樣品進行表達譜測序(表1)。
分別得到有效序列26004442,25041098條。經統計分析后,得到歸一化序列30216946,27124882條。將這些數據進行A/T/G/C堿基含量分布統計,發現該文庫堿基分布均勻,模糊堿基N %在合理范圍之內。同時,進行堿基質量分布統計,通過公式計算,可以得出一個綜合的值,即質量值(Q),用來評估測序的質量好壞,結果見表1,發現所獲得測序數據達到后續分析要求。堿基錯誤率分布統計分析發現數據的堿基錯誤率均可以達到低于0.1 %。經統計分析后,得到歸一化序列25338808和24413890條。
將質控后得到的高質量測序序列使用(http://tophat.cbcb.umd.edu/)與指定的參考基因組比對,參考基因組來自于http://www.ncbi.nlm.nih.gov/genome/genomes/10731,如表2所示,發現符合率分別達85.31 %,85.32 %。
飽和度分析顯示飽和度總體質量較高,該測序量能夠覆蓋絕大多數的表達基因。冗余序列分析顯示此樣本冗余序列含量正常。基因覆蓋度分析顯示結果不具有偏向性,結果較均一。
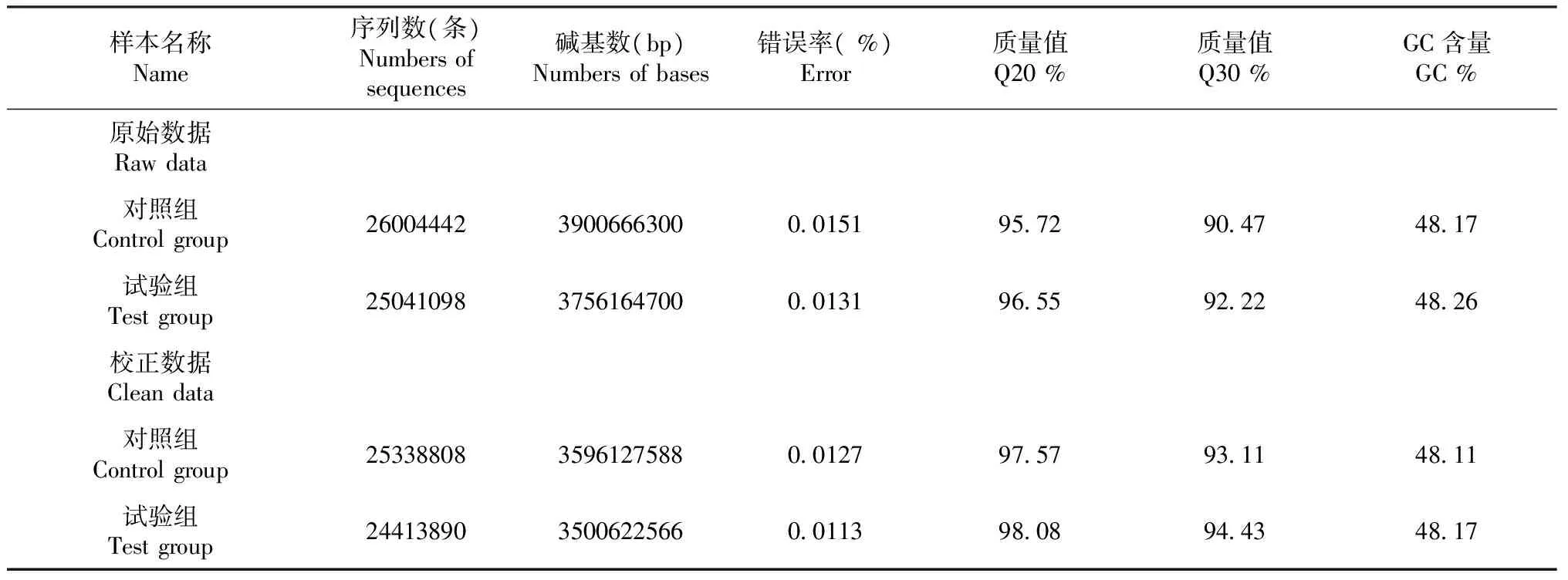
表1 測序數據統計結果

表2 與參考基因組比對結果

表3 金堂黑山羊下丘腦差異表達基因的GO功能分類
2.2 表達差異分析
將這些序列進行比對后發現,對照組金堂黑山羊152個基因出現顯著性差異表達。其中117個基因上調了表達,35個基因下調了表達。其中,gene44399(transthyretin[Capra hircus])上調表達最高,上調了86.98倍。gene32112(ubiquitin-like protein ISG15)下調表達最多,下調了15倍。
2.3 差異表達基因的GO功能分類以及KEGG功能分類
表3對這些差異表達基因進行GO功能分類,發現1個生物學過程出現了顯著性差異(P<0.05),為器官形態變化(GO: 0009887)。
對這些差異表達基因進行KEGG功能分類,發現調節途徑并未發生顯著性改變。
3 討 論
金堂黑山羊是一個優秀的地方山羊品種,具有生長發育快,體格大,特別是其繁殖力明顯高于其它山羊品種。山羊是季節性發情動物,分別于春季和秋季發情。只有在發情期,山羊才會啟動卵泡發育。已有研究表明:山羊發情后在1個發情期后出現3~4個卵泡波,第1個FSH卵泡波峰值出現在發情后的第1~5天。張超等[5]研究了不同繁殖力山羊血漿中FSH的分泌規律,發現大足黑山羊在1個發情周期出現3個卵泡波,第1個卵泡波FSH峰值出現在第2天,為8.422 IU/L,而莎能奶山羊在1個發情期有4個卵泡波,第1個卵泡波FSH峰值出現在第1天,為6.227 IU/L。葛世豪等[7]研究了濟寧青山羊的FSH分泌規律,發現濟寧青山羊在1個發情有4個卵泡波,第1個卵泡波FSH峰值出現在第2天,為3.63 IU/L。侯衍猛等[8]研究了萊蕪黑山羊的FSH分泌規律,發現萊蕪黑山羊在1個發情有4個卵泡波,第1個卵泡波FSH峰值出現在第5天,為0.70 IU/L。綜上所述,可以確定山羊在發情后第1~5天,將出現第1個卵泡波FSH峰,峰值為0.7~8.4 IU/L。本次研究中,在發情后的第2天對試驗驗組金堂黑山羊進行FSH注射,提高金堂黑山羊的FSH信號強度。按照寧波激素一廠的產品說明,山羊超數排卵為間隔12 h連續4 d肌注FSH,總量為200~250 IU,平均每次注射60~80 IU。為此,選擇1次注射,注射劑量為100 IU,并在注射24 h后,摘取金堂黑山羊的丘腦,檢測FSH信號不同強度調節后,丘腦表達譜出現的差異。
甲狀腺素結合蛋白(transthyretin)是大量存在于腦脊液的一種蛋白,它的主要功能是轉運甲狀腺素等激素[9]。Rojdmark等[10]推測甲狀腺激素作用于下丘腦,通過刺激GnRH的分泌來間接影響促性腺激素的分泌;Erfurth等[11]進一步發現,甲狀腺激素可通過作用于下丘腦的多巴胺能神經元來影響促性腺激素的分泌。在本次研究中,發現在下丘腦中甲狀腺激素結合蛋白基因的上調表達,這可能是由于試驗組FSH劑量的顯著提高,必將通過負反饋來抑制促性腺激素的進一步分泌,而甲狀腺素就是這樣一個良好的調節劑,高表達的甲狀腺素結合蛋白攜帶大量的甲狀腺素在下丘腦中抑制了FSH的繼續分泌,這也是FSH信號通路的一種負反饋調節方式,這與Rojdmark,Erfurth的觀察一致。
干擾素刺激基因15(ISG15)是本次研究中下調表達最多的基因。該基因最早發現于牛和人的細胞中,是泛素小分子的一種,它以共價的方式鏈接在細胞膜和核仁蛋白上,影響分子結合[12]。Cohen等[13]發現泛素化過程作用于細胞表面的FSHR殘基,從而調節FSH信號傳導,Fang等[4],Han等[15]發現到泛素化過程也可作用在與FSH信號傳導相關的小蛋白分子上,從而影響FSH信號傳導。本次研究中試驗組ISG15的下調表達可能是通過減少下丘腦中的FSH信號傳導相關蛋白的泛素化,從而減弱高劑量FSH的信號傳導,從而調節FSH信號通路,這與上述的觀察一致。
在本次研究中發現,試驗組與對照組的GO功能分類顯示只有1個生物學過程出現了顯著性差異,那就是器官形態變化,而KEGG功能分類結果表明沒有任何調節途徑出現顯著性差異。這可能是由于在哺乳動物中,FSH是由垂體分泌,最終作用于卵巢,刺激原始卵母細胞的征集、分化等過程。而下丘腦是性軸中通過釋放促性腺釋放激素來調節垂體分泌FSH等激素,是調節FSH分泌量的器官。那么不同強度的FSH信號對于下丘腦來說就是一種負反饋調節。相對于作用于卵巢的正向調節來說,負向調節就顯得輕微許多。所以在本次研究中只出現了器官形態變化的顯著性差異。
綜上所述,FSH信號通過負反饋調節的方式對下丘腦進行調節,除了少量的基因表達隨著FSH信號強度的變化外,其主要的生物學過程,調節途徑均無顯著性變化。這說明FSH信號的負向調節要輕微很多。
[1]李 鍵. 肉山羊安全生產技術[M]. 北京:中國農業出版社,2005.
[2]張家驊. 家畜生殖內分泌學[M]. 北京:高等教育出版社,2007.
[3]王世銀,石國慶,甘尚權,等.不同繁殖狀態阿勒泰羊下丘腦MTNR1A基因表達變化與其季節性繁殖的關系[J].南方農業學報,2015,46(10):1887-1892.
[4]Tang H, Wang X, Bowers J E, et al. Unraveling ancient hexaploidy through multiply-aligned angiosperm gene maps[J]. Genome Res, 2008, 18: 1944-1954.
[5]Xie C, Mao X, Huang J, et al. KOBAS 2.0: a web server for annotation and identification of enriched pathways and diseases[J]. Nucleic Acids Res, 2011, 39: 16-22.
[6]張 超,羅艷梅,張家驊,等. 不同繁殖力山羊血漿中INHB、ACTA和FSH變化規律的研究[J]. 中國畜牧雜志,2011,47(7):24-27.
[7]葛仕豪,高立坤,侯衍猛,等. 濟寧青山羊發情周期內促性腺激素和性激素分泌規律的研究[J]. 西南農業學報,2007,20(6):1348-1352.
[8]侯衍猛,曹洪防,徐云華,等.萊蕪黑山羊發情周期中FSH、LH、E2和P的分泌規律[J]. 中國獸醫學報,2006,26(3):340-343.
[9]Mita S, Maeda S, Shimada K, et al. Cloning and sequence analysis of cDNA for human prealbumin[J].Biochem. Biophys. Res. Commun., 1984, 124: 558-564.
[10]Rojdmark S,Berg A,Kalluer G. Hypothalamic-Pituitary-Testicular Axis in Patients with Hyperthyroidism[J].Hormone Res, 1988, 29(3): 185.
[11]Erfurth E M, Hedner P. Increased plasma gonadotropin levels in spontaneous hyperthyroidism reproduced by thyroxine but not by triiodothyronine administration to normal subjects[J]. J Clinical Endocrinology & Metabolism, 1987, 64(4): 698.
[12]Langevin C,van L M,Houel A,et al. Zebrafish ISG15 exerts a strong antiviral activity against RNA and DNA viruses and regulates the interferon response[J]. J Virology, 2013, 87(18): 25-36.
[13]Cohen B D, Bariteau J T, Magenis L M, et al. Regulation of follitropin receptor cell surface residency by the ubiquitin-proteasome pathway[J]. Endocrinology, 2003, 144(10): 4393-4402.
[14]Fang W L,Lai S Y,WA Lai,et al. CRTC2 and Nedd4 ligase involvement in FSH and TGFbeta1 upregulation of connexin43 gap junction[J]. J Mol Endocrinol, 2015, 55(3): 263-275.
[15]Han Y, Xia G, Tsang B K. Regulation of cyclin D2 expression and degradation by follicle-stimulating hormone during rat granulosa cell proliferation in vitro[J]. Biol Reprod, 2013, 88(3): 57.
EffectofFSHSignalRegulationonGeneExpressionProfilingofHypothalamusinJintangBlackGoat
CAO Ye1,2,ZHAO Su-jun1,2,XIE Jing1,2,WANG Qiu-shi1,2,LIAO Dang-jin1,2
(1. Sichuan Animal Science Academy, Sichuan Chengdu 610066, China; 2.Animal Breeding and Genetics Key Laboratory of Sichuan Province, Sichuan Chengdu 610066, China)
【Objective】The purpose of this study was to understand the model of FSH signal regulation mechanism in Jintang black goat.【Method】10 healthy adult Jintang black goats in the same reproductive cycle were randomly divided into two groups, one was as control group, and the other is as tested group. On the second day of the estrus, Jintang black goats of tested group were injected with FSH 100IU, and their Hypothalamus were obtained in 24 hours after injection. On the third days of the estrus, the Hypothalamus of control group was obtained. Total RNAs were extracted, and the expression profiles were sequenced. 【Result】The effective sequences obtained from control group and tested group by sequencing analysis were 26004442 and 25041098, respectively; The normalized sequences by statistical analysis were 25338808, 24413890, and the coincidence rate of goat genome were 85.31 % and 85.32 %, respectively. After comparison, 152 genes were found to be significantly different, of which 117 genes were up-regulated, and 35 genes was down-regulated. GO functional classification reveals that the significant differences were founded in 1 biological process, and no significant difference was found in KEGG functional classification. The results indicated that the FSH signal regulate the hypothalamus by negative feedback regulation, and there was no significant change in the main biological process by FSH signal intensity change except for a small number of gene expression, which indicated that the negative regulation of FSH signal was slight. 【Conclusion】The FSH signal regulates the hypothalamus by feedback and is much less than that of the forward regulation.
Jintang black goat;FSH signal;Hypothalamus;Gene expression profiling
1001-4829(2017)12-2820-04
10.16213/j.cnki.scjas.2017.12.034
2017-05-02
四川省應用基礎研究項目“金堂黑山羊FSH信號通路調節機制的研究”(2015JY0008)
曹 冶(1970-),男,四川蓬安人,博士,研究員,現從事動物分子遺傳研究,E-mail:cy3831@163.com。
S827
A
(責任編輯陳 虹)

