高分辨率磁共振對大腦中動脈斑塊與梗死灶類型關系的研究
徐曼曼,徐運,周飛,張鑫,張冰,王一峰,李敬偉,
顱內動脈性疾病(intracranial arterial diseases,ICAD)是由顱內動脈粥樣硬化(intracranial atherosclerosis,ICAS)、動脈夾層、煙霧病、血管炎等各種病因組成的一種疾病[1]。其中,ICAS是ICAD的主要病因,也是復發性卒中的高危因素,尤其是在近期發生過卒中或短暫性腦缺血發作(transient ischemic attack,TIA)及有嚴重動脈狹窄的患者中[2-3]。我國約有46.6%的急性缺血性卒中由ICAS所致[4],并且約3/4的卒中累及大腦中動脈(middle cerebral artery,MCA)。
以往的血管影像學檢查,如數字減影血管造影(digital subtraction angiography,DSA)、計算機斷層掃描血管成像(computed tomography angiography,CTA)和磁共振血管成像(magnetic resonance angiography,MRA)等多基于對血管狹窄程度的評估,而高分辨率磁共振成像(high-resolution magnetic resonance imaging,HRMRI)不僅可以顯示血管狹窄程度,還能夠提供管壁結構以及動脈粥樣硬化斑塊的生物學特性和動脈狹窄局部血管的重構模式[5]。該技術具有無創、分辨率高、可重復性好、多對比的特點。既往人們多關注MCA狹窄程度>50%的患者,認為此類患者發生腦梗死的風險更大,而忽略狹窄程度≤50%的患者,故本文旨在通過HRMRI檢查,探討因MCA狹窄程度≤50%引起缺血性卒中的梗死灶類型與載體動脈的關系及HRMRI在鑒別病變血管狹窄程度和卒中治療、預防等方面的應用優勢。
1 資料與方法
1.1 臨床資料 納入2012年1月-2016年10月在南京鼓樓醫院連續住院的癥狀性MCA粥樣硬化性狹窄的患者。入組標準:①癥狀性MCA狹窄患者,14 d內發生過腦梗死,且癥狀為病變血管所致,狹窄程度≤50%;②存在糖尿病、高血壓、高脂血癥、吸煙、飲酒等≥2個動脈粥樣硬化的危險因素;③能夠行HRMRI,掃描圖像質量可;④耐受且規律服用抗血小板聚集及降脂類藥物。排除標準:①心源性栓塞、血管炎、動脈夾層等其他原因導致的腦梗死患者;②合并頸動脈或椎動脈顱外段中、重度狹窄,MCA狹窄程度>50%;③具有嚴重的心、肺、腎等功能障礙不能耐受磁共振檢查者;④體內有金屬植入等有磁共振檢查禁忌證者。所有患者采集的臨床資料包括年齡、性別、高血壓、糖尿病、吸煙史、高脂血癥及C-反應蛋白。
1.2 影像學檢查 所有患者均采用飛利浦3.0T磁共振(Achieva TX,荷蘭飛利浦醫療系統公司)和標準8通道頭顱線圈進行MRI檢查。常規行頭顱MRI平掃,掃描序列包括T1加權成像、T2加權成像和彌散加權成像(diffusionweighted imaging,DWI),并進行顱腦三維時間飛越法(three-dimensional time of flight,3D-TOF)磁共振血管造影(magnetic resonance angiography,MRA)檢查,然后在病變處垂直血管行HRMRI,掃描序列包括非對比血管成像、脂肪抑制及黑血信號成像技術等,掃描范圍包括正常血管及狹窄段血管(表1)。
1.3 圖像分析 掃描完成后將圖像導入醫學影像信息系統(picture archiving and communication systems,PACS),由2名專門從事血管影像診斷的影像科醫師在不了解患者臨床資料的情況下進行圖像分析。將圖像質量分為4級:1級:管壁及管腔顯示不清;2級:管腔清晰,斑塊顯示不清;3級:管腔、管壁及斑塊顯示清晰,但有少量運動偽影;4級:斑塊結構清晰,無運動偽影[6]。根據華法林-阿司匹林癥狀性顱內疾病試驗(Warfarin–Aspirin Symptomatic Intracranial Disease,WASID)標準計算狹窄率[7]。在矢狀位HRMRI上,手動勾畫測量病灶側MCA M1段最狹窄層面的管腔直徑,以病灶側或對側正常血管層面作為參照點,測量參照管腔直徑和參照管壁直徑(若參照點在同側,則以狹窄點前后的正常血管層面平均值作為參照直徑)。計算狹窄率=(1-管腔直徑/參照管腔直徑)×100%。通過計算血管重構指數(remodeling index,RI)判斷MCA血管的重構方式,RI=最狹窄管腔直徑/參考管腔直徑。RI≤0.95為負性重構(negative remodeling,NR),RI≥1.05為正性重構(positive remodeling,PR),介于0.95~1.05稱之為無重構[8]。斑塊形態學指標包括斑塊位置、長度、厚度。根據矢狀位HRMRI,MCA斑塊位置可根據斑塊最厚點的方向,將之分為上、下、前、后壁4個象限,當斑塊分布在2個或多個象限之間,以斑塊最厚處所在的象限劃分(圖1)[9]。斑塊厚度為MCA最狹窄層面的斑塊厚度,斑塊長度根據斑塊累及的HRMRI層數乘以層厚計算[10]。

表1 高分辨率磁共振成像序列及其主要參數
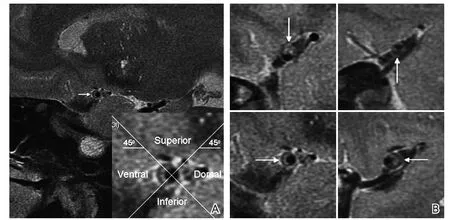
圖1 斑塊位置分布
1.4 腦梗死類型的分類與分組 根據DWI所顯示的梗死病灶部位、大小和分布,按血管供血區域,將腦梗死部位分型如下:①單型梗死:穿支動脈供血區梗死(perforating artery infarct,PAI),皮質支供血區梗死(pial infarct,PI),分水嶺梗死(border zone infarct,BZI);②混合型梗死:PAI+PI,PAI+BZI,PI+BZI,PAI+PI+BZI。單型梗死為梗死僅累及1個MCA供血區,混合型梗死為累及1個以上的MCA供血分區[11]。由兩位神經內科醫師獨立閱讀患者的DWI圖像并確定腦梗死模式,如有閱片結果不一致,由第三位醫師介入并討論后確定。
1.5 統計學分析 應用SPSS 23.0軟件進行統計學分析,計數資料用χ2檢驗或Fisher's精確法進行統計學分析,計量資料以表示并行t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 一般資料 本研究共納入患者51例,其中男34例(66.7%),女17例(33.3%),平均年齡(57.73±13.31)歲。單型梗死組32例,混合型梗死組19例。兩組患者性別、年齡、伴隨疾病和血液指標比較,差異均無統計學意義(表2)。
2.2 MCA管腔(狹窄程度+重構)與腦梗死灶 通過HRMRI管壁成像技術,發現混合型組的MCA狹窄程度[(38.0±8)%]明顯高于單型組[(31.0±10)%],比較差異有統計學意義(t=2.56,P=0.01)。單型組中PAI 22例(68.8%),PI 6例(18.7%),BZI 4例(12.5%),以PAI最多見(圖2);其中PAI的斑塊位置:前壁8例(36.4%),后壁7例(31.8%),上壁1例(4.5%),下壁6例(27.3%);正性重構22例(68.8%),負性重構3例(9.4%)。混合型組中PAI+BZI 7例(36.8%),PAI+PI 2例(10.6%),PI+BZI 5例(26.3%),PAI+PI+BZI 5例(26.3%),以PAI+BZI為主(表3、圖3);正性重構17例(89.5%),無負性重構。
2.3 MCA動脈粥樣硬化斑塊與腦梗死灶 不同類型梗死灶的斑塊形態特征不同。單型梗死組較混合型梗死組斑塊厚度小,差異有統計學意義(P=0.001);而斑塊長度比較,差異無統計學意義(表3)。
3 討論
動脈粥樣硬化性MCA狹窄引起腦梗死的病理生理機制主要包括病變部位的斑塊阻塞穿支動脈開口處、血栓形成、動脈-動脈栓塞、低灌注-栓子清除能力下降等[12]。隨著影像學技術的不斷發展,尤其是HRMRI的臨床應用,進一步加深了醫學研究者對顱內動脈病變的認識。與傳統MR/CTA相比,HRMRI具有幾個優點,首先它可以直視化觀察亞毫米級動脈壁,其次FSE-T2WI序列在高分辨率參數下保持了高信噪比和較短的成像時間[13],使其在顱內動脈粥樣硬化疾病診斷中的應用愈加廣泛。但目前,該檢查方法應用于MCA狹窄程度≤50%的研究不多。
3.1 基線比較 卒中的危險因素可分為不可調節和可調節因素兩大類[14]。不可調節因素主要指年齡、性別及種族等,可調節因素包括高血壓、糖尿病、高脂血癥、吸煙等。本研究中,兩組患者的一般臨床資料比較,年齡、性別、高血壓、糖尿病、高脂血癥、吸煙等差異均無統計學意義,兩組基線水平大致相同,具有可比性。
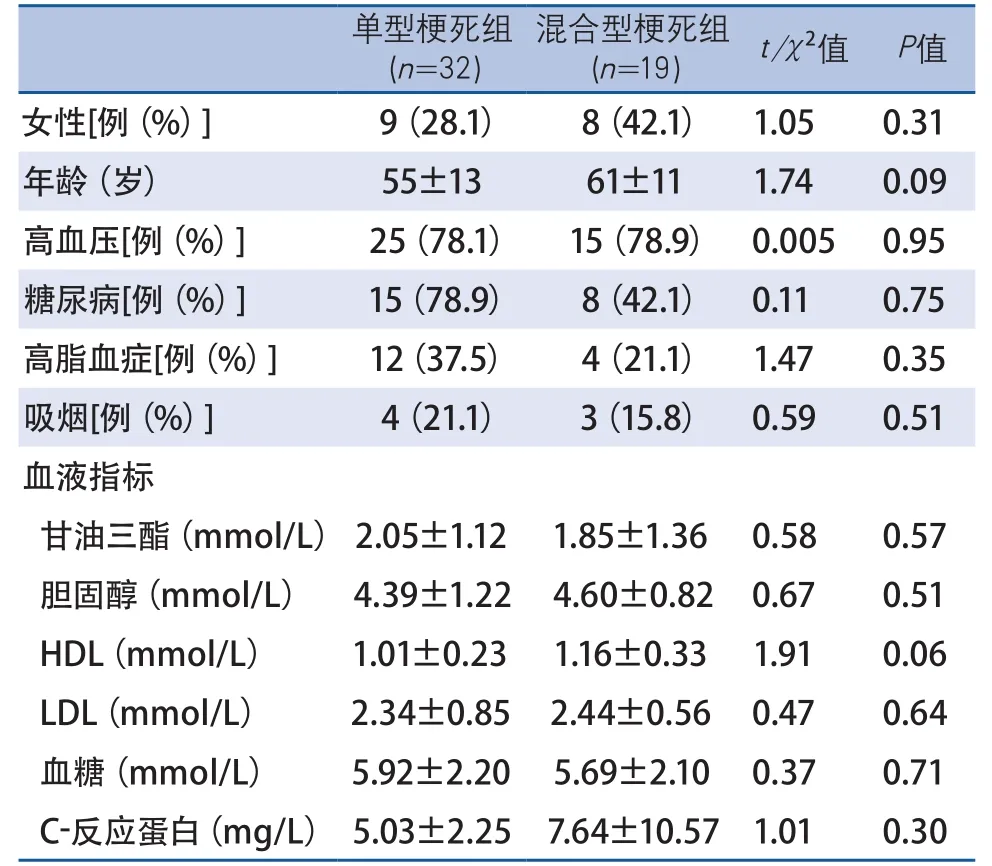
表2 兩組患者一般資料基線水平比較

圖2 單型梗死左側MCA狹窄患者圖像
3.2 HRMRI對MCA管腔(狹窄程度+重構)與腦梗死模式 由于動脈粥樣硬化早期血管外膨性生長,即正性重構效應,在常規影像學檢查中并不表現為狹窄,也不能全面、客觀地確定病變血管的狹窄程度。而HRMRI管壁成像技術能直視病變管腔部位,并準確測量狹窄程度。
當前,血管狹窄程度仍是判斷動脈粥樣硬化病變的主要指標。WANG等[4]分析了來自多中心2864例國內ICAS患者的臨床資料,結果顯示動脈狹窄程度與卒中復發相關,狹窄程度越重越易造成卒中復發。MCA狹窄患者的DWI模式表現為多種腦梗死類型。有研究報道,MCA中度狹窄主要導致PAI,而PI較少見[11]。本研究發現混合型梗死組的MCA狹窄程度較單型組重,且單型梗死組中多數為PAI(68.8%),與文獻報道相符。MCA粥樣硬化性狹窄引起PAI,可能是斑塊或小栓子阻塞穿支動脈開口所致[15]。隨著狹窄程度的增加,MCA狹窄致PAI的同時,也會合并其他部位的梗死。因MCA狹窄后,其遠端分支血管血流主要依靠同側的大腦前、后動脈代償,造成分支血管內血流紊亂,流速緩慢,供血區的血流儲備降低,易促使血栓形成[16],引發BZI和PI。本研究中混合型梗死主要為PAI+BZI類型。由于本研究的對象為MCA狹窄程度≤50%的患者,故可能與前期研究結果稍有所不同。血管重構是狹窄血管自身的代償選擇,包含正性重構(positive remodeling,PR)、負性重構(negative remodeling,NR)兩種方式。冠脈的研究證實PR有利于維持動脈管腔大小,但卻表現為易損斑塊的特性;雖然NR加重管腔狹窄,但多為穩定斑塊[17]。此外,SCHOENHAGEN等[18]研究顯示PR與缺血性癥狀密切相關。隨后MCA的研究也發現類似特性。XU等[17]表明與無癥狀MCA狹窄相比,癥狀性MCA狹窄患者PR率更高。另一項關于基底動脈粥樣硬化狹窄程度≥70%的研究發現,與非PR相比,PR更常見,并且斑塊負荷更大[8]。血管重構的發生機制尚未完全清楚,可能管壁的PR與動脈粥樣硬化斑塊釋放的金屬蛋白酶有關[19],存在PR的病變動脈局部金屬蛋白酶釋放增加,導致斑塊穩定性下降、斑塊破潰和栓子形成,致使遠端分支動脈栓塞形成腦梗死[20]。這也為卒中患者的二級預防及治療提供方向。

表3 兩組病變血管情況比較
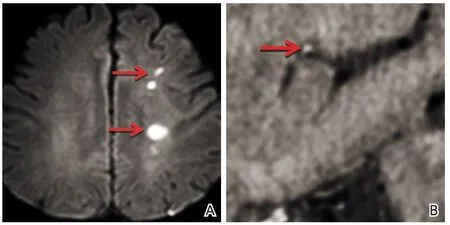
圖3 混合型梗死左側MCA狹窄患者圖像
3.3 HRMRI對MCA動脈粥樣硬化斑塊特征與腦梗死模式評價 在管腔狹窄程度<50%的情況下,頸內動脈的HRMRI研究確定了增加血栓栓塞事件風險斑塊的特征,包括斑塊內出血、大的脂質核、薄的纖維帽等[21-22]。顱內動脈斑塊負荷被揭示是發生卒中的危險因素,有研究提示與無癥狀性MCA狹窄相比,癥狀性狹窄的斑塊更厚,斑塊厚度與管腔之比更大[13,17]。本研究通過HRMRI比較兩組患者的MCA斑塊形態特征,發現除管腔狹窄程度外,混合型組斑塊的一些高危特征。
在本研究中,混合型組的斑塊厚度>單型組。XU等[17]揭示較大的斑塊負荷不僅造成管腔狹窄影響血流動力學,而且還可能在粥樣斑塊的基礎上發生繼發病變,如斑塊內出血、斑塊破裂等。所以本課題推測混合型梗死可能由于斑塊的局部血栓阻塞穿支動脈開口或血栓脫落阻塞遠端血管,引起多個部位的梗死。此外,斑塊位置分布被認為是動脈粥樣硬化性卒中的另一因素。XU等[9]發現,MCA的斑塊更常見于管壁的前壁和下壁,即穿支血管開口的對側;但在癥狀性MCA狹窄患者中,穿支梗死血管粥樣斑塊更多分布于上壁(P=0.001)。本研究中穿支動脈梗死的斑塊多位于前壁(36.4%),與之前的研究不同,推測可能是由于本課題研究對象為MCA輕型狹窄的患者(≤50%),另一原因可能是本課題在確定斑塊位置時是根據斑塊最厚點的方向來統計的,在未引起癥狀性卒中前,斑塊已在前壁形成,隨著斑塊逐漸擴增,阻塞穿支動脈口,導致腦梗死。由于本研究納入的樣本例數少,未發現兩組斑塊分布及斑塊長度存在統計學差異。故早期識別動脈粥樣硬化斑塊,判斷管腔狹窄程度,從而為卒中的病因診斷及臨床治療提供客觀依據,有助于進行針對性卒中二級預防。本研究不足之處為單中心、小樣本的回顧性研究,受到研究對象的MCA狹窄率≤50%的限制,且患者病情相對較輕,故納入患者的選擇上存在一定的偏倚,尚需大樣本臨床研究來一步證實。
本研究發現不同程度的MCA狹窄(狹窄程度≤50%),其梗死灶分布有所不同,單型梗死主要為PAI,混合型梗死主要以PAI+BZI多見;混合型梗死組的狹窄程度較單型組嚴重,斑塊厚度高于單型組,提示斑塊阻塞穿支動脈口或小栓子栓塞遠端分支可能是單型梗死的機制,而血流動力學紊亂可能是混合型梗死的機制。本研究為小樣本研究,結論只適用于該群體患者。
[1] SWARTZ R H,BHUTA S S,FARB R I,et al.Intracranial arterial wall imaging using high-resolution 3-tesla contrast-enhanced MRI[J]. Neurology,2009,72(7):627-634.
[2] ARENILLAS J F. Intracranial atherosclerosis:current concepts[J/OL]. Stroke,2011,42(1 Suppl):S20-S23. DOI: 10.1161/STROKEAHA.110.597278.http://stroke.ahajournals.org/content/42/1_suppl_1/S20.
[3] KASNER S E,CHIMOWITZ M I,LYNN M J,et al. Predictors of ischemic stroke in the territory of a symptomatic intracranial arterial stenosis[J].Circulation,2006,113(4):555-563.
[4] WANG Y,ZHAO X,LIU L,et al. Prevalence and outcomes of symptomatic intracranial large artery stenoses and occlusions in China:the Chinese Intracranial Atherosclerosis(CICAS)Study[J]. Stroke,2014,45(3):663-669.
[5] KIM Y S,LIM S H,OH K W,et al. The advantage of high-resolution MRI in evaluating basilar plaques:a comparison study with MRA[J]. Atherosclerosis,2012,224(2):411-416.
[6] UNDERHILL H R,YARNYKH V L,HATSUKAMI T S,et al. Carotid plaque morphology and composition:initial comparison between 1. 5-and 3. 0-T magnetic fi eld strengths[J]. Radiology,2008,248(2):550-560.
[7] YANG W Q,HUANG B,LIU X T,et al.Reproducibility of high-resolution MRI for the middle cerebral artery plaque at 3T[J/OL]. Eur J Radiol,2014,83(1):e49-e55. DOI: 10.1016/j.ejrad.2013.10.003.http://dx.doi.org/10.1016/j.ejrad.2013.10.003.
[8] MA N,JIANG W J,LOU X,et al. Arterial remodeling of advanced basilar atherosclerosis:a 3-tesla MRI study[J]. Neurology,2010,75(3):253-258.
[9] XU W H,LI M L,GAO S,et al. Plaque distribution of stenotic middle cerebral artery and its clinical relevance[J]. Stroke,2011,42(10):2957-2959.
[10] LI M L,XU W H,SONG L,et al. Atherosclerosis of middle cerebral artery:evaluation with highresolution MR imaging at 3T[J]. Atherosclerosis,2009,204(2):447-452.
[11] LEE D K,KIM J S,KWON S U,et al. Lesion patterns and stroke mechanism in atherosclerotic middle cerebral artery disease:early diffusionweighted imaging study[J]. Stroke,2005,36(12):2583-2588.
[12] ISAKA Y,NAGANO K,NARITA M,et al. High signal intensity on T2-weighted magnetic resonance imaging and cerebral hemodynamic reserve in carotid occlusive disease[J]. Stroke,1997,28(2):354-357.
[13] CHUNG G H,KWAK H S,HWANG S B,et al. High resolution MR imaging in patients with symptomatic middle cerebral artery stenosis[J]. Eur J Radiol,2012,81(12):4069-4074.
[14] SACCO R L,BENJAMIN E J,BRODERICK J P,et al. American Heart Association Prevention Conference. Ⅳ. Prevention and Rehabilitation of Stroke. Risk factors[J]. Stroke,1997,28(7):1507-1517.
[15] BANG O Y,HEO J H,KIM J Y,et al. Middle cerebral artery stenosis is a major clinical determinant in striatocapsular small,deep infarction[J]. Arch Neurol,2002,59(2):259-263.
[16] YONG S W,BANG O Y,LEE P H,et al. Internal and cortical border-zone infarction:clinical and diffusion-weighted imaging features[J]. Stroke,2006,37(3):841-846.
[17] XU W H,LI M L,GAO S,et al. In vivo highresolution MR imaging of symptomatic and asymptomatic middle cerebral artery atherosclerotic stenosis[J]. Atherosclerosis,2010,212(2):507-511.
[18] SCHOENHAGEN P,ZIADA K M,KAPADIA S R,et al. Extent and direction of arterial remodeling in stable versus unstable coronary syndromes:an intravascular ultrasound study[J]. Circulation,2000,101(6):598-603.
[19] ZHU X J,DU B,LOU X,et al. Morphologic characteristics of atherosclerotic middle cerebral arteries on 3T high-resolution MRI[J]. AJNR Am J Neuroradiol,2013,34(9):1717-1722.
[20] 李文君,劉俊艷. 不同機制癥狀性顱內動脈粥樣硬化性疾病的高分辨率磁共振特征[J]. 中國卒中雜志,2016,11(4):262-268.
[21] WASSERMAN B A,WITYK R J,TROUT H H 3RD,et al. Low-grade carotid stenosis:looking beyond the lumen with MRI[J]. Stroke,2005,36(11):2504-2513.
[22] YUAN C,MITSUMORI L M,BEACH K W,et al. Carotid atherosclerotic plaque:noninvasive MR characterization and identif i cation of vulnerable lesions[J]. Radiology,2001,221(2):285-299.

