表面活性劑及其復配體系對漆酶活性和穩定性的影響
劉 海,張淑琴,任大軍,葉 俊,何小勇,張曉晴
(武漢科技大學資源與環境工程學院,湖北 武漢,430081)
漆酶是一種含銅的多酚氧化酶,廣泛存在于細菌、真菌及植物中,它在降解木質素、生物漂白、污水處理、生物感應器、生物燃料電池等方面具有廣闊的應用前景[1]。通過固定化、化學修飾或基因工程等技術可以提高酶的活性和穩定性,其中就包括表面活性劑改性技術[2]。表面活性劑是一類由親水基和疏水基組成的相對平衡的不對稱化合物,與酶結合后通過靜電作用和疏水作用調節酶電荷,使得酶構象及活性中心發生改變,從而影響酶的活性和穩定性。表面活性劑與酶組成的混合體系在食品和飲料加工、醫藥工程和化妝品等應用領域的重要性日益突出[3]。另外,由于混合表面活性劑體系往往比單一表面活性劑具有更優越的性能,故目前對于表面活性劑復配行為的研究也有較多報道[4-6]。
本文主要研究5種表面活性劑Brij-35(十二烷基聚乙二醇醚,非離子型)、Tween-80(非離子型)、TX-100(Triton X-100,非離子型)、AOT(2-乙基己基琥珀酸酯磺酸鈉,陰離子型)、甜菜堿(十二烷基甜菜堿,兩性離子型)對漆酶活性和穩定性的影響,探討漆酶的最佳反應溫度和pH值,同時通過Brij-35與其他表面活性劑組建不同類型的復配體系,分析在表面活性劑復配體系中漆酶的活性與穩定性變化。
1 試驗材料與方法
1.1 試劑與儀器
漆酶(1.07U/mg)、ABTS、AOT、TX-100、Tween-80均購自Sigma公司;Brij-35、甜菜堿等由國藥集團化學試劑有限公司生產。試劑均為分析純。
主要儀器包括電熱恒溫油浴鍋(DU-20型)、紫外可見分光光度計(UV-2550型)、日立熒光光譜儀(F-4600型)及pH酸度計等。
1.2 漆酶活性測定方法
漆酶的催化活性檢測采用ABTS顯色分光光度法,以0.5 mmol/L的ABTS為反應底物,以0.1 mol/L的乙酸-乙酸鈉為緩沖體系[7]。反應體系為3.0 mL,依次取pH=3.5的乙酸-乙酸鈉緩沖溶液1.5 mL、漆酶待測液1.0 mL、ABTS溶液0.5 mL,于25(±1) ℃用紫外可見分光光度計測其420 nm處的吸光度,重復測量12次,每次間隔15 s。將每分鐘轉化1 μmol底物定義為1個酶活力單位U。
本文試驗均設置空白對照組,試驗結果中漆酶相對活性以空白對照組的漆酶活性為基準進行計算。
1.3 表面活性劑類型及濃度對漆酶活性的影響測定方法
單一表面活性劑:分別配制Brij-35、Tween-80、TX-100、AOT、甜菜堿的濃度為0.4、0.8、1.2、1.6、2.0 mmol/L,然后等體積加入0.1 U/mL的漆酶溶液組成漆酶混合液,以不添加表面活性劑的漆酶溶液為對照組。在25(±1) ℃、pH=3.5的條件下與底物ABTS反應,測定酶活性。
表面活性劑復配體系:將不同濃度Brij-35(0.4、0.8、1.2、1.6、2.0 mmol/L)分別與對應濃度的AOT、TX-100、Tween-80、甜菜堿按體積比1∶1進行復配,然后等體積加入0.1 U/mL的漆酶溶液組成漆酶混合液,其他測定條件同上。
1.4 溫度對漆酶活性的影響及漆酶熱穩定性測定方法
恒溫油浴鍋的控制溫度分別設為20、30、40、50、60、70、80 ℃,將添加了單一表面活性劑(1.0 mmol/L)或表面活性劑復配體系(1.0 mmol/L)的漆酶溶液(表面活性劑和漆酶溶液等體積配比)以及空白對照組置于其中,恒溫水浴30 min后取出,冷卻至25(±1) ℃,在pH=3.5條件下測定其活性。
漆酶熱穩定性測定:將上述各漆酶混合液分別在40、50、60 ℃恒溫水浴,每隔1 h取樣測定其活性,條件同上。
1.5 pH值對漆酶活性的影響及漆酶酸堿穩定性測定方法
用乙酸-乙酸鈉緩沖液將1.4節中配制的漆酶混合液以及空白對照組的pH值分別調制為2.5~7.0,靜置30 min后,在25(±1) ℃下測定其活性。
漆酶酸堿穩定性測定:將上述調制的pH值為3.0、3.5、4.0、4.5、5.0的各漆酶混合液在25 ℃水浴保溫,每隔1 h取樣測定其活性,條件同上。
1.6 穩態熒光光譜測定方法
漆酶的穩態熒光光譜試驗采用直徑為1.0 cm的石英樣品池,溶液濃度為3.0 g/L。選取激發波長為284 nm,掃描范圍為300~500 nm。激發和發射帶寬均為5 nm,響應時間為1 s,中速掃描。樣品檢測前在室溫下培養1 h。空白樣品在統一條件下測量,最終結果均排除空白樣品的影響。
2 試驗結果
2.1 表面活性劑類型和濃度對漆酶活性的影響
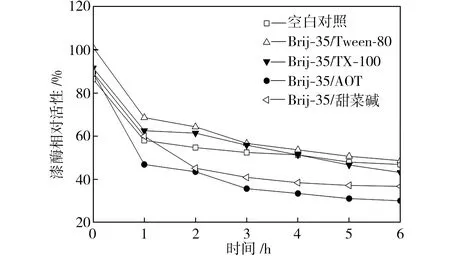
單一表面活性劑的類型和濃度對漆酶活性的影響如圖1所示。從圖1中可以看出,濃度為0.4 mmol/L的Brij-35使漆酶相對活性比空白對照組(相對活性為100%)提高了約13個百分點,而隨著Brij-35濃度的繼續增大,漆酶相對活性逐漸降低,但在Brij-35為2.0 mmol/L的條件下,漆酶相對活性比空白對照組仍高出約5個百分點。以Tween-80為表面活性劑時,隨著其濃度的增大,漆酶相對活性逐漸下降;Tween-80濃度低于1.2 mmol/L時,漆酶活性略高于空白對照組;Tween-80濃度高于1.2 mmol/L時,漆酶活性比空白對照組有所降低。加入TX-100時,漆酶相對活性隨TX-100濃度的增大先升后降,且TX-100濃度為1.2 mmol/L時漆酶活性最高。以AOT為表面活性劑時,漆酶相對活性隨AOT濃度的增大而顯著下降,當AOT濃度為2.0 mmol/L時,漆酶相對活性降到80%以下。隨著甜菜堿濃度的增大,漆酶相對活性變化不明顯,但高濃度甜菜堿對漆酶活性還是有抑制作用。
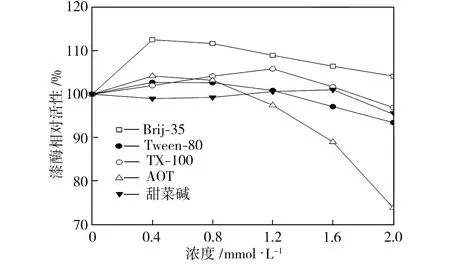
圖1 單一表面活性劑的類型和濃度對漆酶活性的影響
Fig.1Effectsoftypeandconcentrationofsingle-componentsurfactantsonlaccaseactivity
表面活性劑復配體系的類型和濃度對漆酶活性的影響如圖2所示。對于Brij-35/Tween-80復配體系,在其濃度由0.4 mmol/L增加到1.2 mmol/L時,漆酶相對活性緩慢下降;在其濃度由1.2 mmol/L增至2.0 mmol/L時,漆酶相對活性下降較快。對于Brij-35/TX-100復配體系,隨其濃度的增大,漆酶相對活性先升后降,Brij-35/TX-100濃度為0.8 mmol/L時漆酶活性最高。隨著Brij-35/AOT復配體系濃度的增大,漆酶活性開始緩慢降低,而當Brij-35/AOT濃度超過1.2 mmol/L時,漆酶活性顯著下降。Brij-35/甜菜堿復配體系的濃度對漆酶活性影響較小,與僅添加甜菜堿時規律相似。
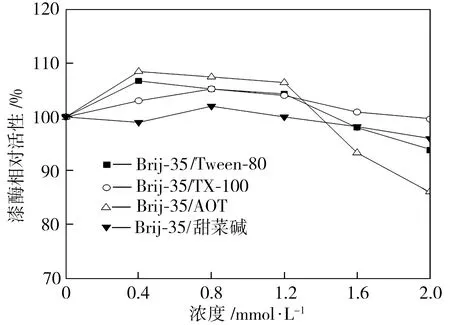
圖2表面活性劑復配體系的類型和濃度對漆酶活性的影響
Fig.2Effectsoftypeandconcentrationofmixedsurfactantsonlaccaseactivity
2.2 溫度對漆酶活性的影響及漆酶熱穩定性
在20~80 ℃范圍內檢測未添加表面活性劑的空白對照組、添加單一表面活性劑或表面活性劑復配體系的漆酶溶液的活性,以空白對照組中漆酶最高活性為100%,計算不同溫度下的漆酶相對活性,結果見表1。從表1中可以看出,不論是添加單一表面活性劑還是表面活性劑復配體系,漆酶的最佳反應溫度均為40 ℃。在20~50 ℃范圍內,漆酶相對活性在70%以上(空白對照組除外);當溫度超過60 ℃時,漆酶相對活性降低較多;當溫度達到80 ℃時,漆酶相對活性低于10%,接近于完全失活。此外,在20~50 ℃范圍內,添加表面活性劑復配體系的漆酶相對活性均高于添加對應單一表面活性劑的漆酶相對活性。
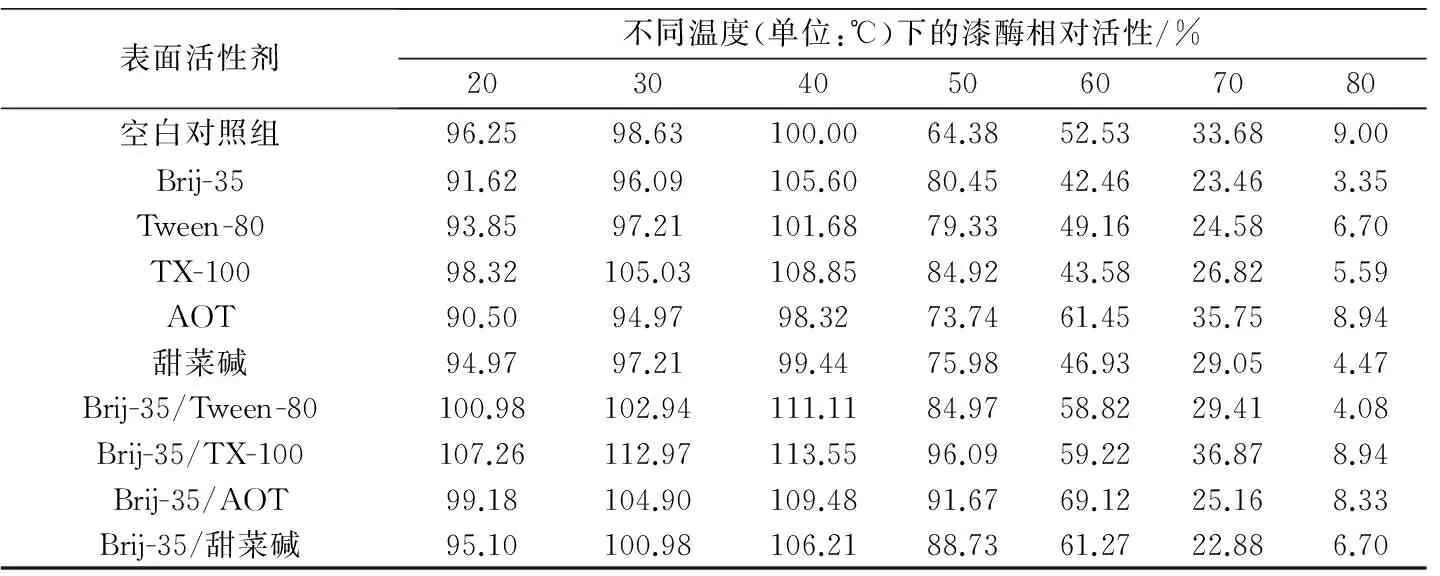
表1 溫度對漆酶相對活性的影響
在40、50、60 ℃下恒溫水浴不同時間后,檢測添加表面活性劑復配體系的漆酶活性,以40 ℃初始時測得的空白對照組活性為100%,計算漆酶相對活性,得到漆酶的熱穩定性曲線,如圖3所示。從圖3中可以看出,在合適條件下表面活性劑復配體系可以提高漆酶的熱穩定性,恒溫水浴6 h后,大部分添加表面活性劑的漆酶的活性都維持在一個相對較高的水平,并且在40 ℃時漆酶的熱穩定性提升更為顯著。總體而言,針對這4種表面活性劑復配體系,漆酶在Brij-35/TX-100及Brij-35/Tween-80復配體系中熱穩定性較好,在Brij-35/AOT復配體系中的熱穩定性較差。
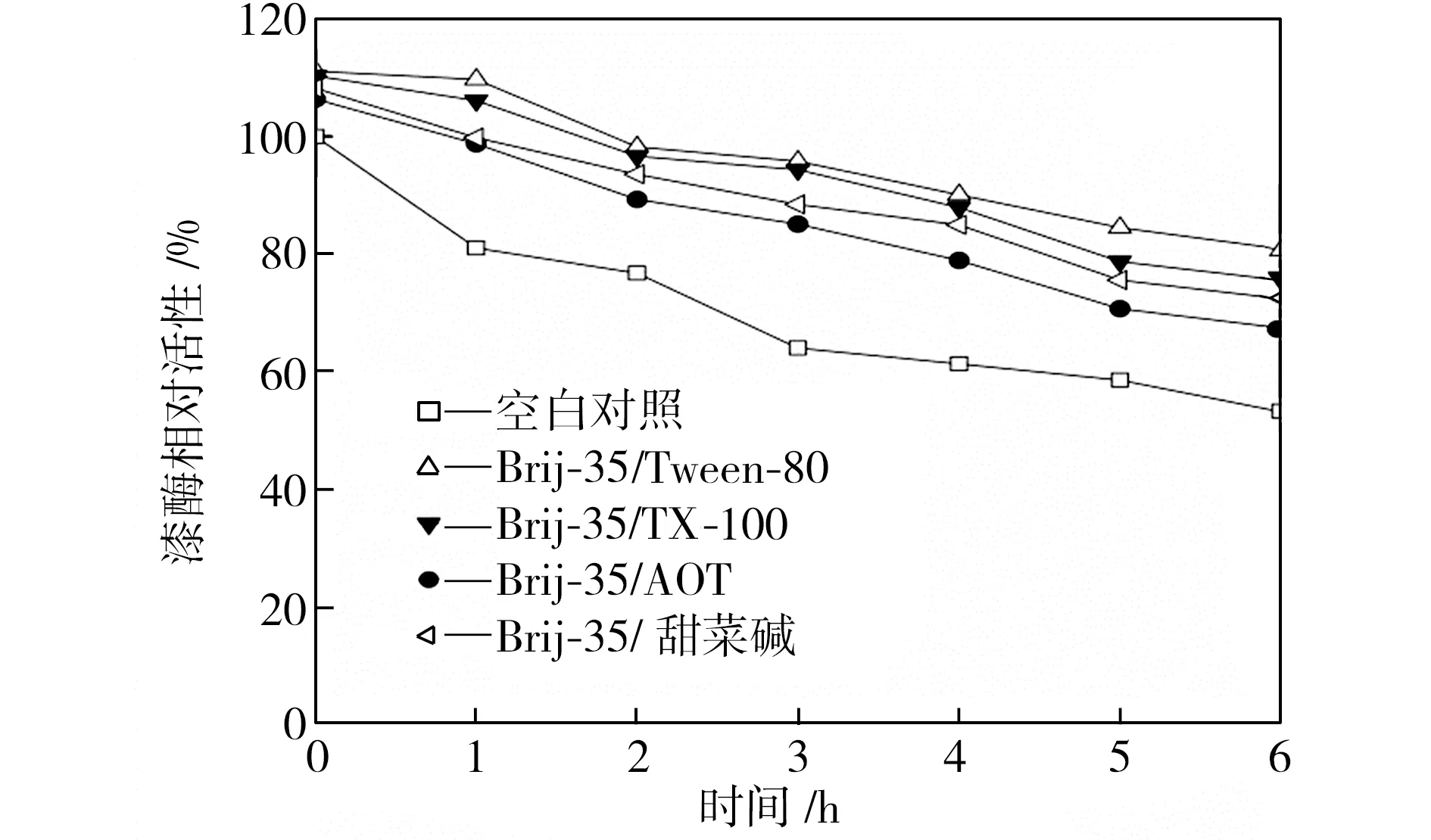
(a)40 ℃

(b)50 ℃
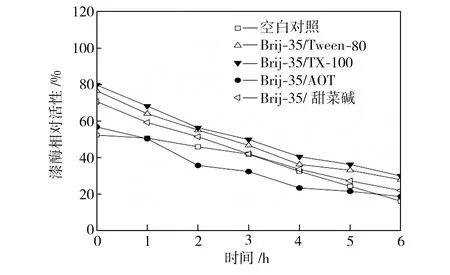
(c)60 ℃
Fig.3Effectofmixedsurfactantsonthethermalstabilityoflaccase
2.3 pH值對漆酶活性的影響及漆酶酸堿穩定性
在pH值為2.5~7.0的范圍內,檢測未添加表面活性劑的空白對照組、添加單一表面活性劑或表面活性劑復配體系的漆酶溶液的活性,以空白對照組中漆酶最高活性為100%,計算不同pH值下的漆酶相對活性,結果見表2。由表2可見,空白對照組中漆酶最適宜的pH值為3.0,加入表面活性劑后,最佳pH值基本沒有變化,但是加入AOT或Brij-35/AOT復配體系時,漆酶最佳pH值從3.0變為3.5。在pH值為3.5~4.5的范圍內,表面活性劑的存在使漆酶的活性均有較大程度的提高;當pH值超過5.0時,漆酶的相對活性低于50%,表面活性劑對漆酶活性的影響不明顯;當pH值達到7.0時,漆酶接近完全失活。
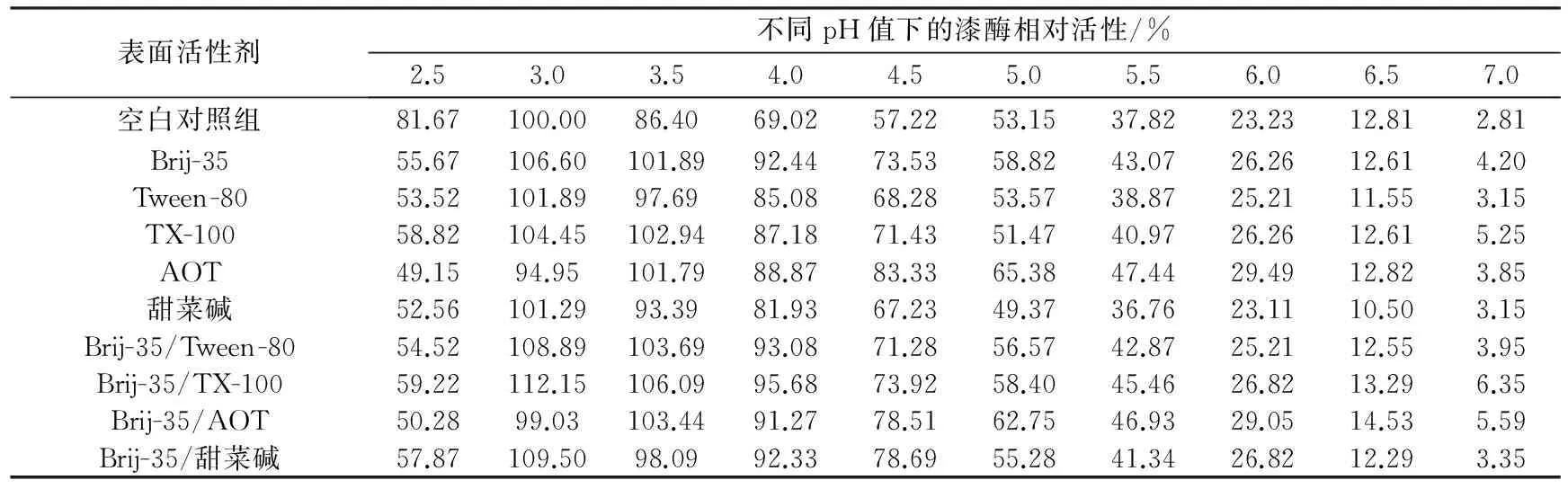
表2 pH值對漆酶相對活性的影響
在pH值為3.0~5.0的范圍內,檢測25 ℃水浴不同時間的空白對照組和添加表面活性劑復配體系的漆酶溶液的活性,以pH=3.0條件下初始時測得的空白對照組活性為100%,計算漆酶相對活性,得到漆酶的酸堿穩定性曲線,如圖4所示。從圖4中可以看出,與空白對照組相比,在Brij-35/TX-100和Brij-35/Tween-80復配體系中,漆酶的酸堿穩定性提高了;在Brij-35/甜菜堿和Brij-35/AOT復配體系中,漆酶的酸堿穩定性降低了。
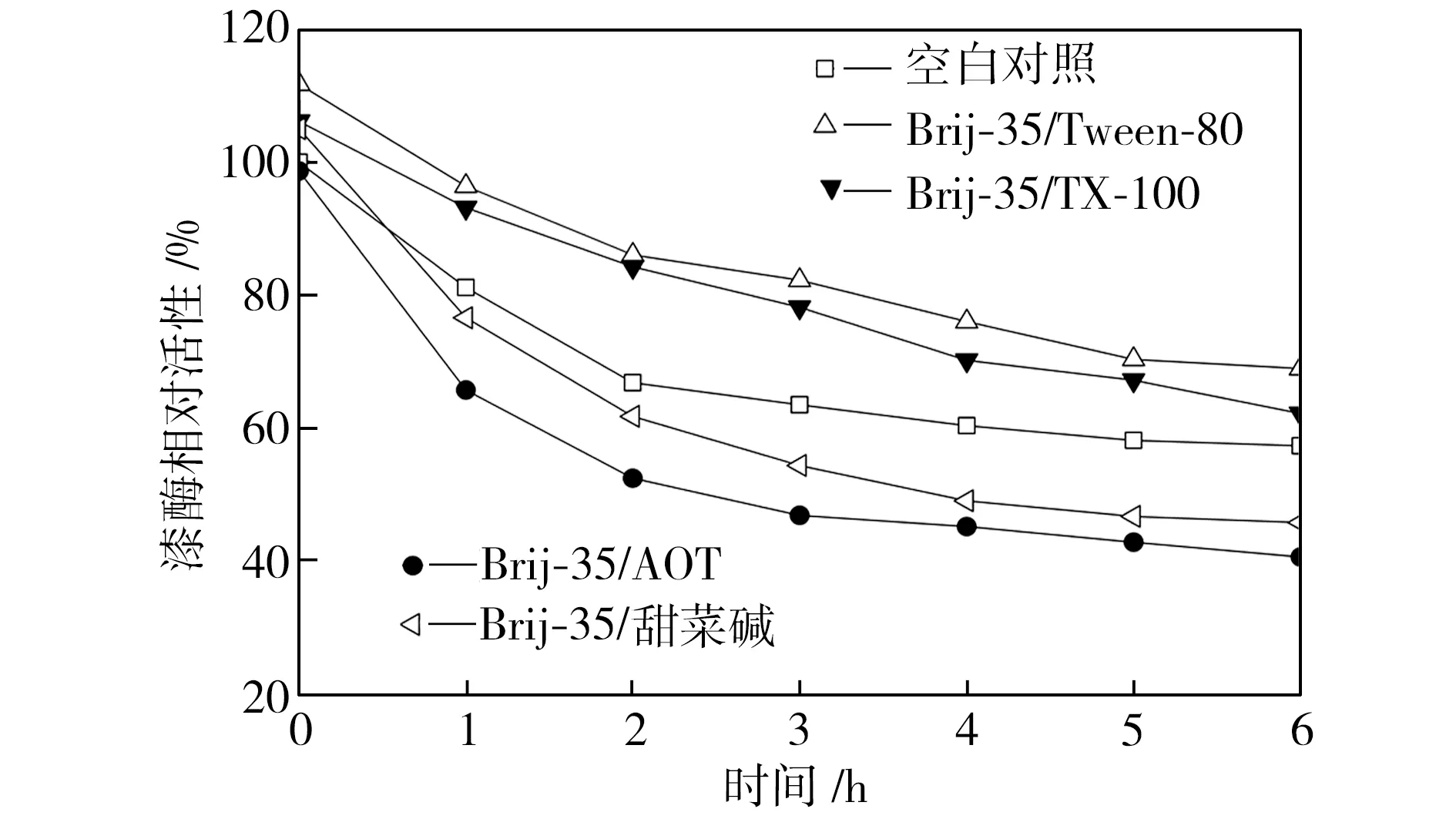
(a) pH=3.0
(b) pH=3.5

(c) pH=4.0
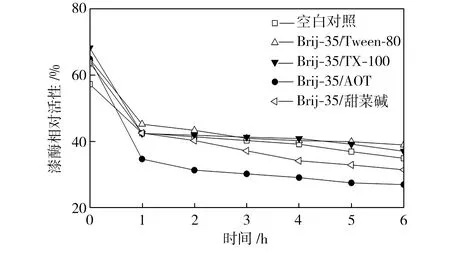
(d) pH=4.5
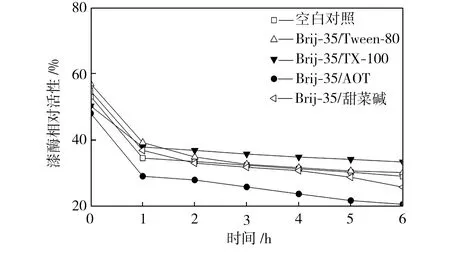
(e) pH=5.0
Fig.4Effectofmixedsurfactantsontheacid-alkalistabilityoflaccase
2.4 漆酶的熒光光譜分析
添加表面活性劑及其復配體系的漆酶熒光光譜如圖5所示,由于TX-100的存在使漆酶熒光圖譜無法正常檢測,故圖5中不包括加入TX-100和Brij-35/TX-100的漆酶對應的譜線。從圖5(a)可以看出,加入單一表面活性劑后,漆酶的最大熒光激發波長未發生紅移,但熒光強度發生改變,按表面活性劑排序依次為Tween-80>Brij-35>甜菜堿>空白對照組>AOT。這可能是由于表面活性劑頭部基團與漆酶的活性基團相互作用,使漆酶中能夠產生內源熒光的氨基酸殘基的微環境發生變化而引起的[8]。當Tween-80存在時,漆酶的疏水性氨基酸殘基暴露于非極性(或極性較小)的環境中,漆酶的熒光強度最高;當AOT存在時,漆酶的疏水性氨基酸殘基暴露于極性環境中,漆酶熒光強度最低。從圖5(b)可以看出,漆酶的熒光強度按表面活性劑復配體系排序依次為Brij-35/Tween-80>Brij-35/甜菜堿>Brij-35/AOT,這與單一表面活性劑存在時漆酶的熒光強度變化趨勢大致相同。
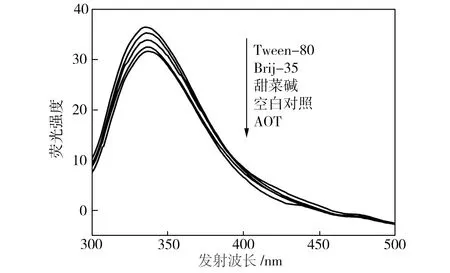
(a)單一表面活性劑

(b)表面活性劑復配體系
3 討論
表面活性劑對漆酶活性的影響方式主要表現為以下幾個方面:①表面活性劑可能與酶促反應底物競爭酶的活性中心;②表面活性劑可能使酶的外部反應條件發生改變;③表面活性劑濃度較高時,溶液中的膠束增多,導致底物在膠束中的分配增加,從而減少了可反應的有效底物濃度。漆酶與表面活性劑之間的相互作用主要包括靜電作用和疏水作用,這與酶的自身結構和電荷性質以及表面活性劑的化學性質有關[9]。靜電作用發生在表面活性劑的頭部基團和酶的帶電氨基酸殘基之間;疏水作用發生在表面活性劑的烷基鏈與酶的疏水性氨基酸殘基之間。這些相互作用使得酶構象及活性中心發生改變,從而影響酶的活性和穩定性。
在本研究中,表面活性劑及其復配體系的濃度增至2.0 mmol/L時,漆酶活性均有不同程度降低,可能是因為高濃度的表面活性劑減少了與漆酶反應的有效底物濃度。在合適條件下,表面活性劑復配體系提高了漆酶的熱穩定性,這可能是由于表面活性劑頭部基團與漆酶的活性中心產生相互作用,減弱了溫度對酶的不利影響,從而有益于酶催化性能的穩定。
4種表面活性劑復配體系互相比較,Brij-35/Tween-80和Brij-35/TX-100復配體系中漆酶穩定性較好,Brij-35/AOT復配體系中漆酶穩定性最差。由于AOT是陰離子型表面活性劑,能形成負電荷膠束,更容易與漆酶的活性中心結合,使漆酶的酶學特性和物理特性發生改變,對漆酶產生不穩定作用[10]。AOT及其復配體系的存在使漆酶的最佳pH值從3.0增加到3.5,也歸因于AOT引起的酶構象變化。甜菜堿對漆酶的影響與AOT類似,但甜菜堿是兩性離子型表面活性劑,在形成陰離子膠束時也形成了陽離子膠束,減少了部分陰離子膠束對漆酶的影響,故加入甜菜堿的漆酶穩定性要好于加入AOT的漆酶穩定性。而TX-100與Tween-80具有非離子特性,與漆酶之間存在疏水作用,使漆酶的疏水性氨基酸殘基暴露于非極性(或極性較小)的環境中,從而導致漆酶較穩定,這與表面活性劑及其復配體系存在時的漆酶熒光光譜測試結果相吻合。
4 結論
(1)表面活性劑對漆酶的催化性能產生影響,但不同類型和濃度的表面活性劑及其復配體系對漆酶活性的影響方式不同,主要取決于表面活性劑頭部基團的離子性質。
(2)添加本文所研究的幾種表面活性劑及其復配體系后,漆酶的最佳反應溫度(40 ℃)沒有改變,最佳pH值(3.0)也基本沒變,但在AOT存在時,漆酶的最佳pH值變為3.5。
(3)通過Brij-35與其他表面活性劑組建的復配體系,在合適條件下可以提高漆酶的活性和穩定性。比較而言,在非離子型與非離子型表面活性劑復配體系(Brij-35/Tween-80,Brij-35/TX-100)中,漆酶的穩定性最佳。
[1] Majeau J A, Brar S K, Tyagi R D. Laccases for removal of recalcitrant and emerging pollutants[J]. Bioresource Technology,2010,101(7):2331-2350.
[2] 熊亞紅,高敬忠,鄭堅鵬,等.提高漆酶穩定性的化學修飾方法的研究[J].化學研究與應用,2011,23(8):985-990.
[3] 于躍,張劍.纖維素酶與表面活性劑的相互作用及其在洗滌劑中的應用[J].化工學報,2016,67(7):3023-3031.
[4] 劉景林,林毅,褚瑩,等.新型陰離子表面活性劑的合成及其反膠束體系的酶催化性能[J].化學學報,2004,62(20):1998-2002.
[5] 張玉霞,趙繼華,杜中玉,等.AOT/TritonX-100混合反膠束體系中假絲酵母脂肪酶催化蓖麻油水解的活性[J]. 物理化學學報,2007,23(9):1483-1486.
[6] Zhu Hongbo, Aitken M D. Surfactant-enhanced desorption and biodegradation of polycyclic aromatic hydrocarbons in contaminated soil[J]. Environmental Science and Technology,2010, 44(19):7260-7265.
[7] Champagne P P, Nesheim M E, Ramsay J A. A mechanism for NaCl inhibition of reactive blue 19 decolorization and ABTS oxidation by laccase[J]. Applied Microbiology and Biotechnology,2013, 97(14):6263-6269.
[8] 王欣欣,李艷,安麗萍,等.光譜法研究Zn2+對枸杞超氧化物歧化酶活力和結構的影響[J].光譜學與光譜分析,2017,37(5):1455-1459.
[9] 梁運姍,袁興中,曾光明,等.表面活性劑在逆膠束酶反應系統中的作用機制[J].中國科學:化學,2011, 41(5): 763-772.
[10] Azimi M, Nafissi-Varcheh N, Mogharabi M, et al. Study of laccase activity and stability in the presence of ionic and non-ionic surfactants and the bioconversion of indole in laccase-TX-100 system[J].Journal of Molecular Catalysis B: Enzymatic,2016,126(4):69-75.

