用過硫酸銨消解測定天然水體中總磷的方法研究
趙金博,李蕾芳,王雪琪
(1.北京師范大學環境學院;2.水環境模擬國家重點實驗室,北京 100875)
目前,測定水體中的總磷含量常用的分析方法是鉬酸銨分光光度法。《水質 總磷的測定 鉬酸銨分光光度法(GB 11893-89)規定,在中性條件下,采用過硫酸鉀溶液對樣品進行消解。由于過硫酸鉀溶解性差,配制過程較為復雜,其溶液不易保存,需現用現配,人為誤差較大,本文研究了用過硫酸銨代替過硫酸鉀對樣品進行消解的可行性。通過對比在同等條件下過硫酸銨消解法和過硫酸鉀消解法對樣品的消解率,筆者發現,兩種消解法得出的結果基本沒有差異。在利用鉬酸銨分光光度法測量水體中磷的含量時,人們完全可以用過硫酸銨代替過硫酸鉀對水樣進行消解,這是一種操作簡單、重復性好、誤差率小的消解方法。本文將利用分析速度更快、操作更加簡單的AA3型流動分析儀測定水樣中磷的含量。
1 研究背景
水體中的磷是以各種磷酸鹽的形式存在的,包括正磷酸鹽、縮合磷酸鹽和有機磷酸鹽,總磷是指水體中各種形態的磷的總和[1]。水體中含磷量的增加,使水體中的浮游生物和藻類大量繁殖而消耗水中的溶解氧,從而加速水體的富營養化。因此,準確測定水體中的總磷含量非常重要[2-3]。
一般情況下,天然水體主要含有以下有機磷:植酸、三磷酸腺苷、三聚磷酸鈉、甲基三苯基溴化磷、對硝基苯磷酸二鈉、葡萄糖-6-磷酸、葡萄糖-1-磷酸和輔羧酶等。
植酸,難溶于水,是磷元素最穩定的化合物,豆、麥和其他谷物富含植酸。植酸在植物體中不是獨立存在的,它同二價、三價陽離子結合形成不溶性復合物。它通常與K+、Ca2+、Mg2+、Zn2+等離子先形成鹽,然后再與蛋白形成具有單層膜的泡狀小球,這些小球進一步聚集為更大體積的球狀體,這是植酸在生物體中的主要沉積形式。植酸是植物體內最重要的含磷化合物,60%~80%有機磷以植酸為載體存在[4]。
三磷酸腺苷(ATP),難溶于水,是一種核苷酸,參與細胞能量代謝、細胞內外信號轉導、細胞結構維持、DNA和RNA合成等[5]。三聚磷酸鈉,白色粉末狀結晶,可溶于水,因其無毒、廉價、鰲合Ca2+和Mg2+能力強,具有乳化、分散、增溶及與LAS顯著的協同效應等性能,被廣泛用為洗滌助劑,在食品行業中用作水分保持劑、品質改良劑、軟化劑和增稠劑等[6]。甲基三苯基溴化磷,難溶于水。
對硝基苯磷酸二鈉,可溶于水,是測定酸性和堿性磷酸酶的顯色底物,可以以對硝基苯磷酸二鈉為基質測定土壤磷酸酶的活性[7]。葡萄糖-6-磷酸(G6P),易溶于水,是糖代謝和糖異生途徑的重要中間產物,廣泛存在于動植物和微生物體中。在糖酵解途徑(EMP),葡萄糖經由己糖激酶反應磷酸化為G6P[8]。葡萄糖-1-磷酸(G-1-P),易溶于水,是糖代謝中重要的中間產物,由磷酸化酶催化體內多糖磷酸解而產生的,在葡萄糖磷酸變位酶的作用下轉變成葡萄糖-6-磷酸進入糖酵解。作為重要的起始反應物,G-1-P可用于二磷酸葡萄糖核苷、麥芽寡糖及海藻糖的生物合成[9]。輔羧酶,易溶于水,參與催化許多有機酸的脫羧反應,可對細胞色素C的活性起到促進作用[10]。
目前,測定水體中的總磷含量常用的分析方法是鉬酸銨分光光度法[11-12],其原理是在酸性介質中,正磷酸鹽與鉬酸銨反應,在銻鹽作用下生成磷鉬雜多酸后,立即被還原劑抗壞血酸還原,生成藍色絡合物,通常稱為磷鉬藍。在測定水體中的總磷含量前,人們通常需要將水體樣品進行消解,將所含磷全部氧化為正磷酸鹽,GB11893-89規定在中性條件下采用過硫酸鉀溶液對樣品進行消解。但是,過硫酸鉀不穩定、易分解,其溶液長期儲存會導致濃度發生變化,因此必須在臨用前進行配置,否則有可能導致樣品消解不完全,且重復性差。當待測水體是工業廢水或有機質濃度較高的水體時,由于有機物含量較高,研究者一般會加入過量的過硫酸鉀來保證水體中所有的有機磷被消解完全,但國內現有過硫酸鉀的純度有限,加入過硫酸鉀的量越多,其結果相對誤差越大,重復性差。此外,過硫酸鉀溶解性較差,0℃時溶解度為1.75 g/mL,室溫下(20℃)為5.3 g/mL,而GB11893-89中試驗要求為每100 mL溶解5 g過硫酸鉀,這將造成在冬季室內氣溫較低時,過硫酸鉀溶液易結晶,嚴重影響樣品的消解率[13]。這還將導致過硫酸鉀的溶解速度非常慢,必須以加熱方式來加快溶解速度。若要加快溶解,絕對不能盲目加熱,最好采用水浴加熱法,水浴溫度一定要低于60℃,否則過硫酸鉀會分解失效。
有學者用過硫酸鈉代替過硫酸鉀進行試驗[13],但是過量鈉鹽與顯色劑反應會產生白色絮狀物質堵塞泵管,經試驗,該方法不適用于AA3型流動分析儀。
本文目的在于驗證一種高效便捷、誤差較小的測量天然水體總磷的新方法,此方法主要針對AA3型流動分析儀。筆者選取天然水體中常見的8種有機磷,通過此創新方法和國標GB11893-89測量方法的對比,驗證本方法的可信度和可行性,并通過對標樣極值反復測量的方法明確新消解方法的適用濃度范圍。
2 試驗方法
2.1 主要儀器和試劑
主要儀器:消解瓶;高壓滅菌鍋;AA3型流動分析儀。
試劑:將天然水體中常見的8種有機磷配制成溶液。表1將常見的天然有機磷按照化學鍵的構成分為難溶(三磷酸腺苷、植酸、甲基三苯基溴化磷)、可溶(三聚磷酸鈉、對硝基苯磷酸二鈉)和易溶(葡萄糖-6-磷酸、葡萄糖-1-磷酸、輔羧酶)三種。其具體參數為:0.5 mL 1.4 mol/L的過硫酸銨溶液;0.5 mL 1.0 mol/L的硫酸;50 g/L的過硫酸鉀溶液;其余試劑同GB11893-89中規定的試劑。
2.2 配制天然水體中常見的8種有機磷水樣
2.2.1 三磷酸腺苷
稱量三磷酸腺苷1.285 g,用去離子水稀釋至1 000 mL,混合均勻,得到1 g/L貯備液,保存在4℃冰箱內冷藏備用。注意:為了避免有機磷光解,所有水樣均用棕色1 L廣口瓶保存。

表1 待消解水體樣品中有機磷選取標準
2.2.2 植酸
稱量植酸3.548 g,用去離子水稀釋至1 000 mL,混合均勻,得到1 g/L貯備液,保存在4℃冰箱內冷藏備用。
2.2.3 三聚磷酸鈉
稱量三聚磷酸鈉3.837 g,用去離子水稀釋至1 000 mL,混合均勻,得到1 g/L貯備液,保存在4℃冰箱內冷藏備用。
2.2.4 甲基三苯基溴化磷
稱量甲基三苯基溴化磷11.512 g,用去離子水稀釋至1 000 mL,混合均勻,得到1 g/L貯備液,保存在4℃冰箱內冷藏備用。
2.2.5 對硝基苯磷酸二鈉
稱量對硝基苯磷酸二鈉8.487 g,用去離子水稀釋至1 000 mL,混合均勻,得到1 g/L貯備液,保存在4℃冰箱內冷藏備用。
2.2.6 葡萄糖-6-磷酸
稱量葡萄糖-6-磷酸7.39 g,用去離子水稀釋至1 000 mL,混合均勻,得到1 g/L貯備液,保存在4℃冰箱內冷藏備用。
2.2.7 葡萄糖-1-磷酸
稱量葡萄糖-1-磷酸7.648 g,用去離子水稀釋至1 000 mL,混合均勻,得到1 g/L貯備液,保存在4℃冰箱內冷藏備用。
2.2.8 輔羧酶
稱量輔羧酶7.432 g,用去離子水稀釋至1 000 mL,混合均勻,得到1 g/L貯備液,保存在4℃冰箱內冷藏備用。
2.3 消解方法
(1)在消解瓶中加入15 mL 2.2中所述的待消解水體樣品、0.5 mL 1.4 mol/L的過硫酸銨和0.5 mL 1.0 mol/L的硫酸,將得到的裝有所述混合物料的消解瓶瓶蓋擰緊后松弛半圈,然后置于高壓滅菌鍋中進行消解處理,待壓力達1.1 kg/cm2、相應溫度為120℃時,保持30 min后停止加熱,待壓力表讀數降至零后,取出放冷,自然冷卻至室溫即可。
(2)按照GB11893-89中所述方法,取25 mL 2.2中所述的待消解水體樣品,加入4 mL 50 g/L過硫酸鉀溶液,將具塞刻度管的蓋塞緊后用一小塊布和線將玻璃塞扎緊或用其他方法固定在大燒杯中置于高壓蒸氣消毒器中加熱,待壓力達1.1 kg/cm2、相應溫度為120℃時,保持30 min后停止加熱。待壓力表讀數降至零后,取出放冷,然后用水稀釋至標線。
2.4 測量磷的含量
將消解后的樣品利用AA3型流動分析儀測量出樣品中磷的含量,根據2.2中配制的溶液磷含量,計算出各個樣品的消解率,結果如圖1所示。
2.5 對照試驗
根據GB11893-89,用過硫酸鉀作為消解時的氧化劑對8種水樣進行消解處理,并用AA3型流動分析儀測出水樣中的磷含量,計算出各個樣品的消解率。
2.6 濃度范圍測量
以植酸(phytic acid)為例,分別配置濃度2 μg/L、5 μg/L、10 μg/L、20 μg/L的樣品,用過硫酸銨法消解測量,每個濃度的樣品取3次平行樣,每個平行樣測量3次。植酸代表了極難溶于水的有機磷。
以植酸(phytic acid)為例,分別配置濃度0 mg/L、1 mg/L、2 mg/L、3 mg/L、4 mg/L、6 mg/L、8 mg/L的樣品,每個濃度的樣品重復消解5次,每個消解樣品連續測量3次(n=15),以樣品濃度的5%為基準,測量樣品在不同濃度下的重復性。
3 試驗結果與討論
對比圖1和圖2可知,本文提供的方法與國標法對天然水體樣品中常見的8種有機磷的消解率都超過了90%。與國標提供的消解方法相比,利用過硫酸銨作為消解時的氧化劑具有相同或更好的消解率,如采用本方法提供的方法對植酸進行消解,消解率達93.3%,而采用國標法的消解率為90%。此外,本方法消解有機磷的誤差率明顯小于國標法,如采用本方法對硝基苯磷酸二鈉和輔羧酶進行消解,誤差率在5%以內,而采用國標法誤差率均超過15%。這說明采用過硫酸銨作為消解時的氧化劑對水體樣品進行消解處理,重復性好、誤差率小、數據可靠性強。
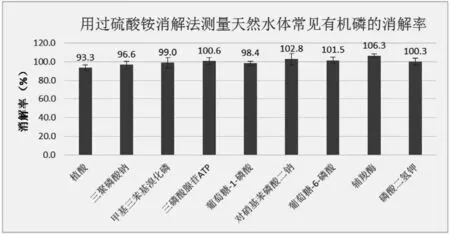
圖1 用過硫酸銨消解法測量天然水體常見有機磷的消解率
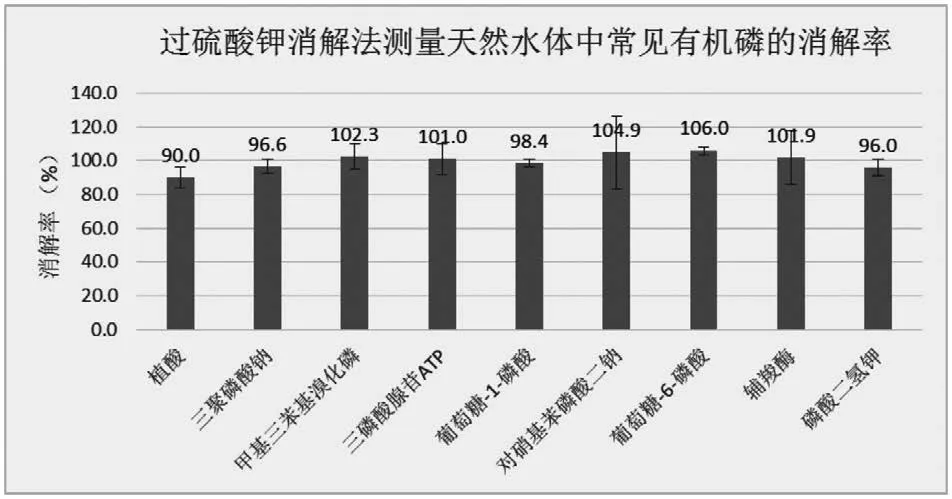
圖2 過硫酸鉀消解法測量天然水體中常見有機磷的消解率
從圖3可以看出,過硫酸銨法消解極難溶于水的植酸在濃度0.002~0.01 mg/L的范圍內回收率并不穩定,在濃度為0.02 mg/L時,回收率穩定并且重復性高,因此,該方法適用的最低有機磷濃度建議值為0.02 mg/L。
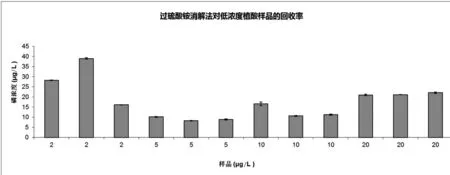
圖3 過硫酸銨消解法對低濃度植酸樣品的回收率
如圖4所示,在0 mg/L的樣品時,樣品的吸光度是高于基線值的。這也驗證了圖3的結論,可能是因為過硫酸銨藥品不純導致本方法無法測量總磷濃度極低的樣品,同時8 mg/L的樣品重復性最差,誤差線已經大于樣品的5%,其消解結果可信度存在一定風險。由于植酸代表了天然有機物中最難降解的有機磷成分,該方法在實踐結果上適用于樣品總磷濃度在0.02~6 mg/L。
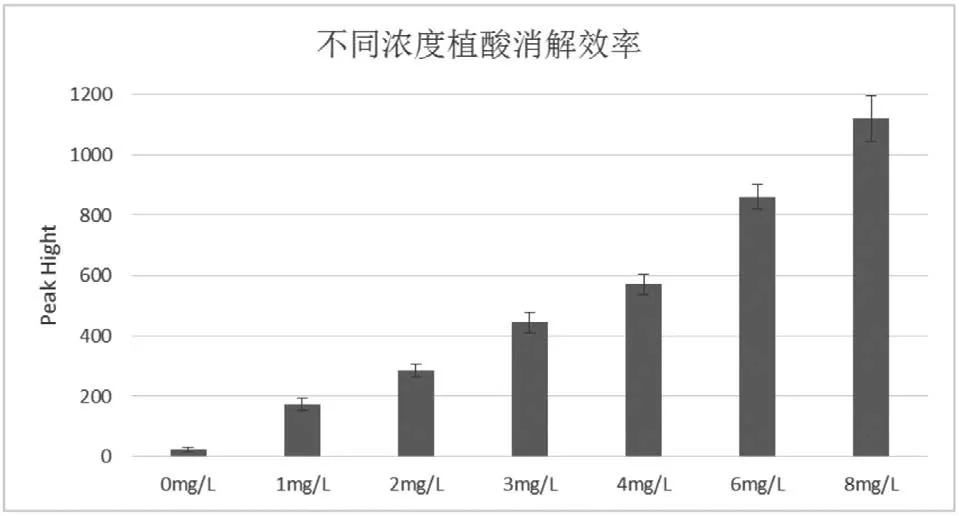
圖4 不同濃度植酸消解效率
4 結論
在使用AA3型流動分析儀測量天然水體總磷時,用過硫酸銨代替過硫酸鉀的方法進行消解是可行的,此創新方法操作更加簡便,誤差更小。
1 CVD Zee,N Roevros,C Lei.Phosphorus speciation,transformation and retention in the Scheldt estuary(Belgium/The Netherlands) from the freshwater tidal limits to the North Sea[J].Marine Chemistry,2007,106(1):76-91.
2 E A Nagul,I D Mckelvie,SD Kolev.The use of on-line UV photoreduction in the flow analysis determination of dissolved reactive phosphate in natural waters[J].Talanta,2015,133:155-161.
3 R T Bannerman.A simplified phosphorus technique[J].Environmental Letters,1975,9(1):43-53.
4 吳 澎,田紀春,王鳳成.谷物中植酸及其應用的研究進展[J].中國糧油學報,2009,24(3):137-143.
5 陳 波,郭 義,趙 雪,等.三磷酸腺苷與針刺效應相關性研究評述[J].針刺研究,2012,37(4):338-344.
6 房秀敏.淺談三聚磷酸鈉[J].日用化學工業,1996,(3):33-35.
7 李瑩飛,耿玉清,周紅娟,等.基于不同方法測定土壤酸性磷酸酶活性的比較[J].中國生態農業學報,2016,24(1):98-104.
8 陳潔梅,潘 濤,陳星旦.二階導數光譜預處理在用FTIR/ATR方法定量測定葡萄糖-6-磷酸和果糖-6-磷酸中的應用[J].光學精密工程,2006,14(1):1-7.
9 許向華,史軍花,趙國罡,等.高產胞外葡萄糖-1-磷酸菌株的篩選及鑒定[J].中國釀造,2011,(4):102-105.
10 戴海平,劉建立,李 泓,等.膜組合技術濃縮輔羧酶[J].中國醫藥工業雜志,2004,35(2):78-80.
11 L Woo,W Maher.Determination of phosphorus in turbid waters using alkaline potassium peroxodisulphate digestion[J].Analytica Chimica Acta,1995,315(1):123-135.
12 P Worsfold,I Mckelvie,P Monbet.Determination of phosphorus in natural waters:A historical review[J].Analytica Chimica Acta,2016,(918):8-20.
13 師 培.用過硫酸鈉消解測定水中總磷的方法研究[J].環境科學與管理,2007,32(10):160-161.

