舟山海域好氧不產氧光合異養細菌群落結構分析*
趙本宣 趙 晟 李汝偉 劉 強 吳常文①
(1. 浙江海洋大學 舟山 316022; 2. 國家海洋設施養殖工程技術研究中心 舟山 316022)
大洋海域更具生存優勢, 這意味著AAPB的豐度和多樣性會隨環境中營養豐富程度的提高而降低, 反之亦然。而Goericke(2002)等在南加利福尼亞沿岸的富營養、中營養和貧營養水域的對比研究卻得出與Kolber等人相反的結論。有人在泥炭沼澤湖泊中研究發現, 在 pH為 6.7—7.6之間時, AAPB的豐度最高(Lew et al, 2016)。因此, 目前AAPB在初級生產力中的地位還不能夠完全明確, 而且影響AAPB分布格局及其在海洋生物生產和物質循環中生態地位的機制或許要比預期的更加復雜(胡耀華, 2006), 只有從季節、年度尺度上對全球多個典型海區的廣泛的自然生態學調查, 獲取更充分、更具代表性的第一手數據,才能全面、準確地評估AAPB在海洋中的生態地位。
基于基因組和其它單基因位點的證據表明,AAPB和厭氧光合細菌一樣也含有細菌葉綠素, 它們是按功能分類的一類屬于變形菌門的細菌(Yurkov et al, 1998a, b; Bryant et al, 2006)。早期發現的大部分AAPB都來源于海洋環境, 在進化上都屬于α-Proteobacteria, 而 唯 一 屬 于 β-Proteobacteria的AAPB來自于淡水環境(Suyama et al, 1999), 基于環境序列的分析表明海洋未可培養細菌中還存在著類似 β-Proteobacteria 的 AAPB (Béjà et al, 2002)。而最近的研究表明在近岸海洋表層微生物群落中γ-Proteobacteria也占有相當的比重(Hu et al, 2006;Cho et al, 2007)。基于可培養和非培養的研究表明AAPB具有屬于α、β、γ分支的廣泛的遺傳多樣性, 這些研究都擴展了AAPB的多樣性(Salka et al, 2008)。由于海洋環境中絕大多數細菌都是未可培養的, 必然還會存在許多稀有的、目前還不為人知的AAPB種類。前人研究表明, 基于 16S rRNA的基因序列與pufM基因的序列分析結果所得到的AAPB系統發育關系不完全一致, 這說明光合作用的超級操縱子的側向遷移產生了高度多樣化的 AAPB 群落(Nagashima et al, 1997; Yurkov et al, 1998a, b)。像 16S rRNA基因, pufM基因存在于所有的AAPB中, 具有保守區和可變區, 使其成為一個很好的用于量化的豐度和評估 AAPB 的遺傳多樣性的分子標記(Achenbach et al, 2001; Allgaier et al, 2003)。由編碼光合反應中心M亞基的pufM基因所設計出來的引物被廣泛地用來擴增來自不同環境的樣品, 作為研究AAPB基因多樣性的最常用的方法(Yutin et al, 2005)。
對整個大西洋和太平洋的觀測證據表明, AAPB的豐度和多樣性沿環境梯度而改變。例如, 沿海和咸水似乎具有獨特的AAPB分支, 而在開放的海洋中卻未發現(Yutin et al, 2007)。同樣, 具有更高生產力的水域, 正如高葉綠素 a濃度所指示的, AAPB多樣性比貧營養水域要低(Jiao et al, 2007)。相反, 在一些主要的出海口定的采樣位置自由生活與顆粒附著AAPB之間不存在顯著差異, 但采樣點之間卻存在遺傳多樣性的顯著差異(Cottrell et al, 2010)。來自波羅的海不同位置的細菌樣本間存在 AAPB實質性的遺傳變異, 包括兩個淡水和咸水分支(Masín et al, 2006;Salka et al, 2008), 進一步表明AAPB的遺傳多樣性,并且這種多樣性具有與環境變量相關的生物地理和潛在的系統地理格局。已有的結果表明, 盡管環境變化可能很重要, 但也可能是特有的AAPB與原有島嶼生物地理學的一些假設一致(Losos, 1967), 即使沒有明顯限制它們懸浮分散在海洋中, 這表明地理的距離可能在這些微生物種群的生態結構中發揮重要作用。而AAPB群體遺傳多樣性也與環境變量和位置相關, 表明種群數量和遺傳多樣性是通過環境變量和特有機制的組合進行調節的(Ritchie et al, 2012)。
舟山群島海域是東海地區集旅游、港口、工業、漁業、養殖區等于一體的重要海域。根據舟山市海洋功能區劃, 結合島礁分布和行政區劃, 在基本涵蓋舟山所有功能海域的基礎上, 我們選擇了 8個典型站位。本文針對這8個典型站位的表層海水樣品, 基于高通量 DNA測序的方法, 利用編碼光合反應復合中心小亞基的pufM基因構建文庫, 對AAPB分布及其系統發育多樣性進行分析, 旨在初步探討舟山群島海域AAPB的多樣性情況, 為今后舟山群島AAPB生態學角色及其在碳循環中的貢獻奠定科學基礎。
1 材料與方法
1.1 樣品采集及預處理
于2016年4月在舟山群島海域選擇8個代表性站位, 采樣點的選擇依據舟山市海洋功能區劃和行政區劃相結合的原則, 采樣站位為東極島(DJ)(122.69°°E, 30.19°N)、岱山(DS)(122.11°E,30.27°N)、沈家門(SJM)(122.32°E, 29.94°N)、枸杞島(GQ)(122.81°E, 30.72°N)、金塘島(JT)(121.85°E,30.07°N)、六橫島(LH)(122.11°E, 29.79°N)、桃花島(TH)(122.30°E, 29.81°N)、朱家尖(ZJJ)(122.41°E,29.92°N), 見圖 1。采集表層(0.5m)海水樣品各2L裝入預先滅過菌的聚乙烯采樣瓶中, 先用真空抽濾裝置經 3μm 孔徑濾膜過濾去除大顆粒雜質, 再用0.22μm 孔徑濾膜過濾, 然后將濾膜取出, 放入已滅菌的含有石英砂的5mL離心管中, 于液氮中保存, 用于細菌DNA提取。

圖1 調查海區及采樣站位(東海舟山群島海域)Fig.1 Location of the study area and sampling stations in the Zhoushan Archipelago, the East China Sea注: 東極島(DJ), 枸杞島(GQ), 金塘島(JT), 六橫島(LH), 沈家門(SJM), 桃花島(TH), 朱家尖(ZJJ), 岱山(DS)。樣品采集于2016年4月8—30日
1.2 環境參數測定
在水樣采集的同時, 利用攜帶的便攜式 HQ-30D溶氧儀測定溶解氧和溫度, 鹽度計和 pH計分別測定鹽度和 pH, 總磷使用便攜多參數水質分析儀(型號:5B-2H)進行測定, 其它一些水質參數, 如 COD、氨氮、硫酸鹽、磷酸鹽、硅酸鹽、亞硝酸鹽和硝酸鹽等使用 Smartchem-200全自動間斷式化學分析儀進行測定。
1.3 DNA的提取及檢測
將保存濾膜的 5mL離心管從液氮中取出, 在無菌的條件下, 剪碎, 加入1mL提取緩沖液, 水樣中細菌DNA具體提取步驟參照美國MOBIO公司強力水樣DNA提取試劑盒的說明書, 并用1.0%瓊脂糖凝膠電泳檢測。
1.4 AAPB pufM基因PCR擴增
采樣針對不產氧光合細菌 pufM 基因擴增引物(Achenbach et al, 2001; Béjà et al, 2002) pufM-557-f(5′-TACGGSAACCTGTWCTAC-3′) 和 pufM-750-r(5′-CCATSGTCCAGCGCCAG AA-3′), 對樣品基因組DNA進行擴增, PCR產物片段長度約為193bp。PCR反應體系為95℃預變性4min, 95℃變性30s, 58℃退火 30s, 72℃延伸 30s, 循環 35次, 72℃延伸 5min。20μL反應混合液, 包括 2μL DNA, 正反引物各 0.7μL,10μL的PCR mastermix (TaKaRa), 用水補齊。擴增產物用1.5% (W/V)的瓊脂糖凝膠電泳檢測擴增效果。
1.5 樣品的高通量測序及數據分析流程
將樣品的 PCR產物, 送至上海翰宇生物科技有限公司在Illumina MiSeqTM平臺上進行高通量測序。為了提高分析結果的質量, 在序列充足的同時, 也要保證序列的質量, 因此, 分析前要先對原始數據進行過濾處理, 得到優質序列。然后對優質序列進行OTU聚類分析。基于OTU聚類分析結果, 可以進行Alpha多樣性分析, 根據 OTU的物種分類結果, 可以進行群落結構的統計分析。將OTU和分類學信息結合在一起進行 Beta多樣性分析。在提供了環境因子的情況下, 可以進行多樣性統計分析。
數據預處理, 使用Mothur v.1.32.1 (Schloss et al,2009) (http://www.mothur.org/wiki/Calculators)對原始數據進行處理, 得到優質序列, 并進行統計。使用QIIME (Caporaso et al, 2010)聚類生成OTU, 相似性設為97%, 即任意兩條reads的相似度均達到97%以上,將該序列聚類為一個OTU。OTU代表序列與NCBI nr數據庫BlastX比對, 得到每個OTU的分類學信息。
本研究中所有的原始數據全部上傳到 NCBI-SRA數據庫(http://www.ncbi.nlm.nih.gov/sra/SRP080714), 登錄號為ID: SRP080714。
2 實驗結果
2.1 環境參數
現場進行定位, 采集表層海水, 采樣深度為0.5m, 溶解氧(DO)、鹽度、pH、溫度現場測定, 其它水質參數, 如 COD、總磷、溶解無機氮(DIN)等帶回實驗室立即進行檢測, 結果如表1所示。從結果可以看出, 水溫為13.8—17.2; ℃溶解氧(DO)變化不大,為10.00—11.85; pH范圍在7.65—7.92; 鹽度變化較大, 20—33, 金塘最低, 東極最高; COD 含量都符合一類海水的標準; 無機氮含量桃花島最高, 為0.438mg/L, 總磷枸杞島最低, 只有0.008mg/L。
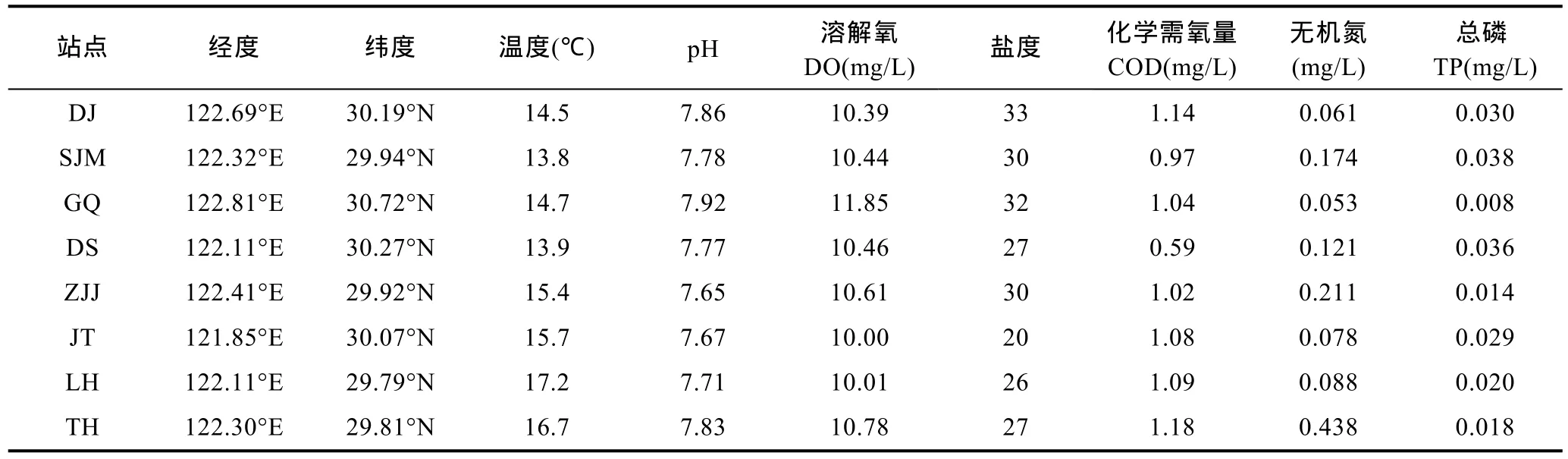
表1 采樣點環境參數Tab.1 The environmental parameters of each sampling station
2.2 OTU聚類和Alpha多樣性
經過預處理的原始測序數據, 一共得到 192633條序列, 我們進行了 OTU聚類分析, 相似性設為97%, 可以看到, 所有的數據最后一共分成 4051個OTU, 各站點 OTU聚類結果分別是 DJ 490個, GQ 670個, JT 1123個, LH 883個, SJM 1526個, TH 1204個, ZJJ 691 個(表 2)。
進行 Alpha多樣性分析, Alpha多樣性指數(estimator), 包括: 豐度評估指數(ACE指數和Chao 1指數)和多樣性評估指數(Shannon指數、Simpson指數和Coverage)。從ACE指數和Chao 1指數的結果可以看出, 各采樣站點微生物豐富度排序是: SJM > ZJJ> TH > JT > LH > GQ > DJ, 而從 Shannon 指數和Simpson指數來看, 各站點微生物多樣性從高到低依次是: SJM > LH > JT > TH > ZJJ > DJ > GQ。從Coverage可以看出, 測序深度已經足夠, 覆蓋度較高,文庫可用于評估AAPB多樣性。從稀釋性曲線(圖2)來看當測序量超過 25000讀長時, 仍然有新的 OTU被發現, 但是整個曲線已經趨于平緩, 說明測序數據量合理, 更多的數據量對發現新 OTU的邊際貢獻很小, 從圖中也可以看出相同序列數時, SJM、TH和JT的OTU數比其它三個位點要高, DJ最低, 說明SJM、TH和JT的微生物豐富度要高于其它三個位點, DJ的微生物豐富度最低。
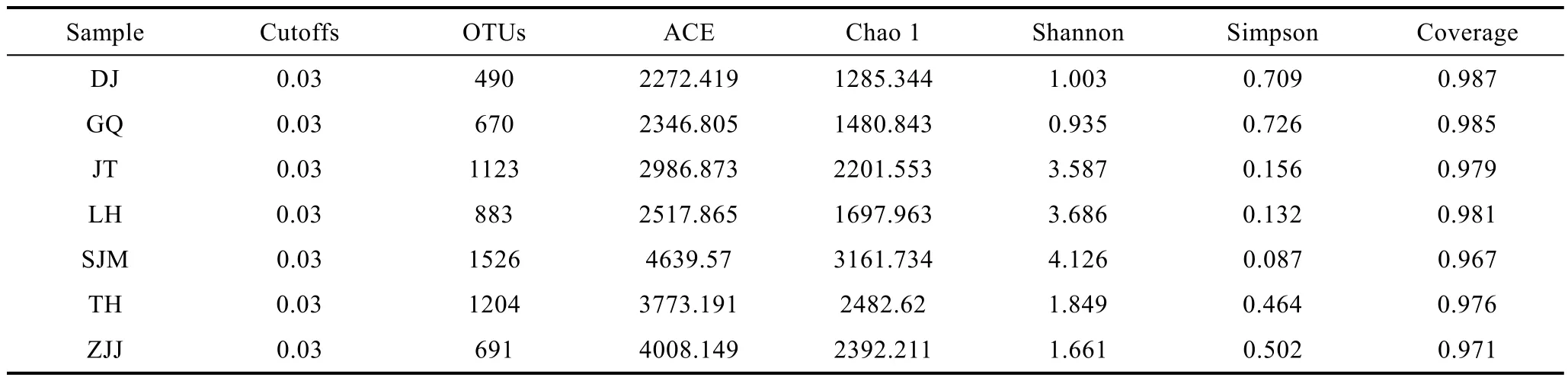
表2 樣品OTUs(cutoff=0.03)聚類和Alpha多樣性指數情況Tab.2 The OTUs and the estimators of each sample (cutoff=0.03)
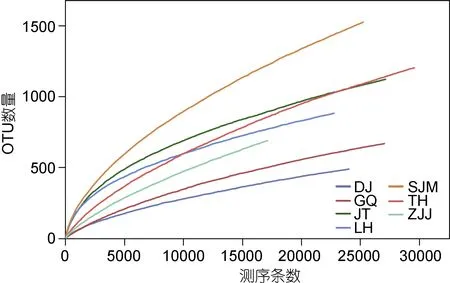
圖2 稀釋性曲線(cutoff=0.03)Fig.2 The rarefaction curve (cutoff=0.03)注: 橫軸為從某個樣品中隨機抽取的測序條數, 縱軸為基于該測序條數能構建的OTU數量。每條曲線代表一個樣品, 用不同顏色標記。東極島(DJ), 枸杞島 (GQ), 金塘島 (JT), 六橫島 (LH), 沈家門 (SJM), 桃花島 (TH), 朱家尖 (ZJJ)
2.3 AAPB群落組成
根據 OTU聚類分析的結果, 各采樣站點樣品中AAPB群落結果組成基本相似, 大部分序列都屬于未明確分類的細菌, 明確分類的門主要包括:Planctomycetes浮霉菌門, Proteobacteria變形菌門,Firmicutes厚壁菌門。AAPB在門水平上的組成分布與前人報道的結果相似(陳晨, 2014), 但是有關Planctomycetes的發現還不是很多。其中,Proteobacteria占已明確分類的細菌類群的絕對優勢,各站點中序列數目分別是DJ 150個, GQ 43個, JT 230個, LH 819個, SJM 195個, TH 89個, ZJJ 86個, 最多的是LH, 其次是JT, 最少的是GQ。Firmicutes只在JT和 ZJJ發現了, Planctomycetes僅在 ZJJ檢測到 1條序列。在明確分類的各細菌門中, 屬于Proteobacteria的AAPB占到總體的97%。
各站點聚類分析結果中未明確分類的 AAPB占大多數, 一共發現了 32個明確分類的屬, 明確分類的屬分類水平的分布情況見圖 3, 其中占優勢的菌屬分別為 Roseobacter、Sphingopyxis、Loktanella、Sphingomonas、Methylobacterium 和 Escherichia, 其中前三個是所有站點共有的屬。其它還包括Skermanella、Brevundimonas、Thalassobium、Bacillus、Isosphaera、Ahrensia、Maritimibacter、Rhodobacter、Sulfitobacter、Elioraea、Erythrobacter、Blastomonas、Citromicrobium、Novosphingobium、Limnohabitans、Rubrivivax、Methyloversatilis、Desulfocapsa、Thiohalocapsa、Thiorhodococcus、Klebsiella、Amphritea、Cellvibrio、Pseudomonas和 Cycloclasticus。有些屬只在某一個位點或其中幾個位點發現, 例如,Isosphaera、 Maritimibacter、 Desulfocapsa、Thiorhodococcus、Klebsiella和 Amphritea只存在于ZJJ, Ahrensia、Blastomonas和Methyloversatilis僅在JT發現。Sulfitobacter和Elioraea是LH特有的兩個屬, 而 Novosphingobium 是 TH 的 特 有 屬,Limnohabitans和Rubrivivax也僅在SJM檢測到。總的來說, 各位點明確分類的 AAPB豐度大小順序是LH>JT>SJM>DJ>TH>ZJJ>GQ。
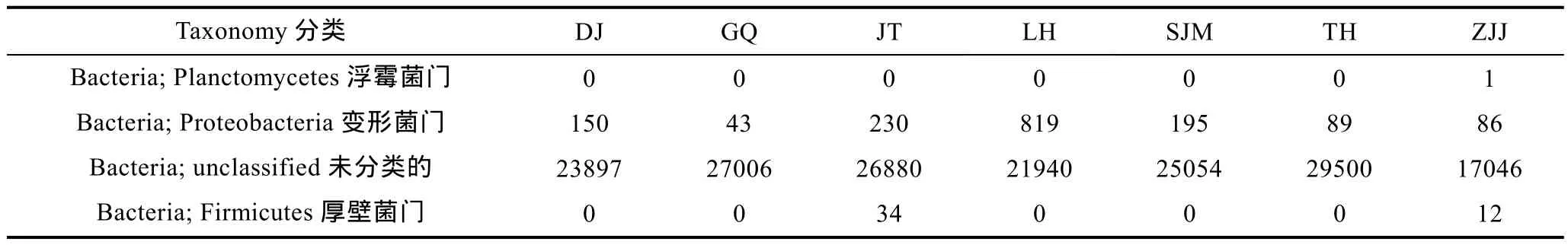
表3 門水平分類結果Tab.3 The taxonomy in phylum for AAPB in each station
2.4 AAPB群落相似性分析
從屬水平的樣品間聚類關系樹(圖 4)可以看出,各采樣位點之間的群落結構相似性, 其中LH和SJM相似性較高, DJ和GQ相似性最高, 然后TH和DJ、GQ兩個比較相似, ZJJ又和DJ、GQ和TH相似性較高, JT和其它位點相似性是最低的。Heatmap圖可以很直觀的反映各位點在 AAPB屬水平上群落組成的相似性和差異性(圖 5)。橫軸代表各采樣位點, 縱軸代表AAPB各屬, 在JT站點, Bacillus和Erythrobacter豐度較高, 而 Roseobacter豐度相對較低, TH站點,Sphingopyxis、Loktanella和 Roseobacter具有較高豐度, GQ主要是未明確分類的一些屬。可以發現, 單獨分析某一個屬的時候, 各站點差別仍然很明顯, 比如:Roseobacter相對豐度最高的是LH, DJ和ZJJ相對豐度比較高的都是 Escherichia, 在 DJ和 SJM,Methylobacterium的豐度相對較高, Bacillus在JT和ZJJ的分布則相對較多。同樣又印證了LH和SJM具有較高相似性, ZJJ、DJ、GQ和TH相似性比較近, 而JT與其它位點差異性是最大的。
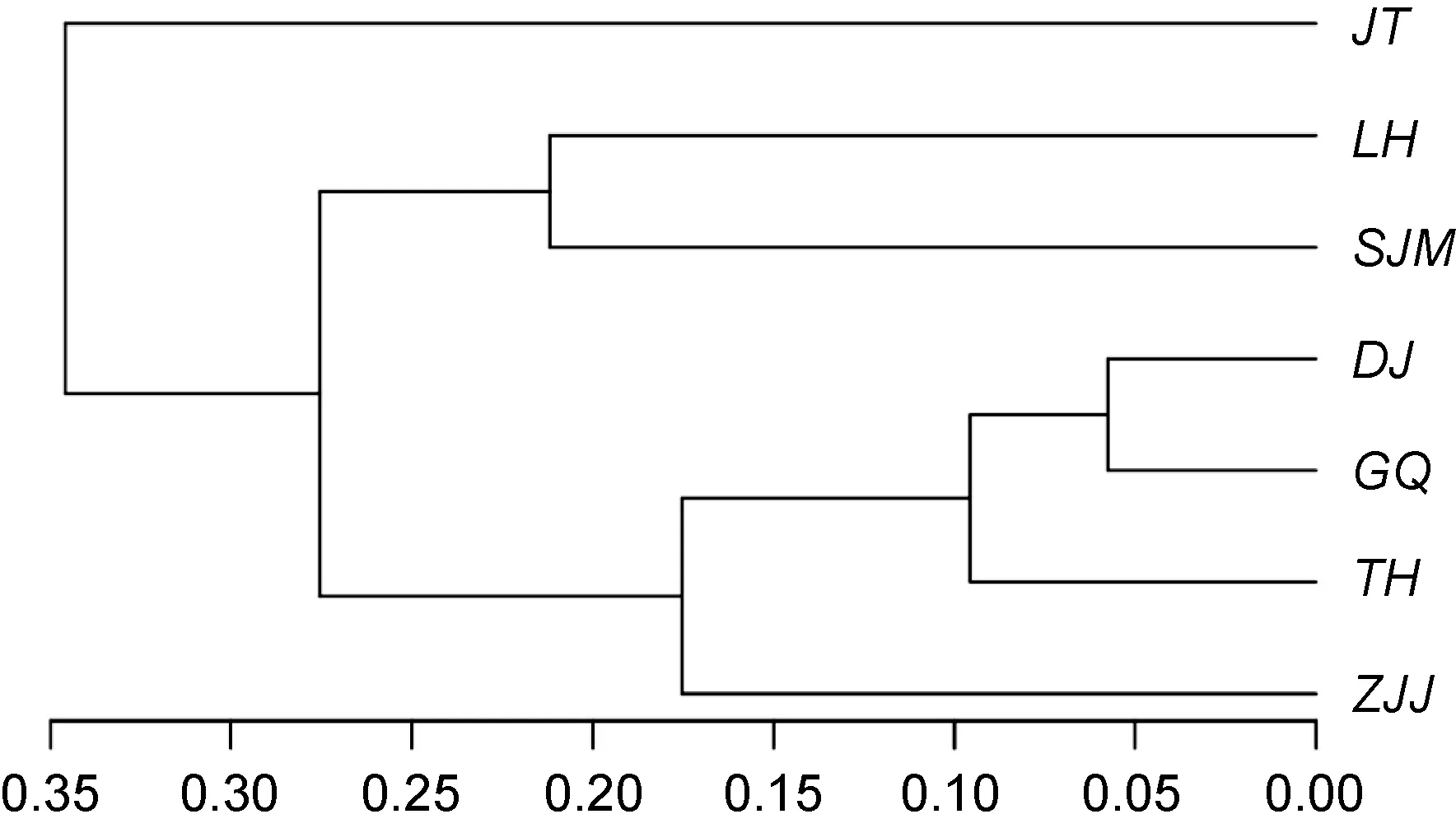
圖4 樣品間聚類關系樹(屬水平)Fig.4 The tree of clustering for all samples at genus level注: 下角的圖例為距離標尺, 分支距離越長, 差異關系越遠。東極島(DJ), 枸杞島(GQ), 金塘島(JT), 六橫島(LH), 沈家門(SJM), 桃花島(TH), 朱家尖(ZJJ)
RDA用于探究的AAPB豐度和環境變量之間的關系。不難發現, 溶解氧(DO)和 pH對于除Roseobacter和Escherichia之外的AAPB各屬細菌均呈正相關性關系, 而其它的環境變量如 COD、總磷(TP)、溫度(T)、無機氮(DIN)和鹽度(salinity)對Roseobacter和Escherichia呈正相關性關系。溶解氧(DO)、總磷(TP)和 pH射線較長, 說明這三種因素對相應的AAPB影響較大, 相關性比較明顯(圖6)。
3 討論與結論
本研究的目的是確定在舟山群島海域不同海洋功能區表層海水之間 AAPB群落組成的異同并進一步探究AAPB與環境因子之間的關系。我們推測舟山群島 AAPB的組成類型將有可能既表現出特有性又具有世界大同主義的細菌群落的格局。
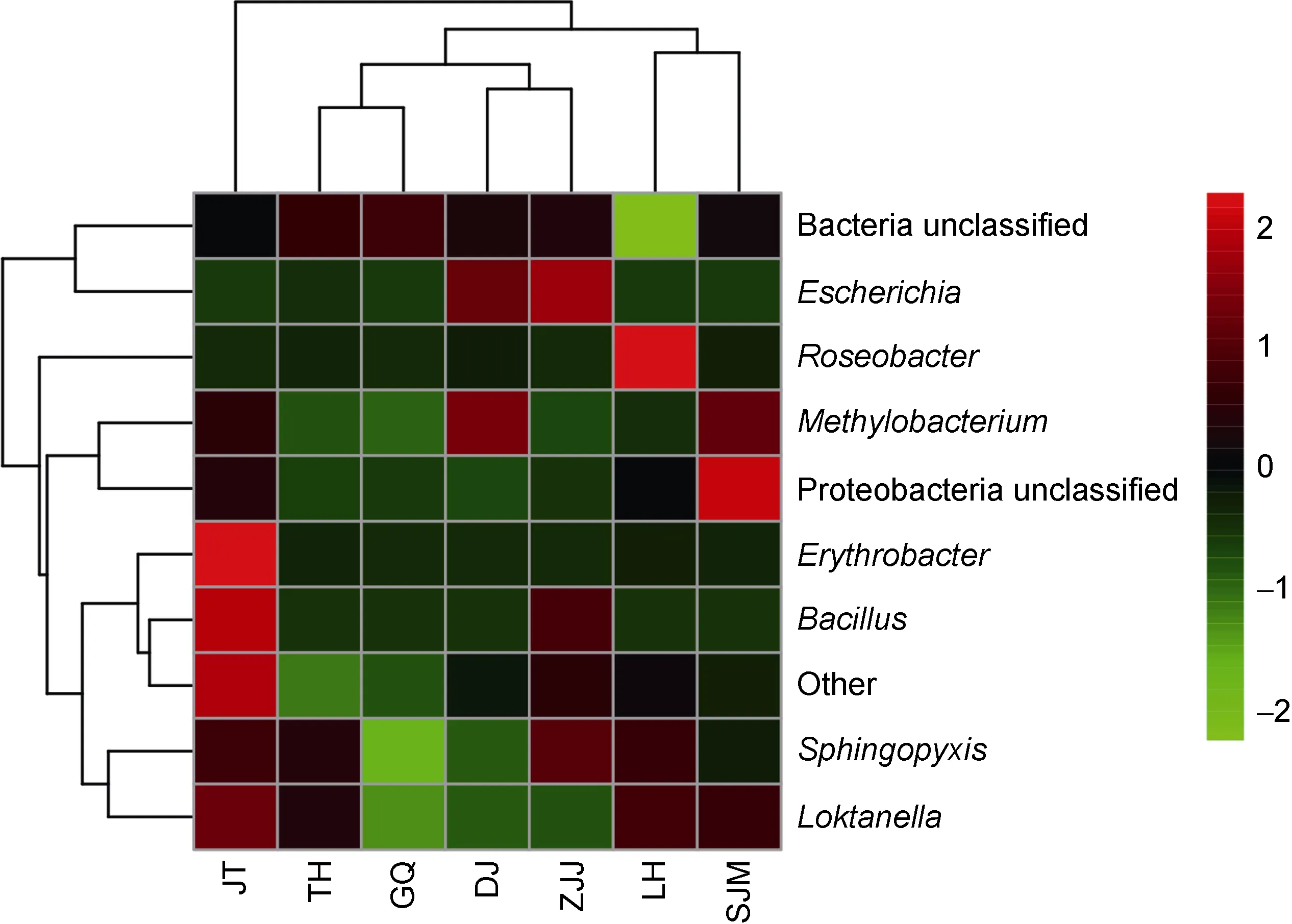
圖5 AAPB屬水平的Heatmap圖Fig.5 The Heatmap of AAPB in the sampling stations at genus level注: 每小格代表其所在樣品中某個物種的相對豐度, 顏色對應的是最上面的色階, 不同顏色代表物種所占比例, 從綠到紅, 代表該樣本橫坐標的豐度越高。東極島(DJ), 枸杞島(GQ), 金塘島(JT), 六橫島(LH), 沈家門(SJM), 桃花島(TH), 朱家尖(ZJJ)
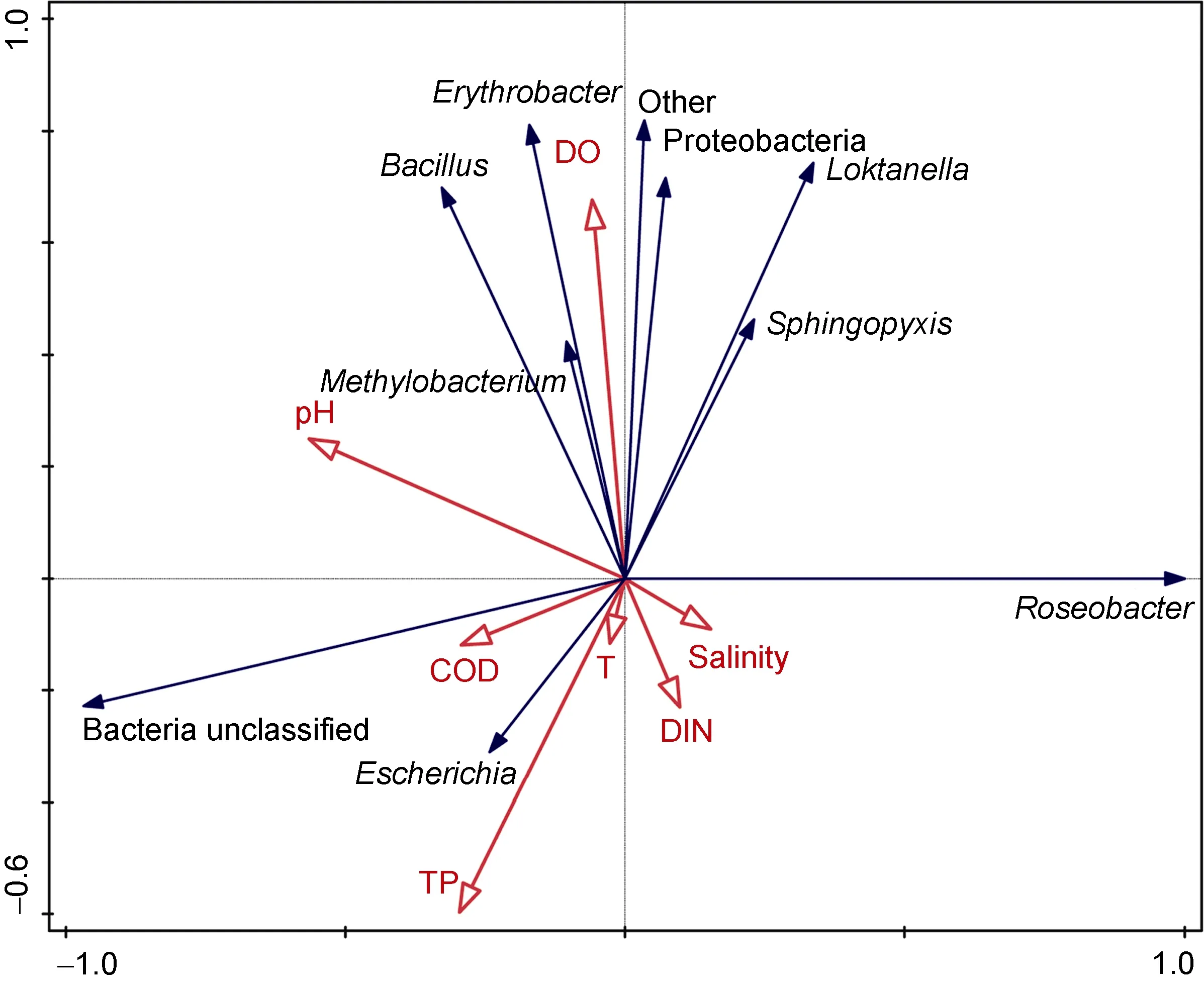
圖6 AAPB與環境參數之間關系的RDA分析Fig.6 Ordination plot of redundancy analysis (RDA) for AAPBs with hydrochemical data (environmental variables)注: 溫度(T), 溶解氧(DO), 鹽度(salinity), 化學需氧量(COD)無機氮(DIN)總磷(TP)。東極島(DJ), 枸杞島(GQ), 金塘島(JT), 六橫島(LH),沈家門(SJM), 桃花島(TH), 朱家尖(ZJJ)
所有的測序結果按照 97%的相似值, 一共歸為4051個 OTU中, 每個采樣站點的 OTU數不等, 為490—1526個。其中, 有28個OTU是所有站點共有的, 并且所含序列數占總測序條數的70%。基于OTU聚類分析的結果, 我們計算了每個樣品的α多樣性指數(表 2)。 7個站點獨有的 OTU數目分別是 DJ 10個、GQ 14個、JT 14個、LH 17個、SJM 33個、TH 24個、ZJJ 28個。Chao 1和ACE指數通常用來計算豐富度情況, 而Shannon和Simpson指數, 被用來估計多樣性。結果表明, 多樣性是排名為: SJM > LH >JT > TH > ZJJ > DJ > GQ, 而豐富度排名為: SJM >ZJJ > TH > JT > LH > GQ > DJ。在各種樣品中 OTU的變化中也觀察到類似的趨勢。稀釋性曲線很好地展示了各樣品測序的情況, 此外結合Alpha多樣性指數,可以得出結論: SJM微生物豐富度和多樣性都是最高的, LH、JT和TH也都比較高, 而DJ和GQ微生物豐富度和多樣性最低(圖2)。
與以往的研究相比(Zhang et al, 2007; Yutin et al,2009; Zeng et al, 2016; Zhang et al, 2016),α-Proteobacteria, γ-Proteobacteria 為優勢類群, 而我們的樣本中細菌群落是由 α-Proteobacteria,γ-Proteobacteria, β-Proteobacteria, δ-Proteobacteria,Bacilli和 Planctomycetia 為主(圖 4)。α-Proteobacteria已經被廣泛研究(Alexandre et al, 2008), 它們在赤潮的時候有明顯的增殖活動, 在沿岸和大洋環境中為主流群體(Gl?ckner et al, 1999; Pinhassi et al, 2000;Eilers et al, 2001; Alonso-Sáez et al, 2007)。近年來, 赤潮在DJ和GQ發生的頻率比以往更高, 可能與它們相對豐度降低有關, 特別是當與γ-Proteobacteria相比較的時候(Teira et al, 2007)。另一方面, 曾經有幾個α-Proteobacteria豐度增大的情況, 例如 Roseobacterlike細菌豐度隨著正烷烴的增加而增大(McKew et al,2007)。雖然一些報告已經描述過從烴污染海洋環境中分離 α-Proteobacteria的分類, 但還是難以確認這些微生物是否能夠降解或利用烴。一項對印度尼西亞海水中烴類降解菌的研究顯示, 屬于Sphingomonadales和 Rhodobacterales的不同的海洋α-Proteobacteria屬的細菌參與了脂肪族和低分子量芳烴的降解過程(Harwati et al, 2007)。值得注意的是, 在波羅的海北部夏季分層條件下, 當細菌的生長受養分可利用性的限制時, Sphingomonas屬種類占浮游細菌的主導地位(Pinhassi et al, 2000)。巧合的是這兩種類型的細菌在各采樣位點均被發現并鑒定出, 而最高是 LH, 其原因可能是因為它位于與許多有機污染物的污水區域。
一些結果表明, 屬于Rhodobacteraceae的AAPB在沿岸海域具有非常重要的影響。類似的結果, 在貧營養的西太平洋(Zheng et al, 2015)和極地沿海地區(Zeng et al, 2016)也有發現, 這表明AAPB更喜歡高透光的表層海水。屬于 Rhodobacteraceae科的Loktanella和Roseobacter兩個屬的 AAPB在所有的采樣站點中都處于優勢地位, 而在細菌屬的分類水平上, ZJJ和JT比其它樣本具有更高的多樣性(圖3)。Roseobacter進化枝在海水中的廣泛分布已經通過多種分子技術得到證實(Schmidt et al, 1991; González et al, 1997; Lanoil et al, 2000), 這些生物體是海洋浮游細菌的一個重要組成部分(Giovannoni, 2000)。目前,仍然缺乏足夠的知識去了解這一群體在海洋環境中的作用和功能。因此, 需要全面的研究以提高我們對α-Proteobacteria在海洋環境中的烴降解生態位的理解。
在JT和SJM也被發現了β-Proteobacterial群體(約占 3%), 然而很少有在除了淡水環境和河口以外其它環境中發現 β-Proteobacterial-like AAPB序列的報道(Ritchie et al, 2012)。Bouvier等(2002)在兩個河口發現了沿著鹽度梯度變化的細菌群落組成, 發現鹽度是β-Proteobacteria額外的控制因素。而伽瑪變形菌的成員被認為是海洋表層水中的重要的代表細菌,這也就意味著它們能夠快速生長并能迅速降解海洋中更容易被降解的有機成分(Pinhassi et al, 2003;Poretsky et al, 2005)。與以往的研究一致, 它們在大西洋、波羅的海和北太平洋(Hu et al, 2006; Masín et al,2006; Boeuf et al, 2013)中占主導地位。在高緯度(>60°N, >60°S)和極地水域缺乏伽馬變形細菌的情況相對于全球性的分布趨勢是一個例外, 表明其成員無法在冰冷的海水環境中發展壯大(Koh et al, 2011;Boeuf et al, 2013)。依賴培養的和非培養的研究表明,AAPB多樣性體現在擁有許多α-, β-和γ-Proteobacteria的成員(Jeanthon et al, 2011)。然而δ-Proteobacteria綱的Desulfocapsa屬在ZJJ的發現, 實屬罕見。在先前的研究報道中, 在石油污染潮下帶沉積物中曾經發現過它的存在(Acosta-González et al, 2013)。在AAPB的相關研究中, 至今幾乎很少有涉及到δ-Proteobacteria綱細菌的發現。究其原因, 這可能與環境有關, ZJJ屬于捕撈區, 基于Azam等(1994, 2007)提出了海洋微食物環的概念, 捕撈區必定具有高豐度的浮游生物, 從而相應地微生物種類和豐度也會更多。
基于非培養的分子技術, 如熒光原位雜交技術(Fluorescence In Situ Hybridization, FISH), 末端限制性片段長度多態性圖譜技術(Terminal-Restriction Fragment Length Polymorphism, T-RFLP)和 puf操縱子大量的插入克隆分析, 拓展了我們對AAPB多樣性和豐度的認識(Grüntzig et al, 2002; Cottrell et al,2006)。與傳統的基于分離培養的數據相比, 在不同類型的功能區, AAPB 含有 α-, β-, δ-和 γ類的變形菌, 并支持 AAPB多樣性遠不止兩個容易被培養的Erythrobacter和Roseobacter屬這一觀點。盡管已經有許多關于 AAPB在不同的地理位置和營養條件下的群落結構的研究(Zeng et al, 2009; Lehours et al,2010), 但尚未發現有沿著各種類型海洋功能區的AAPB分布的研究。我們探索了AAPB在不同功能區域表層海水的分布, 利用基于 pufM基因的高通量測序的數據。共得到 32個明確分類的屬和 7個屬于Proteobacteria綱未分類的屬(圖3), 而大多數OTU屬于未明確分類的AAPB的分支。這些屬分別被劃分為16科、15目、6綱和3門。在結果中, 豐度和多樣性相對較高的是變形桿菌, 其中也包含了大多數綱、目和科, 其次是厚壁菌門和浮霉菌門(表3)。尤其是屬于δ-Proteobacteria的 pufM 基因的發現, 使我們確信AAPB多樣性的復雜程度遠遠超出目前所了解的情況。
溫度是促進 AAPB生長的一個重要環境因素(Masín et al, 2006; Ferrera et al, 2014; Koblí?ek, 2015;Lew et al, 2015)。巴倫支海的數據呈現強烈的線性相關性, 在溫度最高時 AAPB的豐富度和多樣性最高(Lehours et al, 2015)。然而, 在極度貧營養的寒冷的高山湖泊, 電導率、pH值、硝酸鹽含量是影響AAPB群落結構分布和生長的主要因素(Koblí?ek, 2015)。在我們的研究中, Roseobacter屬在LH的豐度最高, 這可能表明溫度是某些Roseobacter屬細菌生長的至關重要條件。AAPB的豐度與pH值在我們研究的范圍內呈正相關, pH值顯著影響阿加西斯泥炭地冰川湖細菌群落的組成和紐約阿迪朗達克公園物種多樣性和豐富度(Frischer et al, 2008, Lin et al, 2012)。AAPB的豐度也可能直接或間接地受到其它因素(如水化學性質和pH值)的影響。水的pH值也可能會顯著改變原生生物和植食性浮游動物的組成。已有研究證明,AAPB經常處在激烈的被捕食的壓力下, 植食性浮游動物群落的改變可能也會嚴重影響 AAPB的數量(Ferrera et al, 2011)。另一個關鍵的環境因素是鹽度,它對海洋微生物的生長也有至關重要的影響。據報道,在特拉華河口和北冰洋西部的 AAPB受到環境鹽度變化影響(Waidner et al, 2008; Boeuf et al, 2013), 但這種影響關系在本研究中未發現。雖然鹽度變化很大(表 1), 在這些變化下的背后可能生存著許多具有相應生理耐受性的AAPB種群。可能的原因是, 不同鹽度的水域之間, 光線充足時, 光合異養可能在溫暖、高鹽度的水和寒冷、低鹽度的水中具有不同的生理作用。除了溫度以外, 不同的鹽度也導致 ZJJ的 pufM多樣性高于JT和LH。
Zohary和Robarts得出結論認為, 冬季在地中海東部, 磷是細菌和浮游植物大面積生長的最主要的限制性營養物質(Zohary et al, 1998)。同樣, 在夏天的地中海西北面水域, 磷的限制性作用也很常見(Zweifel et al, 1993, Sala et al, 2002)。此外, AAPB是一類快速生長代謝活躍的生物, 它們極大地促進了溶解氧的補充。我們可以得出結論認為, DO是影響許多細菌屬分布的一個重要因素(圖 6)。另外, 從采樣站點pufM基因的OTU分類結果表明, AAPB特有分支與特定環境條件有關。這些結果表明觀察到的AAPB豐度的變化往往也會伴隨著種群的遺傳多樣性變化(圖 5)。從屬的分布情況來看, Isosphaera、Maritimibacter、Desulfocapsa、Thiorhodococcus、Klebsiella和 Amphritea這幾個屬只在朱家尖(ZJJ)被發現, Ahrensia、Blastomonas和 Methyloversatilis僅屬于金塘島(JT), Sulfitobacter和 Elioraea只在六橫島(LH)存在, 而Novosphingobium也僅在桃花島被發現(TH), Limnohabitans和 Rubrivivax只存在于沈家門(SJM)(表4)。它們的生理適應和代謝靈活的本性表明了光能異養為其提供了選擇性的優勢。所有的物理和化學因素都可能在構建 AAPB種群結構時起到單獨或協同作用。數據表明, 不同的AAPB群體被各種復雜的環境因素所控制, 這或許可以解釋為什么目前很難準確預測水生環境總AAPB分布的問題。
陳 晨, 2014. 內蒙古高原湖泊好養不產氧光合細菌的分離及其脫氮活性分析和脫氮功能基因的檢測. 呼和浩特: 內蒙古農業大學碩士學位論文
胡耀華, 2006. 代表性海區好氧不產氧光合細菌的光合基因(pufM)生態分布特征, 廈門: 廈門大學碩士學位論文
Achenbach L A, Carey J, Madigan M T, 2001. Photosynthetic and phylogenetic primers for detection of anoxygenic phototrophs in natural environments. Applied and Environmental Microbiology, 67(7): 2922—2926
Acosta-González A, Rosselló-Móra R, Marqués S, 2013.Characterization of the anaerobic microbial community in oil-polluted subtidal sediments: aromatic biodegradation potential after the Prestige oil spill. Environmental Microbiology, 15(1): 77—92
Alexandre A, Laranjo M, Young J P W et al, 2008. dnaJ is a useful phylogenetic marker for alphaProteobacteria.International Journal of Systematic and Evolutionary Microbiology, 58(Pt 12): 2839—2849
Allgaier M, Uphoff H, Felske A et al, 2003. Aerobic anoxygenic photosynthesis in Roseobacter clade bacteria from diverse marine habitats. Applied and Environmental Microbiology,69(9): 5051—5059
Alonso-Sáez L, Balagué V, Sà E L et al, 2007. Seasonality in bacterial diversity in north-west Mediterranean coastal waters: assessment through clone libraries, fingerprinting and FISH. FEMS Microbiology Ecology, 60(1): 98—112
Atamna-Ismaeel N, Finkel O, Glaser F et al, 2012. Bacterial anoxygenic photosynthesis on plant leaf surfaces.Environmental Microbiology Reports, 4(2): 209—216
Azam F, Malfatti F, 2007. Microbial structuring of marine ecosystems. Nature Reviews Microbiology, 5(10): 782—791 Azam F, Smith D C, Steward G F et al, 1994. Bacteria-organic matter coupling and its significance for oceanic carbon cycling. Microbial Ecology, 28(2): 167—179
Béjà O, Suzuki M T, Heidelberg J F et al, 2002. Unsuspected diversity among marine aerobic anoxygenic phototrophs.Nature, 415(6872): 630—633
Beatty J T, 2005. On the natural selection and evolution of the aerobic phototrophic bacteria. In: Govindjee, Beatty J T,Gest H et al, eds. Discoveries in Photosynthesis.Netherlands: Springer, 1099—1104
Boeuf D, Cottrell M T, Kirchman D L et al, 2013. Summer community structure of aerobic anoxygenic phototrophic bacteria in the western Arctic Ocean. FEMS Microbiology Ecology, 85(3): 417—432
Bouvier T C, del Giorgio P A, 2002. Compositional changes in free-living bacterial communities along a salinity gradient in two temperate estuaries. Limnology and Oceanography,47(2): 453—470
Bryant D A, Frigaard N U, 2006. Prokaryotic photosynthesis and phototrophy illuminated. Trends in Microbiology, 14(11):488—496
Caporaso J G, Kuczynski J, Stombaugh J et al, 2010. QIIME allows analysis of high-throughput community sequencing data. Nature Methods, 7(5): 335—336
Cho J C, Stapels M D, Morris R M et al, 2007. Polyphyletic photosynthetic reaction centre genes in oligotrophic marine GammaProteobacteria. Environmental Microbiology, 9(6):1456—1463
Cooney M J, Johnston W A, Pohl S et al, 2006. Influence of photoperiod on pigmentation and metabolic efficiency of the marine aerobic anoxygenic photosynthetic bacterium Erythrobacter longus Strain NJ3Y. Aquatic Microbial Ecology, 43(3): 303—309
Cottrell M T, Mannino A, Kirchman D L, 2006. Aerobic anoxygenic phototrophic bacteria in the Mid-Atlantic bight and the North Pacific Gyre. Applied and Environmental Microbiology, 72(1): 557—564
Cottrell M T, Kirchman D L, 2009. Photoheterotrophic microbes in the Arctic Ocean in summer and winter. Applied and Environmental Microbiology, 75(15): 4958—4966
Cottrell M T, Ras J, Kirchman D L, 2010. Bacteriochlorophyll and community structure of aerobic anoxygenic phototrophic bacteria in a particle-rich estuary. The ISME Journal, 4(7): 945—954
Csotonyi J T, Swiderski J, Stackebrandt E et al, 2010. A new environment for aerobic anoxygenic phototrophic bacteria:biological soil crusts. Environmental Microbiology Reports,2(5): 651—656
Eilers H, Pernthaler J, Peplies J et al, 2001. Isolation of novel pelagic bacteria from the German bight and their seasonal contributions to surface picoplankton. Applied and Environmental Microbiology, 67(11): 5134—5142
Ferrera I, Borrego C M, Salazar G et al, 2014. Marked seasonality of aerobic anoxygenic phototrophic bacteria in the coastal NW Mediterranean Sea as revealed by cell abundance, pigment concentration and pyrosequencing of pufM gene. Environmental Microbiology, 16(9): 2953—2965
Ferrera I, Gasol J M, Sebastián M et al, 2011. Comparison of growth rates of aerobic anoxygenic phototrophic bacteria and other bacterioplankton groups in coastal Mediterranean waters. Applied and Environmental Microbiology, 77(21):7451—7458
Garcia-Chaves M C, Cottrell M T, Kirchman D L et al, 2016.Single-cell activity of freshwater aerobic anoxygenic phototrophic bacteria and their contribution to biomass production. The ISME Journal, 10(7): 1579—1588
Giovannoni S, Rappé M S, 2000. Evolution, diversity, and molecular ecology of marine prokaryotes. In: Kirchmann D L ed. Microbial Ecology of the Oceans. New York:Liss/Wiley, 47—84
Gl?ckner F O, Fuchs B M, Amann R, 1999. Bacterioplankton compositions of lakes and oceans: a first comparison based on fluorescence in situ hybridization. Applied and Environmental Microbiology, 65(8): 3721—3726
Goericke R, 2002. Bacteriochlorophyll a in the ocean: is anoxygenic bacterial photosynthesis important?. Limnology and Oceanography, 47(1): 290—295
González J M, Moran M A, 1997. Numerical dominance of a group of marine bacteria in the alpha-subclass of the class Proteobacteria in coastal seawater. Applied and Environmental Microbiology, 63(11): 4237—4242
Grüntzig V, Stres B, del Río H L A et al, 2002. Improved protocol for T-RFLP by capillary electrophoresis. Michigan: Center for Microbial Ecology, Michigan State University East Lansing
Hallin S, Lydmark P, Kokalj S et al, 2005. Community survey of ammonia-oxidizing bacteria in full-scale activated sludge processes with different solids retention time. Journal of Applied Microbiology, 99(3): 629—640
Harwati T U, Kasai Y, Kodama Y et al, 2007. Characterization of diverse hydrocarbon-degrading bacteria isolated from Indonesian seawater. Microbes and Environments, 22(4):412—415
Hu Y H, Du H L, Jiao N Z et al, 2006. Abundant presence of the γ-like Proteobacterial pufM gene in oxic seawater. FEMS Microbiology Letters, 263(2): 200—206
Jeanthon C, Boeuf D, Dahan O et al, 2011. Diversity of cultivated and metabolically active aerobic anoxygenic phototrophic bacteria along an oligotrophic gradient in the Mediterranean Sea. Biogeosciences, 8(7): 1955—1970
Jiao N Z, Zhang Y, Zeng Y H et al, 2007. Distinct distribution pattern of abundance and diversity of aerobic anoxygenic phototrophic bacteria in the global ocean. Environmental Microbiology, 9(12): 3091—3099
Koblí?ek M, 2015. Ecology of aerobic anoxygenic phototrophs in aquatic environments. FEMS Microbiology Reviews, 39(6):854—870
Koblí?ek M, Falkowski P G, Kolber Z S, 2006. Diversity and distribution of photosynthetic bacteria in the Black Sea.Deep Sea Research Part II: Topical Studies in Oceanography,53(17—19): 1934—1944
Koh E Y, Phua W, Ryan K G, 2011. Aerobic anoxygenic phototrophic bacteria in Antarctic sea ice and seawater.Environmental Microbiology Reports, 3(6): 710—716
Kolber Z S, Van Dover C L, Niederman R A et al, 2000. Bacterial photosynthesis in surface waters of the open Ocean. Nature,407(6801): 177—179
Kolber Z S, Gerald F, Plumley et al, 2001. Contribution of aerobic photoheterotrophic bacteria to the carbon cycle in the ocean. Science, 292(5526): 2492—2495
Labrenz M, Lawson P A, Tindall B J et al, 2005. Roseisalinus antarcticus gen. nov., sp. nov., a novel aerobic bacteriochlorophyll a-producing α-proteobacterium isolated from hypersaline Ekho Lake, Antarctica. International Journal of Systematic and Evolutionary Microbiology, 55(Pt 1): 41—47
Lanoil B D, Carlson C A, Giovannoni S J, 2000. Bacterial chromosomal painting for in situ monitoring of cultured marine bacteria. Environmental Microbiology, 2(6):654—665
Lehours A C, Cottrell M T, Dahan O et al, 2010. Summer distribution and diversity of aerobic anoxygenic phototrophic bacteria in the Mediterranean Sea in relation to environmental variables. FEMS Microbiology Ecology,74(2): 397—409
Lehours A C, Jeanthon C, 2015. The hydrological context determines the beta-diversity of aerobic anoxygenic phototrophic bacteria in European Arctic seas but does not favor endemism. Frontiers in Microbiology, 6: 638
Lew S, Koblí?ek M, Lew M, 2015. Seasonal changes of microbial communities in two shallow peat bog lakes. Folia Microbiologica, 60(2): 165—175
Lew S, Lew M, Koblí?ek M, 2016. Influence of selected environmental factors on the abundance of aerobic anoxygenic phototrophs in peat-bog lakes. Environmental Science and Pollution Research, 23(14): 13853—13863
Lin X, Green S, Tfaily M M et al, 2012. Microbial community structure and activity linked to contrasting biogeochemical gradients in bog and fen environments of the Glacial Lake Agassiz Peatland. Applied and Environmental Microbiology,78(19): 7023—7031
Losos J B, 1967. The theory of island biogeography. Bioscience,18(3): 522—542
Ma?ín M, Nedoma J, Pechar L et al, 2008. Distribution of aerobic anoxygenic phototrophs in temperate freshwater systems.Environmental Microbiology, 10(8): 1988—1996
Masín M, Zdun A, Ston-Egiert J et al, 2006. Seasonal changes and diversity of aerobic anoxygenic phototrophs in the Baltic Sea. Aquatic Microbial Ecology, 45(3): 247—254
McKew B A, Coulon F, Osborn A M et al, 2007. Determining the identity and roles of oil-metabolizing marine bacteria from the Thames estuary, UK. Environmental Microbiology, 9(1):165—176
Moran M A, Miller W L, 2007. Resourceful heterotrophs make the most of light in the coastal ocean. Nature Reviews Microbiology, 5(10): 792—800
Nagashima K V P, Hiraishi A, Shimada K et al, 1997. Horizontal transfer of genes coding for the photosynthetic reaction centers of purple bacteria. Journal of Molecular Evolution,45(2): 131—136
Nuyanzina-Boldareva E N, Akimov V N, Takaichi S et al, 2016.New strains of an aerobic anoxygenic phototrophic bacterium Porphyrobacter donghaensis isolated from a Siberian thermal spring and a weakly mineralized lake.Microbiology, 85(1): 77—86
Percent S F, Frischer M E, Vescio P A et al, 2008. Bacterial community structure of acid-impacted lakes: what controls diversity?. Applied and Environmental Microbiology, 74(6):1856—1868
Pinhassi J, Berman T, 2003. Differential growth response of colony-forming α-and γ-Proteobacteria in dilution culture and nutrient addition experiments from Lake Kinneret(Israel), the eastern Mediterranean Sea, and the Gulf of Eilat.Applied and Environmental Microbiology, 69(1): 199—211
Pinhassi J, Hagstr?m ?, 2000. Seasonal succession in marine bacterioplankton. Aquatic Microbial Ecology, 21(3):245—256
Poretsky R S, Bano N, Buchan A et al, 2005. Analysis of microbial gene transcripts in environmental samples.Applied and Environmental Microbiology, 71(7):4121—4126
Rathgeber C, Beatty J T, Yurkov V, 2004. Aerobic phototrophic bacteria: new evidence for the diversity, ecological importance and applied potential of this previously overlooked group. Photosynthesis Research, 81(2):113—128
Ritchie A E, Johnson Z I, 2012. Abundance and genetic diversity of aerobic anoxygenic phototrophic bacteria of coastal regions of the pacific ocean. Applied and Environmental Microbiology, 78(8): 2858—2866
Sala M M, Peters F, Gasol J M et al, 2002. Seasonal and spatial variations in the nutrient limitation of bacterioplankton growth in the northwestern Mediterranean. Aquatic Microbial Ecology, 27: 47—56
Salka I, Moulisová V, Koblí?ek M et al, 2008. Abundance, depth distribution, and composition of aerobic bacteriochlorophyll a-producing bacteria in four basins of the central Baltic Sea.Applied and Environmental Microbiology, 74(14):4398—4404
Schloss P D, Westcott S L, Ryabin T et al, 2009. Introducing mothur: open-source, platform-independent, communitysupported software for describing and comparing microbial communities. Applied and Environmental Microbiology,75(23): 7537—7541
Schmidt T M, DeLong E F, Pace N R, 1991. Analysis of a marine picoplankton community by 16S rRNA gene cloning and sequencing. Journal of Bacteriology, 173(14): 4371—4378
Schwalbach M S, Fuhrman J A, 2005. Wide-ranging abundances of aerobic anoxygenic phototrophic bacteria in the world ocean revealed by epifluorescence microscopy and quantitative PCR. Limnology and Oceanography, 50(2):620—628
Shiba T, Simidu U, 1982. Erythrobacter longus gen. nov., sp. nov.,an aerobic bacterium which contains bacteriochlorophyll a.International Journal of Systematic Bacteriology, 32(2):211—217
Suyama T, Shigematsu T, Takaichi S et al, 1999. Roseateles depolymerans gen. nov., sp. nov., a new bacteriochlorophyll a-containing obligate aerobe belonging to the β-subclass of the Proteobacteria. International Journal of Systematic Bacteriology, 49 Pt 2: 449—457
Teira E, Lekunberri I, Gasol J M et al, 2007. Dynamics of the hydrocarbon-degrading Cycloclasticus bacteria during mesocosm-simulated oil spills. Environmental Microbiology,9(10): 2551—2562
Waidner L A, Kirchman D L, 2005. Aerobic anoxygenic photosynthesis genes and operons in uncultured bacteria in the Delaware River. Environmental Microbiology, 7(12):1896—1908
Waidner L A, Kirchman D L, 2007. Aerobic anoxygenic phototrophic bacteria attached to particles in turbid waters of the Delaware and Chesapeake estuaries. Applied and Environmental Microbiology, 73(12): 3936—3944
Waidner L A, Kirchman D L, 2008. Diversity and distribution of ecotypes of the aerobic anoxygenic phototrophy gene pufM in the Delaware estuary. Applied and Environmental Microbiology, 74(13): 4012—4021
Yurkov V, Beatty J T, 1998a. Isolation of aerobic anoxygenic photosynthetic bacteria from black smoker plume waters of the Juan de Fuca ridge in the pacific ocean. Applied and Environmental Microbiology, 64(1): 337—341
Yurkov V V, Beatty J T, 1998b. Aerobic anoxygenic phototrophic bacteria. Microbiology and Molecular Biology Reviews:MMBR, 62(3): 695—724
Yutin N, Suzuki M T, Béjà O, 2005. Novel primers reveal wider diversity among marine aerobic anoxygenic phototrophs.Applied and Environmental Microbiology, 71(12): 8958—8962
Yutin N, Suzuki M T, Teeling H et al, 2007. Assessing diversity and biogeography of aerobic anoxygenic phototrophic bacteria in surface waters of the Atlantic and Pacific Oceans using the Global Ocean Sampling expedition metagenomes.Environmental Microbiology, 9(6): 1464—1475
Yutin N, Suzuki M T, Rosenberg M et al, 2009. BchY-based degenerate primers target all types of anoxygenic photosynthetic bacteria in a single PCR. Applied and Environmental Microbiology, 75(23): 7556—7559
Zeng Y X, Dong P Y, Qiao Z Y et al, 2016. Diversity of the aerobic anoxygenic phototrophy gene pufM in Arctic and Antarctic coastal seawaters. Acta Oceanologica Sinica, 35(6):68—77
Zeng Y H, Shen W, Jiao N Z, 2009. Genetic diversity of aerobic anoxygenic photosynthetic bacteria in open ocean surface waters and upper twilight zones. Marine Biology, 156(3):425—437
Zhang L, Gao G, Tang X M et al, 2016. Pyrosequencing analysis of bacterial communities in Lake Bosten, a large brackish inland lake in the arid northwest of China. Canadian Journal of Microbiology, 62(6): 455—463
Zhang Y, Jiao N Z, 2007. Dynamics of aerobic anoxygenic phototrophic bacteria in the East China Sea. FEMS Microbiology Ecology, 61(3): 459—469
Zheng Q, Liu Y, Steindler L et al, 2015. Pyrosequencing analysis of aerobic anoxygenic phototrophic bacterial community structure in the oligotrophic western Pacific Ocean. FEMS Microbiology Letters, 362(8): fnv034
Zohary T, Robarts R D, 1998. Experimental study of microbial P limitation in the eastern Mediterranean. Limnology and Oceanography, 43(3): 387—395
Zweifel U L, Norrman B, Hagstr?m ?, 1993. Consumption of dissolved organic carbon by marine bacteria and demand for inorganic nutrients. Marine Ecology Progress Series,101(1—2): 23—32

