西藏靈菇中兩株產胞外多糖單胞釀酒酵母菌發酵性能及其發酵乳的流變學特性
, ,*,
(1.青海大學農林科學院,青海西寧 810016;2.青海省農林科學院,青海西寧 810016;3.青海省青藏高原農產品加工重點實驗室,青海西寧 810016)
西藏靈菇是一種乳白色膠狀的顆粒物,形酷似米粒[1-2],是一種天然的酸奶發酵劑,屬于開菲爾的一個品系[3],有“西藏雪蓮”之稱[4]。其內部是由乳酸菌、酵母菌和醋酸菌共生而成的,在其生長過程中會產生胞外多糖[5],而胞外多糖產生菌發酵的酸奶具有明顯改善酸奶的組織狀態和穩定性的特點[6-7],因此,篩選和分離產胞外多糖乳酸菌成為現在發酵乳領域研究的熱點。而在西藏靈菇上棲息的微生物由于益生菌的種類不同、培養基不同,其產生的胞外多糖會存在明顯的差異[8-10]。目前研究大部分集中在西藏靈菇中產胞外多糖的乳酸菌,包括嗜熱鏈球菌、馬乳酒樣乳桿菌和植物乳桿菌[11-14],而對西藏靈菇中酵母菌的分離和產胞外多糖特性的相關研究還未見報道。
本研究以前期實驗分離得到的兩株產胞外多糖的單胞釀酒酵母菌為研究對象,但由于其生長特性及發酵特性尚不明確,菌株有效合理的評價體系不完善,其應用價值也受到了限制。因此,本研究通過對分離菌株生長特性、產胞外多糖能力、發酵特性進行研究,同時研究其菌株發酵制備的發酵乳的流變學特性,對于評價不同菌株發酵乳的質地、黏彈性、穩定性方面具有重要作用[15],旨在為分離自西藏靈菇中產胞外多糖的兩株單胞釀酒酵母菌發酵酸乳的品質評價提供理論依據,同時,通過本研究篩選出具有應用價值的菌株,為其后續開發與應用提供參考。
1 材料與方法
1.1材料與儀器
酵母菌J5、J7由青海省青藏高原農產品加工重點實驗室分離得到,經鑒定均為單胞釀酒酵母菌;脫脂乳培養基 將新鮮牛乳離心(4000 r/min條件下10 min),滅菌(105 ℃,20 min);YEPD培養基 葡萄糖20 g、蛋白胨10 g、酵母提取物5 g、氯霉素 0.2 g、蒸餾水 1 L,105 ℃下滅菌20 min;葡萄糖標準品(100 mg) 合肥博美生物科技有限責任公司;鮮牛乳 采自青海省良種繁殖場;Sevage試劑 氯仿∶正丁醇=5∶1 (V/V);其他試劑 均為分析純。
DHR流變儀 美國TA儀器;pHS-3C型精密酸度計 上海儀電科學儀器股份有限公司;LDZX-75KBS型立式壓力蒸汽滅菌器 上海申安醫療器械廠;SW-CJ-2D型雙人凈化工作臺 蘇州凈化設備有限公司;AL204型分析天平 梅特勒-托利多儀器(上海)有限公司;N4S紫外可見分光光度計 上海儀電分析儀器有限公司;LRH-150型生化培養箱 上海齊欣科學儀器有限公司;THZ-300C型恒溫振蕩器 上海一恒科學儀器有限公司;BCD-649WE型冰箱 青島海爾股份有限公司;DL-5M型高速臺式冷凍離心機 長沙湘儀離心機儀器有限公司;FD-1A-50型真空冷凍干燥機 北京博醫康實驗儀器有限公司。
1.2實驗方法
1.2.1 菌種的活化 用接種環挑取保藏菌株兩環,接種于100 mL液體YEPD培養基中,28 ℃培養48 h進行活化,活化2次。
1.2.2 兩株單胞釀酒酵母菌生長特性研究 將兩株活化后的菌種以4%的接種量接入液體YEPD培養基,28 ℃下培養,每3 h取樣,測定其在600 nm波長處的吸光值(OD600值)及pH的變化[16]。
1.2.3 菌種胞外多糖的提取及多糖含量的測定
1.2.3.1 菌種胞外多糖的提取 胞外多糖的提取參照文獻[17-18]并改進。兩株菌株以5%的接種量接入脫脂乳培養基,在28 ℃下培養48 h,得到的發酵乳在沸水浴中加熱15 min后,冷卻離心(4000 r/min,20 min),將離心后上清液中加入80%(w/v)的三氯乙酸至終濃度4%(w/v),4 ℃下靜置過夜后離心(8000 r/min,20 min);再向上清液中添加無水乙醇至終濃度75%(v/v),4 ℃靜置22 h后離心(8000 r/min,20 min),取離心后沉淀物,加入Sevage試劑除蛋白(樣品體積的1/5),濃縮液透析48 h后冷凍干燥得到胞外多糖粗品。
1.2.3.2 胞外多糖含量測定 胞外多糖含量的測定:采用苯酚-硫酸法[19]。以葡萄糖為標準品得到標準曲線,回歸方程為:Y=0.0145X-0.0173,R2=0.9954。式中:Y為樣品的吸光度A;X為樣品中胞外多糖質量濃度(mg/L)。
1.2.4 兩株單胞釀酒酵母菌發酵性能測定 發酵劑的制備[20]:取兩環酵母菌的斜面菌種接種到裝有5 mL滅菌牛乳(105 ℃下滅菌20 min)試管中,28 ℃培養至大量氣泡產生時(高泡期),再以2%~3%的接種量移入100 mL滅菌牛乳中,28 ℃搖床振蕩培養至菌數達到(6~7)×107個/mL時即為酒母。再以5%接種量接入滅菌牛乳中進行發酵,28 ℃培養30 h,4 ℃冷藏24 h得成品,測定2株菌發酵乳成品的發酵酸度、乙醇含量、pH及感官品質,同時探究兩株單胞釀酒酵母菌發酵乳的流變特性,確定兩株單胞釀酒酵母菌發酵性能優劣[21]。
1.2.4.1 發酵酸度的測定 采用0.1 mol/L NaOH滴定法測定發酵乳的酸度[22]。
1.2.4.2 乙醇含量測定 采用重鉻酸鉀氧化比色法[23]。
1.2.4.3 pH測定 采用pHS-3C型精密酸度計。
1.2.4.4 感官評定 根據2株菌制備的發酵乳的色澤、組織狀態、滋味與氣味給發酵乳評級打分(總分100分),評定標準見表1[24],品嘗人員8名,取平均值,評價其菌株發酵性能差異。
1.2.5 發酵乳流變特性測定
1.2.5.1 兩株單胞釀酒酵母菌發酵乳表觀粘度隨剪切速率變化的測定 參考文獻[25-26]的方法并進行改進。椎板(40 mm,1°),4 ℃下線性剪切,剪切速率為0.1~100 s-1,測定時間為300 s,連續測定30個數據點,檢測樣品的表觀黏度隨剪切速率的變化情況。
1.2.5.2 兩株單胞釀酒酵母菌發酵乳樣的剪切應力隨剪切速率變化的測定 參考文獻[25-26]的方法并進行改進。椎板(40 mm,1°),4 ℃條件下線性剪切,檢測樣品剪切應力隨剪切速率變化的情況:首先轉子的剪切速率由 0 s-1升高到600 s-1,采集30個數據點,測試時間150 s;到達600 s-1后再降速到0 s-1,采集30個數據點,測試時間150 s。
1.2.5.3 兩株單胞釀酒酵母菌發酵乳頻率掃描測定 參考文獻[25-26]的方法并進行改進。椎板(40 mm,1°),在4 ℃ 條件下,應變為0.5%,頻率由0.1 Hz變化到10 Hz,對發酵乳樣品進行頻率掃描,采集30個數據點。
1.3數據處理
所有實驗均重復3次。數據用DPS 6. 5進行方差分析和多重比較,以p<0. 05為顯著性檢驗標準。
2 結果與分析
2.1兩株單胞釀酒酵母菌生長特性研究
微生物OD600值是反映菌體生長狀態的一個指標,通常用來指菌體細胞密度,是追蹤液體培養物中微生物生長的標準方法。兩株單胞釀酒酵母菌生長曲線見圖1。由圖1可見,這兩株單胞釀酒酵母菌活菌數的變化符合細菌生長典型規律。兩株單胞釀酒酵母菌的生長規律基本一致,初期兩株單胞釀酒酵母菌在0~9 h生長較為緩慢,無明顯生長延遲期;9~15 h菌數增加較快,兩株酵母均在9 h后達到對數生長期,酵母菌J5在15 h后進入生長平穩期,而酵母菌J7相對延后,18 h后進入生長平穩期。在整個生長過程中,在0~12 h,J7的活菌數高于J5,J7生長速度較快;隨著時間的延長且在18 h后,J5與J7生長趨勢接近,都進入穩定期,但J5活菌數略高于J7。
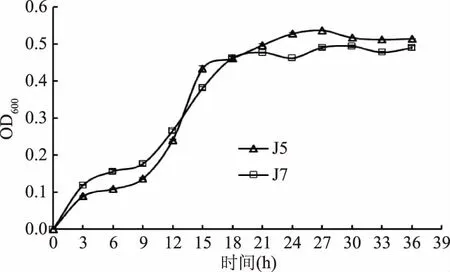
圖1 兩株單胞釀酒酵母菌生長曲線Fig.1 Growth curves of two Kazachstania unispora
2.2兩株單胞釀酒酵母菌發酵過程中pH變化情況
兩株酵母菌不同發酵時間的pH變化見圖2。由圖2可知,兩株酵母菌均隨發酵時間的延長,其pH一直呈下降趨勢。在0~9 h期間兩株酵母菌下降幅度基本一致,都較為緩慢,隨著發酵時間的延長,酵母菌J7的pH在9 h后下降速度較快,產酸速度明顯高于J5;J5菌株pH基本保持平穩下降趨勢,下降幅度較小。由此可見,J7菌株發酵產酸能力明顯高于J5,J7適宜用于酸乳發酵生產。
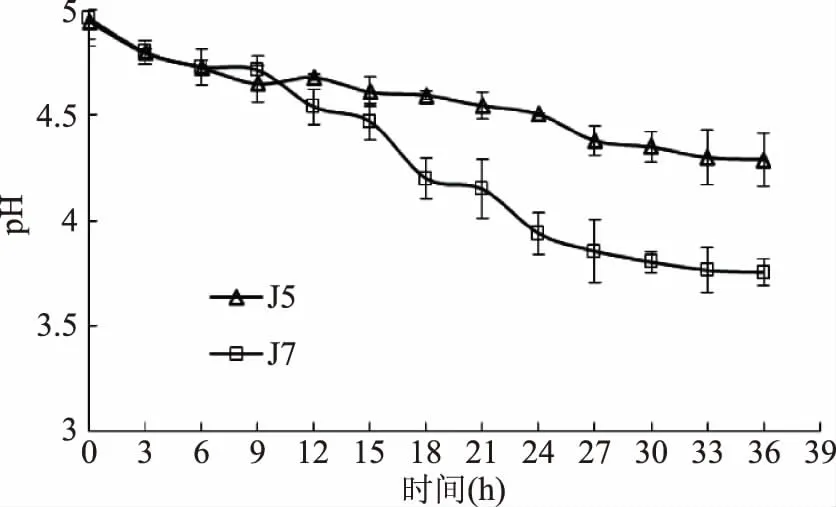
圖2 兩株單胞釀酒酵母菌發酵過程中pH變化曲線Fig.2 The pH change curves of two Kazachstania unispora in fermentation course
2.3兩株單胞釀酒酵母菌發酵產胞外多糖產量
兩株單胞釀酒酵母菌發酵產胞外多糖結果見圖3。由圖3可知,兩株單胞釀酒酵母菌產胞外多糖存在顯著差異(p<0. 05),其中酵母菌J5產胞外多糖產量較低為240.68 mg/L,酵母菌J7產胞外多糖較高,達到350.02 mg/L。與其他文獻[27-28]報道西藏靈菇中優勢菌產胞外多糖含量相比,本研究分離得到的兩株單胞釀酒酵母菌具有更高的產胞外多糖的能力,且菌株J7多糖產量顯著高于菌株J5。
2.4兩株單胞釀酒酵母菌發酵性能的比較
兩株單胞釀酒酵母菌發酵特性比較見表2。由表2可知,兩株單胞釀酒酵母菌中,菌株J7發酵酸度較高,菌株J5稍弱,但二者產乙醇量無顯著差異。而在組織狀態和滋氣味上,菌株J7制備得到的發酵乳其組織狀態較好、滋氣味較佳,菌株J5的發酵乳滋氣味及組織狀態均較差。綜合考慮,菌株J7相對于菌株J5發酵性能優良。

表2 兩株單胞釀酒酵母菌發酵性能比較結果Table 2 The comparison in fermentation performance of two Kazachstania unispora
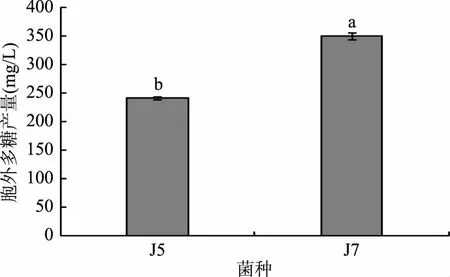
圖3 兩株單胞釀酒酵母菌產胞外多糖產量Fig.3 The exopolysaccharide production of two Kazachstania unispora注:不同字母表示差異顯著(p<0. 05)。
注:表中數據為3次重復的平均值,同列數據不同字母表示差異顯著(p<0.05)。2.5兩株單胞釀酒酵母菌發酵乳的流變學特性研究
2.5.1 兩株單胞釀酒酵母菌發酵乳表觀粘度隨剪切速率的變化 在食品的制備過程中,黏彈性的測量如表觀黏度的測量等提供了一種認識食品的流變學特性的方法,同時也有利于消費者對食品進行初步評價[29]。在0.01~100 s-1的剪切速率下,對兩株單胞釀酒酵母菌發酵乳進行表觀粘度測定,結果見圖4。兩種發酵乳的表觀黏度都呈現隨剪切速率的延長而降低的趨勢,表現出剪切稀釋的特征。0~20 s-1,隨著剪切時間的延長酵母菌J5表觀黏度下降較快,與J7相比下降幅度較大;在20 s-1之后,酵母菌J5、J7下降速度基本保持一致,但J5表觀黏度較J7下降較多,發酵乳的黏度大小依次為:J7發酵乳>J5發酵乳,說明菌株J7具有較高的表觀黏度,發酵性能較好。
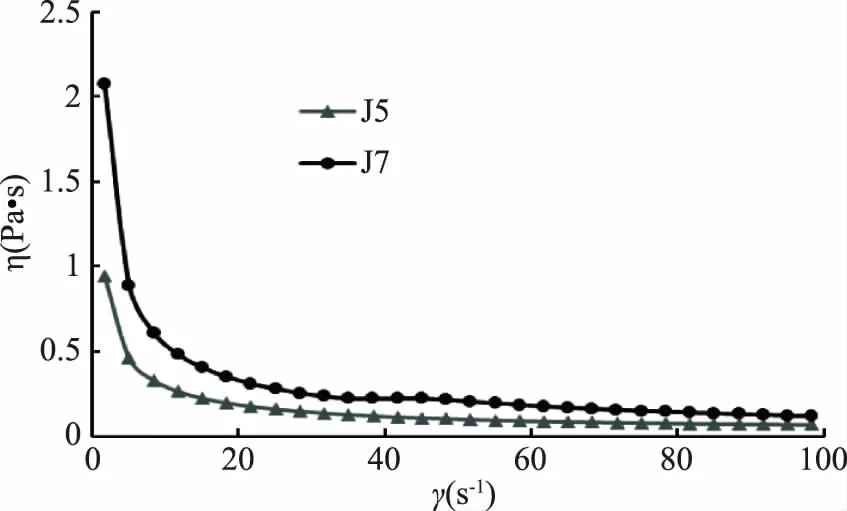
圖4 兩株單胞釀酒酵母菌發酵乳樣品表觀黏度隨剪切速率變化曲線Fig.4 Curves of apparent viscosity with shear rate for fermented dairy products from two Kazachstania unispora
2.5.2 兩株單胞釀酒酵母菌發酵乳樣的剪切應力隨剪切速率的變化 兩株單胞釀酒酵母菌發酵乳的剪切應力隨剪切速率的變化結果見圖5。由圖5可知,2 種發酵乳樣品的剪切應力隨剪切速率的變化曲線都出現類似環狀曲線,形成觸變環。在觸變性實驗中得到的觸變環其面積的大小可以代表樣品觸變性的情況,面積越大說明此樣品的結構恢復速度越慢,越小則恢復速度越快。J5發酵乳、J7發酵乳的觸變環面積分別為377.63 Pa/s、346.96 Pa/s。從觸變環面積可以看出J5發酵乳與J7發酵乳觸變環面積相近,J7發酵乳觸變環面積相對較小,說明菌株J7發酵出的乳結構恢復速度快,發酵性能好。

圖5 兩株單胞釀酒酵母菌發酵乳樣品剪切應力隨剪切速率變化曲線Fig.5 Curves of shear stress with shear rate for fermented dairy products from two Kazachstania unispora
2.5.3 兩株單胞釀酒酵母菌發酵乳頻率掃描 兩株單胞釀酒酵母菌發酵乳樣品的頻率掃描結果見圖6。由圖6可知,在0.1~10 Hz的線性粘彈性范圍內,隨著掃描頻率的增大,2個樣品的G′和G″都呈現增加趨勢,且每個樣品的G′值都高于G″的值,體現出了類凝膠的特性。通過測定比較2種單胞釀酒酵母菌制備的發酵乳的粘彈性,結果發現J7發酵乳G′及G″值均高于J5發酵乳的G′及G″值,表明,菌株J7制備的發酵乳具有較高的粘彈性,且J7具有更好的發酵性能。
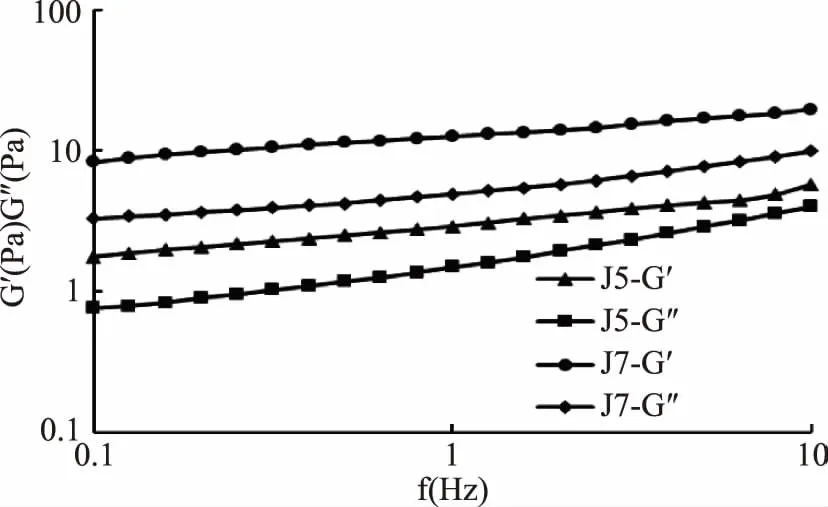
圖6 兩株單胞釀酒酵母菌發酵乳樣品彈性模量G′和黏性模量G″隨頻率變化曲線Fig.6 Curves of elastic modulus and viscous modulus with frequency for fermented dairy products from two Kazachstania unispora
3 結論
從西藏靈菇中分離的兩株單胞釀酒酵母均具有較高的產胞外多糖的能力,菌株J7胞外多糖產量高于菌株J5,菌株J7的發酵特性明顯優于菌株J5,且 J7發酵乳具有較好的組織狀態和滋氣味,綜合而言,菌株J7具有一定的應用潛力。
2株單胞釀酒酵母菌為正觸變流體,其觸變環面積菌株J7<菌株J5,即J7發酵乳結構恢復能力較強;菌株J7發酵乳較菌株J5具有較高的表觀黏度;菌株J5及J7發酵乳的G′值都高于G″值,均表現類固體的特性,且菌株J7發酵乳表現出較高的黏性和彈性。
[1]劉慧,譚鋒,董雨蒙,等.功能性開菲爾酸奶最佳發酵條件的研究[J].中國乳品工業,2003(1):26-27.
[2]GracielaL G,Analia G A,GracielaA L D. Chemical and microbiological characterization of kefir grains[J].Journal of Dairy Research,2001,68:639-652.
[3]楊希娟,師俊玲,樊明濤.西藏靈菇牛乳發酵液中的菌相與物質變化[J].中國食品學報,2007,7(4):42-46.
[4]蔚曉敏,程菲兒,張苗青,等.藏靈菇發酵乳中乳酸菌的分離鑒定及其應用研究[J].山西農業大學學報:自然科學版,2013(5):436-440.
[5]Zhou J Z,Liu X L,Jiang H H,et al. Analysis of the microflora in Tibetan kefir grains using denaturing gradient gel electrophoresis[J]. Food Microbiology,2009,26(8):770-775.
[6]Ruas M S,Hugenholtz J,Zoon P. An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J]. International Dairy Journal,2002,12(2/3):163-171.
[7]劉慧,熊利霞,易欣欣,等.藏靈菇中高產胞外多糖乳酸菌的篩選及其發酵性能的研究[J]. 食品科學,2007,28(5):211-215.
[8]馬宇驥,李健,劉魯蜀,等.藏靈菇研究現狀及分析[J]. 食品工業,2016(12):201-204.
[9]王輯,田政,趙笑,等.藏靈菇發酵產胞外多糖的影響因素及其應用研究[J]. 食品工業科技,2015(18):203-208.
[10]董健,陳歷俊,姜鐵民,等.西藏靈菇顆粒中菌種的分離鑒定[J].食品科技,2015,40(1):6-9.
[11]Ahmed Z,Wang Y P,AnjumN,et al. Characterization of exopolysaccharide produced by Lactobacillus kefiranofaciens ZW3 isolated from Tibet kefir-Part II[J]. Food Hydrocolloids,2013,30(1):343-350.
[12]Jiang S J,Qlan F,Ren X H,et al. Studies on the preliminary characterization of a novel exopolysaccharide produced by streptococcus thermophilus strain from Tibetan kefir grain[J].Advanced Materials Research,2013,690/693:1374-1377.
[13]Qin Q Q,Xia B S,Xiong Y,et al. Structural characterization of the exopolysaccharide produced by Streptococcus thermophilus 05-34 and its in situ application in yogurt[J]. Journal of Food
Science,2011,76(9):C1226-C1230.
[14]Wang Y P,Li C,Liu P,et al. Physical characterization of exopoloysaccharide produced by Lactobacillus plantarum KF5 isolated from Tibet kefir[J]. Carbohydrate Polymers,2010,82(3):895-903.
[15]徐夢夢,孟岳成.熱殺菌處理對攪拌型酸奶流變性質影響的研究[J].食品科技,2013,38(5):62-68.
[16]王剛,劉娟,陳光,等.產D-乳酸假腸膜明串珠菌生長特性分析[J].湖北農業科學,2015,55(5):1239-1241.
[17]Wang Y P,Ahmed Z,Wu F,et al. Physicochemical properties of exopolysaccharide produced by Lactobacillus kefiranofaciens ZW3 isolated from Tibet kefir[J]. International Journal of Biological Macromolecules,2008,43(3):283-288.
[18]呂曉鵬. 黑果枸杞多糖的分離純化與結構表征研究[D].西安:西北大學,2012.
[19]梁雪.產胞外多糖酵母菌株的篩選鑒定及多糖結構初步分析[D].哈爾濱:東北林業大學,2010.
[20]邵東燕.西藏靈菇乳的發酵機制及其純種復合發酵劑研究[D].楊凌:西北農林科技大學,2008.
[21]王玉華,鄭明珠,關曉玲,等.2株滋味與氣味乳酸菌的篩選及其生長特性的研究[J].中國乳品工業,2005,33(11):7-10.
[22]Guizel Z B,Seydim A C,Greene A K,et al. Determination of organic acids and volatile flavor substances in kefir during fermentation[J]. Journal of Food Composition and Analysis,2000(13):35-43.
[23]葛奉娟,王欲曉,周俊,等.重鉻酸鉀氧化比色法和氣相色譜法定量分析發酵液中乙醇的比較研究[J].徐州工程學院學報(自然科學版),2011,26(2):64-68.
[24]呂曉鵬.黑果枸杞多糖的分離純化與結構表征研究[D].西安:西北大學,2012.
[25]王松松,陳慶森. 3種發酵乳制品流變性質的比較與分析[J].食品科學,2011,32(19):7-11.
溫研,張英華,趙新淮. 脫脂乳的氧化交聯處理以及對凝固型酸奶流變學的影響[J].食品與發酵工業,2011,37(8):11-15.
[26]劉慧,李蘭平,熊利霞,等.功能性開菲爾酸奶復合發酵劑的研制[J].食品科學,2005,26(12):139-143.
[27]曹永強,王輯,趙笑,等. 植物乳桿菌 YW11 生產胞外多糖的發酵條件研究[J].食品科學技術學報,2016,34(1):42-49.
[28]楊同香,仲玉備,吳孔陽. 高產胞外多糖乳酸菌的篩選及其在發酵乳中的應用[J].食品科技,2016,41(2):26-29.
[29]Marshall V M. Fermented milks and their future. I Micrological aspects[J]. J Dairy Sci,1987,54:559-574.

