大黃魚魚卵磷脂酰膽堿納米脂質體對Hep G2細胞增殖活性影響的初步探究
孫 鶴 ,張 敏 ,魏 微 ,梁 鵬 ,2,陳麗嬌 ,2,程文健 ,2
大黃魚魚卵作為大黃魚加工過程中的主要副產物,其含有豐富的營養物質,尤其是二十二碳六烯酸(Docosahexaenoic acid,DHA)、二十碳五烯酸(Eicosapentaenoic acid,EPA) 和磷脂 (Phospholipids,PLs),具有較高的食用價值和營養價值[1]。PLs是構成生物細胞的重要物質,按其來源可分為動物磷脂、植物磷脂、微生物磷脂。植物磷脂以大豆磷脂最為常見,但由于不飽和脂肪酸的存在,導致其穩定性不高,易氧化變質。生產PLs的微生物主要包括細菌、酵母等,但需借助高度的發酵技術,并進行大量菌株的篩選,所以微生物來源的PLs要比動植物性PLs昂貴得多。相比而言,由于海洋磷脂結合了大量的DHA、EPA,海洋磷脂的抗氧化性使得DHA-PLs和EPA-PLs在進入人體后,可以較好地被人體細胞攝取。此外,相比于結合其他較低不飽和度的脂肪酸磷脂來說,DHA-PLs和EPA-PLs的氧化穩定性更高。PLs種類繁多、結構復雜,不同的PLs具有不同的生物學功能。研究表明,磷脂酰膽堿(Phosphatidylcholine,PC) 具有提高免疫功能、改善肝臟脂質代謝障礙、激活巨噬細胞活力、增強機體抵抗疾病的能力[2-3]。結合有DHA、EPA的PC,在擁有PC和EPA、DHA等各自功能特性的基礎上具有許多獨特的生物學活性。Martin Rossmeisl等人[4]研究發現富含ω-3多不飽和脂肪酸(Polyunsaturated fatty acids,ω-3 PUFA) 的PLs能夠對非酒精性脂肪肝起到一定的預防作用;胡世偉等人[5]研究發現海參EPA-PC能顯著降低糖尿病大鼠空腹血糖水平,改善口服葡萄糖耐量,促進空腹血清胰島素的分泌,增加肝糖原含量。崔潔等人[6]研究表明DHA-PLs對試驗性肥胖小鼠脂質代謝具有良好的調節減肥作用。課題組前期采用大黃魚魚卵磷脂研究了其對小鼠脂質代謝的調節作用,結果表明大黃魚魚卵磷脂具有顯著改善脂質吸收的作用[7]。因此,近年來源于水產品中的PC作為PLs的主要功能組分越來越受到研究者的關注[8]。
課題組前期研究發現大黃魚魚卵中PC的含量高達60%以上,以氯仿-甲醇法提取的大黃魚魚卵粗磷脂為原料,分離純化出純度達96.34%的魚卵磷脂酰膽堿(Roe-PC)[9]。試驗在前期研究的基礎上,為進一步提高大黃魚魚卵資源利用水平,在明確魚卵主要功能組分PC脂肪酸組成信息的基礎上,將Roe-PC制備成納米脂質體,以期更好地提高其生物利用度。主要采用薄膜分散法[10]制備了Roe-PC納米脂質體,通過噻唑蘭染色吸光值法(Methyl thiazolyl tetrazolium value,MTT) 初步探究了其對HepG2細胞的增殖效應,為后續研究Roe-PC對HepG2細胞增殖效應的分子機制奠定前期基礎。
1 材料與方法
1.1 試劑與儀器
大黃魚魚卵磷脂酰膽堿(Roe-PC),純度≥95%,自制;膽固醇,中國惠興生化試劑有限公司提供;氯仿,上海中試化工總公司提供;DMEM培養基、新生牛血清、二甲基椏楓(DMSO),美國Gibco公司提供;胰蛋白酶、MTT,美國Amiresco公司提供;人肝癌HepG2細胞,南京凱基生物科技有限公司提供;其他試劑均為國產分析純。
RE-52AA型旋轉蒸發器,上海亞榮生化儀器廠產品;FCD-270SE型海爾電冰柜,青島海爾特種電冰柜有限公司產品;SQP型電子天平,賽多利斯科學儀器(北京)有限公司產品;HH-4型數顯恒溫水浴鍋,常州國華電器有限公司產品;680型酶標儀,美國BIO-RAD公司產品;DL-CJ-1N型超凈工作臺,北京東聯哈爾儀器公司產品;Bj5060UV型CO2培養箱,德國Heraeus公司產品;CKX41型倒置顯微鏡系統,Olympus公司產品。
1.2 試驗方法
1.2.1 Roe-PC脂肪酸組成的分析
委托上海市糧油制品質量監督檢驗站,依據GB/T 17376—2008《動植物油脂脂肪酸甲酯制備》和GB/T 17377—2008《動植物油脂脂肪酸甲酯氣相色譜分析》進行分析。
1.2.2 Roe-PC納米脂質體的制備
將質量比為1∶1.5的膽固醇和Roe-PC用少量的氯仿溶于容積為500 mL的圓底燒瓶中旋轉蒸發,旋轉蒸發溫度不宜過高,一般在30℃左右,得到一層干燥的PLs膜,加入一定量的D-Hanks振蕩混勻,然后在超聲儀上處理,直到其成為均勻的乳白色懸濁液。通過200 nm的微孔濾膜過濾后,即得到Roe-PC納米脂質體。
1.2.3 Roe-PC納米脂質體形態和大小的測定
采用透射電子顯微鏡觀察Roe-PC納米脂質體的形態,將制得的Roe-PC脂質體滴一滴到碳涂層銅網格,2 min后,用濾紙吸取水分,背景染色,采用1%的硅鎢酸鹽染色30 s,用濾紙除去多余的硅鎢酸鹽,采用透射電子顯微鏡觀察干樣品,并使用相機拍照[11]。
1.2.4 肝癌細胞的培養
HepG2細胞用含10%胎牛血清的DMEM培養基培養。當細胞達到80%~90%密度時傳代,一般3 d傳1次,每次1傳2,細胞生長穩定、形態良好即可使用。取對數生長期細胞接種于96孔培養板進行試驗。所有試驗操作均在無菌條件下培養。
1.2.5 MTT法檢測Roe-PC納米脂質體對HepG2細胞增殖活性的影響
將處于對數生長期的HepG2細胞,經0.25%的胰酶消化,用DMEM完全培養基制成密度為2×105mL的細胞懸液,接種于96孔培養板內,100 L/孔。培養24 h后,對照組只加培養液,試驗組加入Roe-PC納米脂質體,使其質量濃度分別為25,50,100,150,200,300,400 g/mL,每組質量濃度設5個平行孔,置于37℃,5%的CO2細胞培養箱內分別培養24,48,72 h。每孔加20 L MTT液,繼續培養4 h。隨后,棄掉孔內培養上清液,加入二甲基椏楓(DMSO) 150 L/孔,振蕩器上振蕩溶解5~10 min,使其藍紫色結晶物完全溶解,用酶標儀測490 nm處OD值,以T(樣品組OD值) /C(對照組OD值)表示細胞增殖活性。
1.2.6 數據分析
采用SPSS17.0統計軟件對試驗數據進行統計學分析。數據以X±S表示,組間比較采用單因素方差分析,p<0.05為差異有統計學意義。
2 結果與討論
2.1 大黃魚魚卵PC脂肪酸組成分析
大黃魚魚卵PC的脂肪酸組成分析結果見表1。
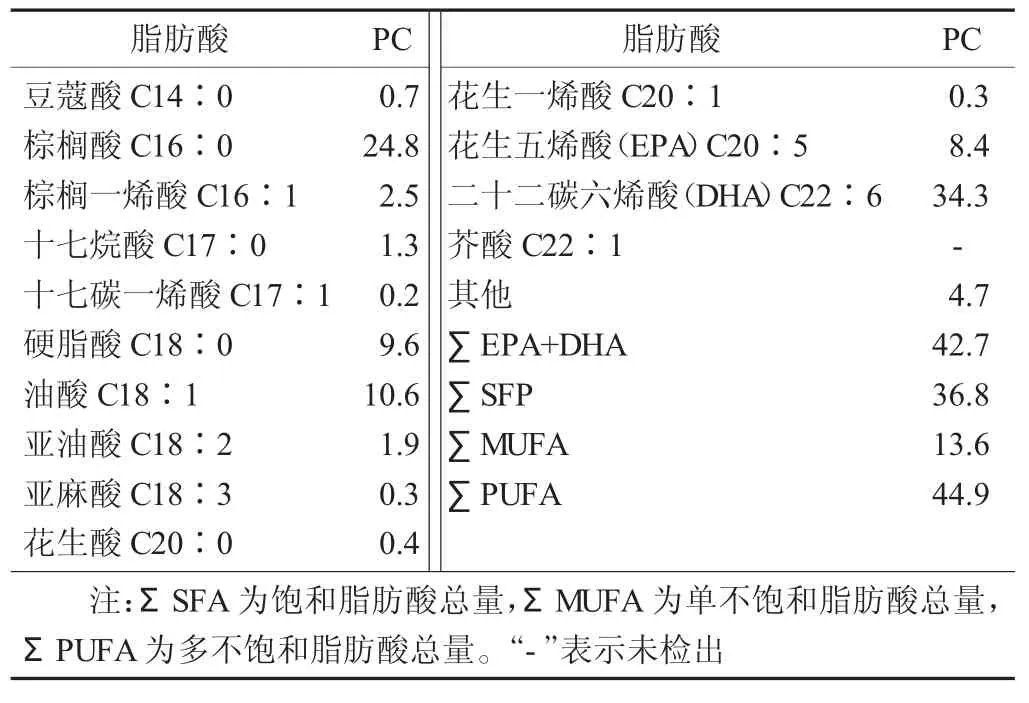
表1 大黃魚魚卵PC的脂肪酸組成分析結果/%,n=3
由表1可以看出,在大黃魚魚卵PC中檢測出13種脂肪酸,碳原子數為14~22,其中飽和脂肪酸(SFA) 5種,單不飽和脂肪酸(MUFA) 4種,多不飽和脂肪酸(PUFA) 4種。SFA主要包括豆蔻酸(C14∶0)、棕櫚酸 (C16∶0)、十七烷酸 (C17∶0)、硬脂酸(C18∶0)、花生酸(C20∶0),以棕櫚酸(C16∶0)含量為最高,占總脂肪含量的24.8%。對于MUFA而言,在檢測到的MUFA中以油酸(C18∶1)含量最為豐富。脂肪酸是魚類生長發育階段重要的代謝能源,同時也是魚類機體重要的內源性營養物質。有研究表明C16∶0,C18∶1脂肪酸是魚類代謝的主要能量來源,試驗結果與該結論一致,即C16∶0,C18∶1在大黃魚魚卵PC中含量較高。PUFA方面,PC中PUFA的含量高達44.9%,EPA、DHA占據了主要比例,其中DHA含量達到34.3%,遠遠高于其他脂肪酸的含量。鄒舟等人[12]研究了鰱魚各部位磷脂的脂肪酸組成,結果表明各部位間EPA+DHA的總量,內臟中明顯高于其他部位,其總和為27.12%。孫艷賓[13]研究了太平洋磷蝦油脂的提取工藝及其脂肪酸組成,其中EPA+DHA在油脂脂肪酸中含量為31.9%。宮勛等人[14]研究了池沼公魚肌肉的脂肪酸組成,其中EPA和DHA的含量分別為8.43%和11.85%,其總和為20.28%。由此可以看出大黃魚魚卵是富含EPA-PC和DHA-PC的海洋資源,具有很好的開發應用前景。
2.2 Roe-PC納米脂質體的形態和大小
Roe-PC脂質體的透射電鏡形態見圖1。
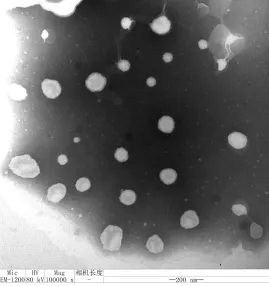
圖1 Roe-PC脂質體的透射電鏡形態
利用透射電子顯微鏡觀察Roe-PC納米脂質體的形態。試驗經薄膜分散法制備得到的脂質體為乳白色混懸液,在透射電鏡下觀察,放大1×105倍的Roe-PC納米脂質體的電鏡顯示,脂質體分布均勻、顆粒間彼此分散獨立、連續成圓形或橢圓形微球體,平均粒徑為100 nm。
2.3 Roe-PC脂質體對HepG2細胞增殖活性的影響
MTT比色法的檢測原理為活細胞線粒體中的琥珀酸脫氫酶能使外源性的MTT還原為水不溶性的藍紫色結晶甲瓚,并沉積在細胞中,而死細胞則無此功能。DMSO能溶解細胞中的結晶,通過酶標儀測定其吸光值,可間接反映活細胞數量[15]。試驗將前期純化所得的Roe-PC制作成納米脂質體,并配制成不同濃度,檢測其在24,48,72 h下對HepG2細胞增殖活性的影響。表2是Roe-PC脂質體處理HepG2細胞后進行MTT測定得到的吸光值,每個質量濃度梯度5個重復。
Roe-PC脂質體質量濃度對HepG2細胞處理不同時間吸光值的影響(X±S) 見表2,Roe-PC脂質體對HepG2細胞增殖活性的影響見圖2。
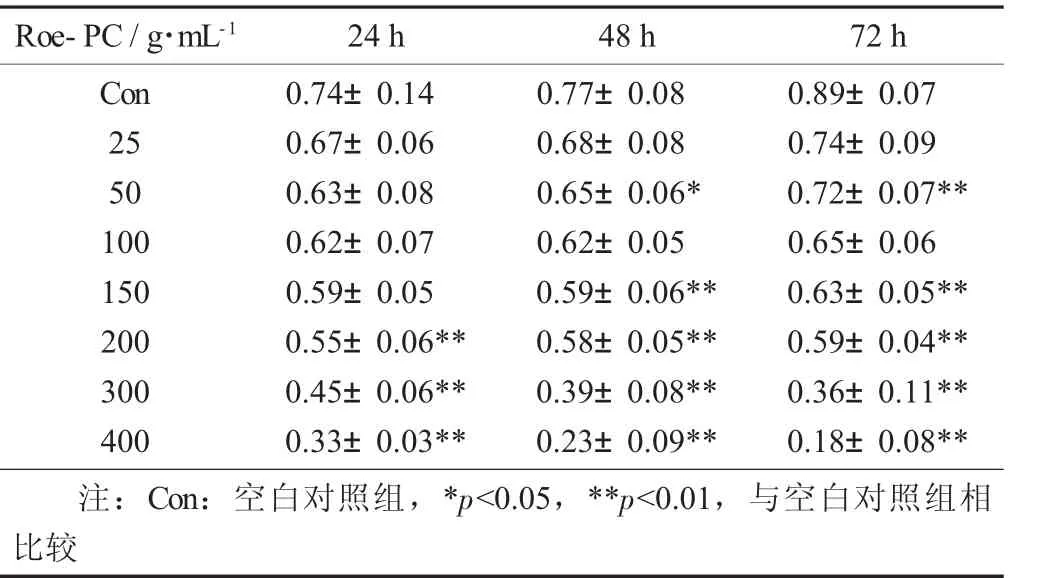
表2 Roe-PC脂質體質量濃度對HepG2細胞處理不同時間吸光值的影響(X±S)
以未添加Roe-PC脂質體處理組為對照組,處理組與對照組比值的百分數即為細胞增殖率,結果進行統計學分析。試驗結果表明,不同質量濃度的Roe-PC脂質體處理HepG2細胞24 h后,其增殖活性沒有顯著變化,當Roe-PC脂質體質量濃度達到200μg/mL時其增殖活性才被顯著抑制(0.55±0.06 VS 0.74±0.04,p<0.01),抑制率 (IR) 為 26%;而延長作用時間至48,72 h后,細胞增殖受到了抑制,受試物質量濃度越高,抑制作用越強,且隨著作用時間的延長,其抑制作用有增強的趨勢,Roe-PC質量濃度為400μg/mL,作用時間為72 h時抑制作用最強 (0.18±0.08 VS 0.89±0.07,p<0.01),其 IR 達到80%。說明Roe-PC脂質體對HepG2細胞的增殖抑制作用具有時效和量效的關系。同時說明Roe-PC脂質體有抑制癌細胞增殖的作用,但需要一定的作用時間后才能發揮效果。
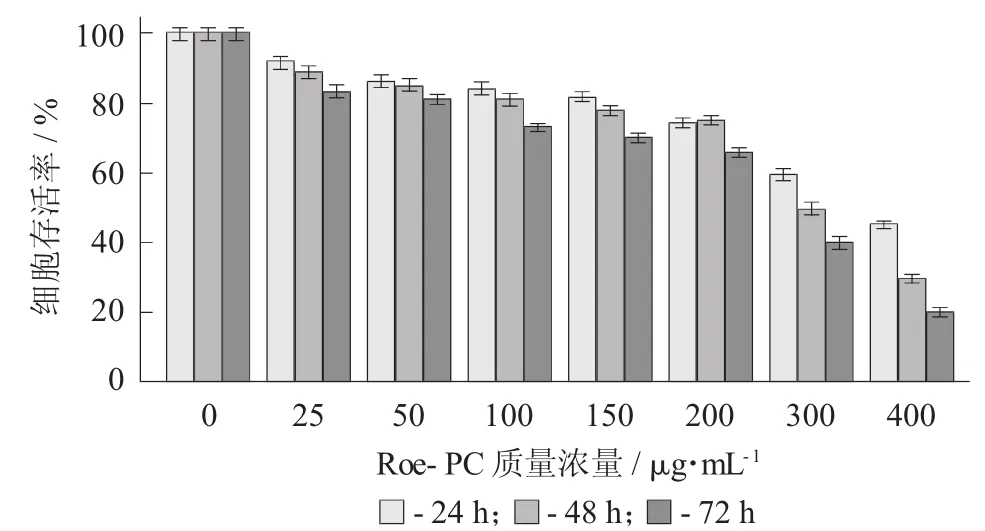
圖2 Roe-PC脂質體對Hep G2細胞增殖活性的影響
2.4 Roe-PC脂質體對HepG2細胞形態學的影響
Roe-PC脂質體處理HepG2細胞72 h后的形態學變化見圖3。
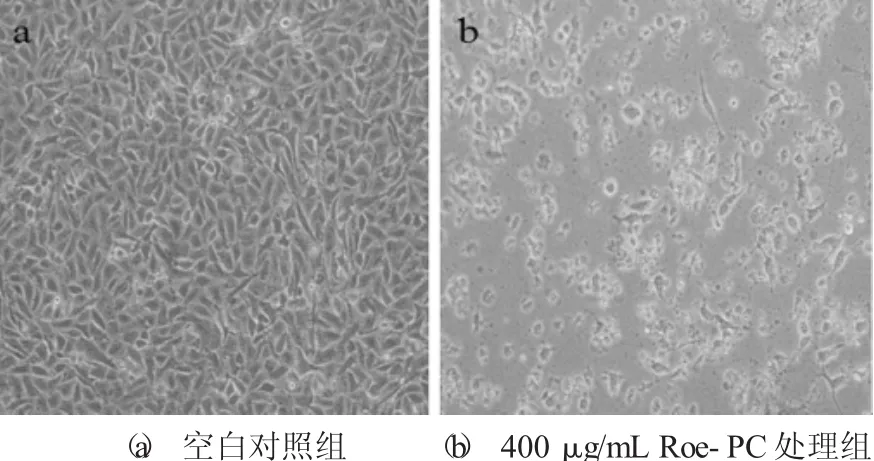
圖3 Roe-PC脂質體處理HepG2細胞72 h后的形態學變化
為了更直觀地觀察Roe-PC脂質體對HepG2細胞的抑制作用,在顯微鏡下觀察未處理和400μg/mL Roe-PC脂質體處理后的HepG2細胞,二者都培養72 h,倒置顯微鏡觀察并拍照。由圖3可知,正常對照組細胞呈匯合生長且貼壁性好,細胞輪廓清晰、密度大,相互排列緊密,連接成大片,細胞生長旺盛;Roe-PC脂質體處理后的細胞數量顯著下降,并且收縮呈圓形,部分細胞脫落至培養液中,表明其生長與活力被顯著抑制。
3 討論
試驗以大黃魚魚卵中獲得的PC為研究材料,首先分析了其脂肪酸組成信息,結果發現PUFA的含量高達44.9%,而且EPA,DHA占據了主要組成比例,其中DHA含量更是高達34.3%,遠遠高于其他脂肪酸的含量。進一步采用薄膜分散法獲得了100 nm級的脂質體,并對其形態進行了表征。在此基礎上,初步開展了Roe-PC脂質體對細胞增殖活性方面的研究,試驗結果說明Roe-PC脂質體對HepG2細胞的增殖具有一定的抑制作用。
根據文獻報道,DHA對于腫瘤細胞的生長抑制作用在許多細胞試驗和動物模型中得到了證實[16-19]。DHA能抑制直腸癌、前列腺癌、乳腺癌等多種腫瘤細胞的增殖,并誘導其凋亡。孫思楠[20]研究了不同濃度的DHA對人肝癌細胞株Bel-7402細胞增殖及細胞凋亡的影響。結果表明,DHA可抑制人肝癌細胞Bel-7402的增殖并誘導細胞早期凋亡,且呈時間-劑量依賴性。李群珍等人[21]以人肝癌HepG2細胞為研究對象,檢測了DHA聯合5氟尿嘧啶(5-FU)的體外抗腫瘤作用。結果表明,DHA聯合5-FU可抑制肝癌細胞的增殖并誘導其凋亡,二者具有協同作用。Chapkin R S等人[22]研究發現,DHA可通過改變生物膜的結構和功能來抑制肝癌HepG2細胞的增殖。多不飽和脂肪酸是構成生物膜結構的脂肪酸,腫瘤細胞膜DHA比例升高導致線粒體膜電位下降,細胞呼吸鏈受損,膜通透性增加,使細胞凋亡誘導因子得以釋放,半胱氨酸蛋白酶的級聯反應得以進行,導致細胞凋亡。同樣,EPA對于腫瘤細胞的生長也具有一定的抑制作用。王占有[23]研究了不同濃度的EPA對人肝癌細胞株HepG2細胞增殖活性的影響。結果表明,一定濃度的EPA對HepG2細胞的生長具有明顯的抑制作用,且隨作用時間的延長抑制率增加。其作用機制可能與其影響肝癌細胞脂質過氧化有關。盛虹[24]研究發現,EPA能夠抑制胃癌細胞的增殖并具有濃度依賴性,但無時間依賴性。
試驗所獲得的PC主要與DHA協調發揮效果,但其具體機制尚不明確,有待今后更進一步的研究。此外,Roe-PC脂質體在體外的穩定性如何還需要進行深入的研究和分析。為今后開發Roe-PC脂質體保健功能食品提供更為全面的科學依據。
4 結論
大黃魚魚卵PC富含DHA和EPA,以魚卵中純化所得的PC為材料,采用薄膜分散法制備了Roe-PC納米脂質體,以人肝癌HepG2細胞為研究對象,進行體外抗腫瘤試驗,通過MTT法測定了Roe-PC納米脂質體對HepG2細胞增殖活性的影響。結果表明,Roe-PC納米脂質體對HepG2細胞的生長抑制作用具有時效和量效的關系。研究結果對魚卵磷脂資源利用和進一步深入研究其中的分子機制奠定了前期基礎。
[1]Bekhit AE-DA,Morton J D,Dawson C O,et al.Optical properties of raw and processed fish roes from six commer-cial New Zealand species[J].Journal of Food Engineering,2009(2):363-371.
[2]袁利鵬,劉波,熊波,等.大豆磷脂的制備、功能特性及行業應用研究進展 [J].中國釀造,2013,32(5):13-15.
[3]Hosokawa M,Takahashi K,Hou CT.Handbook of industrial biocatalysis[M].Boca Raton:CRC Press,2005:13-15.
[4]Rossmeisl M,Medrikova D,Van Schothorst E M,et al.Omega-3 phospholipids form fish suppress hepatic steatosis by integrated inhibition of biosynthetic pathways in dietary obese mice[J].Biochimica et Biophysica Acta(BBA) -Molecular and Cell Biology of Lipids,2014 (2):267-278.
[5]胡世偉,王靜鳳,徐雷雷,等.海參磷脂型二十碳五烯酸降血糖機制研究 [J].深圳大學學報(理工版),2013,30(4):349-355.
[6]崔潔,劉小芳,董喆,等.DHA-磷脂對肥胖小鼠脂質代謝的影響 [J].中國油脂,2014(1):27-31.
[7]梁鵬,許艷萍,程文健,等.大黃魚魚卵磷脂對小鼠脂質代謝的調節作用 [J].現代食品科技,2016(11):1-7.
[8]杜陽吉.大豆粗磷脂中磷脂酰膽堿的分離純化研究 [J].中國食品添加劑,2014(4):86-91.
[9]程新偉,梁鵬,孫鶴,等.大黃魚魚卵磷脂酰膽堿的分離純化 [J].福建農林大學學報(自然版),2017,46(2):228-233.
[10]鄧瑩.多柔比星脂質體的制備研究及表征 [D].南京:東南大學,2010.
[11]Gharib R,Greigegerges H,Jraij A,et al.Preparation of drug-in-cyclodextrin-in-liposomes at a large scale using a membrane contactor:application to trans-anethole[J].Carbohydrate Polymers,2016 (4):276-285.
[12]鄒舟,王琦,于剛,等.鰱魚各部位磷脂組分及脂肪酸組成分析 [J].食品科學,2014,35(24):105-109.
[13]孫艷賓,劉云,陳洪基,等.太平洋磷蝦油脂提取工藝及其脂肪酸成分分析 [J].中國釀造,2014,33(12):68-71.
[14]宮勛,李紅今,張莉,等.池沼公魚肌肉中脂肪酸成分的GC-MS分析 [J].吉林化工學院學報,2013,30(11):93-95.
[15]李慧.杜仲木脂素對HepG2細胞甘油三酯聚集的影響[D].長沙:中南大學,2013.
[16]Jude S, Roger S, Martel E, et al.Dietary long-chain omega-3 fatty acids of marine origin:a comparison of their protective effects on coronary heart disease and breast cancers[J].Prog Biophys Mol Biol,2006 (1/3):299-325.
[17]Kelavkar U P,Hutzley J,Dhir R,et al.Prostate tumor growth and recurrence can be modulated by theω-6:ω-3 ratio in diet:athymic mouse xenograft model simulating radical prostatectomy[J].Neoplasia,2006,8 (2):112-124.
[18]Shirota T, Haji S, Yamasaki M, et al.Apoptosis in human pancreatic cancer cells induced by eicosapentaenoic acid[J].Nutrition,2005,21(10):1 010-1 017.
[19]Chen Z Y,Istfan N W.Docosahexaenoic acid is a potent inducer of apoptosis in HT-29 colon cancer cells[J].Prostaglandins Leukot Essent Fatty Acids,2000,63 (5):301-308.
[20]孫思楠.DHA對人肝癌細胞凋亡和侵襲力的影響及其機制研究 [D].合肥:安徽醫科大學,2013.
[21]李群珍,鄧紅,張茂祥,等.二十二碳六烯酸聯合5氟尿嘧啶對人肝癌細胞HepG2增殖的抑制作用 [J].現代消化及介入診療,2013(4):243-245.
[22]Chapkin R S,Hong M Y,Fan Y Y,et al.Dietaryω-3 PUFA alter colonocyte mitochondrial membrane composition and function[J].Lipids,2002,37 (2):193-199.
[23]王占有.ω-3多不飽和脂肪酸誘導人肝癌細胞HepG2凋亡及其分子機制的研究 [D].洛陽:河南科技大學,2010.
[24]盛虹.ω-3多不飽和脂肪酸對胃癌細胞生長的影響及其機制研究 [D].上海:上海交通大學,2012.◇

