胰十二指腸切除術后早期液體平衡與胰瘺相關
劉 薇 張 進 趙 松 李文雄 鄭 悅
(首都醫科大學附屬北京朝陽醫院外科ICU,北京 100027)
胰十二指腸切除術(pancreaticoduodenectomy,PD)是治療壺腹周圍惡性腫瘤和某些良性疾病的主要手術方式。由于手術創傷大、時間長,PD術后合并癥較為多見,其中術后胰瘺(postoperative pancreatic fistula,POPF)是PD最常見的合并癥之一,可致腹腔內感染和致命性大出血,從而延長住院時間,增加病死率。性別(男性)、體質量指數(body mass index,BMI)(>25 kg·m-2)、胰管直徑(≤3 mm)、柔軟的胰腺質地、術中大量輸液等術前術中因素被認為與PD術后POPF的發生率相關[1-4],但術后液體管理對POPF的影響尚不明確。本研究旨在探討對PD術后住重癥加強治療病房(intensive care unit, ICU)的患者進行早期液體管理對POPF的影響。
1 資料與方法
1.1 一般資料
經首都醫科大學附屬北京朝陽醫院倫理委員會批準(批準文號:2016—科73),回顧性收集2014年1月至2016年12月期間首都醫科大學附屬北京朝陽醫院外科ICU(surgical ICU,SICU)連續收治的PD術后患者的臨床資料。納入標準:①行PD手術者;②術后入住SICU;③年齡≥18歲。排除標準:①消化道重建方式采用非Child法和/或胰腸吻合方式采取非胰管空腸黏膜吻合的患者;②術前診斷休克的患者;③急診手術患者;④慢性腎功能不全和/或腎病患者。最終入選病例237例,其中男性129例,女性108例,年齡:31~83歲。POPF的診斷與分級采用國際胰腺外科學組(International Study Group on Pancreatic Surgery,ISGPS) 2016年更新的定義和分級系統[5],引流液淀粉酶濃度大于血清淀粉酶正常值上限的3倍且發生了與術后胰瘺直接相關的臨床狀態及預后改變可診斷為POPF,POPF分級詳見表1。
1.2 研究方法
回顧性收集和記錄患者術前、術中和術后的臨床資料。1)術前資料:包括性別、年齡、合并癥(糖尿病、高血壓等)、入院時的BMI等基礎疾病狀況,原發病性質為良性或惡性疾病、病變部位為胰腺或非胰腺疾病(依據術后病理診斷)、入院時和術前血清白蛋白(albumin, Alb)和總膽紅素濃度、術前是否存在膽管炎、是否行膽道引流[包括經皮肝穿膽道引流(percutaneous transhepatic cholangial drainage,PTCD)和內鏡下乳頭括約肌切開術(endoscopic sphincterotomy, EST)],ASA分級(American Society of Anesthesiologists Physical Status Classification,ASA class)等術前疾病狀況;2)術中資料:包括手術時間、術中液體平衡、術中是否使用血管活性藥物、出血量以及是否行血管切除重建等術中情況;3)術后資料:包括術后24 h液體平衡量(FB 24 h)和48 h累積液體平衡量(FB 48 h),術后當天(Day 0 Alb)、第1天(Day 1 Alb)和第2天(Day 2 Alb)的白蛋白濃度,術后當天紅細胞壓積(hematocrit, Day 0 Hct),術后12 h內動脈血乳酸最高值[lactic acid, Lac12 h(max)]等。隨訪患者是否發生POPF以及發生的時間,研究終點為PD術后28d內患者的POPF發生率,并據此將患者分為胰瘺組(POPF)和非胰瘺組(Non-POPF)。分析影響POPF發生的危險因素以及術后液體平衡對POPF發生率的影響。

表1 國際胰腺外科學組(ISGPS)2016年更新POPF分級臨床評定表[5]Tab.1 The Revised 2016 ISGPS Classification and Grading of POPF[5]
*: A clinically relevant POPF is defined as a drain output of any measurable volume of fluid with amylase level greater than 3 times the upper Institutional normal serum amylase level, associated with a clinically relevant development/condition related directly to the POPF;#: Suggests prolongation of hospital or ICU stay, includes use of therapeutic agents specifically employed for fistula management or its consequences(of these: somatostatin analogues, TPN/TEN, blood product transfusion or other medications).△: Postoperative organ failure is defined as the need for re-intubation, hemodialysis, and/or inotropic agent>24 hours for respiratory, renal, or cardiac insufficiency, respectively.ISGPS: International Study Group on Pancreatic Surgery;POPF: postoperative pancreatic fistula;BL: biochemical leak;ICU:intensive care unit;TPN:total parenteral nutrition;TEN:total enteral nutrition.
1.3 統計學方法
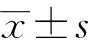
2 結果
2.1 患者術前基線資料
237例患者中,術后28d內發生POPF者共30例(12.7%),其中B級POPF 24例(10.1%),C級POPF 6例(2.5%),死亡3例(1.3%),死亡均發生在C級POPF患者,C級POPF患者病死率為50%。患者術前基線資料見表2。性別、是否患有糖尿病、原發病是否為胰腺疾病、入院和術前白蛋白濃度、術前是否行膽道引流在POPF組和Non-POPF組之間差異有統計學意義(P<0.05)。
2.2 患者術中和術后資料
患者術中及術后臨床資料見表3。FB 48 h在兩組之間差異有統計學意義(P<0.05)。

表2 患者術前基線資料Tab.2 Baseline characteristics of patients
a: Value expressed as median(IQR),Pby Mann-WhitneyUtest;b: Value expressed as number(percentage),Pby Chi-square test;c: Value expressed as number(percentage),Pby Chi-square test with continuity correction;d: Value expressed as number(percentage),Pby Mann-WhitneyUtest.*P<0.05; #: Cholangitis was diagnosed based on the following criteria:①presence of fever with upper quadrant pain;② radiological(sonographic or computed tomographic) or endoscopic evidence of biliary tract obstruction due to stones or stricture from benign or malignant origin; and③ laboratory findings of hyperbilirubinemia and an elevated serum alkaline phosphatase level;POPF: postoperative pancreatic fistula;BMI:body mass index;Alb: albumin;TBIL: total bilirubin;ASA:American Society of Anesthesiologists;IQR: interquartile range.

表3 患者術中及術后資料Tab.3 Intraoperative and postoperative data
a: Value expressed as median(IQR),Pby Mann-Whitney U test;b: Value expressed as number(percentage),Pby Chi-square test with continuity correction;c: Value expressed as number(percentage),Pby Chi-square test;*P<0.05;POPF: postoperative pancreatic fistula;FB: fluid balance;Alb: albumin;Day0Alb: albumin at immediately postoperation;Day1Alb: albumin at postoperative day 1;Day2Alb: albumin at postoperative day 2;Hct: hematocrit;Day0Hct: hematocrit at immediately postoperation;Lac: Lactate;Lac12h(max): Maximal value of postoperative Lactate within 12h;FB24h: cumulative fluid balance postoprative 24h;FB48h: cumulative fluid balance postoprative 48 h;IQR: interquartile range.
2.3 POPF相關因素的Logistic回歸分析
多因素Logistic回歸分析模型顯示,患者性別(男性)、高BMI、患有糖尿病、入院時低白蛋白濃度、術前高膽紅素濃度以及FB 48 h是POPF的獨立危險因素,詳見表4。
2.4 FB 48 h對POPF及C級POPF發生率的影響
根據FB 48 h將患者分為4組:液體負平衡組(FB 48 h≤0 mL·kg-1·h-1)、少量液體正平衡組(0 mL·kg-1·h-1

表4 PD術后POPF相關因素的Logistic回歸分析Tab.4 Logistic regression analysis: risk factors associated with POPF following PD
*P<0.05;PD: pancreaticoduodenectomy;POPF: postoperative pancreatic fistula;BMI:body mass index;Alb: albumin;TBIL: total bilirubin;FB: fluid balance;Day2Alb: albumin at postoperative day 2;FB48h: cumulative fluid balance postoperative 48 h.

表5 FB 48 h對POPF及C級POPF發生率的影響Tab.5 Impact of FB 48 h on the incidence of POPF and Grade C POPF
*P<0.05;a: value expressed as number(percentage),Pby likelihood ratio Chi-square test;FB: fluid balance;FB48h: cumulative fluid balance postoperative 48h;POPF: postoperative pancreatic fistula.
3 討論
2005年的POPF定義和分級系統[6]中的A級POPF,因其與無胰瘺患者不存在明顯的臨床治療及預后差異[7-8],在2016年國際胰腺外科組(ISGPS)更新的POPF定義和分級系統中被更名為生化漏(biochemical leak,BL)[5],不再被診斷為POPF。2016年的一項國際多中心研究[9]中,納入與不納入2005年定義和分級系統中A級胰瘺的POPF發生率分別為19.2%和11.1%,在本研究中,POPF發生率為12.7%,與之相當。
多個研究[10-11]顯示,圍術期液體管理可以影響術后患者的結局。圍術期低血容量狀態可產生嚴重的后果,導致單一或多個器官功能障礙,甚至是死亡[12]。值得注意的是,液體過負荷同樣有害,可導致術后合并癥的發生率顯著增加[10]。對于PD,沒有文獻定義術中、術后給予多少液體是恰當的。本研究結果顯示,PD術前和術中影響POPF發生率的獨立危險因素包括性別(男性)、高BMI、罹患糖尿病、入院時低白蛋白濃度、術前高膽紅素濃度;而術后影響POPF發生率的獨立危險因素只有FB 48 h。進一步研究顯示,FB 48 h達負平衡能顯著降低POPF發生率;與中等量和少量液體正平衡相比,大量液體正平衡(FB 48 h>1 mL·kg-1·h-1)雖不顯著增加POPF發生率,但顯著增加了C級POPF的發生率。
既往的研究[13]顯示,C級POPF相關病死率高達25%(0%~100%)。在PD術后早期,應盡量避免大量液體正平衡(FB 48 h>1 mL·kg-1·h-1)以降低C級POPF的發生率。造成術后早期液體大量正平衡的原因可能有如下兩種情況:①術中容量相對不足:麻醉藥物有可能通過減慢心率等作用掩蓋某些提示容量不足的征象,麻醉醫師亦有可能將血壓下降等容量不足的征象誤判為麻醉藥物的不良反應,從而造成術中隱匿性容量不足,這種情況下,術中和術后早期胰腸吻合口可能已經遭受到因灌注不足而導致的愈合障礙,而對于循環系統則需要更多的液體正平衡來彌補術中的容量不足,這也可以解釋胰瘺組術中液體平衡顯著低于非胰瘺組而術后早期液體平衡顯著高于非胰瘺組的臨床現象。有文獻[14]推薦腹腔內手術術中應給予10 mL·kg-1·h-1~15 mL·kg-1·h-1的液體輸注,但這一推薦缺乏可靠的研究證據。②術后容量過負荷:術后患者在ICU中的液體管理通常以維持血流動力學穩定、保障組織器官灌注為目標,有可能導致不必要的容量過負荷。無論何種原因導致的液體正平衡過多,都有可能對胰腸吻合口愈合造成影響。有研究[15]顯示,過多的液體輸注降低組織氧合并導致水腫,這種效應與吻合口愈合不良密切相關。
PD手術時間長、創傷大,全身炎性反應通常較其他腹腔臟器手術更為嚴重,可導致全身毛細血管通透性增高(毛細血管漏),血管內液體強制性轉移至第三間隙,因此在術后早期往往不得不給患者補液,恰當的液體正平衡有利于維持有效循環血容量及恰當的組織灌注,同時保障胰腸吻合口的血流供應[16-17]。盡管筆者的研究結果提示FB 48 h達負平衡能顯著降低POPF發生率,但對于術后全身炎性反應較重的患者,FB 48 h難以達到負平衡;ICU醫師應在保障有效血容量和良好器官組織灌注的前提下,盡量減少PD術后早期的液體正平衡量以降低C級POPF發生率。
本研究存在一些局限性:由于該研究是回顧性的,無法獲得有關胰腺組織結構、胰腸吻合細節的客觀資料,而這些因素可能是POPF的重要原因之一。但研究中提供的數據均來自于首都醫科大學附屬北京朝陽醫院肝膽外科、麻醉科和外科ICU的臨床信息管理系統,數據的真實性使研究結果具有一定的可信度。
總之,PD術后早期液體正平衡量是POPF的獨立危險因素,FB 48 h超過1 mL·kg-1·h-1時,C級POPF發生率顯著增高。臨床尚需要一些大型前瞻性研究以評價PD術后早期液體管理對POPF的影響。
[1] Hu B Y, Wan T, Zhang W Z, et al. Risk factors for postoperative pancreatic fistula: analysis of 539 successive cases of pancreaticoduodenectomy[J]. World J Gastroenterol, 2016, 22(34):7797-7805.
[2] Yu L, Huang Q, Xie F, et al. Risk factors of postoperative complications of pancreatoduodenectomy[J]. Hepatogastroenterology, 2014, 61(135):2091-2095.
[3] Bruns H, Kortendieck V, Raab H R, et al. Intraoperative fluid excess is a risk factor for pancreatic fistula after partial pancreaticoduodenectomy[J]. HPB Surg, 2016:2016, 1601340.
[4] Wang S, Wang X, Dai H, et al. The effect of Intraoperative fluid volume administration on pancreatic fistulas after pancreaticoduodenectomy[J]. J Invest Surg, 2014, 27(2):88-94.
[5] Bassi C, Marchegiani G, Dervenis C, et al. The 2016 update of the international study group(ISGPS) definition and grading of postoperative pancreatic fistula: 11 Years After[J]. Surgery, 2017, 161(3):584-591.
[6] Bassi C, Dervenis C, Butturini G, et al. Postoperative pancreatic fistula: an international study group(ISGPF) definition[J]. Surgery, 2005, 138(1):8-13.
[7] Pratt W B, Maithel S K, Vanounou T, et al. Clinical and economic validation of the international study group of pancreatic fistula(ISGPF) classification scheme[J]. Ann Surg, 2007, 245(3):443-451.
[8] Kim W S, Choi D W, Choi S H, et al. Clinical validation of the ISGPF classification and the risk factors of pancreatic fistula formation following duct-to-mucosa pancreaticojejunostomy by one surgeon at a single center[J]. J Gastrointest Surg, 2011, 15(12):2187-2192.
[9] McMillan M T, Soi S, Asbun H J, et al. Risk-adjusted outcomes of clinically relevant pancreatic fistula following pancreatoduodenectomy: a model for performance evaluation[J]. Ann Surg, 2016, 264(2):344-352.
[10] Bundgaard-Nielsen M, Secher N H, Kehlet H. ‘Liberal’vs‘restrictive’ perioperative fluid therapy—a critical assessment of the evidence[J]. Acta Anaesthesiol Scand, 2009, 53(7):843-851.
[11] Chappell D, Jacob M, Hofmann-Kiefer K, et al. A rational approach to perioperative fluid management[J]. Anesthesiology, 2008, 109(4):723-740.
[12] de Aguilar-Nascimento J E, Diniz B N, do Carmo A V, et al. Clinical benefits after the implementation of a protocol of restricted perioperative intravenous crystalloid fluids in major abdominal operations[J]. World J Surg, 2009, 33(5):925-930.
[13] Pedrazzoli S. Pancreatoduodenectomy(PD) and postoperative pancreatic fistula(POPF): A systematic review and analysis of the POPF-related mortalityrate in 60,739 patients retrieved from the English literature published between 1990 and 2015[J]. Medicine(Baltimore), 2017, 96(19):e6858.
[14] Nisanevich V, Felsenstein I, Almogy G, et al. Effect of intraoperative fluid management on outcome after intraabdominal surgery[J]. Anesthesiology, 2005, 103(1):25-32.
[15] Jonsson K, Jensen J A, Goodson W H 3rd, et al. Tissue oxygenation, anemia, and perfusion in relation to wound healing in surgical patients[J]. Ann Surg, 1991, 214(5):605-613.
[16] 李潔. 彈簧圈在胰十二指腸切除術后出血治療中的臨床應用[J].首都醫科大學學報,2015,36(3):483-487.
[17] 李可,楊艷.胰十二指腸切除術后胰瘺的防治進展[J].中國煤炭工業醫學雜志,2015,18(12):2155-2160.

