以分泌型熒光素酶為報告基因的Nrf2報告系統的建立
張爾婷 江 娜 劉 清 彭麗倩 張倩雯 梁碧華 李潤祥 鄧蕙研 李華平 朱慧蘭
人體皮膚受紫外線(Ultraviolet,UV)照射后產生活性氧族(reactive oxygen species,ROS),并通過信號傳導誘發氧化應激反應,造成皮膚光損失,老化甚至皮膚癌。氧化應激不僅是造成皮膚急性炎癥反應如皮膚紅斑,水腫等反應的重要因素,同時也是觸發多種細胞凋亡的促發因素[1]。
在防御氧化應激的機制中,核因子E2相關因子2(nuclear factor erythroid 2-related factor 2, Nrf2)信號通路起著緩解ROS等氧化應激反應的重要作用,同時也是細胞內最重要的抗氧化通路之一。Nrf2在皮膚內能廣泛的表達,尤其是在上皮細胞,包括表皮角質細胞中高表達[2]。
目前在與UV誘導疾病的研究中尚無合適的細胞模型,每次急性光損傷實驗均需重復UV照射,實驗操作不穩定且操作繁瑣,導致實驗結果難以相互參考。因此建立與檢測Nrf2相關活性的靈敏可靠方法,是該領域研究的前提。其中分泌型熒光素酶(Gaussia Luciferase,GL)較螢火蟲熒光素酶具有高分泌表達,檢測靈敏度高,且無需裂解細胞等優點。本研究的目的構建一個易檢測、高靈敏的Nrf2信號通路報告系統。
1 材料與方法
1.1 質粒、菌株和細胞 HaCaT細胞,分泌型熒光素酶載體,大腸桿菌質粒( 購自上海中國科學院細胞研究所)。
1.2 試劑 Secrete-Pair Dual Luminescence Assay Kit(購自Genecopoeai 公司);lipofec3000脂質體(購自Invitrogen公司)。
1.3 設備 Infinite F200Pro多功能酶標儀(購自Invitrogen公司)。UVA照射儀(上海Sigma公司),UVA照射儀(上海Sigma公司),紫外線輻射強度測試儀(上海Sigma公司)。
2 方法
2.1 細胞培養 將HaCaT細胞培養至對數生長期后,取出各鋪24板細胞培養板,并加入500 uL不含抗生素的完全培養基。
2.2 核苷酸鏈序列設計 以mini-ML(gtgttcctgaaggggggctataaaagggggtgggggcgcgttcgtcctcactctcttcc)和mini-CV(gtaggcgtgtacggtgggaggcctatataagcagagctcgtttagtgaaccgtcagatcgcctggaga)作為基礎轉錄序列,在其上游的EcoRI和XhoI位點之間分別串聯1個、2個、4個和8個抗氧化反應元件(Anti-oxidant response element, ARE),各個不同個串聯元件引物序列如表1所示。同時以CMV啟動子驅動的堿性磷酸酶(Alkinane Phosphtase, AP)為內參報告。

表1 核苷酸序列設計
2.3 載體的構建和分組 引物進行褪火后,與XhoI+EcoRI酶切的載體連接,隨后轉化,挑取單克隆進行測序。根據所使用的經測序驗證后的質粒分為2組:以mini-ML為基礎轉錄元件,在EcoRI---XhoI之中分別串聯了1、2、4、8個ARE元件。以mini-CV為基礎轉錄元件,在EcoRI---XhoI之中分別串聯了1、2、4、8個ARE元件。
2.4 轉染 HaCaT細胞一個24孔板鋪板24 h后, 每孔板加入600 ng質粒進行轉染,采用Lipofectamine3000脂質體進行轉染,參照Lipofectamine3000說明書[4],簡述如下:lipo3000每孔加入1 uL,p3000加入1.2 uL。同時HaCaT細胞的control 均加入等量的lipo3000和p3000而無質粒。加入SF(10 uM)和tBHQ(20 uM)繼續培養24 h。取培養基上清測定。
2.5 mini-ML序列和mini-CV序列基礎輕錄活性的對比 沒有插入ARE元件的ML空載體(mini-ML)和沒有插入ARE元件的CV空載體(mini-CV)的分別轉染HaCaT細胞后,以DMSO (Vehicle),SF(10 μM)和tBHQ(20 μM)處理24 h后,取培養基上清測定。
2.6 分段取樣 ML-8XARE質粒轉染至HaCaT細胞后,予SF(10 uM)和tBHQ(20 uM)處理,分別于0 h,6 h和24 h,3個時相點取50 μL培養基上清凍存于-80℃,用于測定Gluc和AP活性。
2.7 UV照射后測定Gluc活性 ML-8XARE質粒轉染到HaCaT細胞后,分別給予20 J/m2的UVA和200 J/m2的進行光照,在光照后的4 h,6 h和24 h的3個時間點取50 μL培養基上清測定Gluc和AP活性,做好標記后立即凍存于-80℃。
2.8 測定Gluc和AP活性 取得培養基上清解凍后,采用TECAN公司Infinite F200Pro多功能酶標儀,按照其化學發光測量辦法,測定Gluc和AP活性,每孔做三次平行轉染,進行數據收集。通過對ARE轉錄原件的串聯數目、ARE序列,ARE串聯間隔序列進行篩選和優化,獲得最高靈敏度的ARE序列和串聯數目。
2.9 統計學方法 統計篩選得到最合適的ARE元件串聯數目。用SPSS18.0和graphpad prism6.0軟件進行數據分析和作圖,采用單因素方差分析(ANOVA)進行假設檢驗,P<0.05為差異有統計學意義。
3 結果
3.1 不同ARE元件的重組質粒報告基因載體鑒定的測序結果 對含重組質粒的菌落進行篩選并增菌,堿裂解法提取質粒DNA后,用DNA測序儀試劑盒進行測序。在質粒的EcoRI---XhoI之中分別串聯了1個,2個,4個,8個ARE元件,測序的長度順序結果(藍色標示區域)與預期結果相一致,見圖1~4。
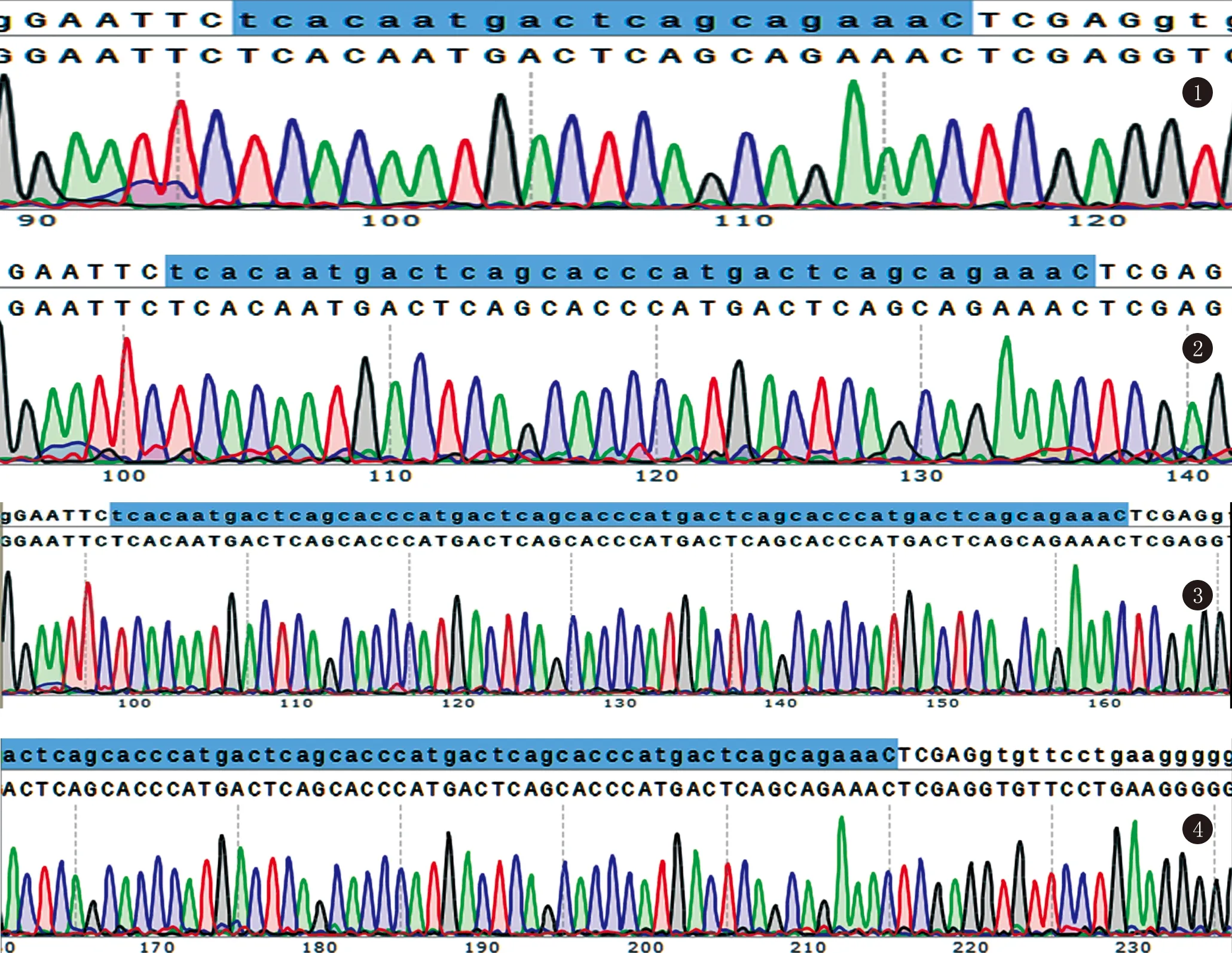
圖1 1個ARE元件的測序結果與預期結果一致(從左至右均為3’到5’的序列)圖2 2個ARE元件的測序結果與預期結果一致(從左至右均為3’到5’的序列)圖3 4個ARE元件的測序結果與預期結果一致(從左至右均為3’到5’的序列)圖4 1個ARE的元件測序結果與預期結果一致(從左至右均為3’到5’的序列)
3.2 不同ARE元件數目
3.2.1 以mini-ML序列作為基礎轉錄序列,在其后分別插入1,2,4和8個ARE轉錄元件,分別轉染HaCaT細胞。將沒有插入ARE元件的mini-ML空載體的值設為1。如圖5所示,當插入ARE元件逐漸增多時,Gluc活性發生了變化,ARE元件逐漸增多時,Gluc的活性越大(P<0.05),其中ML-8XARE時Gluc的活性最大。
3.2.2 當以CV序列作為基礎轉錄序列,在其后分別插入1,2,4和8個ARE轉錄元件,分別轉染HaCaT細胞后,圖6表明了Gluc 活性變化差異倍數,以沒有插入ARE元件的ML空載體的值設為1。可見當插入ARE元件逐漸增多時,Gluc活性越大(P<0.05)。說明當ML-8XARE的Gluc活性最大。
3.3 mini-ML和mini-CV基礎轉錄活性的比較 比較不含轉錄元件時,檢測mini-ML和mini-CV對抗氧化劑響應的情況。由圖7可見ML-Vehicle對三種抗氧化劑的反應均小于CV-Vehicle(P<0.05)。說明mini-ML序列本身對抗氧化劑響應要遠小于mini-CV序列,因此在后續實驗中選用mini-ML作為基礎轉錄序列。
3.4 抗氧化劑作用不同時間,Gluc活性情況 比較不同時間點的ML-8ARE對抗氧化劑SF和tBHQ的活性反映情況 。圖8表明了Gluc的相對熒光倍數,即活性變化差異倍數。結果顯示當選用ML-8ARE時,對SF和tBHQ在處理是作用最強的時間是6 h(P<0.05)。
3.5 UV照射對Gluc活性的影響 轉染ML-8ARE質粒的HaCaT細胞,經UVA和UVB照射后,各個時間點Gluc活性不同。圖9表明了Gluc活性變化差異倍數。結果顯示當以ML-8ARE時,UVA和UVB作用24 h時,Gluc活性最強。UVA和UVB之間差異不明顯。
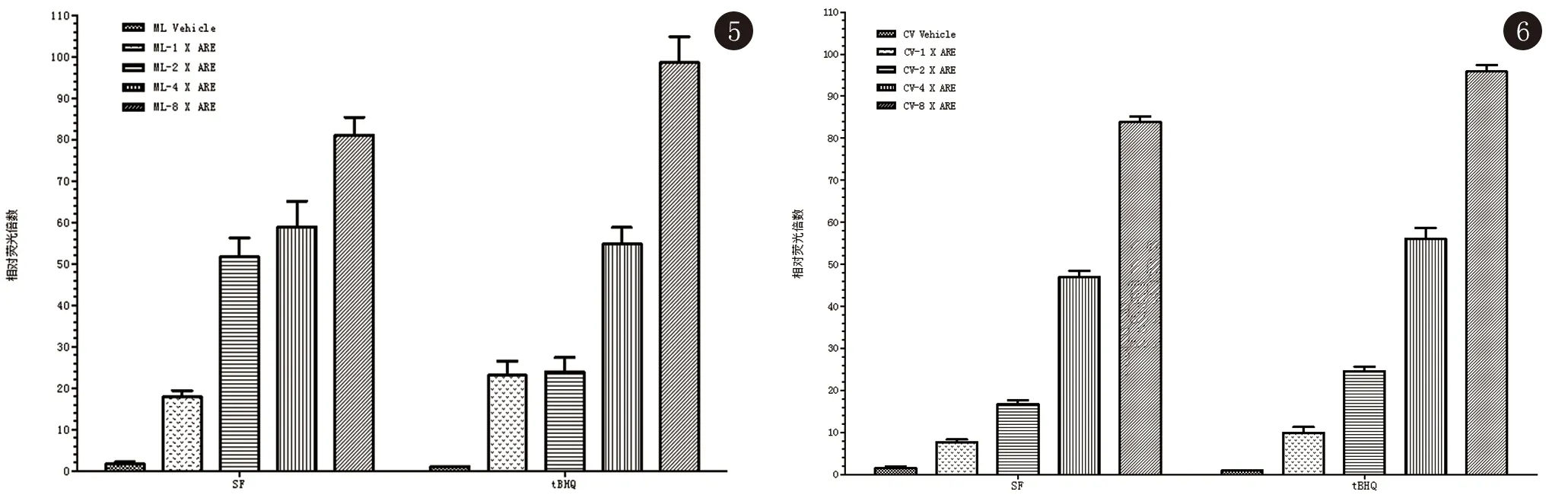
圖5 以mini-ML為基礎轉錄序列,不同ARE元件個數對Gluc活性的影響圖6 以mini-CV為基礎轉錄序列,不同ARE元件個數對Gluc活性的影響
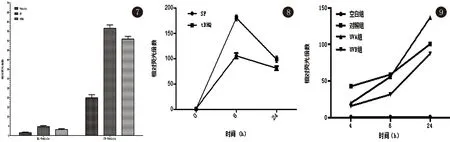
圖7 不含ARE原件時,mini-ML 和mini- CV對抗氧化劑的響應圖8 抗氧化劑作用不同時間,Gluc活性情況圖9 UV照射Gluc活性的影響
4 討論
在判斷UV輻射是否導致細胞損傷以造成UV致急性光損傷模型的實驗中,目前主要通過觀察細胞形態學或繁瑣的Nrf2核轉位等判定手段。在UV導致急性光損傷中沒有合適且易檢測的分子標記物。本實驗希望通過建立Nrf2的報告系統,實現當細胞受到光損失時,胞內產生ROS,激活Nrf2轉移到細胞核內與ARE結合,啟動Nrf2的報告系統的轉錄、翻譯和分泌到胞外,啟動下游基因的轉錄。希望通過檢測Nrf2的報告系統的活性,從而判斷Nrf2的激活情況及細胞受到急性光損傷的情況。
目前,關于Nrf2的報告系統的主要有β-半乳糖、螢火蟲熒光素酶、綠色熒光蛋白等。β-半乳糖的報告系統翻譯過程較復雜,且不能應用于順勢表達和單細胞以上水平的研究。螢火蟲熒光素酶、綠色熒光蛋白和Gluc一樣,同屬熒光蛋白家族,具有無需其它外源因子的參與自有熒光機制;熒光不干擾細胞和組織的正常生長和功能[4],觀察過程選用顯微鏡等設備即可完成等優點。Gluc檢測靈敏度高螢火蟲熒光素酶的1000倍以上,在多種哺乳動物細胞中均能高效的分泌表達,具有無需裂解細胞,檢測方便快捷,可實現長期活性的監測的優點。因此本實驗選用Gluc作為報告基因。
本實驗中,為了建立以Gluc為報告基因的Nrf2報告系統,我們選取了8個ARE元件分別插入質粒的EcoRI---XhoI中,并以CMV啟動子驅動的AP為內參報告。采用抗氧化劑SF和tBHQ篩選出不同時間(0 h,6 h及24 h)時的熒光強度,結果表明6 h時熒光強度最高。抗氧化劑處理正常細胞,可迅速激活Nrf2通路,并在6 h時達到最高,但隨時間的延長,抗氧化劑的活性逐漸降低,此后細胞本身的反饋抑制機制導致Nrf2通路回復到正常水平而下降。當采用不同波長的UV,即UVA和UVB時,熒光強度在24 h時達到最高,主要原因在于當受到紫外照射后,細胞受到應急損傷,有可能發生細胞凋亡,從而啟動細胞本身的抗氧化機制。而啟動這一抗氧化機制是個相對比較緩慢的過程,因此在24 h時熒光強度最強。綜上結果,我們在實際應用該報告系統時,應同時測量6 h和24 h的ML-8ARE的熒光強度以避免細胞2種不同的反應機制對結果造成的影響。
[1] Svobodova A, Walterova D, Vostalova J. Ultraviolet light induced alteration to the skin[J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2006,150(1):25-38.
[2] Braun S, Hanselmann C, Gassmann MG, et al. Nrf2 transcription factor, a novel target of keratinocyte growth factor action that regulates gene expression and inflammation in the healing skin wound[J]. Mol Cell Biol,2002,22:5492-5505.
[3] Alam J, Cook JL. Reporter genes: application to the study of mammalian gene transcription[J]. Anal Biochem,1990,188:245-254.
[4] Chalfie M, Tu Y, Euskirchen G, et al. Greenfluorescent protein as a marker for gene expression[J].Science,1994,263:802-805.

