木薯MeTPP1基因克隆、結構變異及其表達分析
丁澤紅 鐵韋韋 付莉莉 胡偉
(中國熱帶農業科學院熱帶生物技術研究所,海口 571101)
海藻糖是由兩個葡萄糖分子通過半縮醛羥基縮合而成的非還原性雙糖[1],在真菌、細菌、藻類、動物和植物中廣泛存在,是天然雙糖中最穩定的糖質。海藻糖具有生物抗逆性,其含量在脅迫環境下被大量積累[2],對植物抵抗干旱、低溫、高鹽和營養脅迫等非常重要。植物中海藻糖主要經TPS/TPP途徑合成,即尿苷二磷酸葡萄糖和6-磷酸葡萄糖在海藻糖-6-磷酸合成酶(trehalose-6-phosphate synthase,TPS)催化作用下生成6-磷酸海藻糖,之后在海藻糖-6-磷酸酯酶(trehalose-6-phosphate phosphatase,TPP)的水解作用下生成海藻糖[3]。由此可見,TPP參與海藻糖生物合成催化反應的最后一步,是植物海藻糖生物合成途徑的關鍵酶。
植物中TPP基因以基因家族的形式存在,擬南芥中有 10 TPP 基因(AtTPPA-AtTPPJ)[4-5],水稻中有 13個TPP基因(OsTPP1-OsTPP13)[6],它們都含有TPP基因家族保守結構域。通過酵母互補實驗,Vogel等[7]最早鑒定并克隆了兩個擬南芥TPP成員——AtTPPA和AtTPPB。他們發現,AtTPPA和AtTPPB基因表達后可以互補tps2突變體的功能,并能夠在體內(in vivo)和體外(in vitro)實驗中檢測到TPP活性。隨后的研究表明,擬南芥TPP基因的表達受到低溫、干旱、鹽、滲透脅迫和激素(包括ABA、JA等)處理的調控[5]。水稻OsTPP1基因是擬南芥AtTPPA基因的同源基因。表達分析顯示,OsTPP1的表達也受到低溫、鹽、滲透脅迫和ABA處理誘導,并伴隨著TPP活性和海藻糖含量的提高[8]。在水稻中超表達OsTPP1基因后,轉基因植株對鹽和低溫的耐受性增強[6]。進一步分析表明,OsTPP1可以激活脅迫相關基因的表達(如冷脅迫響應基因Lip5、Lip9、DREB1B和非生物脅迫信號基因OsMPK3、OsMPK4),這可能是OsTPP1超表達植株抗逆性增強的主要原因[6]。值得注意的是,Nuccio等[9]在玉米中超表達OsTPP1基因后,多年份多地點田間試驗表明,轉基因植株在正常和干旱條件下均可以增加玉米結實率和收獲指數,進而增加產量。由此可見,OsTPP1是一個可用于作物抗逆遺傳改良的重要候選基因。然而,目前這些研究還主要集中在模式植物擬南芥和水稻中,在熱帶作物(如木薯)中的研究還很少。
木薯(Manihot esculenta Crantz)是熱帶和亞熱帶地區重要的糧食和經濟作物,與甘薯和馬鈴薯并稱為世界三大薯類作物,在現代農業和工業中占有非常重要的地位。木薯具有較好的抗旱特性,然而在長時間或較為嚴重的干旱條件下,其塊根產量會顯著下降[10]。作為典型的熱帶作物,木薯對低溫反應非常敏感,極端的低溫天氣可以造成木薯大幅減產甚至絕收[11]。因此,提高木薯對干旱和低溫等非生物脅迫的耐受性,使其在惡劣環境下維持原有產量或是減少產量損失具有重要意義。
至今為止,木薯中尚沒有關于TPP基因克隆及其參與非生物脅迫調控的研究報道。本研究以OsTPP1基因為切入點,采用同源基因克隆的方法從木薯品種Ku50葉片中克隆了一個海藻糖-6-磷酸酯酶基因(命名為MeTPP1),分析其在木薯野生種和栽培種之間的結構變異,并通過熒光定量PCR(qRTPCR)分析了其在野生種和栽培種之間、以及在干旱、低溫和ABA脅迫處理下的表達水平,旨在為進一步研究MeTPP1在木薯抗逆中的功能提供理論參考。
1 材料與方法
1.1 材料
本研究所用材料包括木薯主推廣栽培品種Ku50(高淀粉、抗逆性較好)和野生種W14(低淀粉),由中國熱帶農業科學院熱帶生物技術研究所提供。植物RNA提取試劑盒(貨號:DP437)購自天根生化科技有限公司,cDNA反轉錄試劑盒(貨號:K1622)購自Fermentas 公司。PCR引物在上海生工生物工程股份有限公司合成。
1.2 方法
1.2.1 木薯種植與處理 木薯種植按照丁澤紅等[12]方法進行:在木薯種植季節,將木薯Ku50種莖切成15 cm左右的莖段,選擇粗細勻稱且具有3-4個芽眼的莖段種植于塑料盆(上直徑18.5 cm,下直徑14.8 cm,高18.8 cm)中,每盆1莖段。木薯基質采用蛭石與營養土按照1∶1的體積比進行混合。種植大約10 d后進行間苗,每盆保留1棵苗。木薯種植60 d后,分別進行干旱、低溫和ABA處理。(1)干旱處理:采用PEG-6000進行干旱模擬處理。處理植株澆灌20%的PEG-6000溶液,對照植株不施PEG(用澆灌自來水代替)。在處理0、3、和24 h后,分別收集第一片完全展開葉、未展開葉、老葉、和根的樣品,液氮速凍、-80℃保存待用;(2)低溫處理:選取生長狀況一致的植株放置于光照培養箱,進行4℃低溫脅迫處理。在處理0、6、和24 h 后,分別收集第一片完全展開葉、未展開葉、和根的樣品,液氮速凍、-80℃保存待用;(3)ABA處理:采用100 μmol/L ABA溶液進行澆灌處理,在處理0、3、5、和7 d 后收集第一片完全展開葉的樣品,液氮速凍、-80℃保存待用。
為了比較木薯野生種W14和栽培種Ku50中MeTPP1基因的表達情況,我們收集了正常大田種植環境下木薯葉片(90 d)和儲藏根(150 d)的樣本,用于qRT-PCR分析。
1.2.2 引物合成及qRT-PCR 本研究所用引物包括MeTPP1基因qRT-PCR引物(qMeTPP1-L:5'-GGCTTGACGCCATGAAATCC-3';qMeTPP1-R:5'-TACTTAAGCGTCCAGGTGGC-3'),actin內 參 基 因 引 物(qActin-L:5'-TGATGAGTCTGGTCCATCCA-3';qActin-R :5'-CCTCCTACGACCCAATCTCA-3'), 和MeTPP1基因全長擴增引物(gMeTPP1-L:5'-ATGGACCTTAAATCGAATCACACTG-3';gMeTPP1-R :5'-CTTCACTTCTTCCACATCACAAGAT-3')。 采 用SYBR Green I 試劑盒進行qRT-PCR分析,每個樣品含有3次生物學重復。qRT-PCR反應在Mx 3005P熒光定量PCR儀(Stratagene,美國)上進行qRT-PCR分析。基因相對表達量按照2-ΔΔCt進行計算[13]。
1.2.3 生物信息學分析 生物信息學分析方法參照丁澤紅等[12]進行,具體描述如下:用BLASTP搜索Phytozome數據庫,根據序列相似性獲取其他物種中與MeTPP1同源的蛋白質序列;用ExPASy ProtParam軟件計算蛋白質的分子量和等電點;用Plant-mPLoc軟件預測亞細胞定位情況;用NCBICDD數據庫預測保守結構域;用ClustalX軟件進行序列比對;用DnaSPv5進行SNP分析及ka/ks計算;用MEGA5.2軟件構建Neighbor-joining系統進化樹(bootstrap = 1 000);用PlantCARE分析啟動子元件;用Primer 5.0軟件設計PCR引物。
木薯野生種W14和栽培種Ku50中MeTPP1基因序列由前期全基因組測序確定[14];栽培種AM560中MeTPP1序列從Phytozome數據庫下載。
2 結果
2.1 MeTPP1基因克隆
以水稻OsTPP1(LOC_Os02g44230)蛋白質序列為查詢序列,通過BLASTP搜索Phytozome木薯數
據庫獲得與OsTPP1同源的序列(cassava4.1_0098-37m.g),之后根據數據庫提供的參考序列,設計引物進行PCR擴增(圖1)。測序后獲得一個全長為1 131 bp的序列,編碼376個氨基酸(圖2),根據其與水稻OsTPP1基因的同源性將其命名為MeTPP1。通過序列比對發現,MeTPP1與參考序列之間共有2個堿基差異,它們均可導致氨基酸編碼的改變。將MeTPP1與基因組序列比對得知,該基因含有11個外顯子和10個內含子。ProtParam預測MeTPP1蛋白的分子式為C1890H2959N505O564S15,總原子數目為5 933,分子量為42 261.2 Da,理論等電點(pI)為7.05,不穩定系數為38.03,屬于穩定蛋白。亞細胞定位預測該蛋白質定位于葉綠體或液泡。NCBI-CDD保守結構域分析表明,MeTPP1編碼的蛋白含有TPP基因家族保守結構域(PLN02580,圖3),進一步表明克隆到的基因為木薯MeTPP1基因。
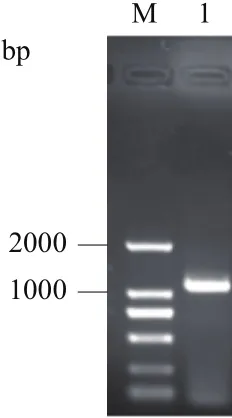
圖1 MeTPP1基因cDNA電泳圖
2.2 MeTPP1序列比對與系統進化樹分析
通過BlastP搜索Phytozome數據庫獲取其他物種中與MeTPP1具有較高同源性的蛋白質序列,之后構建系統進化樹。分析結果表明,這些基因大致上被聚類為3組(圖4):木薯MeTPP1基因聚類在第I組,它與楊樹(Potri.015G126900.1)和杞柳(SapurV1A.0129s0190.1)中同源基因的親緣關系較近,序列相似性分別為77.8%和74.5%。大豆和雷蒙德氏棉中的同源基因也聚類在第I組。擬南芥AtTPPA聚類在第II組,同時還包含了其他十字花科的物種,如琴葉擬南芥、鼠耳芥、薺菜花和白菜型油菜。水稻OsTPP1聚類在第III組,它與二穗短柄草的同源基因親緣關系較近。此外,許多C4植物包
括玉米、高粱、小米、狗尾草、黍羊和柳枝稷也被聚類在第III組。

圖2 木薯MeTPP1及其推導的氨基酸序列

圖3 MeTPP1蛋白質結構域分析

圖4 木薯MeTPP1基因與其他物種TPP基因系統進化樹
2.3 MeTPP1基因結構變異分析
為了揭示MeTPP1在基因組結構上的變異,本研究將野生種W14、栽培種Ku50和AM560(Phytozome木薯數據庫測序品種)中MeTPP1的DNA序列進行比對分析,共發現5個插入/缺失(Indel)和43個SNP,其中有9個SNP屬于錯義突變,可引起氨基酸編碼的改變(圖5)。
序列兩兩比較表明,MeTPP1的結構變異主要來自于栽培種與野生種之間的差異,而栽培種與栽培種之間的差異很小,僅有2個SNP。野生種與栽培種ka/ks比值接近于0.43,暗示MeTPP1基因在進化過程中受到了純化選擇。
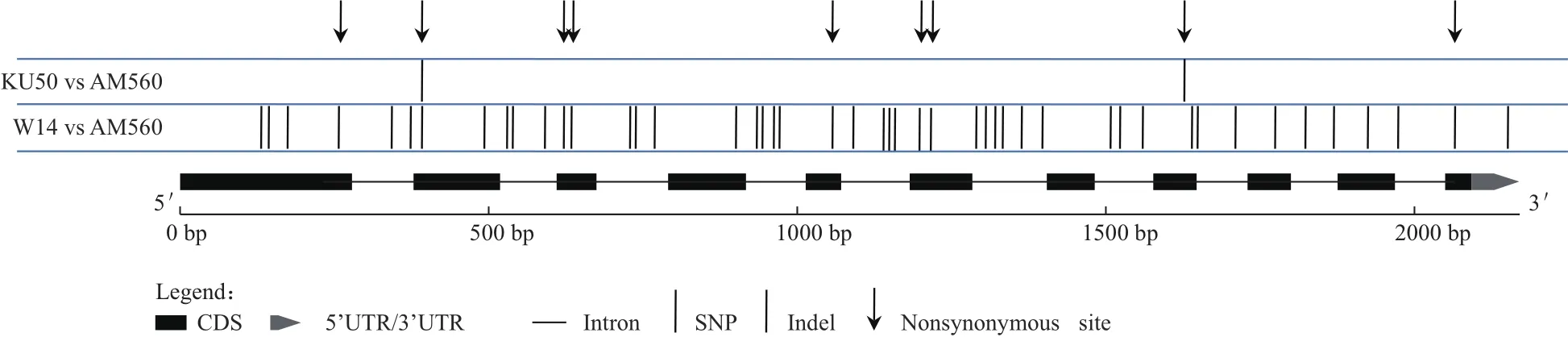
圖5 MeTPP1基因結構變異
2.4 MeTPP1基因啟動子分析
啟動子是影響基因表達的重要調控元件,與基因的轉錄起始和表達程度息息相關。本研究選取MeTPP1起始密碼子(ATG)上游1 500 bp的序列進行啟動子元件分析,發現了一系列與脅迫相關的元件,如干旱誘導元件MBS、熱脅迫響應元件HSE、以及防御與脅迫相關元件TC-rich repeats。脫落酸(Abscisic acid,ABA)是一種非常重要的植物激素,處于植物響應干旱、低溫、熱脅迫等非生物逆境的信號傳導中樞,在非生物逆境條件下可調控基因的表達。值得指出的是,本研究在MeTPP1啟動子區域發現了一個ABA響應元件ABRE,暗示MeTPP1可能通過ABA介導的信號通路參與木薯非生物脅迫響應。除此之外,我們還發現了茉莉酸響應元件CGTCA-motif和TGACG-motif、水楊酸響應元件TCA-element、赤霉素響應元件P-box、和許多與光響應相關的元件,包括G-Box、GT1-motif、和Sp1等。這些結果表明,MeTPP1可能參與木薯干旱、低/高溫、激素和光照相關的基因表達調控。
2.5 MeTPP1基因表達分析
首先,我們考察了MeTPP1基因在木薯野生種W14和栽培種Ku50中的表達情況。結果表明,葉片中MeTPP1在W14中的表達量要顯著的高于Ku50;而根中的表達趨勢正好相反,但表達量無顯著差異(圖6-A)。
其次,我們考察了MeTPP1基因在不同脅迫條件下的表達情況。在PEG-6000脅迫條件(模擬干旱)下,MeTPP1的表達量在老葉和第一片完全展開葉中均呈現先下降后上升的變化趨勢,而在未展開葉和根中均呈現持續下降的變化趨勢(圖6-B),表明在木薯不同組織中MeTPP1可能采取不同的表達策略來響應干旱脅迫。在低溫脅迫下,無論是在未展開葉、第一片完全展開葉、還是在根中,MeTPP1的表達量均呈現持續上升的變化趨勢,其表達量在低溫處理24 h后分別上升了3.5、11.6和24.2倍(圖6-C)。在ABA處理條件下,MeTPP1在葉片中的表達量顯著下降了,在處理3 d、5 d、7 d后分別下降了76.6%、66.2%和72.7%(圖6-D)。
這些結果充分表明,MeTPP1基因在轉錄水平受到干旱、低溫和ABA處理顯著誘導,可進一步研究其在木薯非生物脅迫中的功能。
3 討論
海藻糖是重要的滲透調節物質,增加植物體內海藻糖含量可以提高植物抵御干旱和低溫等脅迫的抗性[15]。TPP負責催化海藻糖生物合成途徑的最后一步反應,是海藻糖生物合成途徑中的一個關鍵酶。植物中TPP以基因家族的形式存在,擬南芥中有10個TPP基因,水稻中有13個TPP基因,它們都含有TPP基因家族保守結構域[4,6]。研究表明,增加TPP基因的表達可以提高植物對非生物逆境脅迫的抗性。例如,在擬南芥中超表達AtPPD基因后,轉基因植株抗鹽能力增強[16];在水稻中超表達OsTPP1基因后,轉基因植株體內OsTPP1表達量上升,對低溫、鹽和干旱脅迫的抗性增強[6,8]。進一步實驗表明,OsTPP1基因的表達調控與ABA代謝相關[8]。最近,研究人員將OsTPP1基因在玉米中進行超表達后發現,轉基因植株在正常和干旱條件下均可以增加玉米產量[9]。不難看出,TPP是一個重要的抗逆候選基因,可用于作物遺傳改良育種。目前有關TPP基因功能的研究主要集中在模式植物擬南芥和水稻中,在熱帶作物(如木薯)中尚無TPP基因克隆的相關報道,對其功能也知之甚少。本研究采用同源基因克隆的方法,從木薯葉片中克隆了OsTPP1的同源基因,將其命名為MeTPP1。序列分析表明MeTPP1編碼376個氨基酸,含有TPP基因家族保守結構域,具有11個外顯子和10個內含子。進化樹分析表明,它與杞柳和楊樹中TPP基因的親緣關系較近。
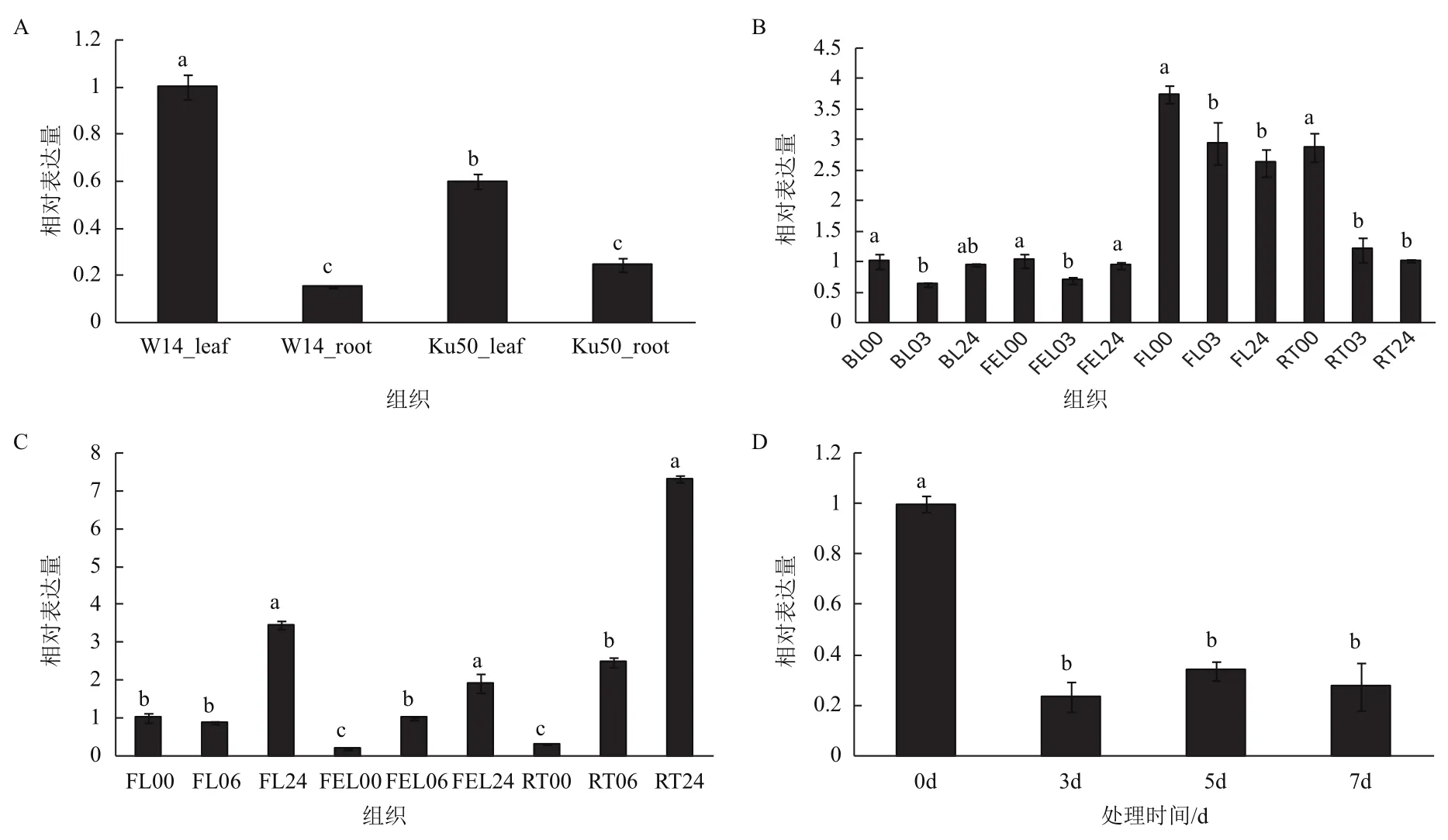
圖6 MeTPP1基因的表達分析
基因結構變異可以引起基因表達量的改變[17]。本研究發現,MeTPP1的表達量在野生種W14和栽培種Ku50之間存在顯著差異;而序列比對發現,MeTPP1在木薯野生種W14和栽培種Ku50之間存在大量的堿基變異,其中僅有9個SNP會引起氨基酸編碼的改變,推測這9個錯義突變可能與野生種和栽培種之間MeTPP1的表達差異有關。
TPP基因的表達受到干旱、低溫、鹽、機械損傷和滲透脅迫等調控,且不同TPP成員對各種脅迫的響應不一樣。例如,在擬南芥幼苗中,AtTPPE、AtTPPF、AtTPPG和AtTPPJ的表達均受到低溫、鹽和滲透脅迫的誘導;而AtTPPA和AtTPPH的表達僅受到低溫脅迫誘導但被鹽和滲透脅迫抑制[5]。另外,不同TPP成員對激素的響應也不一樣。AtTPPD和AtTPPI的表達均受到ABA處理誘導,AtTPPA和AtTPPB的表達受到ABA處理抑制,而AtTPPE、AtTPPF和AtTPPG的表達則同時受到ABA和JA處理誘導[5]。在水稻中,OsTPP1基因表達也受到低溫、鹽、干旱和ABA處理的誘導[6,8]。啟動子是調控基因表達的重要元件。本研究在MeTPP1啟動子區域發現了干旱誘導元件MBS和溫度(熱脅迫)響應元件HSE,這與MeTPP1基因在干旱和低溫脅迫條件下的表達分析結果是吻合的。植物響應外界非生物脅迫的信號傳導路徑大致上可以分為兩種:一種是依賴于ABA信號通路的;另一種是不依賴于ABA信號通路的[18]。本研究在MeTPP1啟動子區域發現了一個與ABA響應相關的元件ABRE,而且表達分析結果顯示MeTPP1的表達也是受到ABA信號響應的。因此,本研究推測MeTPP1可能是通過依賴于ABA的信號通路參與木薯干旱和低溫等非生物脅迫響應。然而,具體有哪些基因參與了MeTPP1介導的分子調控網絡尚不清楚,還需要進一步研究。
4 結論
本研究通過同源基因克隆的方法從木薯葉片中克隆了一個海藻糖-6-磷酸酯酶基因MeTPP1,該基因編碼376個氨基酸,含有TPP家族保守結構域。序列比對分析表明,MeTPP1在木薯野生種和栽培種之間共有9個錯義突變,它們可能與MeTPP1的表達有關。實時熒光定量PCR分析表明,MeTPP1表達量受到干旱、低溫和ABA處理的響應,可作為候選基因進一步研究其在木薯抗逆中的功能。
[1] 張雯, 王宇斐, 郭延平. 高等植物6-磷酸海藻糖信號調控研究進展[J]. 植物生理學報, 2016, 52(4):394-400.
[2] 張建波, 王莎莎, 郝大海, 等. 干旱和低溫脅迫影響煙草幼苗海藻糖代謝的差異比較[J]. 生物技術通報, 2015, 31(10):111-118.
[3] 史健志, 等. 壇紫菜6-磷酸海藻糖合成酶(TPS)家族基因的克隆及表達特征分析[J]. 水產學報, 2015, 39(4):485-495.
[4] Vandesteene L, Dijck PV. Expansive evolution of the trehalose-6-phosphate phosphatase gene family in Arabidopsis[J]. Plant Physiology, 2012, 160(2):884.
[5] Li P, Ma S, Bohnert HJ. Coexpression characteristics of trehalose-6-phosphate phosphatase subfamily genes reveal different functions in a network context[J]. Physiol Plant, 2008, 133(3):544-556.
[6] Ge LF, Chao DY, Shi M, et al. Overexpression of the trehalose-6-phosphate phosphatase gene OsTPP1 confers stress tolerance in rice and results in the activation of stress responsive genes[J]. Planta,2008, 228(1):191-201.
[7] Vogel G, Aeschbacher RA, Müller J, et al. Trehalose-6-phosphate phosphatases from Arabidopsis thaliana:identification by functional complementation of the yeast tps2 mutant[J]. Plant Journal for Cell & Molecular Biology, 1998, 13(5):673-683.
[8] Pramanik MHR, Imai R. Functional identification of a trehalose 6-phosphate phosphatase gene that is involved in transient induction of trehalose biosynthesis during chilling stress in rice[J]. Plant Molecular Biology, 2005, 58(6):751-762.
[9] Nuccio ML, Wu J, Mowers R, et al. Expression of trehalose-6-phosphate phosphatase in maize ears improves yield in well-watered and drought conditions[J]. Nat Biotechnol, 2015, 33(8):862.
[10] Okogbenin E, Setter TL, Ferguson M, et al. Phenotypic approaches to drought in cassava:review[J]. Front Physiol, 2013, 4:93.
[11] 盧賽清, 盤歡, 馬崇熙, 等. 2008年廣西木薯低溫凍害情況及應對措施[J]. 廣西熱帶農業, 2009(1):21-22.
[12] 丁澤紅, 付莉莉, 等. 木薯 MeNCED3基因克隆、結構變異及其表達分析[J]. 生物技術通報, 2016(10):148-153.
[13] Fu L, Ding Z, et al. Physiological investigation and transcriptome analysis of Polyethylene Glycol(PEG)-induced dehydration stress in cassava[J]. Int J Mol Sci, 2016, 17(3):283.
[14] Wang W, Feng B, et al. Cassava genome from a wild ancestor to cultivated varieties[J]. Nat Commun, 2014, 5 :5110.
[15] Garg AK, Kim JK, Owens TG, et al. Trehalose accumulation in rice plants confers high tolerance levels to different abiotic stresses[J]. Proc Natl Acad Sci USA, 2002, 99(25):15898.
[16] Krasensky J, et al. The redox-sensitive chloroplast trehalose-6-phosphate phosphatase AtTPPD regulates salt stress tolerance[J].Antioxid Redox Signal, 2014, 21(9):1289-1304.
[17] Hao GP, et al. Nucleotide variation in the NCED 3 region of Arabidopsis thaliana and its association study with abscisic acid content under drought stress[J]. J Integr Plant Biol, 2009, 51(2):175-183.
[18] Shinozaki K. Gene networks involved in drought stress response and tolerance[J]. J Exp Bot, 2007, 58(2):221-227.

