一種高效表達堿性蛋白酶的新型啟動子的篩選及研究
陳坤 袁飛燕 柴昊男 劉煥 王興吉 張會圖 路福平
(1. 工業發酵微生物教育部重點實驗室 天津科技大學生物工程學院,天津 300457;2. 山東隆科特酶制劑有限公司,沂水 276400)
蛋白酶是一類能夠催化水解肽鍵的酶,在食品、環境、醫藥等各類領域具有重要的應用價值[1-2],主導全球工業酶市場[3]。堿性蛋白酶(Alkaline protease)是一類最適pH值偏堿性的蛋白酶,在食品、洗滌以及皮革等行業有著廣泛的用途[4-5]。堿性蛋白酶強的水解、耐熱及耐堿能力[6],使其一直以來備受人類研究的關注。
由于堿性蛋白酶的廣泛用途以及產酶效率不高等原因,一直以來市場都處于供不應求的現狀[7]。目前,國內外對于微生物堿性蛋白酶的研究主要側重于菌種選育、酶轉譯及調控機制的研究等方面[8-9],而對于提高生產菌產酶能力和酶的性質的研究較少。近年來,越來越多的研究者開始將注意力轉向通過生物技術和蛋白質手段構建堿性蛋白酶高產工程菌等方面[10]。
枯草芽孢桿菌由于其無致病性、安全、無明顯密碼子偏嗜性、代謝產物分離純化簡便等優點[11-12],被廣泛作為酶與抗生素等的表達宿主應用于工業生產。另一方面,枯草芽孢桿菌高效表達元件嚴重匱乏、遺傳轉化效率低和分泌系統較弱等問題[13-14],同時也限制了其應用價值。
在微生物遺傳系統中,啟動子具有十分重要的作用,選用強啟動子介導目的基因的表達是提高基因異源表達非常有效的方法[15]。從地衣芽孢桿菌中篩選獲得一種新型的強組成型啟動子,以兩種堿性蛋白酶基因為報告基因,研究其在枯草芽孢桿菌WB600中的表達強度,以期構建堿性蛋白酶高效表達系統,并為枯草芽孢桿菌異源基因的表達提供新型調控元件。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒 枯草芽孢桿菌(B.subtilis)WB600、地衣芽孢桿菌(B.licheniformis)11965和枯草芽孢桿菌表達載體pUBA110均為本實驗室保藏。1.1.2 試劑和培養基 DNA聚合酶、限制性內切酶、T4 DNA Ligase均購自TaKaRa公司;GeneRuler 1 kb DNA Ladder、Pierce Unstained Protein MW Marker 購自Thermo公司;質粒提取試劑盒、DNA切膠回收試劑盒購自OMEGA公司;福林酚、酪蛋白底物、三氯乙酸等購自Sangon Biotech(Shanghai)公司。
種子培養基(肉湯培養基):牛肉膏0.5%,蛋白胨1%,氯化鈉0.5%,初始pH值為7.2-7.4;發酵產酶培養基:玉米粉6.4%,豆餅粉4%,磷酸氫二鈉0.4%,磷酸二氫鉀0.03%,高溫淀粉酶0.07%(防止糊化)。
枯草芽孢桿菌感受態制備培養基:(1)SP-A Salts Solution :(NH4)2SO40.4%,K2HPO4·3H2O 2.8%,KH2PO41.2%,Trisodium Citrate Dihydrate 0.2% ;(2)SP-B Salts Solution :MgSO4·7H2O 0.04% ;(3)100×CAYE Solution :Casamino acid 2%,Yeast Extract 10% ;(4)SPI Medium(20 mL):SP-A Salts Solution 9.8 mL,SP-B Salts Solution 9.8 mL,50% Glucose 200 μL,100×CAYE 200 μL ;(5)SPII Medium(6 mL):SPI Medium 5.88 mL,50 mmol/L CaCl260 μL,250 mmol/L MgCl260 μL ;(6)100×EGTA Solution:10 mmol/L EGTA溶液,溶解時加入少量NaOH至pH 8.0。
1.2 方法
1.2.1 地衣芽孢桿菌啟動子篩選 由本實驗室菌種保藏庫中接種地衣芽孢桿菌11965于無抗LB平板上,37℃培養12 h,挑取單菌落于新的LB平板三區劃線進行活化,12 h后挑取單菌落于50 mL種子培養基中,220 r/min過夜培養,分別接取2 mL種子培養液于3個裝有100 mL發酵培養基的500 mL擋板瓶中,37℃,220 r/min振蕩培養,每隔8 h進行取樣,離心收集上清液,進行SDS-PAGE蛋白電泳分析,切取最亮的條帶進行蛋白質譜檢測。
1.2.2 啟動子及信號肽片段的克隆 蛋白質譜結果顯示該酶為地衣芽孢桿菌幾丁質酶(Chitinase),由NCBI數據庫獲取其基因序列,通過在線軟件Promoter 2.0 Prediction Server(http://www.cbs.dtu.dk/services/Promoter/)和SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)分析其啟動子和信號肽。Degering等[16]的研究表明源于地衣芽胞桿菌幾丁質酶的信號肽dBli00338使蛋白酶subtilisin BPN'分泌表達量提高了6-7倍,因此選用dBli00338代替報告基因自身信號肽。通過引物pChi-F和SP-R(表1),以地衣芽孢桿菌11965基因組為模板,PCR擴增幾丁質酶啟動子和信號肽片段。PCR反應體系為:無菌雙蒸水 33.8 μL,10×Pyrobest Buffer 5 μL,dNTP Mixture(2.5 mmol/L)5 μL,上游引物和下游引物各2 μL,基因組模板2 μL,Pyrobest DNA聚合酶0.2 μL。PCR反應條件為:94℃預變性5 min;94℃變性30 s,54℃退火30 s,72℃延伸30 s,共30個循環;72℃延伸10 min。0.8% 的瓊脂糖凝膠電泳檢測,切膠回收PCR產物。

表1 引物及核苷酸序列
選用啟動子pShuttle-09和pyxiE為對照,驗證pChi的表達強度。啟動子pShuttle-09和pyxiE分別通過引物pS-F/pS-R和pY-F/pY-R(表1)經PCR擴增獲得,并與引物SP-F/SP-R擴增的信號肽dBli00338片段通過重疊PCR技術進行連接。
1.2.3 兩種堿性蛋白酶成熟肽基因的克隆 報告基因所用的兩種堿性蛋白酶基因分別為克勞氏芽孢桿菌堿性蛋白酶基因alk(GenBank Sequence ID:FJ940727.1)和地衣芽孢桿菌堿性蛋白酶基因apr(GenBank Sequence ID:AY590140.1)。根據編碼基因序列,運用在線分析軟件SignalP 4.1 Server分析得到兩種蛋白酶基因的成熟肽序列,并設計PCR引物alk-F/alk-R和apr-F/apr-R(表1)。
1.2.4 表達載體的構建 PCR產物切膠回收后獲得的啟動子-信號肽片段與報告基因成熟肽片段分別使用Bam HI酶切后連接,連接產物純化后使用Sac II和Xho I雙酶切并切膠回收,通過T4 DNA連接酶克隆到pUBA110表達載體上,連接反應體系為(10 μL):pUBA110載體片段3 μL,啟動子-信號肽-報告基因片段 5 μL,10×T4 DNA Buffer 1 μL,T4 DNA連接酶1 μL,16℃連接6 h,連接產物通過化學轉化轉入枯草芽孢桿菌WB600感受態細胞。
1.2.5 枯草芽孢桿菌WB600感受態的制備及轉化
(1)挑取新活化的枯草芽孢桿菌WB600單菌落于5 mL LB液體培養基中,37℃,220 r/min,過夜培養;(2)取100 μL培養液轉接至5 mL SPI培養基中,37℃,220 r/min培養至對數生長末期OD600=1.2(約3-4 h);(3)取200 μL生長至對數期末的培養液至2 mL SPII培養基中,37℃,100 r/min 培養 1.5 h;(4)在上述SPII培養基的菌體中加入20 μL 10 mmol/L EGTA,37℃,100 r/min培養10 min;(5)加入連接產物,37℃,100 r/min培養30 min;(6)調節轉速至220 r/min,繼續培養1.5 h,取菌液涂布于含有50 μg/mL卡那霉素(Kan)的LB篩選平板,37℃培養12 h,篩選陽性轉化子進行驗證。
將構建的重組質粒分別命名為pCalk110、pCapr110、pSalk110、pSapr110、pYalk110 和pYapr110,所對應的重組菌命名為C1、C2、S1、S2、Y1和 Y2。
1.2.6 蛋白酶粗酶液的制備及分析 將新鮮平板上的6株菌的單菌落分別接入50 mL Kan抗性種子培養基中,37℃、220 r/min振蕩培養12 h,分別檢測菌株種子液的OD600,以相同的接種量轉接于含有Kan抗性的裝有100 mL發酵培養基的擋板瓶中,每株菌做3個平行,于37℃、220 r/min發酵培養,每隔6 h收集發酵液,4℃、12 000 r/min離心取上清,用于SDS-PAGE分析和酶活測定。SDS-PAGE分析取用20 μL發酵上清液與5 μL 5×SDS-PAGE Loading Buffer混合均勻,沸水浴10 min后上樣10 μL。
堿性蛋白酶酶活測定參照GB/T 23527-2009[17]附錄B福林酚法進行,1個酶活力單位(U/mL)定義為1 mL酶液在40℃、pH10.5條件下反應1 min水解酪蛋白產生1 μg酪氨酸所需要的酶量。
2 結果
2.1 地衣芽孢桿菌啟動子篩選
對地衣芽孢桿菌11965進行發酵培養,分別取24 h,32 h,40 h,48 h的發酵上清液,使用12% 的蛋白分離膠檢測,如圖1所示,分子量大小為60 kD左右的胞外蛋白表達量最高。切取48 h該酶的蛋白電泳條帶進行蛋白質譜檢測,如圖2為對該蛋白多肽鏈打斷后不同出峰時間的元素豐度。對各出峰時間肽鏈進行蛋白質二級質譜,結果如表2,通過NCBI數據庫進行比對,初步確定該酶為地衣芽孢桿菌幾丁質酶(Chitinase)。
2.2 重組表達載體的構建
含有不同啟動子和報告基因的重組表達載體構建過程見圖3。通過PCR擴增及DNA切膠回收,成功獲得5條基因片段,分別為399 bp的pChidBli0338,314 bp的pShuttle-09-dBli0338,248 bp的pyxiE-dBli0338,1 062 bp的克勞氏堿性蛋白酶基因alk成熟肽和1 053 bp的地衣堿性蛋白酶基因apr成熟肽,以及通過Sac II-XhoI雙酶切并切膠回收獲得的3 729 bp的pUBA110載體片段(圖4),大小均與預期相符。重組載體連接產物轉化進入WB600感受態,通過Kan抗性平板篩選,分別挑取轉化子提取質粒DNA進行驗證并由北京華大基因科技有限公司測序,測序分析與實驗結果完全一致,證明報告基因和啟動子-信號肽片段成功克隆到載體pUBA110上,重組表達載體pCalk110、pCapr110、pSalk110、pSapr110、pYalk110和pYapr110及所對應的重組菌C1、C2、S1、S2、Y1和Y2構建成功。
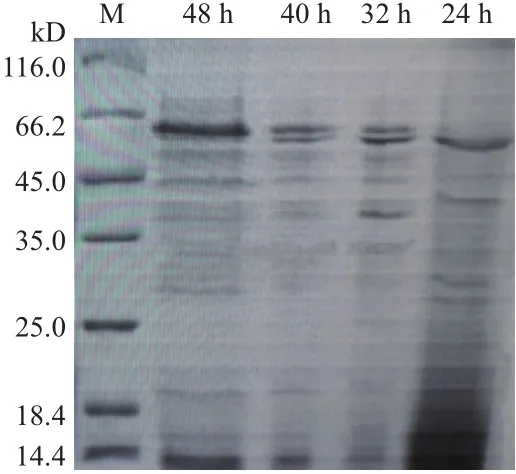
圖1 地衣芽孢桿菌11965發酵上清蛋白電泳
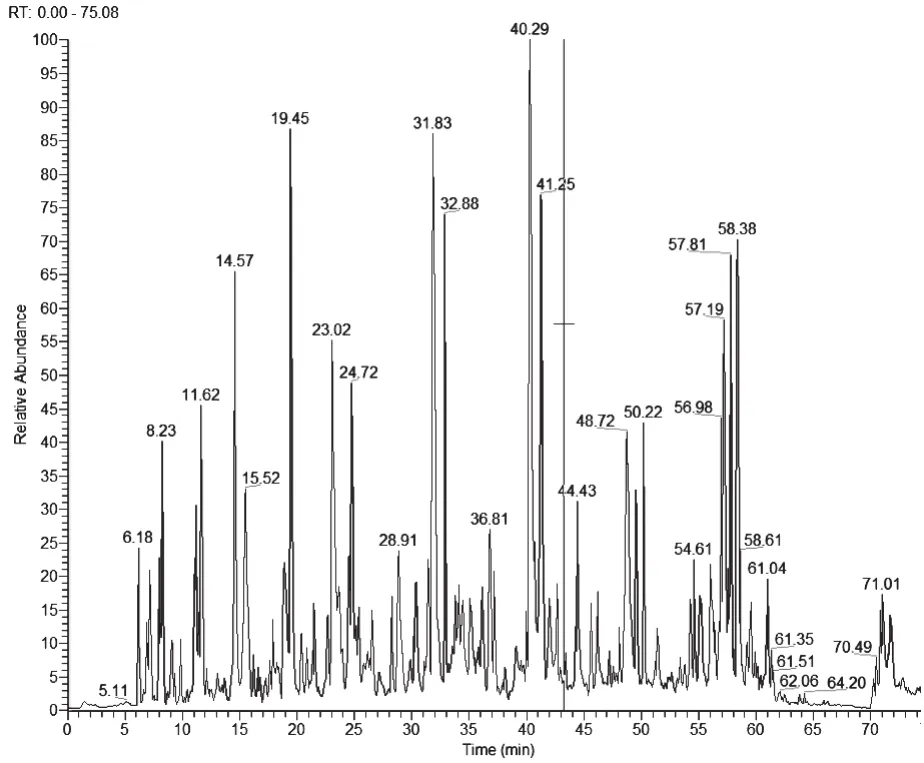
圖2 斷裂的目的蛋白不同出峰時間的元素豐度

表2 目的蛋白各肽段的總二級質譜結果
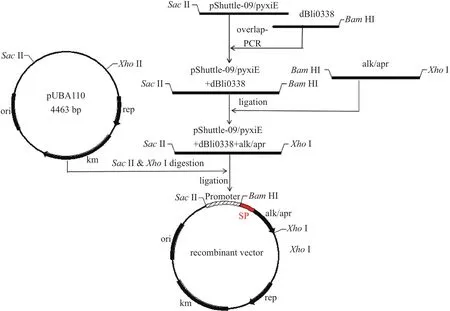
圖3 含有不同啟動子和報告基因的重組表達載體的構建
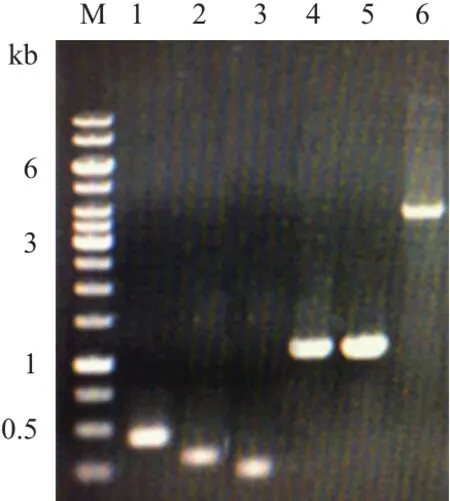
圖4 重組載體各片段的PCR擴增及pUBA110的酶切回收
2.3 發酵上清液的SDS-PAGE檢測
分別取C1、S1、Y1、C2、S2和Y2六株菌48 h的發酵上清液通過1.5 mL,10 K的超濾柱濃縮后進行蛋白電泳檢測。SDS-PAGE結果(圖5)顯示,6株菌均有一條清晰的條帶,且與目標蛋白分子量大小38.8 kD和31.3 kD相一致,表明在3種啟動子的調控下,兩種堿性蛋白酶報告基因均成功表達。
2.4 不同啟動子對兩種堿性蛋白酶基因表達強度的影響
測定不同時間發酵上清液中堿性蛋白酶的酶活,每組實驗作3個平行,通過SPSS(Statistical Product and Service Solutions)軟件對實驗結果進行統計學分析并檢測其顯著性,實驗結果由x-±s表示。如圖6,發酵培養48 h時,各重組菌發酵上清液中堿性蛋白酶活性達到最高。篩選得到的啟動子pChi對兩種報告基因的啟動強度明顯高于另外兩個啟動子,發酵48 h時,pChi、pShuttle-09、pyxiE表達克勞氏堿性蛋白酶的活性分別為(8027.55±230.84)U/mL、(7124.62±295.48)U/mL、(5268.28±196.49)U/mL(P= 5.49×10-4< 0.01),表達地衣堿性蛋白酶的活性分別為(3545.42±146.97)U/mL、(2638.91±106.72)U/mL、(1472.78±89.65)U/mL(P= 6.74×10-6< 0.01)。結果表明,pChi的啟動強度是pShuttle-09的1.25倍,pyxiE的2倍,該結果與蛋白電泳初步檢測的結果相一致。
2.5 啟動子pChi結構預測與分析
通過在線分析軟件BPROM對篩選所獲得啟動子pChi進行結構預測和分析,結果如圖7。pChi具有原核啟動子典型的保守序列-35區(TTGTCT)和-10區(TATTAG),被σA因子識別,間隔為16 bp。轉錄起始位點(+1)與-10區之間的間隔為6 bp,核糖體結合位點(SD,AGGAGA)距離幾丁質酶基因的起始密碼子(GTG)8 bp。
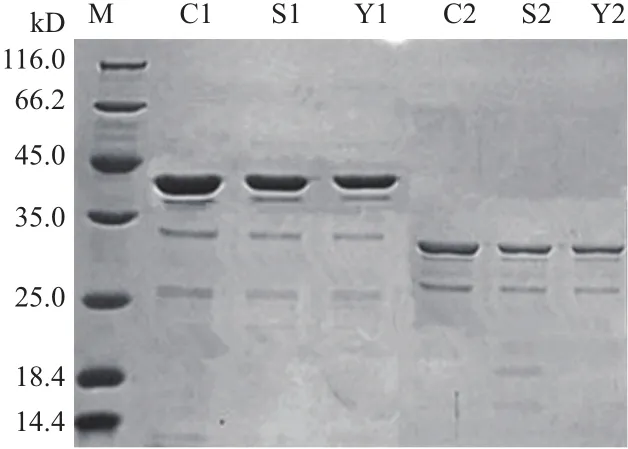
圖5 重組菌的蛋白電泳檢測
3 討論
Yang等[18]利用啟動子誘捕技術由地衣芽孢桿菌中篩選的啟動子pShuttle-09表達強度達到P43的8倍,pShuttle-09為雜合啟動子,含有兩對典型的保守序列,均被σA因子識別,分別為相距18 bp的-35區(TTGACG)和-10區(TATTAT),相距19 bp的-35區(CTGAAA)和-10區(TATAAT)。SD(GAGAGG)距離基因luxS的起始密碼子(ATG)4 bp。Zhang等[19]由枯草芽孢桿菌篩選獲得的啟動子pyxiE表達強度也高于P43,pyxiE含有間隔為20 bp的-35區(TTGACA)和-10區(AATAAA),轉錄起始位點(+1)與-10區間隔為7 bp,典型的SD序列(AGGCGG)距離基因yxiE的起始密碼子(ATG)7 bp。
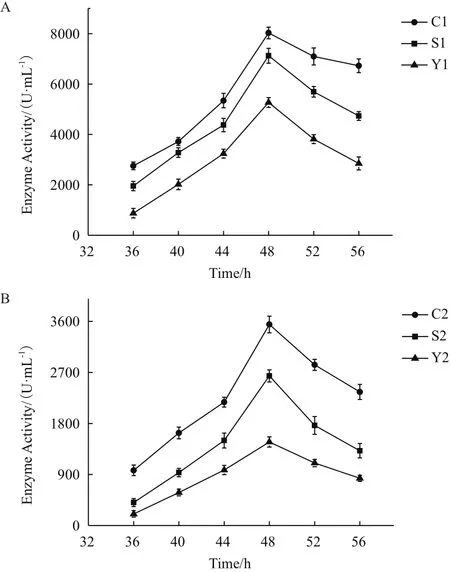
圖6 六株重組菌的產酶曲線

圖7 啟動子pChi結構分析
啟動子的啟動強度主要取決于啟動子的結構,一般來說,兩保守區序列-35區和-10區間隔為17 bp或18 bp時啟動活性最強,而RBS結合位點與起始密碼子之間的距離也是決定啟動子強度的關鍵因 素,通 常 為 10 bp[20]。pChi、pShuttle-09、pyxiE三個啟動子的保守序列均被σA因子識別,pChi和pShuttle-09兩保守區之間間隔為16 bp和18 bp,但pyxiE為20 bp,這可能是造成pyxiE的啟動活性遠低于其它兩種啟動子的主要原因。而pChi和pShuttle-09中SD與起始密碼子分別相距8 bp、4 bp,這可能是pChi表達活性高于pShuttle-09的原因之一。
4 結論
由地衣芽孢桿菌基因組中篩選獲得一種新型組成型啟動子,以克勞氏芽孢桿菌堿性蛋白酶和地衣芽孢桿菌堿性蛋白酶基因為報告基因,對其表達活性進行研究。結果顯示,啟動子pChi的表達強度是pShuttle-09的1.25倍,pyxiE的2倍,從而為介導枯草芽孢桿菌表達系統中異源基因的高效表達奠定基礎。另一方面,構建了堿性蛋白酶高效表達工程菌,實現了堿性蛋白酶的高效分泌表達,推動堿性蛋白酶的基因工程改造進程以及工業化生產。
[1] Sharma KM, Kumar R, Panwar S, et al. Microbial alkaline proteases:Optimization of production parameters and their properties[J]. Journal of Genetic Engineering and Biotechnology,2017, 15(1):115-126.
[2] Rani K, Rana R, Datt S. Review on latest overview of protease[J].International Journal of Current Life Sciences, 2012, 2(1):12-18.
[3] Raval VH, Pillai S, Rawal CM, et al. Biochemical and structural characterization of a detergent-stable serine alkaline protease from seawater haloalkaliphilic bacteria[J]. Process Biochemistry,2014, 49(6):955-962.
[4] Amit G, Babu J, Abin M, et al. Biosynthesis and properties of an extracellular thermostable serine alkaline protease from Virgibacillus pantothenticus[J]. World Journal of Microbiology and Biotechnology, 2008, 24(2):237-243.
[5] Jose D, Manjusha K, Jose S, et al. Purification and characterization of highly active LasB protease from Pseudomonas aeruginosa MCCB 123[J]. Indian Journal of Experimental Biology, 2017, 55(5):303-310.
[6] 鄧菊云. 微生物堿性蛋白酶研究進展[J]. 現代食品科技,2008, 24(3):293-296.
[7] Sharma KM, Kumar R, Vats S, et al. Production, partial purification and characterization of alkaline protease from Bacillus aryabhattai K3[J]. Chinese Journal of Applied and Environmental Biology,2014, 38(2):290-298.
[8] Jaouadi B, Ellouz-Chaabouni S, Rhimi M, et al. Biochemical and molecular characterization of a detergent-stable alkaline protease from Bacillus pumilus CBS with high catalytic efficiency[J].Biochimie, 2008, 90(9):1291-1305.
[9] Abidi F, Limam F, Marzouki MN. Purification and characterization of an alkaline protease prot1 from Botrysis cinerea[J]. Applied Biochemistry and Biotechnology, 2007, 141(2-3):361-376.
[10] Suseela L, Anjali CH, Muralidhar P. Enhanced production of alkaline protease by Aspergillus niger DEF 1 isolated from dairy form effluent and determination of its fibrinolytic ability[J].African Journal of Microbiology Research, 2017, 11(11):440-449.
[11] Liu L, Liu YF, Shin HD, et al. Developing Bacillus spp. as a cell factory for production of microbial enzymes and industrially important biochemicals in the context of systems and synthetic biology[J]. Applied Microbiology and Biotechnology, 2013, 97(14):6113-6127.
[12] Dong HN, Zhang DW. Current development in genetic engineering strategies of Bacillus species[J]. Microbial Cell Factories, 2014,13(1):63-73.
[13] Goosens VJ, Otto A, Glasner C, et al. Novel twin-arginine translocation pathway-dependent phenotypes of Bacillus subtilis unveiled by quantitative proteomics[J]. Journal of Proteome Research, 2012, 12(2):796-807.
[14] 余小霞, 田健, 劉曉青, 等. 枯草芽孢桿菌表達系統及其啟動子研究進展[J]. 生物技術通報, 2015, 31(2):35-44.
[15] Phan TT, Nguyen HD, Schumann W. Development of a strong intracellular expression system for Bacillus subtilis by optimizing promoter elements[J]. Journal of Biotechnology, 2012, 157(1):167-172.
[16] Degering C, Eggert T, Puls M, et al. Optimization of protease secretion in Bacillus subtilis and Bacillus licheniformis by screening of homologous and heterologous signal peptides[J]. Applied and Environmental Microbiology, 2010, 76(19):6370-6376.
[17] 中華人民共和國國家質量監督檢驗檢疫總局, 中國國家標準化管理委員會. GB/T 23527-2009 蛋白酶制劑[S]. 北京:中國標準出版社, 2009.
[18] Yang MM, Zhang WW, Ji SY, et al. Generation of an artificial double promoter for protein expression in Bacillus subtilis through a promoter trap system[J]. PLoS One, 2013, 8(2):e56321.
[19] Zhang AL, Liu H, Yang MM, et al. Assay and characterization of a strong promoter element from B. subtilis[J]. Biochemical and Biophysical Research Communications, 2007, 354(1):90-95.
[20] Song YF, Nikoloff JM, Zhang DW. Improving protein production on the level of regulation of both expression and secretion pathways in Bacillus subtilis[J]. Journal of Microbiology and Biotechnology,2015, 25(7):963-977.

