四種炎癥標志物對HBV相關原發性肝癌術后預后的預測價值
崔 晗,朱藝偉,游 杰,姚明解,薄亞聰,張 玲,趙二江,崔玲玲,呂全軍
1)鄭州大學公共衛生學院營養與食品衛生學教研室 鄭州450001 2)北京大學基礎醫學院病原生物學系 北京100191 3)鄭州大學附屬腫瘤醫院肝膽外科 鄭州 450003 4)鄭州大學附屬腫瘤醫院病案室 鄭州 450003
肝癌是世界上第二大癌癥死亡原因,占癌癥死亡人數的9.1%;2012年中國肝癌發病人數為39.4萬,占全世界的50%,死亡人數為38.3萬[1]。HBV感染是肝癌的重要危險因素,據估計我國慢性乙肝患者有2 000萬例[2]。肝癌預后非常差,總死亡率與發病率之比為0.95[1]。有效的預后生物標志物有助于預測治療效果。炎癥在癌癥的發生發展及預后中起著重要作用[3]。中性粒細胞與淋巴細胞比值(NLR)、血小板與淋巴細胞比值(PLR)、單核細胞與淋巴細胞比值(MLR)、預后營養指數(PNI)等作為炎癥標志物,在癌癥中的作用已有諸多研究[4-7]。以往的肝癌研究僅對一到兩個炎癥標志物進行分析,且結論并不一致[8-10]。本研究對331例HBV相關肝癌患者的臨床及隨訪資料進行分析,探討術前NLR、PLR、MLR和PNI預測HBV相關肝癌術后預后的價值。
1 對象與方法
1.1研究對象回顧性分析2006年4月至2013年7月于鄭州大學附屬腫瘤醫院接受根治性切除術的HBV相關原發性肝癌患者的臨床病理資料。納入標準:慢性乙型肝炎患者;術后病理證實為原發性肝癌;術前未經其他抗癌治療;術前無全身感染;未合并其他惡性腫瘤;手術方式為根治性肝癌切除術。收集的指標包括年齡,性別,肝內播散、肝硬化、門靜脈癌栓,包膜狀況,腫瘤直徑、腫瘤數目,術前AFP水平,術前3 d的中性粒細胞、淋巴細胞、血小板及白蛋白水平。共有331例患者納入本研究。NLR=中性粒細胞計數/淋巴細胞計數,PLR=血小板計數/淋巴細胞計數,MLR=單核細胞計數/淋巴細胞計數,PNI=血清白蛋白值+5×淋巴細胞計數。
1.2隨訪采用門診復查及電話隨訪的方式。患者出院后3個月進行第一次隨訪,出院1 a內每3個月隨訪一次,出院后2~3 a每半年隨訪一次,此后每年隨訪一次。生存時間為自手術當日至死亡日期或終止觀察日期。隨訪截止時間為2015年7月16日。
1.3統計學處理采用SPSS 21.0處理數據。Kaplan-Meier法繪制生存曲線并進行log-rank檢驗,多因素分析采用Cox回歸。檢驗水準α=0.05。
2 結果
2.1患者的一般臨床資料本研究共納入331例HBV相關原發性肝癌患者。患者中位年齡51(18~76)歲,中位生存時間為2.66 a。1、3、5 a生存率分別為69%、47%、30%。其中男性280例,女性51例;肝硬化患者313例,伴門靜脈癌栓72例,包膜不完整58例。331例患者中,299例獲得隨訪,隨訪率90.3%。
2.2NLR、PLR、MLR及PNI的界值NLR、PLR、MLR的中位數分別為2.41(1.63~3.52)、106.80(73.66~151.74)、0.24(0.18~0.28)。NLR、PLR、MLR取中位數為界值,PNI界值參照文獻[11-12]取45。根據界值,將患者分為高低兩組。
2.3影響肝癌患者生存的單因素分析門靜脈癌栓、腫瘤直徑、腫瘤數目、包膜狀況、術前血清甲胎蛋白(AFP)、血清谷草轉氨酶(AST)、血清谷氨酰轉肽酶(GGT)水平、肝內播散、Child分級、NLR、PLR、MLR、PNI是影響患者生存的因素(表1)。
ALT:谷丙轉氨酶
2.4影響肝癌患者生存的Cox分析將單因素分析有意義的變量納入Cox回歸,變量賦值見表2。經檢驗,門靜脈癌栓、術前AFP、AST水平、肝內播散、NLR、PNI是影響患者生存的獨立因素(表3)。高NLR組和低NLR組1、3、5 a的累積生存率分別為58%、33%、23%和79%、61%、38%。高PNI組和低PNI組1、3、5 a的累積生存率分別為76%、56%、37%和48%、26%、15%。

表2 變量賦值表
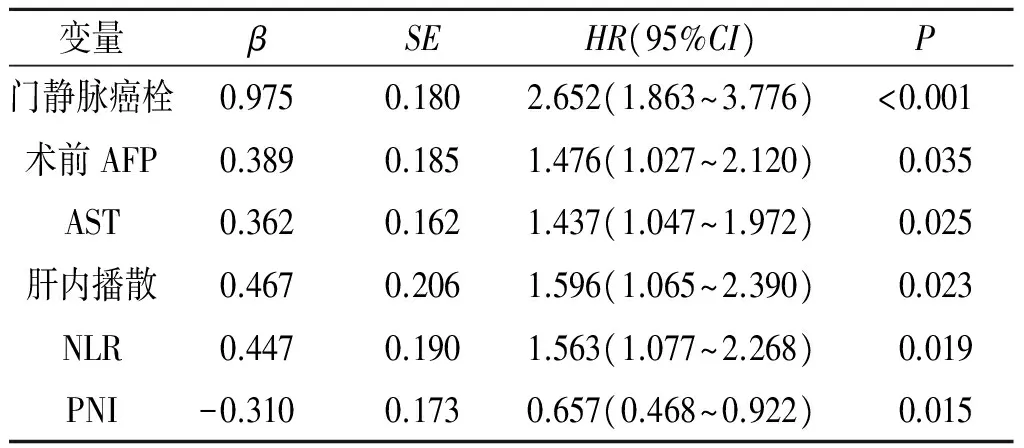
表3 影響肝癌患者生存的Cox分析
3 討論
炎癥與腫瘤的發生發展密切相關,它們之間的關系是雙向的。活化的炎癥細胞充當活性氧(ROS)和活性氮介質(RNI)的來源,導致DNA損傷和基因組不穩定。而DNA損傷可導致炎癥反應,促進腫瘤的發生發展[3,13]。目前對肝癌中炎癥標志物的研究多僅針對一到兩種,且結論并不一致。本研究同時對4種炎癥標志物進行分析,以研究其對HBV相關原發性肝癌術后預后的預測價值。單因素分析的結果發現,4種炎癥標志物均與患者的預后有關;多因素分析發現術前NLR是影響原發性肝癌根治術后預后的獨立危險因素,HR(95%CI)為1.563(1.077~2.268);PNI升高是保護因素,HR(95%CI)為0.657(0.468~0.922),與以往研究[12,14]一致。有研究[15-16]發現術前PLR和MLR是肝癌患者生存的獨立影響因素,低PLR組患者術后預后較好,低MLR組患者的總生存時間長于高MLR組。然而本研究的多因素分析并未發現PLR和MLR與患者預后有關聯。
慢性HBV感染是導致肝癌的重要因素,其導致的炎癥狀態是導致肝癌的原因之一[17]。術前高NLR和低PNI的患者預后較差,可能機制如下:①升高的中性粒細胞會釋放大量的ROS,ROS可導致錯配修復酶的直接氧化失活,導致DNA損傷和遺傳不穩定性,為腫瘤的侵襲和轉移提供有利的微環境[4,18]。②中性粒細胞能分泌細胞因子如IL-1、腫瘤壞死因子和血管內皮生長因子,促進腫瘤血管形成、進展和轉移[6]。③T細胞在機體的抗腫瘤免疫過程中起著重要的作用,包括直接的細胞毒性作用和抑制癌細胞增殖及轉移。T細胞數目的增多特別是活化的CTLs和Th細胞與癌癥較好的預后有關。調節性T細胞通過抑制促腫瘤的炎癥反應發揮抗腫瘤作用。相對的,T細胞的缺乏或特異性細胞毒性機制的中斷使癌癥更易發生[3]。而中性粒細胞可以通過產生一氧化氮、精氨酸酶和ROS來抑制T細胞的活化[19]。④白蛋白由肝臟合成,是反映機體營養狀況的重要指標,腫瘤患者多伴有營養不良。白蛋白水平的下降與患者較差的預后有關[20-21]。
綜上所述,術前高NLR狀態是HBV相關原發性肝癌術后預后的獨立危險因素,而術前高PNI狀態是保護因素。外周血檢查方便、可重復性好且廉價,炎癥指標簡便易得,可以作為常用預后指標的補充。但由于樣本代表的局限性,尚需大樣本量多中心的前瞻性研究加以驗證。
[1] World Health Organization.International Agency for Research on Cancer.GLOBOCAN 2012:Estimated Cancer Incidence,Mortality and Prevalence Worldwide in 2012[EB/OL][2017-12-04]. http://globocan.iarc.fr/Pages/fact_sheets_population.aspx.
[2] 陳丹丹,劉媛,姬旭慧,等.原發性肝癌發病影響因素的病例對照研究[J].鄭州大學學報(醫學版),2013,48(2):249
[3] GRIVENNIKOV SI,GRETEN FR,KARIN M.Immunity, inflammation,and cancer[J].Cell,2010,140(6):883
[4] HU H,YAO X,XIE X,et al.Prognostic value of preoperative NLR, dNLR, PLR and CRP in surgical renal cell carcinoma patients[J].World J Urol,2017,35(2):261
[5] YING HQ,DENG QW,HE BS,et al.The prognostic value of preoperative NLR, d-NLR, PLR and LMR for predicting clinical outcome in surgical colorectal cancer patients[J].Med Oncol,2014,31(12):305
[6] DENG Q,HE B,LIU X,et al.Prognostic value of pre-operative inflammatory response biomarkers in gastric cancer patients and the construction of a predictive model[J].J Transl Med,2015,13:66
[7] LIAO R,TANG ZW,LI DW,et al.Preoperative neutrophil-to-lymphocyte ratio predicts recurrence of patients with single-nodule small hepatocellular carcinoma following curative resection: a retrospective report[J].World J Surg Oncol,2015,13:265
[8] TIAN XC, LIU XL, ZENG FR, et al. Platelet-to-lymphocyte ratio acts as an independent risk factor for patients with hepatitis B virus-related hepatocellular carcinoma who received transarterial chemoembolization[J]. Eur Rev Med Pharmacol Sci,2016,20(11):2302
[9] WANG Y, ATTAR BM, FUENTES HE, et al. Evaluation of the prognostic value of platelet to lymphocyte ratio in patients with hepatocellular carcinoma[J]. J Gastrointest Oncol,2017,8(6):1065
[10]CHAN AW, CHAN SL, WONG GL, et al. Prognostic nutritional index (PNI) predicts tumor recurrence of very early/early stage hepatocellular carcinoma after surgical resection[J]. Ann Surg Oncol,2015,22(13):4138
[11]鄧巖,王志鑫,苗潤晨,等.預后營養指數在原發性肝癌肝切除患者預后評估中的價值[J].現代腫瘤醫學,2016,24(13):2107
[12]PINATO DJ,NORTH BV,SHARMA R.A novel, externally validated inflammation-based prognostic algorithm in hepatocellular carcinoma: the prognostic nutritional index (PNI)[J].Br J Cancer,2012,106(8):1439
[13]ELINAV E, NOWARSKI R, THAISS CA, et al. Inflammation-induced cancer: crosstalk between tumours, immune cells and microorganisms[J]. Nat Rev Cancer,2013,13(11):759
[14]LIMAYE AR,CLARK V,SOLDEVILA-PICO C,et al.Neutrophil-lymphocyte ratio predicts overall and recurrence-free survival after liver transplantation for hepatocellular carcinoma[J].Hepatol Res,2013,43(7):757
[15]蘇子劍,翟軍偉,潘群雄,等.術前血小板/淋巴細胞比值與肝癌預后的關系[J].中國普通外科雜志,2016,25(1):12
[16]唐濤,廖銳,李靜,等.肝細胞癌患者根治性切除術后的預后因素分析[J].中華外科雜志,2016,54(6):439
[17]李天翔,吳力群,蔣曉,等.中性粒細胞與淋巴細胞比值在預測HBV相關肝細胞癌術后患者預后中的價值[J].中華肝臟外科手術學電子雜志,2014,3(1):12
[18]COLOTTA F, ALLAVENA P, SICA A, et al. Cancer-related inflammation, the seventh hallmark of cancer: links to genetic instability[J]. Carcinogenesis,2009,30(7):1073
[19]HE W,WEI M,YANG X,et al.Do inflammatory markers predict prognosis in patients with synchronous colorectal cancer?[J].Medicine(Baltimore),2017,96(17):e6607
[20]薄亞聰,姚明解,張玲,等.術前血液生化指標與原發性肝細胞癌預后的關系[J].鄭州大學學報(醫學版),2015,50(5):662
[21]朱迎,董健,王萬里,等.青年原發性肝癌的臨床病理特征及肝切除術后的生存分析[J].西安交通大學學報(醫學版),2014,35(3):419