AFP在早期肝癌診斷中的臨床價值研究*
侯玉麗,姜菲菲,王穎,婁金麗,張永宏,李寧,趙艷
(首都醫科大學附屬北京佑安醫院,北京 100069)
原發性肝癌(hepatocelluar carcinoma,HCC)是全球常見惡性腫瘤,>90%的HCC為肝細胞肝癌,HCC的早期診斷是其防治關鍵[1-4]。甲胎蛋白(alphafetal protein,AFP)是臨床常用的原發肝癌血清診斷標志物之一,但既往的臨床觀察及研究均基于肝癌發病的整體,忽略了肝癌的不同臨床分期中AFP水平差異,因此,AFP對肝癌整體診斷敏感度不高,難以滿足肝癌早期診斷的需求,容易造成漏診[5]。本研究通過比較AFP在肝病不同進展階段的血清水平,利用受試者工作特征曲線(receiver operating characteristic curve,ROC)確定對早期肝癌診斷的臨界值,探討AFP在早期肝癌診斷中的臨床價值。
1 資料與方法
1.1 一般資料
選取2015年1月-2016年6月于本院就診的71例肝硬化患者作為肝硬化組。其中,男性51例,女性20例;年齡32~83歲,平均(53.4±11.1)歲;均為乙肝病毒感染者。所有患者均符合2005年中華醫學會肝病學分會、中華醫學會感染病學分會聯合修訂的《慢性乙型肝炎防治指南》肝硬化診斷標準。同期選取本院就診的71例肝癌患者作為肝癌組,均與乙型肝炎病毒相關,根據巴塞羅那(barcelona clinic liver cancer,BCLC)標準進行分級[6]。將BCLC 0級和BCLC A級納入早期肝癌,BCLC B級、C級及D級納入中晚期肝癌。其中早期肝癌患者46例(早期肝癌組),男性33例,女性13例;年齡38~76歲,平均(53±9.7)歲。中晚期肝癌患者25例(中晚期肝癌組),男性20例,女性5例;年齡40~76歲,平均(55.17±9)歲。所有患者均經影像學B超、CT、MRI、肝穿及手術病理檢查證實,均符合衛生部組織專家指定的《原發性肝癌診療規范(2011年版)》。
1.2 試劑與儀器
AFP、生化指標檢測等配套試劑盒(美國雅培公司)、e601全自動電化學發光免疫分析儀器(瑞士羅氏公司)、全自動生物化學分析儀(美國雅培公司)、7500 QT-PCR儀器(美國ABI公司)及1-15P離心機(德國Sigma公司)。
1.3 方法
1.3.1 標本采集抽取待檢者清晨空腹靜脈血液2 ml,室溫放置1 h,500 r/min離心10min,血清用于AFP和一系列生化指標的檢測。
1.3.2 腫瘤標記物檢測方法采用e 601全自動電化學發光免疫分析儀檢測AFP、ɑ-L巖藻糖苷酶(alpha-l-fucosidase,AFU)、 糖 類 癌 抗 原 199(carbohydrate antigen 19-9,CA199)、 癌 胚 抗 原(carcinoembryonicantigen,CEA)及癌抗原153(cancer antigen 15-3,CA153)腫瘤標記物。
1.3.3 肝功能檢測方法應用全自動生物化學分析儀檢測丙氨酸氨基轉移酶(alanine aminotransferase,ALT)、天冬氨酸氨基轉移酶(aspartate Aminotransferase,AST)、總膽紅素(total bilirubin,Tbil)、直接膽紅素(direct bilirubin,Dbil)、血清總蛋白(total protein,TP)、血清白蛋白(Albumin,ALB)、γ-谷氨酰轉肽酶(γ-glutamyl transpeptidase,GGT)、堿性磷酸酶(alkaline phosphatase,ALP)及總膽固醇(Cholesterol,CHO)等指標。
1.3.4 乙肝病毒病毒載量檢測采用7500 QT-PCR儀器進行乙肝病毒DNA定量檢測。
1.4 統計學分析
數據分析采用SPSS 20.0統計軟件,計量資料以均數±標準差(±s)表示,采用秩和檢驗(H檢驗);計數資料以率表示,采用χ2檢驗;相關分析用Pearson法;利用ROC曲線確定診斷早期肝癌的臨界值。P<0.05為差異有統計學意義。
2 結果
2.1 肝硬化組及肝癌不同分期組患者的臨床資料比較
BCLC A級患者46例,占64.8%;BCLC B級患者15例,占21.1%;BCLC C級患者2例,占2.8%;BCLC D級患者8例,占11.3%。將肝硬化組及肝癌不同分期組患者的男性比例、年齡、ALT及logDNA比較,差異無統計學意義(P>0.05),中晚期肝癌組患者AST、Tbil、Dbil、ALB、ALP及CHO與早期肝癌組和肝硬化組患者比較,差異有統計學意義(P<0.05)。見表1。
2.2 肝硬化組及肝癌不同臨床分期組腫瘤標記物水平比較
3組患者logAFP、logCA199比較,差異有統計學意義(P<0.05)。早期肝癌組與中晚期肝癌組患者logAFP水平比較,差異有統計學意義(t=-3.133,P=0.003),中晚期肝癌組AFP水平高于早期肝癌組,提示AFP水平與腫瘤分期相關。見表2。
2.3 AFP檢測水平與腫瘤體積相關性分析
AFP檢測水平與腫瘤體積呈正相關(r=0.440,P=0.006),AFP水平隨著腫瘤體積的增大而提高。見圖1。
2.4 AFP的ROC曲線分析
采用ROC曲線對AFP的檢測結果進行分析,ROC曲線下的面積是0.824,95%置信區間=(0.749,0.898)。ROC曲線下面積>0.8,說明血清AFP水平對肝癌的診斷有一定的準確性,診斷價值較高。當敏感度+特異度最大時,最佳切割值為15.315 ng/ml,靈敏性為80.4%,95%置信區間(0.661,0.906);特異性為69%,95%置信區間(0.569,0.795)。當前AFP診斷水準20 ng/ml時,早期肝癌診斷的靈敏性為69.6%,95%置信區間(0.543,0.823);特異性為78.9%,95%置信區間(0.676,0.877)。見圖2。

表1 肝硬化組及肝癌不同分期組的臨床資料比較
表2 肝硬化組及肝癌不同分期組腫瘤標記物水平比較 (±s)
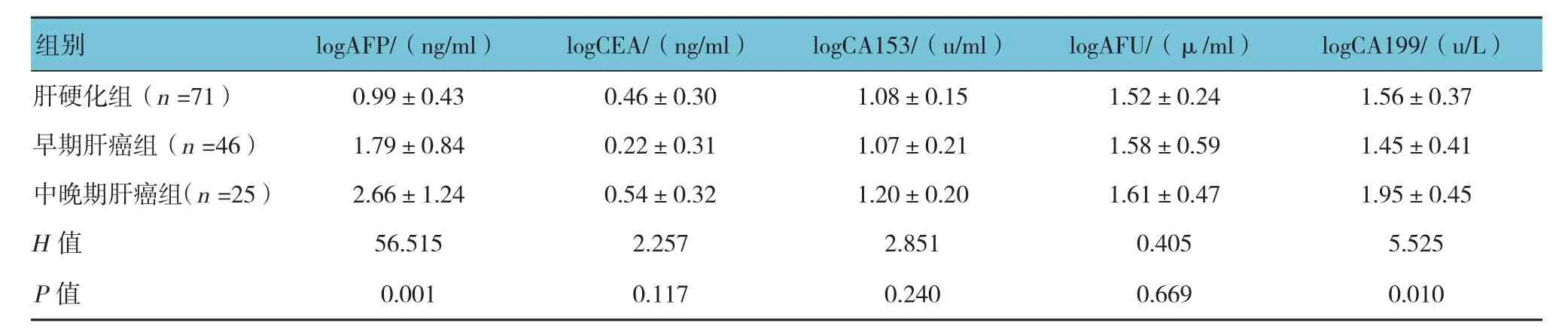
表2 肝硬化組及肝癌不同分期組腫瘤標記物水平比較 (±s)
肝硬化組(n =71) 0.99±0.43 0.46±0.30 1.08±0.15 1.52±0.24 1.56±0.37早期肝癌組(n =46) 1.79±0.84 0.22±0.31 1.07±0.21 1.58±0.59 1.45±0.41中晚期肝癌組(n =25) 2.66±1.24 0.54±0.32 1.20±0.20 1.61±0.47 1.95±0.45 H值 56.515 2.257 2.851 0.405 5.525
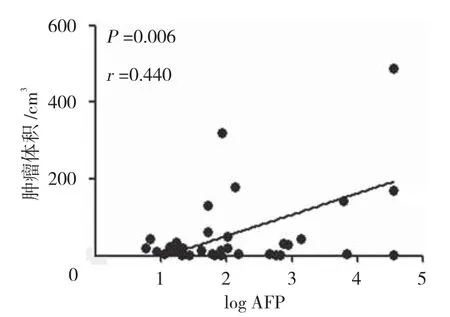
圖1 logAFP水平與腫瘤體積的相關性

圖2 AFP對早期肝癌診斷的ROC曲線
3 討論
AFP在胎兒發育過程中表達,并且,在出生后的300 d內,逐漸降低到<10 ng/ml[7]。1963年,ABELEV在患有肝癌的小鼠血清中首次檢測到AFP,隨后由TATARINOV和STANISLAWSKI-BIRENEWAJG等對AFP在人類肝癌中的診斷進行研究[8]。長期以來,AFP是應用最廣泛的診斷肝癌的血清標記物,雖然目前歐洲肝臟研究協會和美國肝病研究協會不再推薦測定AFP水平來診斷肝癌,并且對于AFP的診斷靈敏性存在一定的質疑,但是,大量的研究表明,AFP水平的測定對于我國肝癌的診斷還是很有價值的[9]。AFP目前的診斷標準為>20 ng/ml,其敏感度為40%~65%,特異度為76%~96%,靈敏度較低,不能對早期肝癌進行及時的診斷和預測[10]。本文旨在進一步認識AFP與肝癌的關系以提高AFP在早期肝癌診斷中的價值,更好的對肝癌進行早期干預和治療。
本研究中發現,HCC患者血清AFP水平高于肝硬化患者,并且中晚期肝癌患者的AFP水平高于早期肝癌患者,因此,AFP水平升高對HCC的診斷具有重要價值,并且與肝癌的分期相關。對不同大小腫瘤HCC患者血清AFP水平進行分析顯示,AFP水平的高低與腫瘤大小相關,AFP水平可以在一定程度上反映腫瘤的大小,這一結論與既往一些報道結果一致[11-12]。
常規監測篩查早期肝癌的指標目前主要包括AFP和肝臟超聲檢查,其中血清AFP的檢測簡單易行,便于篩查,因此,探討AFP對早期肝癌的診斷價值具有重要的臨床意義。本研究中對早期肝癌組患者血清AFP水平進行ROC曲線繪制,ROC曲線下面積>0.8,說明血清AFP對早期肝癌的診斷有一定準確性,診斷價值較高。對于早期肝癌診斷的最佳血清AFP值,各個研究者都各有所見,AHN等[13]的研究中認為AFP水平17.4 ng/ml為診斷早期肝癌的最佳臨界值。MARRERO和ZHANG等[14-15]的研究中認為AFP水平10.9 ng/ml為診斷早期肝癌的最佳臨界值,并且其靈敏度是優于DCP和AFP-L3%對于早期肝癌的診斷。筆者的研究通過ROC曲線等統計學分析得到的最佳臨界值為15.3 ng/ml,更加符合中國人的診斷標準,而國內外研究結果均<20 ng/ml,意味著臨床上如果以血清AFP 20 ng/ml作為診斷肝癌的臨界值,那么用于肝癌的篩查將會出現較多的漏診,因此推薦使用15.3 ng/ml用于早期肝癌的篩查。
總之,目前AFP的診斷水平不能靈敏的對早期肝癌進行診斷,建議以15.3 ng/ml進行診斷,但是,AFP不能作為肝癌診斷的唯一血清學指標。隨著基因技術、蛋白質組學的飛速發展,一些新的腫瘤標記物相繼出現并進入研究中,例如GP73、GPC3、miRNA等,它們的聯合應用可以提高診斷的靈敏度和特異度[16-19]。筆者會繼續研究AFP與其它腫瘤標記物聯合檢測對早期肝癌診斷的價值,為肝癌的早期診斷提供了一定的臨床價值。
[1]LAFARO K J, DEMIRJIAN A N, PAWLIK T M. Epidemiology of hepatocellular carcinoma[J]. Surgical Oncology Clinics of North America, 2015, 24(1): 1-17.
[2]MCGLYNN K A, TSAO L, HSING A W, et al. International trends and patterns of primary liver cancer[J]. Int J Cancer, 2001, 94(2):290-296.
[3]FORNER A, LLOVET J M, BRUIX J. Hepatocellular carcinoma[J].Lancet, 2012, 379(9822): 1245-1255.
[4]TSUCHIYA N, SAWADA Y, ENDO I, et al. Potentiality of immunotherapy against hepatocellular carcinoma[J]. World Journal of Gastroenterology, 2015, 21(36): 10314-10326.
[5]HUNG C H, HU T H, LU S N, et al. Circulating microRNAs as biomarkers for diagnosis of early hepatocellular carcinoma associated with hepatitis B virus[J]. Int J Cancer, 2016, 138(3):714-720.
[6]YEN Y H, CHANGCHIEN C S, WANG J H, et al. A modified TNM-based Japan Integrated Score combined with AFP level may serve as a better staging system for early-stage predominant hepatocellular carcinoma patients[J]. Digestive and Liver Disease,2009, 41(6): 431-441.
[7]ADRIANA T, ANNALISA A, MAURIZIO M, et al. Effect of preand post-treatment α-fetoprotein levels and tumor size on survival of patients with hepatocellular carcinoma treated by resection,transarterial chemoembolization or radiofrequency ablation: a retrospective study[J]. BMC Surg, 2014, 14: 40.
[8]CHAN S L, CHAN A T, YEO W. Role of alpha-fetoprotein in hepatocellular carcinoma: prognostication, treatment monitoring or both[J]. Future Oncol, 2009, 5(6): 889-899.
[9]YAO M, ZHAO J, LU F. Alpha-fetoprotein still is a valuable diagnostic and prognosis predicting biomarker in hepatitis B virus infection-related hepatocellular carcinoma[J]. Oncotarget, 2016,7(4): 3702-3708.
[10]楊穎, 木尼熱 馬合蘇提, 包永江, 等. GP73和AFP單項與聯合診斷原發性肝癌的價值[J]. 中華檢驗醫學雜志, 2012,35(11): 1034-1037.
[11]LIU C, XIAO G Q, YAN L N, et al. Value of α-fetoprotein in association with clinicopathological features of hepatocellular carcinoma[J]. World J Gastroenterol, 2013, 19(11): 1811-1819.
[12]TOYODA H, KUMADA T, TADA T, et al. Tumor markers for hepatocellular carcinoma: simple and significant predictors of outcome in patients with HCC[J]. Liver Cancer, 2015, 4(2): 126-136.
[13]AHN D G, KIM H J, KANG H, et al. Feasibility of α-fetoprotein as a diagnostic tool for hepatocellular carcinoma in Korea[J].Korean J Intern Med, 2016, 31(1): 46-53.
[14]MARRERO J A, FENG Z, WANG Y, et al. Alpha-fetoprotein, desgamma carboxyprothrombin, and lectin-bound alpha-fetoprotein in early hepatocellular carcinoma[J]. Gastroenterology, 2009,137(1): 110-118.
[15]ZHANG S Y, LIN B D, LI B R. Evaluation of the diagnostic value of alpha-l-fucosidase, alpha-fetoprotein and thymidine kinase 1 with ROC and logistic regression for hepatocellular carcinoma[J].FEBS Open Bio, 2015, 5: 240-244.
[16]LIN L, LU B, YU J, et al. Serum miR-224 as a biomarker for detection of hepatocellular carcinoma at early stage[J]. Clin Res Hepatol Gastroenterol, 2016, 40(4): 397-404.
[17]ZHANG Z, ZHANG Y, WANG Y, et al. Alpha-fetoprotein-L3 and Golgi protein 73 may serve as candidate biomarkers for diagnosing alpha-fetoprotein-negative hepatocellular carcinoma[J]. Onco Targets Ther, 2016, 9: 123-129.
[18] TSUCHIYA N, SAWADA Y, ENDO I, et al. Biomarkers for the early diagnosis of hepatocellular carcinoma[J]. World J Gastroenterol, 2015, 21(37): 10573-10583.
[19]SONG P P, XIA J F, INAGAKI Y, et al. Controversies regarding and perspectives on clinical utility of biomarkers in hepatocellular carcinoma[J]. World J Gastroenterol, 2016, 22(1): 262-274.

