益生性植物乳桿菌對切達干酪揮發性風味形成的影響
郝曉娜,張 健,楊亞威,余志堅,曹永強,楊貞耐,*
(1.北京食品營養與人類健康高精尖創新中心,北京工商大學,北京 100048;2.東君乳業(禹城)有限公司,山東 德州 253000)
1 材料與方法
1.1 材料與試劑
發酵劑:乳酸乳球菌Lactoccocus lactis XZ3303和Lactococcus lactis ssp. cremoris QH27-1由內蒙古農業大學提供,L. plantarum 1-2由本實驗室凍干保藏(活菌數11.0(lg(CFU/g)));商品凝乳酶:Stamix 1150NB德國科漢森股份有限公司;脫脂乳粉 新西蘭恒天然集團有限公司。
1.2 儀器與設備
705型-80 ℃超低溫冰箱 美國Thermo Electron公司;50 L干酪槽 上海浦麗盛三環食品設備工程有限公司;MLS-3750高壓蒸汽滅菌鍋 日本Sanyo公司;BCN-1360B超凈工作臺 北京東聯哈爾儀器制造有限公司;DVB-CAR-PDMS手動固相微萃取進樣器 美國Supelco公司;7890A-7000 氣相色譜-質譜聯用儀 美國Agilent公司;CP124S分析天平 德國Sartorius公司;HZQ-Q恒溫培養箱 上海一恒實驗設備有限公司;CT3質構儀 美國Brookfield公司。
1.3 方法
1.3.1 發酵菌株活化與接種
乳酸乳球菌XZ3303、QH27-1分別按體積分數3%接種于12 g/100 mL脫脂乳中,30 ℃培養6~8 h,活化3 代后用作干酪的生產發酵劑,接種量為1.5%(體積分數,下同)。
1.3.2 實驗分組及益生菌的添加
益生菌添加方式實驗分組如表1所示。益生菌干酪1和益生菌干酪2分別向100 mL巴氏殺菌乳中添加0.1、1 g L. plantarum 1-2凍干粉,至乳中益生菌L.plantarum 1-2活菌數分別為8.0(lg(CFU/mL))和9.0(lg(CFU/mL))。益生菌干酪3在排乳清后向100 g凝乳中拌入0.1 g的L. plantarum 1-2凍干粉,至凝乳中L. plantarum 1-2活菌數為8.0(lg(CFU/g))。
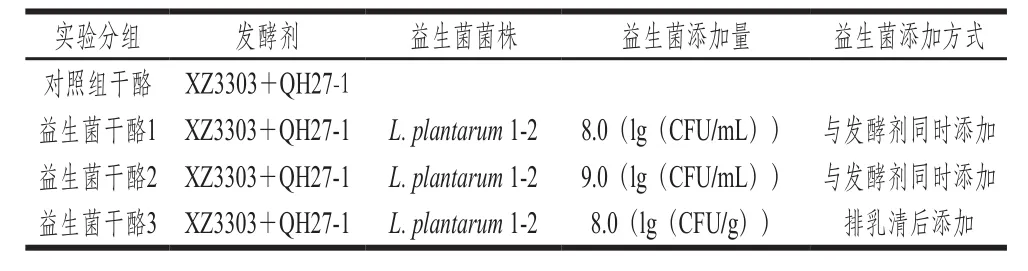
表1 干酪制作實驗分組Table1 Experimental groups of cheeses
1.3.3 干酪制作流程
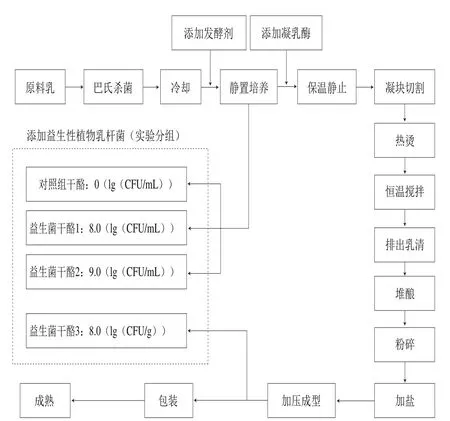
圖1 切達干酪制作流程圖Fig. 1 Schematic illustration of Cheddar cheese production
干酪制作過程如圖1所示。對照組干酪(未添加益生菌)的制作:鮮牛乳經65 ℃、30 min巴氏殺菌后,冷卻至31 ℃,添加發酵劑(添加量體積分數1.5%);31 ℃保溫發酵45 min,添加凝乳酶,靜置40 min待乳凝固,用干酪刀切割成約長8 mm的立方塊,緩慢攪拌以防止凝塊黏連,凝塊升溫至38 ℃(每5 min升高1 ℃),當pH值降到6.1~6.2時,排除乳清,并于38 ℃堆釀。pH值降至5.4~5.5時,揉碎凝塊,添加質量分數2%食鹽,然后裝入干酪模具壓榨。真空包裝,并于4 ℃條件下成熟0、4、8、12 周[9]。
益生菌干酪1、2的制作:按照上述對照組干酪的工藝流程,原料乳滅菌后添加發酵劑,同時按照圖1添加益生菌L. plantarum 1-2。益生菌干酪3的制作與對照組干酪的工藝流程相似,僅在向凝塊中添加食鹽后添加益生菌L.plantarum 1-2于凝塊中,混勻。
1.3.4 干酪的理化及微生物指標測定
1.3.4.1 干酪得率的測定
在干酪制作過程中,準確稱量并記錄原料乳、發酵劑、食鹽的用量以及干酪成品的產量,用于干酪得率計算。干酪得率是干酪加工過程中的重要參數之一,可反映工藝參數的經濟合理性,評定干酪的生產效益,衡量產率提高工藝改進的有效性。干酪得率計算方法如下式:

1.3.4.2 干酪含水量的測定
依據GB 5009.003—2010《食品中水分的測定》中的方法測定干酪含水量。
1.3.4.3 干酪pH值的測定
稱取10 g干酪樣品,磨碎后加入12 mL 50 ℃蒸餾水,勻漿處理1 min,樣品充分勻漿后,將樣品放置于50 ℃水浴中保溫處理30 min,5 000×g、20 ℃條件下離心15 min,去除上層脂肪,取下層溶液測定pH值。
1.3.4.4 干酪微生物指標的測定
分別在干酪成熟的第0、4、8、12周取樣,平板涂布測定干酪樣品中L. plantarum 1-2的活菌數。準確稱取11 g干酪加入99 mL 2 g/100 mL檸檬酸鈉溶液(40 ℃),勻漿處理2 min,用生理鹽水將樣品稀釋到適當倍數,吸取50 μL稀釋液均勻涂布于M17培養基上,培養24 h,計算益生菌L. plantarum 1-2的活菌數。
1.3.5 干酪質構指標的測定
質構儀測定干酪硬度、內聚性和彈性3 個指標。去掉干酪樣品上下及邊緣約5 mm的部分,將干酪樣品切成1.5 cm×1.5 cm×1.5 cm大小的樣品。將樣品在室溫條件下放置30 min,使其溫度均衡,并避免樣品在測試過程中發生溫度變化。質構儀參數設定如下:測試前速度2.0 mm/s,測試速度0.4 mm/s,返回速度0.4 mm/s,循環2 次,數據頻率20 點/秒,觸發點負載5 g,壓縮比50%,探頭型號TA11/1000。
1.3.6 干酪揮發性風味物質的測定
通過氣相色譜-質譜聯用法分析對比干酪風味成分。稱取5 g干酪樣品,磨碎后加入到30 mL萃取瓶中,將萃取瓶加蓋密封,置于50 ℃水浴鍋中平衡20 min,固相微萃取50 ℃吸附40 min后插入氣相色譜進樣口,250 ℃條件下解吸5 min。
1.3.6.1 色譜條件
程序升溫:初始溫度為40 ℃,在此溫度下保持3 min,然后以5 ℃/min的速度升溫至200 ℃,保持0 min,再以10 ℃/min的速度升溫到250 ℃,保持3 min,后運行3 min。載氣(He)恒定流速為1.2 mL/min,進樣口溫度250 ℃,分流比為5∶1。
1.3.6.2 質譜條件
電子電離源,電子能量70 eV,傳輸線溫度280 ℃,離子源溫度230 ℃,四極桿溫度150 ℃,質量掃描范圍m/z 40~250。
1.3.6.3 干酪風味物質的數據分析
質譜圖經計算機檢索同時與NIST08質譜圖相匹配,并結合人工圖譜解析及相關資料分析,確認揮發性物質的各個化學成分,根據化合物的峰面積,按面積歸一化法計算出各成分的相對含量。
揮發性化學成分作為變量,成熟時間、益生菌添加量和益生菌添加方式作為環境因子,每個樣品不同成熟期的干酪作為一個樣本,應用CANOCO 4.5統計分析軟件對數據進行分析。首先,根據梯度長度分析結果,確定冗余分析模型的適用性。之后,依次設置軟件分析參數:Available Data=Species and environment data available,Scaling: Linear Methods=Do not post-transform,Transformation of Species D=Log transformation,對風味物質進行冗余分析,研究環境因子、變量、樣本之間的相互關系。
應用Cluster 3.0對風味物質和樣品進行聚類。導入文本文件至Cluster 3.0軟件,設置軟件分析參數:Adjust Data=Log transform data,選擇Hierarchical=Genes和Arrays下的Cluster,點擊Average linkage對揮發性物質和樣本進行聚類分析。
2 結果與分析
2.1 干酪理化及微生物指標測定結果
2.1.1 干酪得率分析

表2 干酪得率Table2 Cheese yield
由表2可知,對照組干酪得率顯著低于添加了益生菌L. plantarum 1-2的干酪組,益生菌干酪1、2、3三組干酪得率無顯著差異。這可能是因為L. plantarum 1-2為產EPS的益生菌,能夠有效結合干酪中游離的水分,從而提高干酪得率。Dabour等[24]研究發現,與不添加產EPS發酵劑生產的低脂切達干酪相比,添加了產黏液多糖或產莢膜多糖發酵劑生產的低脂切達干酪的水分含量增加量分別為3.6%和4.8%,干酪得率分別增加了0.28%和1.19%。
2.1.2 干酪含水量分析
干酪含水量不僅會影響干酪得率,還會對干酪的品質產生重要影響。因此,在干酪的成熟過程中,加強對干酪含水量的檢測和控制有重要意義。從圖2可以看出,在干酪成熟的過程中,4 種干酪含水量隨著成熟時間的延長而下降,下降趨勢緩慢;且不添加益生菌L. plantarum 1-2的對照組干酪變化較為明顯,而益生菌干酪1、2、3組含水量下降相對緩慢,差異性小。可能是干酪成熟期間,酶和微生物水解蛋白質使干酪的網狀結構遭到破壞,產生大量游離水,游離水造成干酪成熟期間水分下降[25]。益生菌干酪含水量下降慢的原因可能是益生菌L. plantarum 1-2產生EPS結合更多的水。Costa等[26]分別利用產EPS的L. lactis ssp.cremoris DPC6532及其不產EPS的同基因型變種菌株L. lactis ssp. cremoris DPC6533作為發酵劑生產低脂切達干酪,結果發現添加了產EPS發酵劑生產出的干酪含水量和干酪得率顯著高于不產EPS組的干酪。
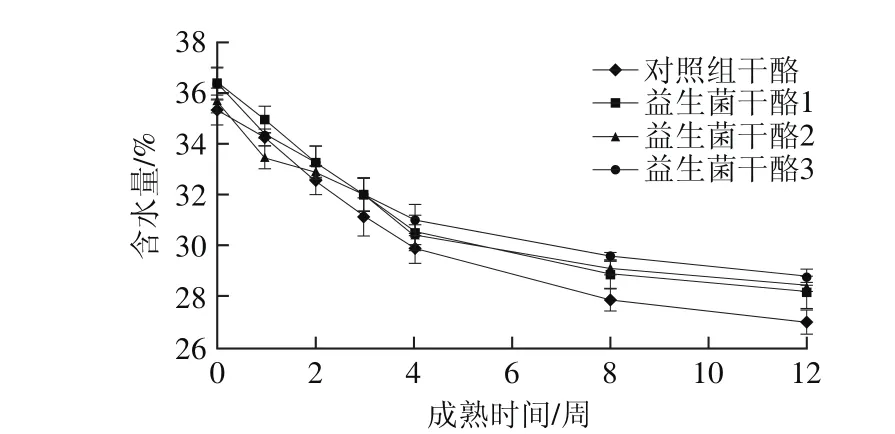
圖2 干酪成熟期間含水量的變化Fig. 2 Changes in moisture content during cheese ripening
2.1.3 干酪pH值分析
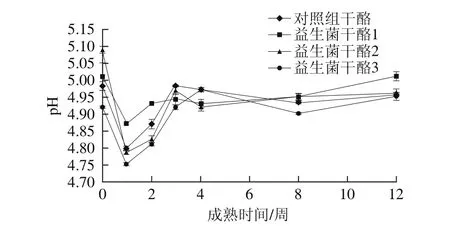
圖3 干酪成熟期間pH值的變化Fig. 3 Changes in pH during cheese ripening
由圖3可知,4 組干酪在成熟前期pH值下降速度較快,并達到最小值。這是由于在成熟前期,大量乳酸菌分解利用干酪中殘留的乳糖生成乳酸,使得干酪pH值迅速下降。而干酪在成熟的中后期乳糖被慢慢耗盡,隨著干酪成熟時間的延長,蛋白質發生水解游離出的NH4+與乳酸中和,導致pH值在成熟中期有小幅度上升[27]。在干酪成熟后期pH值趨于平穩。但益生菌干酪組和對照組干酪pH值無顯著差異(P>0.05),說明益生菌L. plantarum 1-2的加入不會使干酪質量發生明顯偏差,這對標準化生產干酪至關重要。
2.1.4 干酪微生物指標分析
對各組干酪成熟過程中L. plantarum 1-2的存活情況進行測定。由表3可知,隨著干酪成熟時間的延長,干酪中的L. plantarum 1-2活菌數量降低。盡管益生菌干酪2中的L. plantarum 1-2添加量最多,其活菌數量下降顯著,這可能由于其在殺菌乳中添加,凝乳切割處理后排乳清時,大量菌體隨乳清排出而造成有效添加量降低。益生菌干酪1和益生菌干酪2中L. plantarum1-2的添加量不同,其成熟過程中活菌數變化表現出差異性。何志剛等[28]發現植物乳桿菌R23在枇杷酒中的菌體生物量總體也呈下降趨勢。益生菌干酪3中L. plantarum 1-2在排除乳清之后添加,減少了菌種隨乳清排出時的損失。益生菌干酪2和益生菌干酪3成熟12 周時,益生菌L. plantarum 1-2活菌數無顯著性差異,表明益生菌L. plantarum 1-2以9.0(lg(CFU/mL))添加量與主發酵同時添加到殺菌乳中與排除乳清后添加8.0(lg(CFU/g))對切達干酪成熟12 周后益生菌L. plantarum 1-2的活菌數無顯著影響。

表3 益生性L. plantarum1-2分別在干酪成熟0、4、8、12 周過程中的存活情況Table3 Viable count of L. plantarum1-2 in probiotic cheese after 0, 4,8, and 12 weeks of ripening(lg(CFU/g))
2.2 干酪質構指標測定結果
由圖4可知,隨著干酪成熟時間的延長,4 組干酪的質構參數均呈現下降趨勢。在干酪成熟的1~4周內,干酪的硬度、內聚性和彈性迅速下降,這是由于干酪在成熟過程中,酪蛋白被干酪中殘余的凝乳酶及發酵劑菌株繼續水解,產生大量水溶性物質,酪蛋白的空間網狀結構遭到破壞,從而導致干酪體系變得松散。而在干酪成熟中期和后期(4~12 周),下降有所減緩。由圖4A可以看出,在整個成熟期內,對照組干酪的硬度始終高于益生菌干酪組,但差異并不顯著(P>0.05)。推測是由于L. plantarum 1-2產生的EPS破壞了蛋白質的網狀結構,使其空間結構變得疏松,從而導致硬度下降。張卓丹等[29]研究發現,EPS在干酪凝乳過程中,干擾蛋白質之間的相互作用,導致干酪凝塊變軟。
內聚性用于表征干酪在機械作用下裂解的速率,其外在表現是抗拉強度。由圖4B可知,在干酪成熟前期,4 組干酪內聚性均呈下降趨勢,但差異不顯著(P>0.05);在干酪成熟后期,對照組干酪內聚性顯著高于益生菌干酪(P<0.05)。干酪在成熟過程中,干酪內部原有化學鍵的完整性遭到破壞,蛋白質間的相互作用發生變化,在外力的作用下容易發生永久性變形,導致內聚性下降,因此干酪的內部結合力會隨著時間的延長而降低。
彈性參數用于表征干酪在外力作用后形狀的復原能力。由圖4C可以看出,干酪的彈性隨成熟時間的延長而呈現下降趨勢,4 周后下降速度趨于平緩。隨著干酪蛋白水解加快,干酪中長鏈的結構蛋白逐漸變短,酪蛋白網絡結構坍塌,從而導致干酪質地變得柔軟,彈性變差。對照組干酪的彈性在整個干酪成熟期間均低于3 個益生菌干酪,在干酪成熟前期差異不顯著(P>0.05);在干酪成熟后期,即第8~12周,對照組干酪的彈性顯著低于益生菌干酪組(P<0.05),推測是由于EPS破壞了蛋白質的空間網絡結構,使干酪質地變得松軟,但益生菌干酪之間差異并不明顯(P>0.05)。
2.3 干酪成熟期間的風味物質分析
由表4可知,4 組干酪在不同的成熟時期(0、4、8、12 周)特征性風味物質的變化,對照組干酪和益生菌干酪組的風味物質的種類和相對含量均存在較大差異。對照組干酪共檢測出風味物質26 種,其中烴類化合物6 種、醇類化合物6 種、醛類化合物2 種、酮類化合物4 種、脂肪酸類化合物5 種、酯類化合物3 種;益生菌干酪1、2、3中除上述26 種風味物質外,還檢測出乙苯、十二烷、己醇和丙酮4 種揮發性風味物質。Salmeron等[30]在植物乳桿菌發酵谷物中也鑒定到上述風味物質如乙醛、乙醇、丙酮、乙酸乙酯等。由圖5可知,各組干酪中不同種類風味物質的分布及相對含量具有一定的相似性,其中醇類物質的相對含量最高,醛類物質的相對含量最低;隨著成熟時間的延長,醇類和酯類物質相對含量有所下降,醛類和脂肪酸類物質的相對含量有所上升。

表4 干酪中揮發性風味物質相對含量Table4 Volatile flavor compounds in cheese
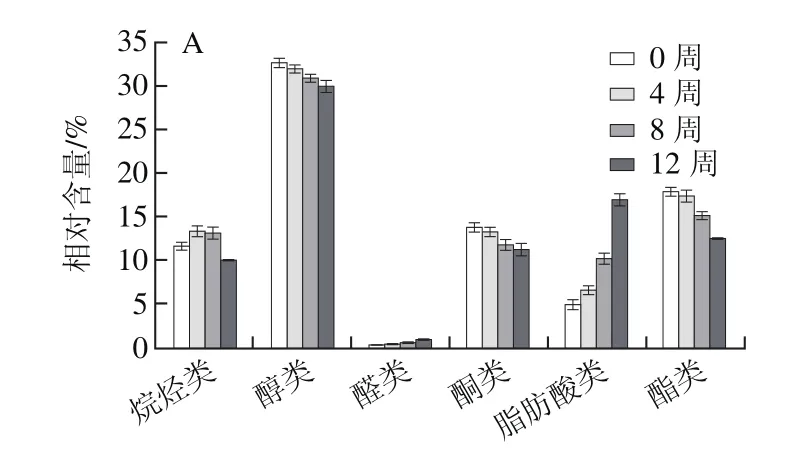
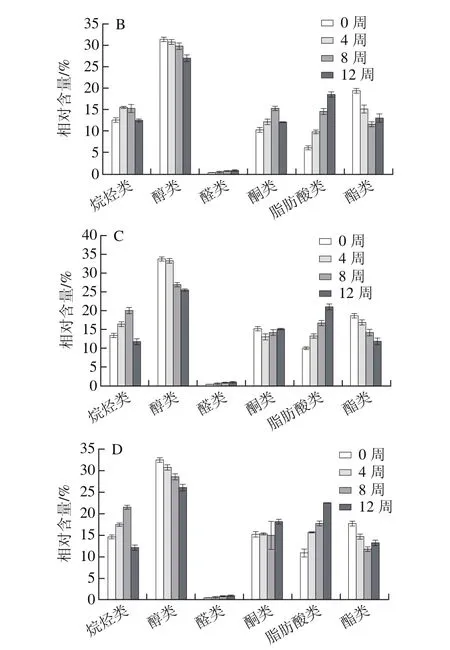
圖5 干酪成熟期間對照組干酪(A)、益生菌干酪1(B)、益生菌干酪2(C)和 益生菌干酪3(D)風味化合物的相對含量Fig. 5 Changes in flavor compound contents of control cheese (A),probiotic cheese 1 (B), probiotic cheese 2 (C) and probiotic cheese 3 (D)during cheese ripening
烴類化合物主要來源于原料乳本身[31],而不是在干酪成熟過程中產生,它們的閾值相對較高,因此對干酪整體風味的貢獻較小[32]。烴類化合物在干酪中普遍存在,且種類較多,以C10~C22的烷烴和一些支鏈烯烴為主。與益生菌干酪組相比,對照組僅檢測出6 種烴類化合物(苯、癸烷、甲苯、十一烷、對二甲苯和十三烷),而在3 個益生菌干酪組中均檢測出8 種烴類化合物(還包括乙苯和十二烷),乙苯等雜環類化合物可賦予干酪堅果味和杏仁味,使干酪風味更加飽滿。
醇類化合物通常具有芳香味和植物香味,但因醇類化合物閾值較高,因此對干酪整體風味貢獻不大。醇類化合物通常存在于干酪的水溶性成分中,可以與脂肪酸進一步反應形成酯,因此可間接影響干酪風味。此外,通過氨基酸代謝、乳糖代謝以及甲基酮的還原等代謝途徑也可生成相應的醇類。對照組干酪中檢測出6 種醇類化合物,即乙醇、3-甲基-1-丁醇、甲基丁烯醇、2-乙基-1-己醇、十六醇和苯乙醇,益生菌干酪1、2和3中還檢測出了己醇,己醇具有樹脂、花、植物的風味。3-甲基-1-丁醇可賦予干酪水果香味和酒香味,從而對改善干酪風味起到重要作用。在整個干酪成熟期內,益生菌干酪中3-甲基-1-丁醇含量均高于對照組,表明L. plantarum 1-2的添加對干酪風味有貢獻作用。此外,正己醇僅在益生菌干酪中檢測到,說明此風味物質由L. plantarum 1-2代謝產生。在切達干酪中,醇類的過度積累會造成風味缺陷[33]。本研究中,醇類化合物含量隨干酪成熟時間延長呈現下降趨勢,有利于減少干酪的酸敗風味。
醛類化合物是脂肪酸和游離脂肪酸發生自動氧化而生成。在對照組干酪和益生菌干酪中均檢測出2 種醛類化合物,即己醛和壬醛。其中己醛能賦予干酪新鮮味和青草味,壬醛具有板油氣味,這2 種物質在干酪中普遍存在。醛類化合物的化學性質比較活潑,屬于不穩定的中間體化合物,在一定條件下易被還原成相應的醇,因此通常而言這類化合物在乳制品中的含量都不高。醛類物質主要參與酸類物質和酯類物質間的相互轉化,能夠引起干酪不潔風味的苯乙醛在本實驗中未檢測出。
酮類化合物由多不飽和脂肪酸氧化、熱降解、氨基酸降解和微生物代謝產生,其感知閾值低,風味獨特,可賦予干酪水果香味、花香味和霉味[34-35],并隨著碳鏈的增加香氣更加濃郁[36]。本實驗在對照組中共檢測出4 種酮類化合物,包括2-庚酮、3-羥基丁二酮、2-壬酮和 2,7-二甲基-5-羥基-4-辛酮;在益生菌干酪組中還檢測出丙酮。由圖5可知,與對照組相比,益生菌干酪中酮類物質含量較高,尤其是3-羥基丁二酮,該化合物由干酪的檸檬酸代謝所產生的二乙酸轉化而來,賦予干酪清新的奶油香氣,使干酪風味變得更為飽滿,進一步提高干酪的感官品質[37]。2-壬酮呈果香、甜香、青香及椰子、奶油的氣味[38]。2-庚酮是亞油酸的氧化產物,能賦予干酪水果香味。
脂肪酸類化合物是由乳脂肪經脂肪酶水解形成的,有顯著的特征氣味,而且還是烷烴類、酯類和甲基酮等風味物質的前體。低碳數脂肪酸較低的閾值保證了干酪的典型發酵風味[39]。在4 組干酪中均檢測出了乙酸、丁酸、己酸、辛酸和癸酸。其中乙酸是由乳酸或檸檬酸在發酵菌株的作用下生成,賦予干酪醋味;丁酸可賦予干酪多汁味、奶油味;己酸具有油脂味;其他飽和脂肪酸主要貢獻干酪的水果酸味和油酸味。辛酸具有清香和微弱的水果酸氣味、淡酸味[40]。本實驗檢測到的酸類化合物均為直鏈脂肪酸,為脂肪的水解產物,含量隨成熟時間的延長而增加,對酯類化合物的形成具有很大貢獻,表明隨著干酪成熟時間的延長脂肪的水解作用逐漸加強。
酯類化合物具有較低的閾值,通常提供甜味和水果味[41],可以緩解短鏈酸類化合物帶來的尖刺感,使干酪的整體風味更加柔和,然而過多的酯類化合物則容易引起干酪偏水果味的缺陷[42]。短鏈酯類化合物在常溫下揮發性較強,并且具有較低的閾值,因此具有較大的風味貢獻潛力。本實驗中,這類化合物相對含量均隨干酪成熟時間延長而下降,避免了水果味缺陷的產生。在4 組干酪中共檢測出3 種酯類化合物,分別為乙酸乙酯、乙酸乙烯酯和己酸乙酯。其中乙酸乙酯含量較高,賦予干酪水果香味,隨干酪成熟時間的延長含量逐漸下降。在干酪成熟初期(0 周),乙酸乙酯便大量存在,第12周時,對照組干酪中乙酸乙酯相對含量為7.77%,低于益生菌干酪1(8.08%)、益生菌干酪2(8.54%)和益生菌干酪3(9.65%),說明L. plantarum 1-2的添加對干酪風味具有積極作用。
2.4 冗余分析益生菌L. plantarum 1-2對切達干酪成熟過程中揮發性風味含量和種類的影響
2.4.1 干酪成熟時間的影響
為了進一步研究干酪成熟時間、益生菌活菌數和添加方式對干酪風味形成的影響,對干酪的風味物質進行統計學分析。去趨勢對應分析(detrended correspondence analysis,DCA)結果顯示梯度長度最大值為0.703,依據?milauer等[43]方法,統計分析梯度長度小于3,適于線性分析模型,采用RDA線性模型分析。
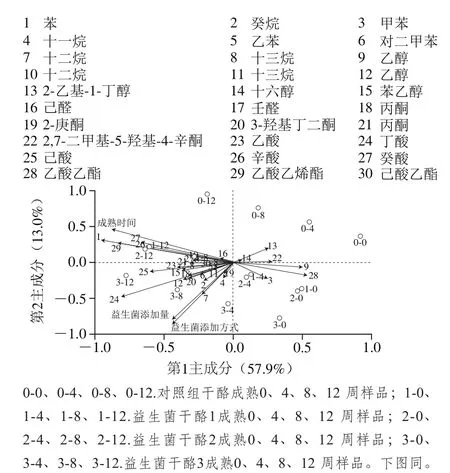
圖6 干酪風味物質的冗余分析Fig. 6 Redundancy analysis of cheese flavor substances
如圖6所示,第1、2主成分對風味物質的影響所能解釋的比例為70.9%。干酪成熟時間和橫軸的相關系數為0.867 3。箭頭代表不同的影響因素,其方向代表該因素對干酪風味影響的取向,長短代表對風味影響的大小。干酪成熟時間射線最長且沿著各組干酪成熟時間的方向,說明成熟時間與干酪揮發性風味物質含量呈正相關,且影響最大,這是因為無論是益生菌還是干酪中的酶類,其水解和產生揮發性風味物質都是復雜的生化反應,部分物質互為前體和產物,其形成需要較長的時間。
揮發性風味物質與成熟時間射線的夾角及投影反映了成熟時間因素對該揮發性風味物質影響的相關性和大小。2,7-二甲基-5-羥基-4-辛酮、2-乙基-1-己醇、乙醇、十六醇、甲苯、乙酸乙酯含量與成熟時間之間為鈍角,所以呈負相關關系。苯的含量與成熟時間呈正相關,且在成熟時間射線上的投影最長,說明苯與成熟時間相關性最強,對照組干酪隨著干酪成熟時間的延長實現從無到有的變化。其次是癸酸、丁酸和乙酸乙烯酯。
2.4.2 L. plantarum 1-2活菌數的影響
從圖6可知,相比干酪成熟時間對干酪揮發性風味的影響,益生菌活菌數對干酪揮發性風味的影響要小一些。各組干酪在益生菌添加量射線上的投影一致,說明模型的合理性。
丁酸在益生菌添加量射線上的投影最長,說明丁酸受益生菌活菌數的影響最大,其次是乙酸。賴氨酸可生成丁酸和乙酸,這2 種物質是切達干酪中重要的物質,丁酸表現出汁味和干酪味,乙酸表現出蠟味[43]。乙醇、2,7-二甲基-5-羥基-4-辛酮、十六醇、2-乙基-1-己醇與益生菌添加量的射線呈鈍角,說明這4 種揮發性風味物質與活菌數呈負相關。
2.4.3 L. plantarum 1-2添加方式的影響
干酪的加工過程中,排乳清過程降低了干酪的水分含量,一定量的微生物和酶隨乳清一同排出,此過程也會影響干酪成熟過程和產品的穩定性[44]。益生菌添加方式對干酪揮發性風味的影響與益生菌添加量對干酪揮發性風味物質的影響相似。由圖6可知,丁酸受益生菌添加方式的影響最大,其次是乙酸。乙醇、2,7-二甲基-5-羥基-4-辛酮、十六醇、2-乙基-1-己醇與益生菌添加方式呈負相關。益生菌干酪成熟12 周,丁酸含量最高達對照組的3.96 倍(P<0.05)。
各組干酪在益生菌添加方式射線上的投影一致,并且益生菌干酪1和益生菌干酪2距離接近,這是因為益生菌干酪1和益生菌干酪2添加菌種的方式一致。對照組干酪和益生菌干酪3分布在益生菌干酪1和益生菌干酪2的兩側。
益生菌添加量和添加方式射線之間的夾角為銳角,說明兩者呈正相關關系,相關系數為0.778 9。兩者與干酪成熟時間的相關系數為0.000 0。說明兩者與成熟時間因素相互獨立。為了研究益生菌添加量和益生菌添加方式之間的相關性,以干酪中風味物質種類和含量為指標聚類分析干酪樣品。由圖7可知,甲苯、乙醇、乙酸乙酯、2,7-二甲基-5-羥基-4-辛酮、3-甲基-1-丁醇、3-羥基丁二酮呈上調的趨勢,說明干酪的風味以這6 種風味物質貢獻為主。3 種益生菌干酪按成熟時間(0、4、8、12 周)分布于4 個區域,但對照組干酪不同,成熟4 周的樣品和益生菌干酪成熟0 周的樣品聚為一類;成熟8 周的樣品和益生菌干酪成熟4 周的樣品聚為一類;成熟12 周的樣品和益生菌干酪成熟8 周的樣品聚為一類。說明添加益生菌L. plantarum 1-2促進了干酪的成熟。周蕊等[45]同樣得到植物乳桿菌可促進干酪的成熟。不同成熟時期的益生菌干酪2和益生菌干酪3樣品都聚為一類,說明在殺菌乳中添加9(lg(CFU/mL))益生菌L. plantarum 1-2與排乳清后在凝乳中添加8(lg(CFU/g))L. plantarum 1-2,對干酪風味的影響一致。
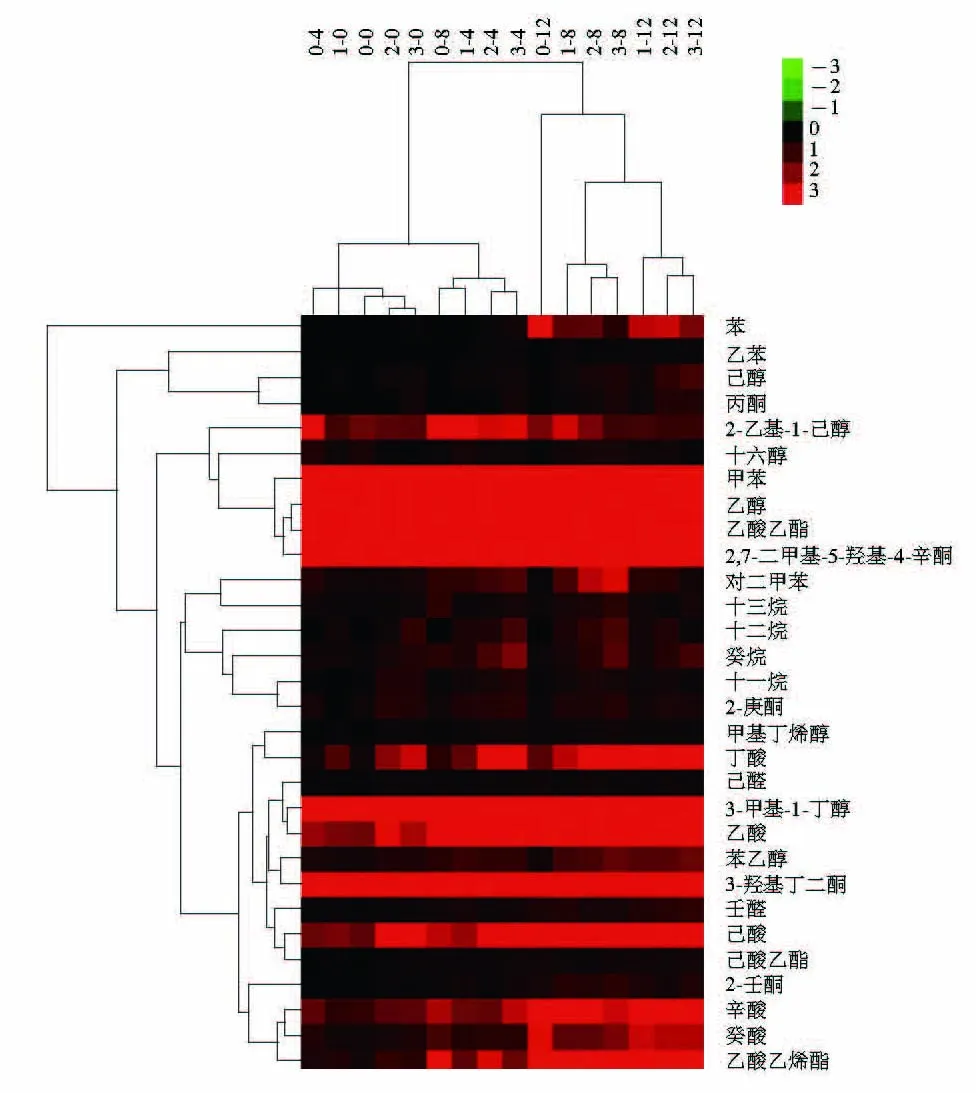
圖7 干酪樣品中揮發性風味物質含量的熱圖Fig. 7 Heat map from cluster analysis of volatiles in cheese sample
3 結 論
本研究考察了益生菌L. plantarum 1-2活菌數及其添加方式、干酪成熟時間對切達干酪揮發性風味形成的影響。氣相色譜-質譜檢測出30 種揮發性風味物質,添加益生菌改變了干酪中風味物質的種類和含量,與對照組相比增加了乙苯、十二烷、己醇和丙酮4 種風味物質。成熟時間對干酪風味的影響最大,苯隨干酪成熟時間的延長實現了從無到有的變化。另外,風味物質中丁酸受益生菌活菌數和添加方式的影響最大。益生菌活菌數與干酪揮發性風味物質含量呈正相關;相同成熟時間,活菌數越高,揮發性風味物質含量顯著增加或減少。在排乳清后添加益生菌(8(lg(CFU/g)))獲得了與在殺菌乳中添加高活菌數益生菌(9(lg(CFU/mL)))相似的揮發性風味物質種類與組成,表明適宜的添加方式可以降低益生菌用量、節約成本并獲得相似的產品品質。本研究結果為在益生菌干酪加工中選擇適宜的益生菌添加方式及用量,提高益生菌干酪的品質提供了理論支持。
[1] 王輯, 楊貞耐. 益生菌干酪成熟過程中微生態變化的研究進展[J].食品安全質量檢測學報, 2014(4): 990-994.
[2] ROSS R P, FITZERALD G, COLLINS K, et al. Cheese delivering biocultures-probiotic cheese[J]. Australian Journal of Dairy Technology, 2002, 57: 71-78.
[3] KAILASAPATHY K, CHIN J. Survival and therapeutic potential of probiotic organisms with reference to Lactobacillus acidophilus and Bifidobacterium spp.[J]. Immunology & Cell Biology, 2000, 78(1): 80-88.
[4] TINDALL B J. The type strain of Lactobacillus casei is ATCC 393, ATCC 334 cannot serve as the type because it represents a different taxon, the name Lactobacillus paracasei and its subspecies names are not rejected and the revival of the name ‘Lactobacillus zeae’ contravenes Rules 51b (1) and (2) of the International Code of Nomenclature of Bacteria. Opinion 82[J]. International Journal of Systematic & Evolutionary Microbiology, 2008, 58(7): 1764.DOI:10.1099/ijs.0.2008/005330-0.
[5] PHILLIPS M, KAILASAPATHY K, TRAN L. Viability of commercial probiotic cultures (L. acidophilus, Bifidobacterium sp., L. casei, L.paracasei and L. rhamnosus) in Cheddar cheese[J]. International Journal of Food Microbiology, 2006, 108(2): 276-280. DOI:10.1016/j.ijfoodmicro.2005.12.009.
[6] MADUREIRA A R, AMORIM M, GOMES A M, et al. Protective effect of whey cheese matrix on probiotic strains exposed to simulated gastrointestinal conditions[J]. Food Research International, 2011,44(1): 465-470. DOI:10.1016/j.foodres.2010.09.010.
[7] 王一博, 張昊, 郭慧媛, 等. 益生菌干酪的研究進展[J]. 中國乳業,2012(12): 46-49. DOI:10.16172/j.cnki.114768.2012.12.004.
[8] IBRAHIM F, RUVIO S, GRANLUND L, et al. Probiotics and immunosenescence: cheese as a carrier[J]. Fems Immunology &Medical Microbiology, 2010, 59(1): 53. DOI:10.1111/j.1574-695X.2010.00658.x.
[9] ZHANG L, ZHANG X, LIU C, et al. Manufacture of Cheddar cheese using probiotic Lactobacillus plantarum K25 and its cholesterollowering effects in a mice model[J]. World Journal of Microbiology &Biotechnology, 2013, 29(1): 127-135. DOI:10.1007/s11274-012-1165-4.
[10] OZTURKOGLU-BUDAK S, GURSOY A, AYKAS D P, et al. Volatile compound profiling of Turkish Divle Cave cheese during production and ripening[J]. Journal of Dairy Science, 2016, 99(7): 5120.DOI:10.3168/jds.2015-10828.
[11] SODA M E, MADKOR S A, TONG P S. Adjunct cultures: recent developments and potential significance to the cheese industry 1[J]. Journal of Dairy Science, 2000, 83(4): 609. DOI:10.3168/jds.S0022-0302(00)74920-4.
[12] LYNCH C M, PLH M S, FOX P F, et al. Manufacture of Cheddar cheese with and without adjunct lactobacilli under controlled microbiological conditions[J]. International Dairy Journal, 1996,6(8/9): 851-867. DOI:10.1016/0958-6946(96)00019-2.
[13] PUCHADES R, LEMIEUX L, SIMARD R E. Evolution of free amino acids during the ripening of Cheddar cheese containing added lactobacilli strains[J]. Journal of Food Science, 2010, 54(4): 885-888.DOI:10.1111/j.1365-2621.1989.tb07905.x.
[14] INNOCENTE N, BIASUTTI M, RITA F, et al. Effect of indigenous lactobacillus rhamnosus isolated from bovine milk on microbiological characteristics and aromatic profile of traditional yogurt[J]. LWTFood Science and Technology, 2016, 66: 158-164. DOI:10.1016/j.lwt.2015.10.031.
[15] POGA?I? T, MAILLARD M B, LECLERC A, et al. Lactobacillus and Leuconostoc volatilomes in cheese conditions[J]. Applied Microbiology & Biotechnology, 2016, 100(5): 1-12. DOI:10.1007/s00253-015-7227-4.
[16] STEFANOVIC E, KILCAWLEY K N, REA M C, et al. Genetic,enzymatic and metabolite profiling of the Lactobacillus casei group reveals strain biodiversity and potential applications for flavour diversification[J]. Journal of Applied Microbiology, 2017, 122(5):1245-1261. DOI:10.1111/jam.13420.
[17] IORIZZO M, TESTA B, LOMBARDI S J, et al. Selection and technological potential of Lactobacillus plantarum bacteria suitable for wine malolactic fermentation and grape aroma release[J]. LWTFood Science and Technology, 2016, 73: 557-566. DOI:10.1016/j.lwt.2016.06.062.
[18] HAFNER S D, WINDLE M, MERRILL C, et al. Effects of potassium sorbate and Lactobacillus plantarum MTD1 on production of ethanol and other volatile organic compounds in corn silage[J]. Animal Feed Science & Technology, 2015, 208: 79-85. DOI:10.1016/j.anifeedsci.2015.07.007.
[19] 程曉燕, 孫銀鳳, 劉娜, 等. 傳統酸面團中植物乳桿菌發酵饅頭抗氧化特性及揮發性風味物質特征[J]. 食品科學, 2015, 36(12): 87-92.DOI:10.7506/spkx1002-6630-201512016.
[20] TOCMO R A N L. Organosulphide profile and hydrogen sulphidereleasing activity of garlic fermented by Lactobacillus plantarum[J].Journal of Functional Foods, 2017, 30: 254-259. DOI:10.1016/j.jff.2017.01.001.
[21] KLEEKAYAI T, PINITKLANG S, LAOHAKUNJIT N, et al. Volatile components and sensory characteristics of Thai traditional fermented shrimp pastes during fermentation periods[J]. Journal of Food Science & Technology, 2016, 53(3): 1399-1410. DOI:10.1007/s13197-015-2142-3.
[22] 王水泉, 包艷, 董喜梅, 等. 植物乳桿菌的生理功能及應用[J]. 中國農業科技導報, 2010, 12(4): 49-55.
[23] 楊亞威, 趙愛梅, 王輯, 等. 傳統奶豆腐中產胞外多糖乳酸菌的分離篩選及其潛在益生菌特性[J]. 中國乳品工業, 2015, 43(12): 8-13.
[24] DABOUR N, KHEADR E, BENHAMOU N, et al. Improvement of texture and structure of reduced-fat Cheddar cheese by exopolysaccharide-producing lactococci[J]. Journal of Dairy Science,2006, 89(1): 95-110. DOI:10.3168/jds.S0022-0302(06)72073-2.
[25] JENNESS R. Composition and characteristics of goat milk: review 1968-1979[J]. Journal of Dairy Science, 1980, 63(10): 1605-1630.
[26] COSTA N E, HANNON J A, GUINEE T P, et al. Effect of exopolysaccharide produced by isogenic strains of Lactococcus lactis on half-fat Cheddar cheese[J]. Journal of Dairy Science, 2010, 93(8):3469-3486. DOI:10.3168/jds.S0022-0302(80)83125-0.
[27] 梅俊. 西藏開菲爾干酪的風味變化及可食膜包裝研究[D]. 上海: 上海交通大學, 2015: 52-53.
[28] 何志剛, 梁璋成, 任香蕓, 等. 植物乳桿菌R23在枇杷酒中生長及蘋果酸乳酸發酵特性研究[J]. 中國食品學報, 2011, 11(4): 36-41.DOI:10.16429/j.1009-7848.2011.04.025.
[29] 張卓丹. 嗜熱鏈球菌ST1的益生特性及其在低脂發酵乳中的應用[D].長春: 吉林大學, 2012: 31-32.
[30] SALMERóN I, LOEZA-SERRANO S, PéREZ-VEGA S, et al.Headspace gas chromatography (HS-GC) analysis of imperative flavor compounds in Lactobacilli-fermented barley and malt substrates[J]. Food Science & Biotechnology, 2015, 24(4): 1363-1371.DOI:10.1007/s10068-015-0175-z.
[31] 艾對, 張富新, 李延華, 等. 頂空固相微萃取-氣質聯用法分析羊乳和牛乳中揮發性化合物[J]. 食品與發酵工業, 2014, 40(10): 189-193.
[32] 衣宇佳. 國產類契達干酪的風味研究[D]. 無錫: 江南大學, 2008: 43-46.
[33] 郭本恒. 乳品化學[M]. 北京: 中國輕工業出版社, 2001: 65-87.
[34] 李青. 酶法改性干酪風味劑的制備及應用的研究[D]. 天津: 天津科技大學, 2012: 44-46.
[35] WOLF I V, PEROTTI M C, ZALAZAR C A. Composition and volatile profiles of commercial Argentinean blue cheeses[J]. Journal of the Science of Food and Agriculture, 2011, 91(2): 385-393. DOI:10.3168/jds.S0022-0302(80)83125-0.
[36] 舒宏福. 新合成食用香料手冊[M]. 北京: 化學工業出版社, 2005: 23-30.
[37] MCSWEENEY P L H, FOX P F. Metabolism of residual lactose and of lactate and citrate[J]. Cheese Chemistry Physics & Microbiology,2004(4): 361-371. DOI:10.1016/S1874-558X(04)80074-5.
[38] 孫寶國. 食用調香術[M]. 北京: 化學工業出版社, 2003: 55-59.
[39] PRICE E J, LINFORTH R S, DODD C E, et al. Study of the influence of yeast inoculum concentration (Yarrowia lipolytica and Kluyveromyces lactis) on blue cheese aroma development using microbiological models[J]. Food Chemistry, 2014, 145(4): 464-472.DOI:10.1016/j.foodchem.2013.08.081.
[40] 牛婕, 甘伯中, 喬海軍, 等. 牦牛乳軟質干酪成熟期揮發性風味成分分析[J]. 食品科學, 2010, 31(18): 278-282.
[41] YEE A L, MAILLARD M B, ROLAND N, et al. Great interspecies and intraspecies diversity of dairy propionibacteria in the production of cheese aroma compounds[J]. International Journal of Food Microbiology, 2014, 191: 60. DOI:10.1016/j.ijfoodmicro.2014.09.001.
[42] THOMSEN M, GOURRAT K, THOMAS-DANGUIN T, et al.Multivariate approach to reveal relationships between sensory perception of cheeses and aroma profile obtained with different extraction methods[J]. Food Research International, 2014, 62(8): 561-571. DOI:10.1016/j.foodres.2014.03.068.
[43] SINGH T K, DRAKE M A, CADWALLADER K R. Flavor of Cheddar cheese: a chemical and sensory perspective[J].Comprehensive Reviews in Food Science & Food Safety, 2010, 2(4):166-189. DOI:10.1111/j.1541-4337.2003.tb00021.x.
[44] 楊貞耐, 張健. 干酪質量安全問題與控制技術[J]. 食品科學技術學報, 2015, 33(6): 11-17. DOI:10.3969/j.issn.2095-6002.2015.06.003.
[45] 周蕊, 李曉東, 潘超. 促熟干酪的非發酵劑乳酸菌篩選及其對干酪漿模型蛋白質降解的研究[J]. 食品科學, 2012, 33(1): 131-135.

