嗜酸乳桿菌ATCC4356分選酶A基因克隆、表達及功能分析
吳 京,王文文,熊蓉露,吳 振,*,潘道東,,*,曾小群,郭宇星
(1.寧波大學 浙江省動物蛋白食品精深加工技術重點實驗室,浙江 寧波 315211;2.南京師范大學金陵女子學院,江蘇 南京 210097)
革蘭氏陽性細菌的表面蛋白可以使細菌黏附于一些細胞和組織表面,這種機制可以促使細菌成功定殖于機體內并逃避宿主的免疫監視[1]。部分表面蛋白發揮作用之前需要分選酶A(sortase A,SrtA)的參與,它可以識別表面蛋白特定的LPXTG序列(X表示任意一種氨基酸),并將表面蛋白在蘇氨酸(T)和甘氨酸(G)之間切開,使表面蛋白錨定在細胞壁上[2-3]。
分選酶是一種膜結合類的轉肽酶,很多表面蛋白發揮功能之前都需要分選酶的參與。目前為止發現的6 種分選酶中,SrtA可以識別LPXTG等序列,使表面蛋白正常發揮功能[4];可催化細菌的多種黏附素或毒力因子錨定在細胞壁表面,在致病菌入侵宿主細胞的過程中發揮著重要作用[5-6]。在對多種革蘭氏陽性細菌的SrtA基因進行敲除后發現,SrtA缺陷菌株生理狀況沒有明顯變化,但對宿主細胞的黏附作用大幅下降,從而很大程度上降低了病原菌的致病性[7-8]。
相較于其他革蘭氏陽性細菌,乳酸菌的分選酶及表面蛋白沒有毒性,因此其分選酶錨定機制被認為是比較安全的。研究發現,乳酸菌SrtA在細菌黏附過程中同樣扮演著重要角色。Malik等[9]研究了植物乳桿菌CMPG5300對陰道上皮細胞的黏附,結果發現,CMPG5300 SrtA基因被敲除后,自身的聚集效應明顯降低,同時對陰道上皮細胞的黏附作用也會減弱,而對SrtA缺陷菌株進行基因回補后,CMPG5300對細胞的黏附能力又有所回升,表明乳酸菌SrtA同樣會影響它對宿主細胞的黏附;SrtA基因的缺失也會影響其他基因的表達,并影響乳酸菌細胞膜的形成。
乳酸菌SrtA可以識別多種表面蛋白,并介導乳酸菌對腸道細胞的黏附,抑制病原菌的入侵[10-11]。雖然這些表面蛋白與腸道細胞的結合位點尚不明確,但可以肯定的是,乳酸菌的表面蛋白可以抑制病原菌對腸道細胞的黏附,并提高乳酸菌在腸胃中的存活率;表面蛋白與腸道細胞受體結合還可以刺激免疫細胞的增殖,增強人體免疫力[12-13];乳酸菌SrtA也有望被開發為一種蛋白質連接工具[14]。因此,對乳酸菌SrtA的研究有助于進一步探究表面蛋白的具體功能,揭示乳酸菌的益生機理。
目前為止,對SrtA的研究主要集中在致病菌及其抑制物的開發上[15-17],雖然獲得了諸多成果,但它們對分選酶家族的廣譜抑制效應尚少見研究。乳酸菌作為人體腸道中的優勢菌群,鮮有文獻報道這些抑制劑對乳酸菌SrtA的影響。本研究擬利用pET28a(+)載體對Lactobacillus acidophilus ATCC4356的SrtA進行異源表達,并分析其酶學特性,期望獲得具有活性的SrtA,驗證分選酶抑制劑對乳酸菌SrtA的抑制作用,為提高乳酸菌分選酶的催化效率以及為后續分選酶抑制劑的篩選奠定基礎。
1 材料與方法
1.1 材料
L. acidophilus ATCC4356、pET28a(+)為本實驗室保存;熒光多肽Dabcyl-QALPTTGEE(Edans)由上海強耀生物科技有限公司合成;大腸桿菌感受態細胞Trans1-T1、Transetta(DE3)、克隆載體pEASY-Blunt Zero、親和層析柱Ni-NTA Resin 北京全式金生物技術有限公司;高保真DNA聚合酶、限制性內切酶、T4 DNA連接酶 日本TaKaRa公司;查爾酮 天津一方科技有限公司。
1.2 儀器與設備
INFINITE M200 PRO酶標儀 瑞士TECAN公司;H2500R-2、H-2050R低溫離心機 長沙湘儀離心機儀器有限公司;聚合酶鏈式反應(polymerase chain reaction,PCR)儀 美國Labnet公司;超聲波細胞粉碎機 寧波新芝生物科技股份有限公司;Universal HoodⅡ凝膠成像分析系統 美國Bio-Rad公司;Mini Drop超微量分光光度計 依科賽生物科技有限公司;MC99-3自動液相分離層析儀 上海滬西分析儀器廠有限公司。
1.3 方法
1.3.1 嗜酸乳桿菌SrtA基因的克隆及鑒定

表1 PCR引物序列Table1 Sequences of primers used for PCR
使用信號肽分析軟件SignaIP分析SrtA的氨基酸序列,發現L. acidophilus ATCC4356 SrtA(Lap-SrtA)存在一個信號肽剪切位點,位于第48個氨基酸處。根據分析結果,如表1所示,設計引物SrtAΔN48-F、SrtAΔN48-R去除Lap-SrtA N端48 個氨基酸,以XhoⅠ和BamHⅠ作為酶切位點,通過PCR克隆得到目的基因SrtAΔN48,用瓊脂糖凝膠電泳檢測PCR結果。PCR程序:98 ℃預變性4 min;98 ℃ 10 s,58 ℃ 5 s,72 ℃ 1 min,30 個循環;72 ℃延伸10 min。
PCR產物割膠回收后與Blunt Zero克隆載體連接,轉入大腸桿菌Trans1-T1感受態細胞,卡納霉素篩選轉化子,雙酶切驗證,并送至上海桑尼生物技術有限公司測序。
1.3.2 重組原核表達載體的構建
用BamH I和Xho I分別雙酶切Blunt Zero-SrtAΔN48和完整質粒pET28a(+),瓊脂糖凝膠電泳檢測酶切效果,然后割膠回收目的基因SrtAΔN48和被切開的載體pET28a(+)。用T4 DNA連接酶連接pET28a(+)與SrtAΔN48,連接產物轉入大腸桿菌Transetta(DE3),卡那霉素篩選轉化子。并通過雙酶切、測序等獲取重組表達載體pET28a-SrtAΔN48。
1.3.3 重組載體在大腸桿菌中的誘導表達
將含有重組表達載體pET28a-SrtAΔN48的大腸桿菌接種于卡那霉素質量濃度為100 mg/mL的LB肉湯培養基中,37 ℃ 180 r/min 搖床培養至600 nm波長吸光度約為0.6,加入異丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)至終濃度為0.4 mmol/L,25 ℃繼續培養16 h,同時以未加IPTG的培養物作為對照。誘導結束后,5 000 r/min離心收集菌體,用0.01 mol/L PBS緩沖液重懸,超聲波破碎細菌,10 000 r/min離心30 min,收集上清液,利用Ni-NTA親和層析柱純化目的蛋白,然后進行十二烷基硫酸鈉-聚丙烯酰胺凝膠蛋白電泳分析,確定蛋白表達情況。
1.3.4 重組蛋白的活性測定
分選酶活性測定選用Dabcyl-QALPTTGEE(Edans)熒光多肽,分選酶可以識別LPTTG序列,并在T與G之間切割肽鍵,使熒光基團Edans脫落并發出熒光,通過測定反應體系中的熒光強度來測定分選酶的活性。熒光多肽Dabcyl-QALPTTGEE(Edans)用pH 7.5的Tris-HCl緩沖液稀釋至5 mmol/L作為儲備液。
純化的蛋白用蛋白活性緩沖液(50 mmol/L Tris-HCl緩沖液,150 mmol/L NaCl溶液,pH 8.0)稀釋至0.5 mg/mL,加入96 孔板黑板中,并加入分選酶底物肽至終濃度為10 μmol/L(終反應體系為200 μL),在37 ℃培養箱中孵育2 h,使用酶標儀記錄孵育前后體系中的熒光強度(激發波長350 nm,發射波長520 nm),以蛋白活性緩沖液作為陰性對照。
為研究金屬離子對Lap-SrtA酶活性的影響,反應體系中分別加入5 mmol/L的CaCl2、MgCl2、ZnCl2及MnCl2溶液(終反應體系為200 μL),以不加任何金屬離子的反應體系作為對照,37 ℃培養箱中孵育2 h,測定反應體系中熒光強度,計算相對酶活力。
1.3.5 分選酶抑制劑查爾酮對重組蛋白活性的影響
查爾酮用二甲基亞砜溶解,加入反應體系中,使其終濃度分別為20、40、80、120、160、200 μmol/L,在37 ℃培養箱中孵育30 min后,加入熒光肽底物至終濃度為10 μmol/L(終反應體系為200 μL),繼續孵育2 h,按之前的方法讀取熒光強度,計算相對酶活力。
1.3.6 嗜酸乳桿菌SrtA生物信息學分析
分別用ExPASY、TMHMM、PSIPRED、SWISS MODEL[18-19]等蛋白質在線分析軟件分析分選酶的結構特點并與其他分選酶進行比對。
1.4 數據處理
所有數據用Origin 8.5軟件繪制趨勢曲線圖,采用一維方差分析比較數據平均值之間的差異顯著性。
2 結果與分析
2.1 SrtA基因的PCR擴增和重組表達載體的構建

圖1 SrtAΔN48基因PCR產物電泳圖Fig. 1 Agarose gel electrophoresis of PCR products of SrtAΔN48 gene
由圖1可知,以L. acidophilus ATCC4356基因組DNA為模板擴增產物長度為546 bp,符合預計長度。測序結果經過NCBI對比,與L. acidophilus NCFM序列相似性為99%,氨基酸序列完全相同。將克隆載體Blunt Zero-SrtAΔN48雙酶切后得到的SrtAΔN48與pET28a(+)連接,卡那霉素篩選陽性菌,并送至上海桑尼生物技術有限公司測序,測序結果顯示整個克隆過程中沒有引入突變堿基。
2.2 SrtA基因在大腸桿菌中的表達與純化

圖2 Transetta(DE3)/pET28a-SrtAΔN48的表達產物十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分析Fig. 2 SDS-PAGE analysis of expression product from Transetta (ED3)/pET28a-SrtAΔN48
將重組載體pET28a-SrtAΔN48轉入表達菌株Transetta(DE3),在25 ℃、0.4 mmol/L IPTG條件下表達及純化結果如圖2所示。SrtA作為一種膜蛋白,其氨基酸序列的N端含有一段強疏水性序列,包括跨膜區域和信號肽,這段序列可以使膜蛋白成功錨定在細胞壁上;但在基因異源表達過程中,疏水性序列會嚴重影響蛋白質的正確折疊以及可溶性表達[7,20]。為獲得具有活性的SrtA蛋白,本研究設計引物去除了SrtA酶N端的48 個氨基酸,然后使用pET系列載體在大腸桿菌內表達目的基因Lap-SrtAΔN48。L. acidophilus ATCC4356 SrtA基因原本編碼229 個氨基酸,切除N端48 個氨基酸后,相對分子質量會有所減小。由圖2可知,SrtAΔN48在約20 kDa的位置出現了明顯的條帶,同時,利用Ni-NTA親和層析柱,獲得了高純度的SrtAΔN48蛋白。
2.3 金屬離子及查爾酮對嗜酸乳桿菌SrtA酶活力的影響
分選酶進行轉肽作用時不需要ATP的參與,因此在體外可以較為方便地測定Lap-SrtAΔN48的活性。利用帶有熒光基團的底物肽Dabcyl-QALPTTGEE(Edans)測定SrtA的活性,Lap-SrtAΔN48切割熒光基團結果如圖3所示。由于對照組沒有分選酶活性,在孵育過程中,熒光強度會衰減,因此相對酶活力呈負值,SrtA在37 ℃時可以成功切斷肽段LPTTG,使熒光基團Edans發出熒光。

圖3 不同金屬離子對Lap-SrtAΔN48蛋白活性的影響Fig. 3 Effect of different metal ions on Lap-SrtAΔN48 activity
金屬離子是生命體不可缺少的微量元素,對酶的活力和機體生長發育有著重要的影響。由圖3可知,Mg2+、Mn2+可顯著提高Lap-SrtAΔN48的活力(P<0.05);Zn2+也可以提高Lap-SrtAΔN48的活力,但效果并不顯著(P>0.05);Ca2+不會影響Lap-SrtAΔN48的活力(P>0.05),明顯區別于其他SrtA酶。Ilangovan[3]、Li Hong’en[21]等在對金黃色葡萄球菌OS2分選酶(Sa-SrtA)及單核細胞性李斯特菌BUG1600分選酶(Lm-SrtA)的研究過程中發現,Ca2+可以提高Sa-SrtA及Lm-SrtA的活力至原來的4 倍以上。Naik等[22]研究了Sa-SrtAΔN59與Ca2+的關系,結果表明,Sa-SrtA β6與β7之間的谷氨酸(Glu171)可以使Ca2+結合到酶活中心附近,改變Sa-SrtA的動力學結構,提高Sa-SrtA的催化效率,而Lap-SrtAΔN48在這一區域并未發現功能相似的氨基酸(圖6)。

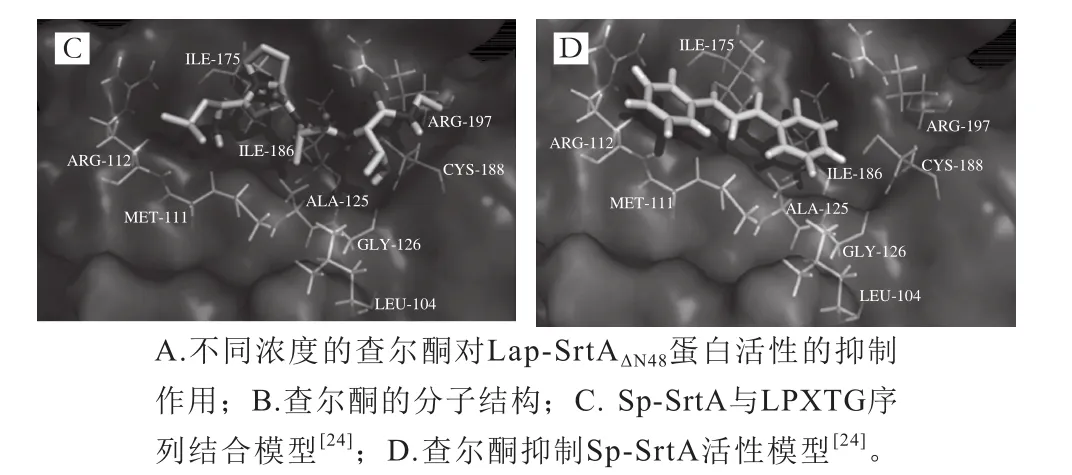
圖4 查爾酮對SrtA蛋白活性的抑制作用Fig. 4 Inhibitory activity of chalcone on SrtA
由圖4可知,查爾酮在體外可以顯著抑制Lap-SrtAΔN48的活性,抑制效果與查爾酮的濃度有關,濃度越高,查爾酮的抑制作用越強。結合以往的研究結果,查爾酮可以與熒光肽底物競爭酶活位點,使Lap-SrtAΔN48喪失轉肽能力。
查爾酮是一種黃酮類化合物,普遍存在于植物體內[23]。研究發現,查爾酮可以直接封閉蛋白酶的活性位點,阻止SrtA的轉肽作用,抑制Listeria monocytogenes、Streptococcus mutans、S. pyogenes[21,24]等多種致病菌對宿主細胞的黏附,具有良好的應用前景。由于查爾酮有較高的廣譜抑制效果,本實驗選擇它作為研究Lap-SrtAΔN48特性的工具。結果顯示,查爾酮同樣會抑制Lap-SrtAΔN48的活性,查爾酮特殊的分子結構具有較大的柔性,如果人體腸道中其他益生菌的SrtA結構與L. acidophilus ATCC4356相似,查爾酮就會干擾正常的腸道微生物環境,影響人體健康。查爾酮對多種SrtA的抑制效應也表明,依靠特殊的分子結構抑制SrtA酶活力的方法沒有特異性,因而在通過查爾酮阻止腸道致病菌對腸道的吸附作用進行治療時,可能會影響人體內原有的微生物,引發一定的副作用。
2.4 Lap-SrtAΔN48重組蛋白生物信息學分析

圖5 預測的Lap-SrtA三維結構Fig. 5 Structure of Lap-SrtA predicted by SWISS MODEL
使用ExPASY在線檢測工具對Lap-SrtAΔN48分析后發現,Lap-SrtAΔN48總氨基酸數為181,分子質量約為20 kDa,理論等電點為9.95,分子式為C891H1466N244O255S11,脂肪指數為85.14,不穩定指數為23.95,屬于穩定蛋白質(不穩定指數大于40屬于不穩定蛋白質)。SrtA屬于Ⅱ類膜拓撲結構(N端位于細胞膜內側,C端位于細胞膜外側),蛋白質在細胞壁外側發揮作用。蛋白質二級結構預測顯示,Lap-SrtAΔN48中含有14.92%的α螺旋結構和26.52%的β折疊結構;可能存在11 個蛋白質識別位點和1 個蛋白質-核酸結合位點。SrtA可以催化多種表面蛋白,這些蛋白質識別位點可能對應的是不同的表面蛋白。
由圖5可知,采用SWISS MODEL構建的蛋白質三維結構顯示,Lap-SrtAΔN48由5 段α螺旋和8 段β折疊結構組成,其中,8 條反向平行的β折疊形成了一個β中心桶狀結構,與單核細胞性李斯特菌、金黃色葡萄球菌、釀膿鏈球菌的基本結構相同。β中心桶狀結構是SrtA的經典結構,是分選酶進行轉肽作用的基礎,研究表明,位于β4、β7和β8上活性位點會形成一個口袋結構,這種結構可以識別表面蛋白的LPXTG序列,并攻擊T與G之間的肽鍵,催化轉肽過程(圖4)[25]。

圖6 Lap-SrtA蛋白與同源蛋白序列比對結果Fig. 6 Results of multiple sequence alignment of Lap-SrtA protein and homologous proteins
由圖6可知,以Lm-SrtA為模板,將Lap-SrtAΔN48與其他革蘭氏陽性細菌分選酶序列比對后發現,多種革蘭氏陽性細菌SrtA之間有很高的同源性,并且均存在組氨酸(H)-半胱氨酸(C)-精氨酸(R)三聯體活性中心,這是SrtA的主要活性氨基酸,此外,組氨酸附近存在LAGH等保守序列,半胱氨酸附近也存在TLITC保守序列,可能與分選酶活性有關。結合序列比對結果,本研究推測Lap-SrtA活性氨基酸為His137、Cys198、Arg205。組氨酸和精氨酸是SrtA酶抓取LPXTG序列的必需氨基酸,而半胱氨酸可以將底物從TG之間切開[26]。
3 討 論
分選酶錨定機制是細菌外蛋白的5 種錨定方式之一[27],本研究利用大腸桿菌表達載體獲得了具有活性的Lap-SrtA蛋白,并對其分子生物學特性作了初步分析。
相較于Sa-SrtA、Lm-SrtA,Ca2+不會影響Lap-SrtA的活性,氨基酸序列比對發現,Lap-SrtA在β6與β7之間沒有谷氨酸(Glu),這可能是Lap-SrtA對Ca2+不敏感的原因之一。谷氨酸是Sa-SrtA結合Ca2+的關鍵氨基酸 ,在Sa-SrtA催化轉肽作用時,Ca2+可以同時結合β6/β7之間的谷氨酸和β3/β4之間天冬氨酸、天冬酰胺、谷氨酸等氨基酸,拉近兩段肽鏈之間的距離,使Sa-SrtA的活性位點發生形變,提高催化效率。另外,金黃色葡萄球菌,單核細胞性李斯特菌均為致病菌,其分選酶及分選酶依賴蛋白多數為毒性蛋白,Sa-SrtA及Lm-SrtA對Ca2+的敏感性很可能是為了適應毒性蛋白的錨定而進化的特殊性質[22]。
生物信息學分析結果顯示,Lap-SrtA的結構和活性位點與Sa-SrtA、Sp-SrtA和Lm-SrtA相似,均由8條β折疊和若干α螺旋及部分β轉角組成;其中,位于β4、β7、β8上的組氨酸-半胱氨酸-精氨酸構成了SrtA的三聯體活性中心。由于具有相似的結構和相同的活性位點,查爾酮同樣可以抑制Lap-SrtA的活性。通過與Lap-SrtA的活性位點相結合,查爾酮可以阻止Lap-SrtA與底物蛋白間的相互作用,抑制Lap-SrtA的催化作用[24]。因此,查爾酮雖然對多種分選酶有抑制效果,但它也有一定的副作用,如果長期作用于生物體,很可能會影響機體內的正常菌群。鑒于查爾酮的廣譜抑制效應,本研究認為,以競爭性抑制為原理篩得的SrtA抑制劑有一定的缺陷,針對致病菌分選酶抑制劑的開發可以從它們對Ca2+的敏感性入手,如果可以進一步確定Ca2+的作用機制,設計相關實驗,降低SrtA與Ca2+的相互作用,同樣可以有效抑制致病菌SrtA的活性,同時不影響嗜酸乳桿菌ATCC4356分選酶的正常功能。
乳酸菌必須定殖于人體腸道中才能發揮益生作用,因此,乳酸菌對腸道細胞的黏附被認為是定殖的首要條件[28]。但是近年來不斷有研究顯示,目前的益生菌產品中的乳酸菌在腸道中的滯留能力并不理想。雖然乳酸菌可以耐受人體消化道嚴苛的環境,成功到達腸道,但它們大部分并不能成功定殖,多數外源乳酸菌在腸道內存在時間很短,一旦停止從外界攝入,它們的數目會在2 周內迅速衰減[29-30]。因此,提高乳酸菌的定殖能力一直是乳品研究者們努力的方向。本實驗研究發現,Lap-SrtA對Ca2+不敏感,催化效率較低,會導致細菌表面黏附蛋白含量減少,對宿主細胞的黏附能力也會降低,因此,嗜酸乳桿菌在腸道中定殖成功率不高,很容易被其他腸道菌群排斥。目前,可以通過改變乳酸菌的培養條件,篩選黏附性較強的乳酸菌菌種,改善乳酸菌在腸道中的定殖率;另一方面,通過分子生物學的方法增強乳酸菌分選酶的含量,進而提高乳酸菌的黏附能力也是一個可行的方法。
分選酶雖然在多種乳酸菌中被發現,但它識別表面蛋白的種類及底物識別機制尚不明確,SrtA在腸道環境中的催化效率、轉運方式、相應的激活劑及抑制劑等仍需要進一步闡明。只有獲得這些酶更為詳細的信息,才能使乳酸菌及其制品獲得更好的應用。
[1] 石潔, 王長軍. 病原菌逃避宿主細胞防御的策略[J]. 微生物學通報,2012, 39(1): 90-98.
[2] MARRAFFINI L A, DEDENT A C, SCHNEEWIND O. Sortases and the art of anchoring proteins to the envelopes of Gram-positive bacteria[J]. Microbiology & Molecular Biology Reviews Mmbr, 2006,70(1): 192-221. DOI:10.1128/MMBR.70.1.192-221.2006.
[3] ILANGOVAN U, TONTHAT H, IWAHARA J, et al. Structure of sortase, the transpeptidase that anchors proteins to the cell wall of Staphylococcus aureus[J]. Proceedings of the National Academy of Sciences, 2001, 98(11): 6056-6061. DOI:10.1073/pnas.101064198.
[4] 羅立新, 施周銘. 一種抗革蘭氏陽性致病菌新型靶酶: 分選酶[J]. 生物化學與生物物理進展, 2006, 33(9): 828-833.
[5] CHEN J, DONG H, MURFIN K E, et al. Active site analysis of sortase A from Staphylococcus simulans, indicates function in cleavage of putative cell wall proteins[J]. Biochemical & Biophysical Research Communications, 2016, 478(4): 1653-1659. DOI:10.1016/j.bbrc.2016.08.175.
[6] 李森, 熱依漢古麗·麥麥提力. 單增李斯特菌srtA基因敲除菌株的構建及其生物學特性[J]. 食品科學, 2017, 38(4): 113-117. DOI:10.7506/spkx1002-6630-201704019.
[7] MAZMANIAN S K, LIU G, TONTHAT H, et al. Staphylococcus aureus sortase, an enzyme that anchors surface proteins to the cell wall[J]. Science, 1999, 285(5428): 760-763.
[8] PATERSON G K, MITCHELL T J. The role of Streptococcus pneumoniae, sortase A in colonisation and pathogenesis[J]. Microbes &Infection, 2006, 8(1): 145-153. DOI:10.1016/j.micinf.2005.06.009.
[9] MALIK S, PETROVA M I, CLAES I J, et al. The highly autoaggregative and adhesive phenotype of the vaginal Lactobacillus plantarum strain CMPG5300 is sortase dependent[J]. Applied & Environmental Microbiology, 2013, 79(15): 4576-4585. DOI:10.1128/AEM.00926-13.
[10] LEBEER S. Functional analysis of Lactobacillus rhamnosus GG pili in relation to adhesion and immunomodulatory interactions with intestinal epithelial cells[J]. Applied & Environmental Microbiology, 2012, 78(1):185-193. DOI:10.1128/AEM.06192-11.
[11] WU Z, GUO X, WANG Q, et al. Sortase A-catalyzed transpeptidation of glycosylphosphatidylinositol derivatives for chemoenzymatic synthesis of GPI-anchored proteins[J]. Journal of the American Chemical Society,2010, 132(5): 1567-1571. DOI:10.1021/ja906611x.
[12] KONSTANTINOV S R, SMIDT H, DE VOS W M, et al. S layer protein A of Lactobacillus acidophilus NCFM regulates immature dendritic cell and T cell functions[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(49): 19474-19479.DOI:10.1073/pnas.0810305105.
[13] RASK C, ADLERBERTH I, BERGGREN A, et al. Differential effect on cell-mediated immunity in human volunteers after intake of different lactobacilli[J]. Clinical & Experimental Immunology, 2013, 172(2): 321-332. DOI:10.1111/cei.12055.
[14] CALL E K, KLAENHAMMER T R. Relevance and application of sortase and sortase-dependent proteins in lactic acid bacteria[J]. Frontiers in Microbiology, 2013, 4(3): 73. DOI:10.3389/fmicb.2013.00073.
[15] ZHULENKOVS D, RUDEVICA Z, JAUDZEMS K, et al.Discovery and structure-activity relationship studies of irreversible benzisothiazolinone-based inhibitors against Staphylococcus aureus sortase A transpeptidase[J]. Bioorganic & Medicinal Chemistry, 2014,22(21): 5988-6003. DOI:10.1016/j.bmc.2014.09.011.
[16] BI C, WANG L, NIU X, et al. The use of chlorogenic acid and its analogues as inhibitors: an investigation of the inhibition of sortase A of Staphylococcus aureus, using molecular docking and dynamic simulation[J]. Biotechnology Letters, 2016, 38(8): 1-7. DOI:10.1007/s10529-016-2112-5.
[17] LIU B, CHEN F, BI C, et al. Quercitrin, an inhibitor of sortase A,interferes with the adhesion of Staphylococcal aureus[J]. Molecules,2015, 20(4): 6533-6543. DOI:10.3390/molecules20046533.
[18] LARKIN M A, BLACKSHIELDS G, BROWN N P, et al. Clustal W and Clustal X version 2.0[J]. Bioinformatics, 2007, 23(21): 2947-2948.DOI:10.1093/bioinformatics/btm404.
[19] GOUET P, COURCELLE E, STUART D I. ESPript: analysis of multiple sequence alignments in PostScript[J]. Bioinformatics, 1999,15(4): 305-308.
[20] 羅立新, 江彬強, 陳謀通. 新抗菌靶點分選酶基因(srtA)在兩種原核載體中的克隆表達[J]. 微生物學報, 2009, 49(2): 186-190.
[21] LI H, CHEN Y, ZHANG B, et al. Inhibition of sortase A by chalcone prevents Listeria monocytogenes, infection[J]. Biochemical Pharmacology, 2016, 106: 19-29. DOI:10.1016/j.bcp.2016.01.018.
[22] NAIK M T, SUREE N, ILANGOVAN U, et al. Staphylococcus aureus sortase A transpeptidase. calcium promotes sorting signal binding by altering the mobility and structure of an active site loop[J]. Journal of Biological Chemistry, 2005, 281(3): 1817-1826. DOI:10.1074/jbc.M506123200.
[23] KUMAR D, KUMAR M, KUMAR A, et al. Chalcone and curcumin derivatives: a way ahead for malarial treatment[J]. Mini Reviews in Medicinal Chemistry, 2013, 13(14): 2116.
[24] 李洪恩. 查爾酮對單增李斯特桿菌以及肺炎鏈球菌D39分選酶A抑制活性的分子機制研究[D]. 長春: 吉林大學, 2016: 51-70.
[25] WALLOCK-RICHARDS D J, MARLES-WRIGHT J, CLARKE D J,et al. Molecular basis of Streptococcus mutans sortase A inhibition by the flavonoid natural product trans-chalcone[J]. Chemical Communications, 2015, 51(52): 10483-10485. DOI:10.1039/c5cc01816a.
[26] ZONG Y, BICE T T H, SCHNEEWIND O, et al. Crystal structures of Staphylococcus aureus sortase A and its substrate complex[J]. Journal of Biological Chemistry, 2004, 279(30): 31383-31389. DOI:10.1074/jbc.M401374200.
[27] COSSART P, JONQUIèRES R. Sortase, a universal target for therapeutic agents against Gram-positive bacteria?[J]. Proceedings of the National Academy of Sciences, 2000, 97(10): 5013-5015.
[28] 周方方, 郭本恒, 吳正鈞, 等. 干酪乳桿菌LC2W對兩種不同胃癌細胞的黏附作用[J]. 中國乳品工業, 2007, 35(8): 15-18.
[29] CHARBONNEAU D, GIBB R D, QUIGLEY E M M. Fecal excretion of Bifidobacterium infantis 35624 and changes in fecal microbiota after eight weeks of oral supplementation with encapsulated probiotic[J].Gut Microbes, 2013, 4(3): 201-211. DOI:10.4161/gmic.24196.
[30] FRESE S A, HUTKINS R W, WALTER J. Comparison of the colonization ability of autochthonous and allochthonous strains of lactobacilli in the human gastrointestinal tract[J]. Advances in Microbiology, 2012, 2(3): 399-409. DOI:10.4236/aim.2012.23051.

