姜黃素拮抗LPS活化巨噬細胞對胰島β細胞的損傷
史立言,劉 巖,陳 為,孟繁平,李 妍*
(1.吉林醫藥學院檢驗學院,吉林 吉林132013;2.延邊大學醫學院,吉林 延吉133002)
糖尿病(diabetes mellitus,DM)是由于胰島素分泌和(或)作用缺陷所引起慢性血糖水平增高為特征的代謝性疾病,雖然糖尿病的病因和發病機制尚未完全闡明,但越來越多的證據表明,免疫損傷因素參與胰腺的損傷[1]。胰島主要是由4類內分泌細胞組成,分泌胰島素的 β細胞組成胰島核心,而α、δ及 PP細胞組成胰島外殼。胰腺是血管密集、血供豐富的器官,當巨噬細胞(macrophage,Mφ)被趨化而浸潤入胰島微環境,可分泌細胞因子及釋放NO等,參與β細胞損傷。感染、代謝和損傷因素刺激下,Mφ的極化將導致其分泌細胞因子和功能的改變[2]。細菌脂多糖(lipopolysaccharides,LPS)結合Toll樣受體4(Toll like receptor 4,TLR-4)而活化Mφ,姜黃素(curcumin)具有抗炎效應[3]。本研究將探討其是否可通過調節Mφ極化而減輕活化巨噬細胞對胰島β細胞的損傷。
1 材料與方法
1.1材料小鼠細胞巨噬細胞RAW264.7和小鼠胰島β細胞Min-6保存于液氮中。1640培養液、胎牛血清(fetal calf serum,FCS)購自Gibco公司。PE熒光素標記抗小鼠CD40、CD86和CD206的抗體購自天津三箭生物技術有限公司;LPS和活性氧(ROS)熒光探針雙氯熒光黃乙酸乙酯(Dichlorofluorescin diacetate,DCFH-DA)溶液購自上海碧云天生物科技有限公司;雙染凋亡檢測試劑盒和酶聯免疫吸附技術(ELISA)檢測小鼠TNF-α試劑盒購eBioscience公司。姜黃素購自Sigma Aldrich公司。
1.2細胞培養和處理復蘇液氮凍存RAW 264.7細胞,在含10% 小牛血清1640培養液、5% CO2、飽和濕度37 ℃培養;用含0.25% 胰蛋白酶和0.2% 乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA) 的消化液消化細胞,每周傳代2-3 次,取對數生長期細胞用于實驗。按1×106/孔接種細胞于6孔培養板,按如下分組加入LPS和姜黃素:對照組(control),脂多糖(LPS)組(2 μg /mL),姜黃素(curcumin)組(7.5 μmol/L ) 和聯合處理組(2 μg /mL LPS+ 7.5 μmol/L curcumin) 。繼續培養細胞24 h,收集培養物上清液于-20℃凍存,消化并收集細胞,完成后續實驗。復蘇并培養Min-6細胞,按1×106/孔接種于6孔培養板,細胞恢復貼壁生長后,按25%比例加入不同實驗分組處理后的RAW 264.7細胞上清液,不添加RAW 264.7細胞上清液組為對照組;繼續培養24 h后,消化收集Min-6細胞,完成后續實驗。
1.3免疫熒光染色和流式細胞術取不同處理因素作用后的RAW264.7細胞,每組 5×105個細胞,懸于100 μl PBS,加入1 μg FITC 標記抗CD 40抗體或陰性對照抗體,4 ℃下避光反應30 min。PBS洗2次后用400 μl的PBS重懸細胞,流式細胞儀檢測陽性表達細胞百分率。相同的方法檢測CD86和CD206表達。
1.4ROS檢測取不同處理因素作用后的RAW264.7細胞,每組 5×105個細胞,懸100 μl PBS ,加入DCFH-DA 儲存液,至其終濃度為 5 μmol/L,混勻后在 37 ℃避光反應 30 min,PBS洗2次,400 μl PBS 重懸細胞,流式細胞儀分析細胞內熒光,以熒光強度均值代表細胞內ROS含量。
1.5ELISA取不同處理因素作用的RAW 264.7 細胞上清液,按照 ELISA 試劑盒操作說明測定 檢測TNF-α含量,每個處理因素設3個復孔。
1.6細胞凋亡檢測取不同處理因素作用后Min-6細胞,每組 5×105個細胞,用195 μl結合緩沖液重懸細胞,加入 5 μl Annexin-V-FITC 工作液,室溫下避光反應 30 min;結合緩沖液洗滌細胞2次,400 μl結合緩沖液重懸細胞,加入PI 溶液5μl,立即上機用流式細胞儀分析。
2 結果
2.1LPS和姜黃素對RAW264.7細胞膜分子表達的影響
實驗結果表明,LPS和姜黃素對RAW264.7細胞膜分子CD40、CD86和CD206的表達均有影響(表1)。與對照組比較,脂多糖組CD40和CD86表達增加,而CD206表達減少;姜黃素組CD206表達明顯增加,CD40和CD86略下降。與脂多糖組比較,聯合處理組CD206表達略增加,CD40和CD86下降。

表1 LPS和姜黃素對RAW264.7細胞膜分子表達的影響
*與對照組(control)比較,P<0.05**與脂多糖組(LPS)比較,P<0.05
2.2LPS和姜黃素對RAW264.7細胞分泌TNF-α的影響
通過檢測發現,LPS可促進RAW264.7釋放TNF-α入細胞培養上清液,而姜黃素處理后,細胞分泌TNF-α較脂多糖組明顯減少(表2)。
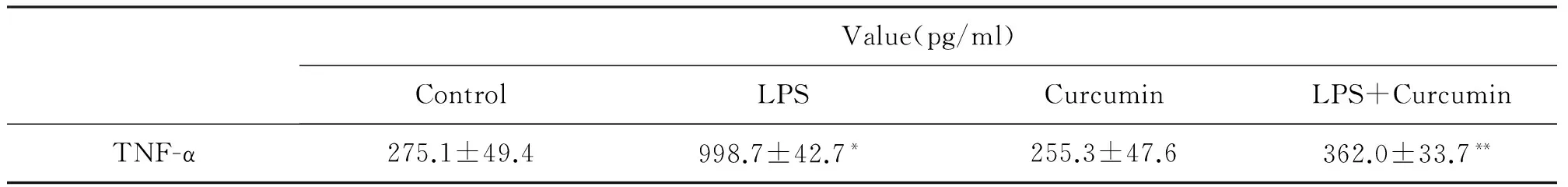
表2 LPS和姜黃素對RAW264.7分泌TNF-α的影響
*與對照組(control)比較,P<0.05**與脂多糖組(LPS)比較,P<0.05
2.3LPS和姜黃素對RAW264.7細胞活性氧的影響
ROS主要由細胞內線粒體產生,巨噬細胞在活化、吞噬和殺傷病原體的過程中伴隨ROS增加[4]。通過熒光探針法檢測細胞活性氧,對照組(control),脂多糖(LPS)組(2 μg /mL),姜黃素(curcumin)組(7.5 μmol/L ) 和聯合處理組代表ROS含量的熒光強度值分別為12.4±1.3,25.7±2.8,9.7±0.9和11.6±1.0(圖1)。分析表明,LPS導致細胞內ROS顯著增加,而低濃度的姜黃素對細胞內ROS僅有弱的減少效應(與對照組比較P<0.05);但姜黃素能能顯著減少LPS激發的活性氧(與脂多糖組比較P<0.05)。

圖1 LPS和姜黃素對RAW264.7細胞活性氧的影響
2.4姜黃素拮抗LPS活化巨噬細胞對Min-6細胞的損傷
采用雙染法檢測Min-6細胞凋亡情況,用新鮮培養液培養組作為空白組(blank),而添加不同條件培養液組對應命名,即對照組(control),脂多糖(LPS)組(2 μg/mL),姜黃素(curcumin)組(7.5 μmol/L ) 和聯合處理組(LPS +curcumin)。
3 討論
糖尿病發生發展的核心是胰島β細胞的功能障礙[5]。多項研究顯示,多種炎癥因子可對胰島β細胞造成損傷,包括TNF-α、IFN-γ和IL-1β等[6],損傷的胰島β細胞刺激巨噬細胞活化,致使其分泌更多的炎性因子,進一步加重胰島細胞的損傷[7]。因此,抑制巨噬細胞活化,使其向調節性分化,可能成為糖尿病的治療手段之一。姜黃素是一種從姜科、天南星科植物的根莖中提取出的一種成分,是傳統中藥姜黃的主要成分,其具有抗炎、抗氧化、抗腫瘤及降血脂等作用[8]。研究表明,它不僅能夠抑制巨噬細胞活化,而且具有使已活化的巨噬細胞向調節型轉變的功能[9]。LPS是細菌細胞壁的主要成分,可刺激巨噬細胞活化,產生炎癥[10]。本研究中,利用LPS誘導小鼠巨噬細胞Raw264.7,使其發生M1型極化,并以其產生的含有炎癥因子的培養液上清作用于小鼠胰島Min-6細胞,模擬體外炎癥損傷模型。結果顯示,LPS使Raw264.7細胞膜分子CD40和CD86表達均有增加,而CD206表達減少,且TNF-α分泌增加,細胞內ROS增加,表明成功建立炎癥模型;而加入姜黃素后,以上指標的變化明顯減弱甚至被逆轉。將M1極化后的Raw264.7培養上清加入Min-6細胞后,以姜黃素干預后的炎癥模型與之對比,雙染凋亡結果顯示,Min-6細胞受到M1極化的巨噬細胞炎癥因子刺激,凋亡比例明顯增加,而姜黃素可顯著抑制其損傷作用,提示姜黃素可能拮抗巨噬細胞的活化,保護炎性因子對胰島細胞的損傷。
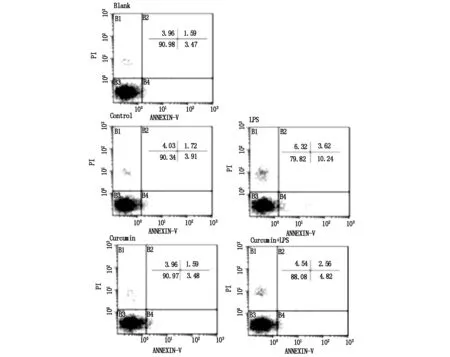
圖2 姜黃素拮抗LPS活化巨噬細胞對Min-6細胞的損傷
[1]Itariu BK,Stulnig TM.Autoimmune aspects of type 2 diabetes mellitus-a mini-review[J].Gerontology,2014,60(3):189.
[2]Garzetti L,Menon R,Finardi A,et al.Activated macrophages release microvesicles containing polarized M1 or M2 mRNAs[J].Journal of Leukocyte Biology,2014,95(5):817.
[3]Nahar PP,Slitt AL,Seeram NP.Anti-Inflammatory Effects of Novel Standardized Solid Lipid Curcumin Formulations[J].Journal of Medicinal Food,2015,18(7):786.
[4]Y,Li,H,Zhu,P,Kuppusamy,JL,Zweier,MA,Trush.Mitochondrial Electron Transport Chain-Derived Superoxide Exits Macrophages:Implications for Mononuclear Cell-Mediated Pathophysiological Processes[J].React Oxyg Species (Apex),2016,1(1):89.
[5]Ludwig B,Barthel A,Reichel A,et al.Modulation of the pancreatic islet-stress axis as a novel potential therapeutic target in diabetes mellitus[J].Vitamins & Hormones,2014,95:195.
[6]吳 紅,梁尚棟.巨噬細胞對2型糖尿病免疫炎性反應作用的研究進展[J].重慶醫學,2015(27):3861.
[7]Morris DL.Minireview:Emerging Concepts in Islet Macrophage Biology in Type 2 Diabetes[J].Molecular Endocrinology,2015,29(7):946.
[8]Nabavi SF,Thiagarajan R,Rastrelli L,et al.Curcumin:a natural product for diabetes and its complications[J].Current Topics in Medicinal Chemistry,2015,15(23):2445.
[9]陳方圓,袁祖貽,周 娟,等.姜黃素促進 RAW264.7源性 M1巨噬細胞向替代激活 M2表型極化[J].西安交通大學學報(醫學版),2015(2):257.
[10]叢賈囡,宋占晨,曲 忻.脂多糖促進人結膜上皮細胞IL-6的表達[J].中國實驗診斷學,2017,21(9).

