硅膠固相萃取-高效液相色譜法測定植物油中的特丁基對苯二酚含量
金瑚,熊巍林,包李林,周青燕,鄒燕娣,林俞霞
(道道全糧油股份有限公司,國家油菜籽加工技術研發分中心,湖南 岳陽,414000)
食用油脂在加工、貯存、使用過程中極易受到光、熱、酶、金屬離子等作用而發生氧化酸敗變質,尤其是富含不飽和雙鍵的植物油更易發生氧化變質。為防止食用油脂酸敗,產生對人體有害的物質, 生產廠家會其加入抗氧化劑。目前常用的氧化劑主要有丁基羥基茴香醚(butyl-hydroxyanisd,BHA)、二丁基羥基甲苯(butylated-hydroxytoluene,BHT)、特丁基對苯二酚(tert-butylhydroquinone,TBHQ)、沒食子酸丙酯(propyl-gallate, PG)等,其中TBHQ的抗氧化性能是BHA、BHT、PG的2~5倍,且其熱穩定性好,低毒,具有抑制細菌和霉毒作用,遇金屬離子不著色等諸多優點而廣泛應用在食用植物油中[1-3]。但是攝入過量TBHQ也會對人體造成傷害[4-5],我國食品添加劑使用衛生標準(GB 2760—2014)規定TBHQ使用的最大量為200 mg/kg。因此油脂中TBHQ應該謹慎監測。現行檢驗方法主要采用氣相色譜法[6-8]、薄層色譜法[6]、比色法[6]和高效液相色譜法[10-22]。油樣的前處理大多采用溶劑提取法,而采用固相萃取的前處理較少。本實驗采用硅膠作為吸附劑進行萃取,利用高效液相色譜進行測定TBHQ含量,為油脂中TBHQ含量的測定提供一種方法。
1 材料與方法
1.1 試驗材料
1.1.1 原料與試劑
硅膠(100~200 μm),青島海洋化工;TBHQ標準品(純度≥99%),滕州市天益工貿有限公司;甲醇(色譜純),Sigma-Alorich;正己烷(分析純),湖南匯虹試劑有限公司;二氯甲烷(分析純),天津市科密歐化學試劑有限公司;不含TBHQ的葵花籽油,公司自給;洗脫液為A:100 mL正己烷/二氯甲烷混合液(體積比1∶1),B:50 mL二氯甲烷。
1.1.2 儀器與設備
1260型高效液相色譜(配有紫外檢測器),安捷倫;RE-201型旋轉蒸發儀,上海越眾儀器設備有限公司;HGC-12A氮吹儀,天津市恒奧科技發展有限公司;玻璃層析柱d=1.2 cm,l=47 cm,帶砂芯配旋塞,上海宸喬生物科技有限公司。
1.2 試驗方法
1.2.1 色譜條件
色譜條件:ZORBAX SB-C18柱(4.6 mm×250 mm);柱溫為30 ℃;檢測波長為280 nm;進樣量20 μL;流動相C為甲醇,流動相D為1%乙酸水溶液,梯度見表1。
1.2.2 標準溶液的繪制和儀器檢出限
稱取0.1 g(精確至0.000 1 g)的TBHQ,用甲醇溶解并定量至100 mL,配制成1 mg/mL標樣儲備液。取一定量的標樣儲備液用甲醇分別稀釋配制成10、50、100、150、200、250 μg/mL標準使用液, 按照1.2.1
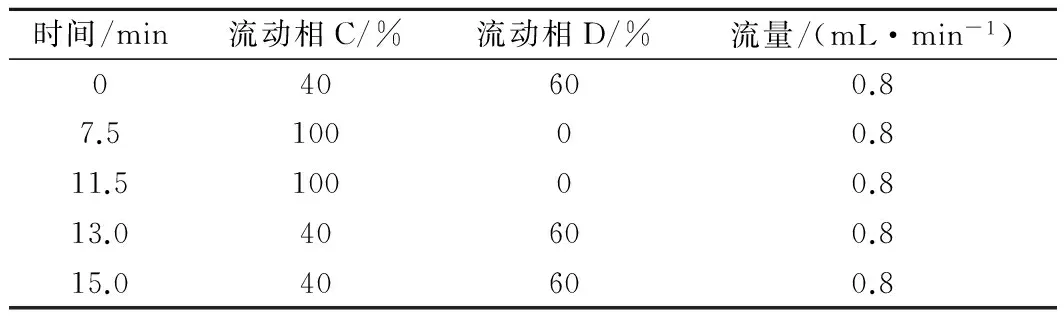
表1 流動相洗脫梯度
中的液相色譜條件進行分析,以標準液的濃度為橫坐標,其峰面積為縱坐標繪制標準曲線。其線性方程如式(1)所示,R2=0.998 6,以儀器的S/N=3計算,測得儀器最低檢出限為1 mg/kg。
Y=20.84×C+34.6
(1)
式中:Y為峰面積;C為TBHQ質量濃度,μg/mL。
A值的大小決定了定子內圓單位表面積所產生的繞組銅損的大小,因而直接影響溫升和效率的高低。在定子鐵心內徑確定的前提下,選擇不同的槽數可決定不同的A值, 電機定子槽數與電負荷的對
1.2.3 樣品的處理
向層析柱中濕法裝入15.0 g硅膠,稱取0.1 g(精確至0.000 1 g)油樣,3~4 mL正己烷溶解上樣,待流完后棄去,加入100 mL A或50 mL B洗脫液,流速為1滴/s,用平底燒瓶收集洗脫液,旋蒸濃縮至近干,向平底燒瓶中加入石油醚清洗2次,每次1 mL,將清洗液轉移到 5 mL玻璃樣品瓶中,并在60 ℃的氮吹儀蒸發至干,加甲醇定容至1 mL,過0.45 μm有機濾膜,上機測定。
2 結果與分析
2.1 樣品前處理探討
鑒于TBHQ和植物油的極性相差較大,而TBHQ屬于酸性類物質,選用硅膠作為吸附劑,能滿足兩者的分離。能否準確測定油中的TBHQ含量,跟硅膠量、油樣量、洗脫劑的極性和用量有密切關系。本實驗以100 mg/kg葵花籽油為樣品,以測出該樣品的TBHQ含量和油脂凈化率高為目的來優化前處理過程。
2.1.1 硅膠量的影響
固定100 mL洗脫液A或50 mL洗脫液B,油樣為0.1 g(TBHQ為10 μg),流速為1滴/s。分別稱取10、15、20 g的硅膠進行試驗,結果發現:當硅膠量為20 g時,使得少量的TBHQ殘留在硅膠柱內沒有被洗脫出來;當硅膠量為10 g時,樣品組分在硅膠內未能進行有效的固液動態平衡分離,導致油脂沒被吸附就洗脫下來了;當硅膠量為15 g時,TBHQ和油脂能較好地分離。
2.1.2 洗脫劑的選擇
固定硅膠量為15 g,油樣0.1 g(TBHQ為20 μg),流速為1滴/s。鑒于目標物TBHQ屬于較大的極性物質,因而選擇洗脫劑為有一定極性的有機溶液。主要選擇了揮發性較小,較為常見且揮發性較小,毒性較小的有機溶劑為正己烷和二氯甲烷。經過反復試驗證明:直接選用極性較大的二氯甲烷作為洗脫劑,TBHQ較易洗脫下來,但是需要控制洗脫劑的用量,否則,用量太大油脂也會一同洗脫下來。經試驗得知,單純使用二氯甲烷作為洗脫劑,且用量為50 mL可以滿足要求。當使用正己烷和二氯甲烷混合液時,需要配制合適的極性才能較好的分離TBHQ和油脂。經過反復試驗,當正己烷和二氯甲烷的體積比為1∶1時,100 mL混合洗脫液足以將20 μg的TBHQ洗脫下來。
2.1.3 洗脫流速的影響
固定硅膠量為15 g,100 mL洗脫液A或50 mL洗脫液B,油樣為0.1 g(TBHQ為10 μg)。流速過大,樣品的洗脫時間縮短,但是吸附到硅膠上的組分還沒來得及擴散就隨著流動相洗脫出去了,使得分離效果差。流速過慢,使得分離時間也較長,組分在硅膠柱內的保留時間長,使得軸向擴散增大,不利于組分分離,經試驗反復證明,流速為1滴/s可以較好地分離TBHQ和油脂。
2.1.4 油樣量的影響
固定硅膠量為15 g,100 mL洗脫液A或50 mL洗脫液B,流速為1滴/s。油樣量大,則更多油脂洗脫下來,油樣量小,若樣品的TBHQ含量少,則可能檢測不出來。經試驗證明,0.1 g的油樣量較為合適。
2.1.5 層析柱規格的影響
固定硅膠量為15 g,100 mL洗脫液A或50 mL洗脫液B,油樣為0.1 g(TBHQ為10 μg),流速為1滴/s。分別選取內徑分別為1.2 cm和2.0 cm的層析柱進行試驗。試驗證明:當層析柱內徑為2 cm時,上同樣量的硅膠,層析柱內填充硅膠高度較矮,使得TBHQ和油脂分離不理想;而當使用內徑較小的層析柱時,硅膠高度較高,使分離效果較理想。
2.2 色譜分離條件
如圖1所示,樣品中的TBHQ與雜質能較好地分開,雜質峰不干擾測定。TBHQ的保留時間為6.227 min。將同一樣品在同一天內重復測定6次并取平均值計算儀器的精密度,測得變異系數RSD%為5.5%,說明儀器精密度良好。
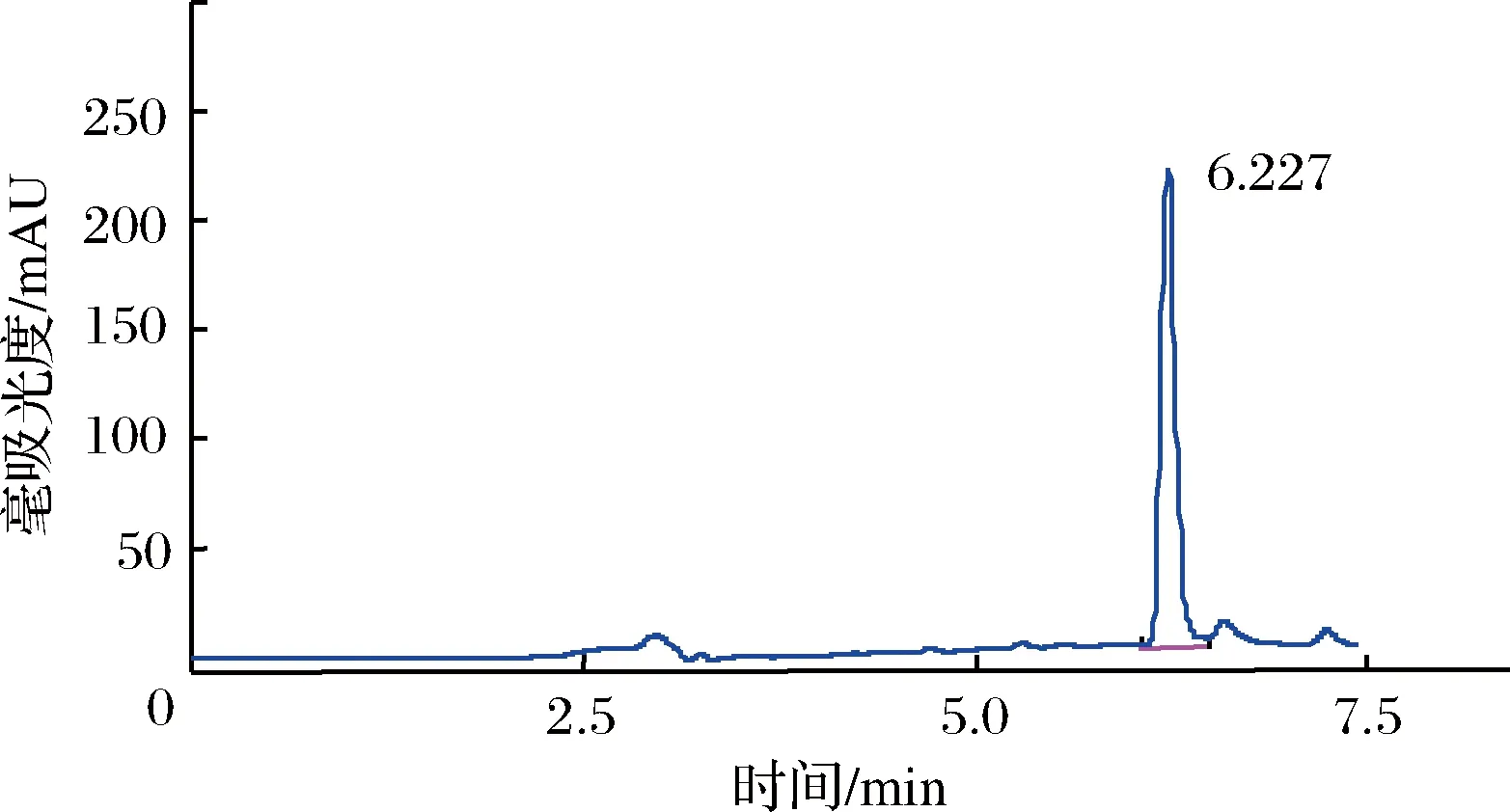
圖1 樣品中TBHQ的色譜分離圖Fig.1 chromatographic separation figure of TBHQ in sample
2.3 方法的回收率和精密度
向不含TBHQ葵花籽油中添加TBHQ,配制濃度為500 mg/kg的儲備樣,繼續稀釋分別配制成60、100、250 mg/kg的標樣,分別稱取少于0.1 g(精確至0.000 1 g)的3種標樣,作為3個加標水平,按照試驗1.2.3樣品處理過程,每個加標樣水平進行3次平行測定,取平均值,計算3種方法的回收率和RSD%。測定結果見表2。
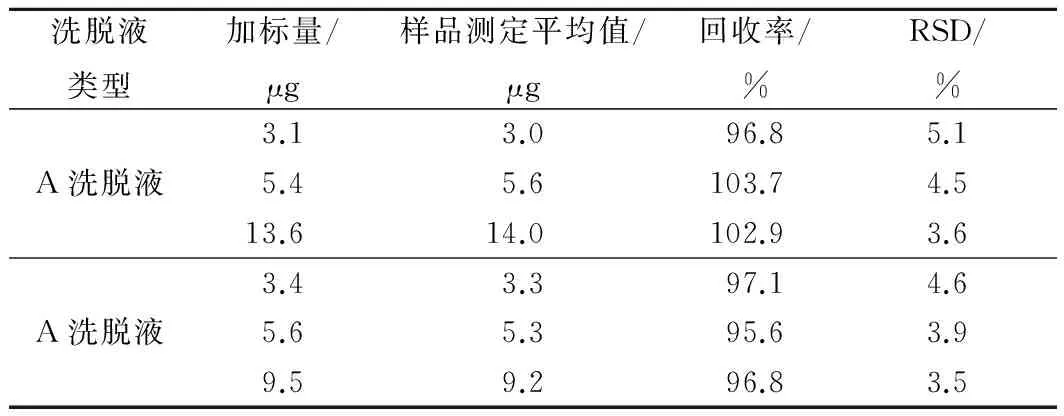
表2 TBHQ含量的回收率
由表2可知, 方法回收率在95.6%~103.7%, RSD%在3.5%~5.1%,說明該方法具有良好的準確性和重現性。
2.4 方法的最大萃取量
稱取含TBHQ為250 mg/kg的油樣0.1 g(精確至0.000 1 g),按照1.2.3步驟處理油樣。實驗結果表明:100 mL的A洗脫液能洗脫21 μg TBHQ;50 mL的B洗脫液能洗脫16 μg TBHQ。
2.5 該方法測定結果與NY/T1602—2008農業行業標準的比較
由表3可知,該方法測出同一油樣的TBHQ含量基本與農業行業標準一致。
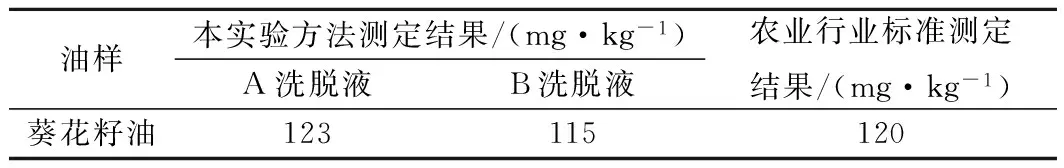
表3 比對實驗
2.6 樣品測定
對本公司葵花籽油中的TBHQ含量進行抽檢6批次,利用A洗脫液和B洗脫液分別抽檢3批次,按照1.2.3的前處理過程進行處理,其結果如表4所示。

表4 樣品中TBHQ含量
3 結論
采用硅膠作為吸附劑萃取植物油中TBHQ,利用反相液相色譜法測定其含量。本實驗對硅膠的用量、油樣量、洗脫劑的極性、流速和層析柱規格進行了優化組合。優化后的試驗,其回收率在95.6%~103.7%, RSD%在3.5%~5.1%,同一樣品的TBHQ含量測定結果與NY/T1602—2008測定的基本一致,說明該方法具有良好的準確性和重復性,可用于植物油中TBHQ含量的測定。
[1] 李書國,陳輝,李雪梅.油脂抗氧化劑分析檢測技術與方法研究進展[J].糧食與油脂,2007(10):42-45.
[2] PERRIN C, MEYER L. Simultaneous determination of ascorbyl palmi-tate and nine phenolic antioxidants in vegetable oils and edible fats by HPLC[J]. Journal of the American Oil Chemists Society, 2003, 80(2):115-118.
[3] 李濤,余旭亞.抗氧化劑的研究與應用現狀[J].食品研究與開發,2003,24(2):23-26.
[4] 蔡發,段小娟,牟志春,等. 高效液相色譜法同時測定食品中的12種抗氧化劑[J].食品科學,2010,31(8):207-211.
[5] 俞曄, 顧燕,曹文忠, 等.高效液相色譜法同時測定食用油中 9 種抗氧化劑[J].食品科技,2007,44(11):181-183.
[6] GB/T 23373—2009.食品中抗氧化劑丁基羥基茴香醚(BHA)、二丁基羥基甲苯(BHT)與特丁基對苯二酚(TBHQ)的測定[S].
[7] 岳振峰,藍芳,謝麗琪.氣相色譜-質譜法測定 XO 醬中 BHA、BHT 和 TBHQ[J].中國糧油學報,2004,19(5):83-85.
[8] 劉紅河,陳衛,康莉,等.氣相色譜法同時測定食品中3種抗氧化劑[J].現代預防醫學,2006,33(12):2 307-2 309.
[9] SN/T 1050—2014.出口油脂中抗氧化劑的測定 高效液相色譜法[S].
[10] NY/T 1602—2008.植物油中叔丁基羥基茴香醚(BHA)、2,6-二叔丁基對甲酚(BHT)和特丁基對苯二酚(TBHQ)的測定 高效液相色譜法[S].
[11] SN/T1050—2002.進出口油脂中抗氧化劑的測定—液相色譜法[S].
[12] 陳錚.液相色譜法測定食用油中抗氧化劑的方法研究[J].計量與測試技術,2001(2):39.
[13] 胡小鐘,建新,孫國保,等.高效液相色譜法同時測定油脂中的9種抗氧化劑[J].分析測試學報,1999,18(5):21.
[14] AOAC Oficial Method 938.15.Phenolic Antioxidants in Oils,Fats and Butter Oil Liquid Chromatographic Method[S].
[15] 郭舒崗,宋先梅,郝曉宏,等.高效液相色譜法測定食用油脂中的TBHQ[J].中國衛生檢驗雜志,2005,15(8):1 004.
[16] 劉年豐,涂一名,夏虹,等.高效液相色譜法測定油脂中抗氧化劑 BHA、TBHQ[J].分析科學學報,2003,10(6):549-551.
[17] 淑娟,馮楠,安娟,等. 快速分離液相色譜法同時測定食品中10種脂溶性抗氧化劑[J].中國衛生檢驗雜志,2010,20(8):1 890-1 892.
[18] 張中偉,李俊怡,穆子明.高效液相色譜外標法測定食用油脂中的叔丁基對苯二酚(TBHQ) [J].食品科技,2012,37(2):313-315.
[19] 許俊妹,馬廣東,張櫻子. 高效液相色譜法同時測定油炸食品中 TBHQ、BHA、BHT[J].廣東化工,2013,40(9):160-161.
[20] 周曉婷,曹小妹,張敬敬,等. 溶劑梯度結合流速梯度洗脫—高效液相色譜法快速測定食用植物油中四種抗氧化劑[J].糧食與油脂,2012(7):32-34.
[21] PERRIN C, MEYER L. Quantification of synthetic phenolic antioxi-dants in dry foods by reversed-phase HPLC with photodiode array detection[J]. Food Chemistry, 2002, 77(1): 93-100.
[22] PERRIN C, MEYER L. Simultaneous determination of ascorbyl palmi-tate and nine phenolic antioxidants in vegetable oils and edible fats by HPLC[J]. Journal of the American Oil Chemists Society,2003,80(2):115-118.

