迷迭香提取物與NaCl協(xié)同改善肌原纖維蛋白凝膠特性
賈 娜,謝振峰,李儒仁*,邵俊花,劉登勇,劉裕慧
肌原纖維蛋白(myofibrillar protein,MP)屬于鹽溶性蛋白,是肌肉蛋白質(zhì)的主要組分,其主要功能特性是能夠熱誘導形成凝膠,從而賦予肉制品尤其是肉糜制品良好的質(zhì)地與口感。溶解度與MP的乳化凝膠特性緊密相關(guān)。在一定離子強度范圍內(nèi),溶解度隨離子強度的增加而增加,因此,在肉制品加工中通常加入NaCl以提高離子強度,同時通過斬拌和混合來提高MP的溶解度。有研究表明,一定離子強度范圍內(nèi),隨著離子強度的增加,豬肉MP的凝膠強度增大[1]。NaCl濃度為0.6 mol/L時,MP的溶解度較高,能夠形成規(guī)則有序的三維凝膠網(wǎng)絡結(jié)構(gòu),而在低濃度NaCl條件下,大部分MP處于未溶解狀態(tài),不能形成穩(wěn)定的凝膠結(jié)構(gòu)[2]。
香辛料是肉制品加工中的主要輔料,香辛料的使用一方面可以賦予產(chǎn)品一定的風味,另一方面還能起到抗氧化、抑菌等作用。目前,香辛料提取物在肉制品抑菌、抗氧化方面的研究報道較多。將迷迭香提取物和香蜂花提取物應用于熟豬肉糜制品,可以顯著降低硫代巴比妥酸值和己醛含量,說明二者起到了抑制脂肪氧化的作用[3-4]。作為肉制品加工中兩種主要的輔料,NaCl和香辛料都會對蛋白質(zhì)的結(jié)構(gòu)和功能特性產(chǎn)生一定的影響;但是,二者究竟如何協(xié)同影響MP的結(jié)構(gòu)和功能特性,進而影響肉糜制品的品質(zhì),尚不完全清楚。本研究旨在制備含不同濃度NaCl的豬肉MP與迷迭香提取物的混合物,通過測定巰基含量、內(nèi)源熒光強度、流變特性、凝膠強度、保水性,以探討NaCl濃度和迷迭香提取物二者共同對MP結(jié)構(gòu)和凝膠特性的影響。
1 材料與方法
1.1 材料與試劑
三元豬背最長肌購自錦州大潤發(fā)超市;迷迭香購自當?shù)厮幏俊?/p>
氯化鈉、磷酸二氫鈉、磷酸氫二鈉、乙醇、磷酸鈉、氯化鎂、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)等均為國產(chǎn)分析純;Tris 美國Sigma公司。
1.2 儀器與設備
FW-200高速萬能粉碎機 北京中興偉業(yè)儀器有限公司;RE-52AA旋轉(zhuǎn)蒸發(fā)器 上海亞榮生化儀器廠;THZ-100B恒溫培養(yǎng)搖床 上海一恒科學儀器有限公司;ALPHA 1-2LD plus冷凍干燥機 德國Martin Christ公司;JYS-A900絞肉機 九陽股份有限公司;T25數(shù)顯型均質(zhì)機、RCT基本型磁力攪拌器 德國IKA集團;PL602-L電子天平 上海速展計量儀器有限公司;970CRT熒光分光光度計 上海精密科學儀器有限公司;UV-2550紫外-可見分光光度計 島津儀器(蘇州)有限公司;TGL-20M臺式高速冷凍離心機 湖南湘儀實驗室儀器開發(fā)有限公司;TA-XT Plus型質(zhì)構(gòu)分析儀 英國Stable Micro Systems公司;DHR-1流變儀 美國TA儀器公司。
1.3 方法
1.3.1 迷迭香提取物的制備
參照Zhang Xue等[5]的方法并做適當修改。迷迭香洗凈瀝干,放置45 ℃干燥箱中烘干,用高速萬能粉碎機粉碎,過40 目篩備用。取50 g粉末于1 000 mL帶塞的錐形瓶中,加入體積分數(shù)為95%的乙醇400 mL,塞緊瓶塞,置于恒溫培養(yǎng)搖床,55 ℃、110 r/min提取12 h,過濾,濾渣加入200 mL 95%的乙醇重提12 h后過濾,合并濾液,旋轉(zhuǎn)蒸發(fā)儀真空濃縮2 h(55 ℃、0.08 MPa),濃縮液在-50 ℃條件下真空冷凍干燥,真空度為7 Pa。所得提取物在-20 ℃保存?zhèn)溆茫缘闾崛÷?1.28%、含水率5%)。
1.3.2 提取MP與制備樣品
參照Liu Gang等[6]的方法并略作修改。稱取約500 g左右的豬肉,破碎并加入4 倍體積的提取液(10 mmol/L Na3PO4、0.1 mol/L NaCl、2 mmol/L MgCl2和1 mmol/L EDTA,pH 7.0),勻漿60 s,3 500 r/min冷凍離心15 min,取沉淀重復上述步驟兩次,最后所得沉淀加入4 倍體積0.1 mol/L NaCl溶液,按上述離心條件洗滌沉淀3 次,最后一次離心前用4 層紗布過濾,然后用0.1 mol/L HCl溶液調(diào)節(jié)pH值至6.0,所得MP于4 ℃冷藏備用。以牛血清白蛋白為標準品,利用雙縮脲法測定MP含量。
配制質(zhì)量濃度為5 mg/mL和40 mg/mL的MP溶液,分別加入0.01 g/g pro的迷迭香提取物,再向混合物中添加NaCl,使其終濃度分別為0.00、0.15、0.45、0.60 mol/L。配制好MP混合溶液于4 ℃冷藏過夜(12 h),同時以不添加迷迭香提取物的MP為對照,用于后續(xù)各項指標的測定。
1.3.3 巰基質(zhì)量摩爾濃度的測定
參照di Simplicio等[7]的方法并略作改進,取上述5 mg/mL的MP溶液1 mL,加8 mL Tris-甘氨酸溶液溶解,均質(zhì)后冷凍10 000 r/min離心15 min,除去不溶性蛋白并取上清液4.5 mL,加入0.5 mL 10 mmol/L Ellman試劑,搖勻靜置30 min后,在412 nm波長處測吸光度,以磷酸鹽緩沖溶液為對照。巰基質(zhì)量摩爾濃度的計算采用摩爾消光系數(shù)法,所得巰基質(zhì)量摩爾濃度以μmol/g pro表示,計算如式(1)所示。
式中:A為吸光度;ε為摩爾消光系數(shù)(13 600 L/(mol·cm));D為稀釋倍數(shù)。
1.3.4 內(nèi)源熒光強度的測定
依據(jù)李學鵬等[8]的方法并適當修改。準確量取0.5 mL 5 mg/mL的MP溶液,用pH 7.0的50 mmol/L磷酸鹽緩沖液稀釋至0.1 mg/mL,磁力攪拌2 h,10 000 r/min冷凍離心30 min,用熒光分光光度計測定。參數(shù)設置:激發(fā)波長為295 nm,波長掃描范圍為300~400 nm,掃描速率為12 000 nm/min,激發(fā)和發(fā)射狹縫寬度均為2.5 nm,靈敏度為3。
1.3.5 MP凝膠的制備
取按照1.3.2節(jié)處理好的40 mg/mL的MP溶液15 mL,置于稱量瓶中,密封,放置70 ℃恒溫水浴鍋中,持續(xù)水浴加熱30 min,隨后自來水冷卻30 min,凝膠樣品貯存在2~4 ℃的冰箱中備用。測定前將MP凝膠在室溫下放置20 min。
1.3.6 凝膠強度的測定
采用TA-XT Plus型質(zhì)構(gòu)分析儀進行測定。將待測樣品與稱量瓶置于平臺,測定參數(shù)為:探頭型號選擇P/0.5,下壓距離為凝膠高度的50%,觸發(fā)力為5 g,測試前速率2 mm/s,測試速率1 mm/s,測試后速率2 mm/s。
1.3.7 保水性的測定
參照Kocher等[9]的方法并適當修改。稱取5 g凝膠樣品,置于15 mL離心管中,稱質(zhì)量記為m2/g,隨后于3 000×g冷凍離心15 min,除去水分后再次稱質(zhì)量,記為m1/g,離心管質(zhì)量記為m0/g,保水性按式(2)進行計算。
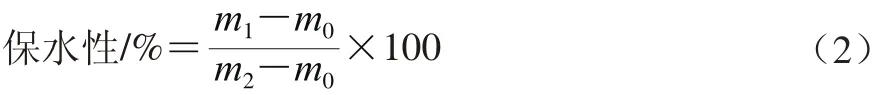
1.3.8 動態(tài)流變特性的測定
取一定量制備好的MP溶液,采用流變儀測定,選用50 mm平板測試,將不同處理條件下的MP乳液均勻涂布于測試平臺,消除氣泡并涂膜硅油密封,測試參數(shù)如下:頻率為0.1 Hz,應變2%,夾縫間距為0.5 mm,起始溫度20 ℃,升溫速率1 ℃/min,終止溫度80 ℃,在該參數(shù)下測定儲能模量(G’)。
1.4 數(shù)據(jù)統(tǒng)計分析
2 結(jié)果與分析
2.1 NaCl濃度和迷迭香提取物對MP結(jié)構(gòu)的影響


圖1 NaCl濃度對內(nèi)源熒光強度的影響Fig. 1 Effect of NaCl concentration and rosemary extract on intrinsicぼuorescence intensity of myoベbrillar proteins
蛋白質(zhì)在天然狀態(tài)下有特定的空間結(jié)構(gòu),蛋白質(zhì)中的色氨酸大量埋藏于內(nèi)部的疏水環(huán)境,色氨酸內(nèi)源熒光強度較高,熒光發(fā)射波長較短;但是,在部分解折疊情況下,蛋白質(zhì)熒光強度降低,發(fā)射波長發(fā)生紅移[10]。由圖1可以看出,添加迷迭香提取物組與對照組的內(nèi)源熒光強度隨NaCl濃度的增加并未呈現(xiàn)規(guī)律性的變化,具體原因有待進一步研究;而當NaCl濃度為0.45 mol/L時,與對照組相比,添加迷迭香提取物組色氨酸發(fā)射波長由332 nm紅移至334 nm,內(nèi)源熒光強度下降。說明加入迷迭香提取物后MP中的部分色氨酸暴露于極性環(huán)境中,由此造成三級結(jié)構(gòu)發(fā)生改變,其特定空間結(jié)構(gòu)部分解折疊,色氨酸內(nèi)源熒光強度下降有可能來自于肌球蛋白桿狀尾部的部分解螺旋[11],也有可能來自于肌球蛋白頭部的結(jié)構(gòu)變化(桿狀尾部對肌球蛋白分子熒光強度的貢獻只占總量的27%)[12-13],迷迭香提取物引起的MP三級結(jié)構(gòu)改變究竟來自于肌球蛋白的頭部還是桿狀尾部,需要進一步證實。此外,迷迭香提取物中的多酚、萜類[14]還有可能通過“屏蔽效應”影響MP的內(nèi)源熒光強度,這種效應可以通過“手和手套”模型來解釋(蛋白中部分疏水基團形成“手套”,而多酚通過氫鍵等與蛋白結(jié)合形成“手”,可能是這種屏蔽效應導致熒光強度下降[15]),該“屏蔽效應”還有可能體現(xiàn)在迷迭香提取物中的酚類物質(zhì)等與蛋白結(jié)合,吸附于蛋白質(zhì)表面,可能對蛋白質(zhì)起一定保護作用,導致熒光強度降低[16]。
2.2 NaCl濃度和迷迭香提取物對巰基質(zhì)量摩爾濃度的影響

圖2 NaCl濃度和迷迭香提取物對巰基質(zhì)量摩爾濃度的影響Fig. 2 Effect of NaCl concentration and rosemany extract on sulfhydryl group content
巰基是MP中重要的活性基團,易被氧化形成二硫鍵,引起蛋白質(zhì)分子間交聯(lián)、聚合,進而影響蛋白質(zhì)的功能特性[17]。從圖2可以看出,當NaCl濃度從0.15 mol/L增加至0.60 mol/L時,加或不加迷迭香提取物的MP的巰基質(zhì)量摩爾濃度變化不顯著(P>0.05),說明增加離子強度對MP巰基質(zhì)量摩爾濃度無顯著影響。當NaCl濃度一定時,與對照組相比,加入迷迭香提取物導致巰基質(zhì)量摩爾濃度顯著降低(P<0.05)。這可能是由于迷迭香提取物中主要成分為鼠尾草酚和鼠尾草酸,二者均含有一個能與巰基結(jié)合的位點,因此使得巰基含量下降[18-19]。Prodpran等[20]研究多酚對魚肉MP總巰基含量的影響時,也得到了類似結(jié)果,即酚類化合物導致總巰基含量降低,可能是由于巰基和酚羥基之間相互作用形成更穩(wěn)定的構(gòu)象。此外,高濃度的綠茶多酚也能與MP巰基通過共價交聯(lián)形成巰基-醌加成物,阻礙蛋白質(zhì)之間形成穩(wěn)定的二硫鍵[21]。
2.3 NaCl濃度和迷迭香提取物對凝膠強度的影響
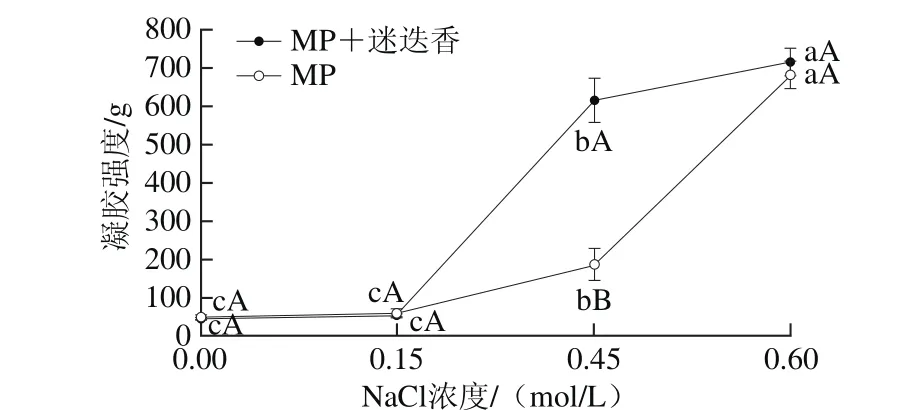
圖3 NaCl濃度和迷迭香提取物對凝膠強度的影響Fig. 3 Effect of NaCl concentration and rosemary extract on gel strength
從圖3可以看出,NaCl濃度在0.00~0.15 mol/L范圍內(nèi),MP+迷迭香組和MP組的凝膠強度變化不顯著(P>0.05),而當NaCl濃度從0.15 mol/L增加至0.60 mol/L時,兩組的凝膠強度均顯著增加(P<0.05)。這是由于一定范圍內(nèi)隨著NaCl濃度的增加,MP與NaCl離子互作形成離子基團雙電子層,降低MP分子之間的靜電相互作用,增加MP分子之間的斥力,水化作用增強,從而改善凝膠特性[22-23]。此外,MP分子之間斥力的增加,導致MP膨脹,持水力增大,這與保水性的結(jié)果一致[24]。當NaCl濃度為0.00、0.15 mol/L時,MP+迷迭香組的凝膠強度與對照組無顯著差異(P>0.05),其主要原因可能在于MP凝膠特性的充分發(fā)揮需要提供足夠的溶解度,NaCl濃度較低時(0.00、0.15 mol/L),MP的溶解度較差。高溶解度狀態(tài)下(0.45、0.60 mol/L)迷迭香提取物可以提高MP的凝膠強度,但在不同NaCl濃度條件下呈現(xiàn)出不同的結(jié)果,NaCl濃度為0.45 mol/L時,MP+迷迭香組的凝膠強度顯著高于MP組(P<0.05),這可能是由于該條件下,迷迭香提取物中含有的多酚類物質(zhì)很容易形成鄰苯醌或鄰苯半醌,該物質(zhì)與蛋白中的巰基、氨基等基團發(fā)生親核加成反應,使蛋白和酚之間形成C—N或C—S共價鍵[25-28]。NaCl濃度為0.60 mol/L時,MP+迷迭香組的凝膠強度高于MP組,但差異不顯著(P>0.05),離子強度的增加可能阻礙了部分蛋白-多酚共價鍵的形成,可見,迷迭香提取物對凝膠強度的顯著增效作用依賴于特定NaCl濃度,具體原因有待進一步研究。
2.4 NaCl濃度和迷迭香提取物對凝膠保水性的影響

圖4 NaCl濃度和迷迭香提取物對保水性的影響Fig. 4 Effect of NaCl concentration and rosemary extract on waterholding capacity
從圖4可以看出,當NaCl濃度從0.00 mol/L增加至0.15 mol/L時,MP+迷迭香組和MP組的保水性沒有顯著變化(P>0.05);隨著NaCl濃度繼續(xù)增加至0.45 mol/L時,兩組的保水性均呈顯著增加趨勢(P<0.05);當NaCl濃度繼續(xù)增加至0.60 mol/L時,MP組的保水性依舊顯著增加(P<0.05),而MP+迷迭香組增加不顯著(P>0.05)。保留肉品內(nèi)部的水分有兩個必要條件,首先肉中含有水分存在的空間,其次含有維持水分的作用力。有研究證實,水分在肉中的存留,主要依賴于水分子和蛋白之間的相互作用,如氫鍵、毛細管作用力、色散力等[29]。MP作為肉中的結(jié)構(gòu)蛋白質(zhì),為肉中的水分提供空間;蛋白所帶的凈負電荷形成強有力的吸附中心,為保留水分提供作用力。添加適量的NaCl可以顯著提高離子強度,有效改善MP的凝膠能力,使其形成均勻的網(wǎng)狀結(jié)構(gòu),同時隨著離子強度增加,MP所帶凈負電荷增加;蛋白與蛋白分子之間以及蛋白與水之間的作用增強,使得蛋白空間內(nèi)持水能力增加,保水性能增強[30-31]。MP+迷迭香組和對照組相比,NaCl濃度為0.45 mol/L時,MP+迷迭香組的保水性顯著高于MP組(P<0.05),其他NaCl濃度下差異不顯著(P>0.05)。一定離子強度下,添加一定量的迷迭香提取物能夠與MP相互作用,影響蛋白分子間以及蛋白與水之間的作用,使凝膠形成能力增強,從而對持水能力起一定促進作用。此外,酚與蛋白之間的相互作用能夠減小蛋白聚合物鏈間的空隙,從而使凝膠結(jié)構(gòu)增強,持水能力增加[32]。
2.5 NaCl濃度和迷迭香提取物對MP凝膠流變特性的影響
流變特性作為MP凝膠的重要特性,能夠反映凝膠的品質(zhì)。儲能模量(G’)反映MP凝膠的彈性特征,G’越高,表明形成凝膠的能力越強[2]。從圖5可以看出,當NaCl濃度為0.00、0.15 mol/L時,MP+迷迭香組和MP組的G’均未呈現(xiàn)典型的“幾”字形曲線,表明在該條件下,MP未能形成穩(wěn)定的凝膠結(jié)構(gòu)。這是由于低離子強度下,MP未能充分溶解,導致凝膠形成能力弱,G’較低。當NaCl濃度為0.45、0.60 mol/L時,G’從40 ℃開始逐漸增加,到46 ℃時達到峰值,這是由于該區(qū)間內(nèi)肌球蛋白頭部的α-螺旋結(jié)構(gòu)開始解旋,頭部交聯(lián),開始形成凝膠;隨后G’從46 ℃開始下降,是由于肌球蛋白尾部變性展開,蛋白穩(wěn)定性降低,黏彈性降低;從50 ℃開始,G’一直呈上升趨勢,主要是因為大多數(shù)肌球蛋白分子可能已經(jīng)展開,成為隨機線圈結(jié)構(gòu),增強了蛋白質(zhì)之間的交聯(lián),從而產(chǎn)生一個穩(wěn)定且不可逆的凝膠結(jié)構(gòu)[33-34]。一定NaCl濃度下,尤其當NaCl濃度為0.45 mol/L時,MP+迷迭香組的G’高于未加提取物的MP組,這可能是由于添加的迷迭香提取物與MP相互作用后產(chǎn)生更多結(jié)合位點,形成酰胺鍵,增大了蛋白與酚的交聯(lián)密度,導致彈性和黏性增強[35-36]。

圖5 NaCl濃度和迷迭香提取物對MP儲能模量的影響Fig. 5 Effect of NaCl concentration and rosemary extract on storage modulus of myoベbrillar proteins
3 結(jié) 論
依賴于特定NaCl濃度(0.45 mol/L),迷迭香提取物可以有效“彌補”減鹽對MP凝膠特性的不利影響。提取物中含有的酚酸、萜類等組分改變了肌球蛋白的三級結(jié)構(gòu),這種有利的部分解螺旋狀態(tài)可以在減鹽條件下有效改善MP的凝膠網(wǎng)絡結(jié)構(gòu),這是減鹽后凝膠強度、儲能模量和保水性沒有顯著下降的重要原因。研究結(jié)果可為尋找新型NaCl替代物提供一定的理論依據(jù)。
[1] JANG H S, CHIN K B. Emulsifing and gelling properties of pork myofibrillar protein as affected by various NaCl levels and pH values[J]. Korean Journal of Food Science and Animal Resources,2009, 81(3): 565-572. DOI:10.5851/kosfa.2011.31.5.727.
[2] 吳菊清, 魏朝貴, 韓敏義, 等. NaCl對豬肉肌原纖維蛋白乳化體系加工特性的影響[J]. 南京農(nóng)業(yè)大學學報, 2014, 37(6): 83-88.DOI:10.7685/j.issn.1000-2030.2014.06.012.
[3] LARA M S, GUTIERREZ J I, TIMóN M, et al. Evaluation of two natural extracts (Rosmarinusofficinalis L., and Melissa officinalis L.) as antioxidants in cooked pork parties packed in MAP[J]. Meat Science, 2011, 88(3): 481-488. DOI:10.1016/j.meatsci.2011.01.030.
[4] 賈娜, 郭倩, 宋立, 等. 迷迭香提取對雞肉糜冷藏過程中品質(zhì)特性的影響[J]. 食品與發(fā)酵科技, 2014, 50(1): 60-63; 91. DOI:10.3969/j.issn.1674-506X.2014.01-015.
[5] ZHANG Xue, KONG Baohua, XIONG Youling L., et al. Production of cured meat color in nitrite-free Harbin red sausage by Lactobacillus fermentum fermentation[J]. Meat Science, 2007, 77(4): 593-598.DOI:10.1016/j.meatsci.2007.05.010.
[6] LIU Gang, XIONG Youling L.. Contribution of lipid and protein oxidation to rheological differences between chicken white and red muscle myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 1996, 44(3): 779-784. DOI:10.1021/jf9506242.
[7] DI SIMPLICIO P, CHEESEMAN K, SLATER T. The reactivity of the SH group of bovine serum albumin with free radicals[J]. Free Radical Research, 1991, 14(4): 253-262. DOI:10.3109/10715769109088954.
[8] 李學鵬, 周凱, 王金廂, 等. 羥自由基對六線魚肌原纖維蛋白的氧化規(guī)律[J]. 中國食品學報, 2014, 14(6): 19-27. DOI:10.16429/j.1009-7848.2014.06.017.
[9] KOCHER P N, FOEGEDING E A. Microcentrifuge-based method for measuring water-holding of protein gels[J]. Journal of Food Science,1993, 58(5): 1040-1046. DOI:10.1111/j.1365-2621.1993.tb06107.x.
[10] CAO Y G, TRUE A D, CHEN J, et al. Dual role (anti-and pro-oxidant)of gallic acid in mediating myofibrillar protein gelation and gel in vitro digestion[J]. Journal of Agricultural and Food Chemistry, 2016,64(15): 3054-3061. DOI:10.1021/acs.jafc.6b00314.
[11] IWASAKI T, YAMAMOTO K. Changes in rabbit skeletal myosin and its subfragments under high hydrostatic pressure[J]. International Journal of Biological Macromolecules, 2003, 33(4): 215-220.DOI:10.1016/j.ijbiomac.2003.08.005.
[12] KING L, LEHRER S S. Thermal unfolding of myosin rod and light meromyosin: circular dichroism and tryptophan fluorescence studies[J]. Biochemistry, 1989, 28(8): 3498-3502. DOI:10.1021/bi00434a052.
[13] RAGHAVAN S, KRISTINSSON H G. Conformational and rheological changes in catfish myosin during alkali-induced unfolding and refolding[J]. Food Chemistry, 2008, 107(1): 385-398. DOI:10.1016/j.foodchem.2007.08.037.
[14] JIANG Jiang, XIONG Youling L.. Natural antioxidants as food and feed additives to promote health beneベts and quality of meat products:a review[J]. Meat Science, 2016, 120: 107-117. DOI:10.1016/j.meatsci.2016.04.005.
[15] HASLAM E, LILLEY T H, CAI Y, et al. Traditional herbal medicines:the role of polyphenols[J]. Planta Medica, 1989, 55(1): 1-8.DOI:10.1055/s-2006-961764.
[16] VONSTASZEWSKI M, JARA F L, RUIZ A L T G, et al. Nanocomplex formation between β-lactoglobulin or caseino macropeptide and green tea polyphenols: impact on protein gelation and polyphenols antiproliferative activity[J]. Journal of Functional Foods, 2012, 4(4):800-809. DOI:10.1016/j.jあ.2012.05.008.
[17] 吳菊清, 邵俊花, 魏朝貴, 等. 離子強度對豬肉肌原纖維蛋白乳化特性和理化特性的影響[J]. 食品科學, 2014, 35(23): 14-19.DOI:10.7506/spkx1002-6630-201423003.
[18] JONGBERG S, T?RNGREN M A, GUNVIG A, et al. Eあect of green tea or rosemary extract on protein oxidation in Bologna type sausages prepared from oxidatively stressed pork[J]. Meat Science, 2013, 93(3):538-546. DOI:10.1016/j.meatsci.2012.11.005.
[19] KATARZYNA W. Antioxidative activity of rosemary extract using connective tissue proteins as carriers[J]. International Journal of Food Science & Technology, 2008, 43(8): 1437-1442. DOI:10.1111/j.1365-2621.2007.01686.x.
[20] PRODPRAN T, BENJAKUL S, PHATCHARAT S. Effect of phenolic compounds on protein cross-linking and properties of film from fish myofibrillar protein[J]. International Journal of Biological Macromolecules, 2012, 51(5): 774-782. DOI:10.1016/j.ijbiomac.2012.07.010.
[21] JONGBERG S, TERKELSEN L S, MIKLOS R, et al. Green tea extract impairs meat emulsion properties by disturbing protein disulベde cross-linking[J]. Meat Science, 2015, 100: 2-9. DOI:10.1016/j.meatsci.2014.09.003.
[22] THAWOMCLIINSOMBUT S. Biochemical and gelation properties of fish protein isolate prepared under various pH and ionic strength conditions[D]. Corvallis: Oregon State University, 2004: 9-10.
[23] 周佺, 郭善廣, 蔣愛民, 等. 肌肉鹽溶蛋白熱誘導凝膠特性研究進展[J]. 食品與機械, 2009, 25(3): 129-131. DOI:10.13652/j.issn.1003-5788.2009.03.031.
[24] 賈娜, 蘆嘉瑩, 劉登勇, 等. NaCl濃度對肌原纖維蛋白-食用膠混合物功能特性的影響[J]. 食品工業(yè)科技, 2014, 35(11): 83-86; 92.DOI:10.13386/j.issn1002-0306.2014.11.010.
[25] DE FREITAS V A P, GLORIES Y, LAGUERRE M. Incidence of molecular structure in oxidation of grape seed procyanidins[J]. Food Chemistry, 1998, 46(2): 376-382. DOI:10.1021/jf970468u.
[26] PETER M G. Chemical modifications of biopolymers by quinones andquinone methides[J]. Angewandte Chemie International Edition,1989, 28(5): 555-570. DOI:10.1002/chin.198933368.
[27] CHEYNIER V F, TROUSDALE E K, SINGLETON V L, et al.Characterization of 2-S-glutathionylcaftaric acid and its hydrolysis inrelation to grape wines[J]. Journal of Agricultural and Food Chemistry, 1986, 34(2): 217-221. DOI:10.1021/jf00068a016.
[28] CAO N, FU Y H, HE J H. Mechanical properties of gelatin films cross-linked, respectively, by ferulic acid and tannin acid[J].Food Hydrocolloids, 2007, 21(4): 575-584. DOI:10.1016/j.foodhyd.2006.07.001.
[29] WHITING R C. Influence of various salts and water solube compounds on the water and fat extudation and gel strength of meat batters[J]. Food Science, 1987, 52(5): 1130-1132. DOI:10.1111/j.1365-2621.1987.tb14025.x.
[30] 周茹, 倪渠峰, 林偉偉, 等. 肌原纖維蛋白溶解度對鹽離子濃度的依賴性[J]. 中國食品學報, 2015, 15(3): 32-39. DOI:10.16429/j.1009-7848.2015.03.005.
[31] 陳立德. 肌原纖維蛋白凝膠作用力影響因素的研究[D]. 重慶: 西南大學, 2010: 2. DOI:10.7666/d.y1670862.
[32] NIE X H, GONG Y D, WANG N N, et al. Preparation and characterization of edible myoベbrillar protein-based ベlm incorporated with grape seed procyanidins and green tea polyphenol[J]. LWTFood Science and Technology, 2015, 64(2): 1042-1046. DOI:10.1016/j.lwt.2015.07.006.
[33] TASKAYA L, CHEN Y C, JACZYNSK I. Color improvement by titanjum dioxide and its effect on gelation and texture of proteins recovered from whole fish using isoelectric solubilization/precipitation[J]. LWT-Food Science and Technology, 2010, 43(3): 401-408. DOI:10.1016/j.lwt.2009.08.021.
[34] EGELANDSDAL B, FRETHEIM K, SAMEJIMA K. Dynamic rheological measurements on heat-induced myosin gels: eあect of ionic strength, protein concentration and addition of adenosine triphosphate or pyrophosphate[J]. Journal of the Science of Food and Agriculture,1986, 37(9): 915-926. DOI:10.1002/jsfa.2740370914.
[35] YAN M Y, LI B F, ZHAO X, et al. Physicochemical properties of gelatin gels from walleye pollock (Theragra chalcogramma) skin cross-linked by gallic acid and rutin[J]. Food Hydrocolloids, 2011,25(5): 907-914. DOI:10.1016/j.foodhyd.2010.08.019.
[36] SAITO H, TAGUCHI T, AOKI H, et al. pH-Responsive swelling behavior of collagen gels prepared by novel crosslinkers based on naturally derived di-or tricarboxylic acids[J]. Acta Biomaterialia, 2007,3(1): 89-94. DOI:10.1016/j.actbio.2006.08.003.

