吸濕對不同干制方式下 枸杞粉活性成分及色澤變化的影響
趙宇慧,李世瑤,徐 昊,卜寧霞,劉敦華
(寧夏大學農學院,寧夏銀川 750021)
粉體吸濕除了受外部環境因素包括溫度、相對濕度影響之外,不同粉體的內部結構和化學成分差異也使得吸濕能力有所不同。近年來,國內外專家對粉體的吸濕性能開展了部分探究,發現不同干制方式對粉體的吸濕性能影響不同[1-4]。研究認為粉體吸濕主要是由于水分和粉末之間形成了液體橋[5]。影響其吸濕特性的原因主要有三個:其一是粉體表面粗糙,粉體間隙形成毛細管,吸附環境中水分;其二是粉體中易溶性成分與水分形成水合物;其三是粉體表面發生溶解,形成液體橋,產生粉體的黏連現象[6]。
枸杞有較高的營養和藥用價值,其自身所含的多糖[7]、黃酮[8]、類胡蘿卜素[9]和甜菜堿具有較高的抗氧化、抗衰老及免疫活性。枸杞加工主要以干制為主,而加工成枸杞粉后,可以用作輔料添加到面包、糕點等食品中,提高食品的營養價值和附加值。但在制粉過程中其所含揮發油、脂肪油、糖類等成分容易受熱或返潮[10],在氧及酶的作用下易發生氧化、分解、聚合等反應而造成結塊、霉變,嚴重影響枸杞粉內在質量,成為制約枸杞制粉工藝中的瓶頸問題。近年來,枸杞采后干制技術有了很大的進步,由傳統的曬干逐漸轉化為熱風干制、太陽能干制、真空冷凍干制、微波干制等。由于每種干制方式的特點不同,因此制得的枸杞粉其性質也有所差別。劉光鵬[3]等對5種不同干燥方式所得枸杞微粉的營養成分和物理特性進行分析測定,發現真空冷凍干燥工藝生產枸杞微粉的品質最好,微波真空干燥次之。目前,對不同干制方式下吸濕前后枸杞粉活性成分研究尚未見報道。研究吸濕特性對不同干制方式下枸杞粉活性成分變化的影響對枸杞粉的貯藏加工有重要意義。
本實驗采用分光光度法和高效液相色譜法測定三種不同干制方式下的枸杞粉在吸濕結塊前后多糖、黃酮、類胡蘿卜素三種活性物質的含量及其色度的變化,并對其吸濕結塊過程中活性物質變化進行分析。
1 材料與方法
1.1 材料與儀器
新鮮枸杞 來自寧夏軍馬場;蘆丁、咖啡酸、4-香豆素、阿魏酸、槲皮素 純度≥98%,購自中國藥品生物制品檢定所;對香豆酸 純度≥98%,購自成都曼斯特生物科技有限公司;甲醇、冰乙酸、正己烷、二氯甲烷、乙腈 均為色譜純,購自天津市大茂化學試劑廠;EDTA、石油醚、無水乙醇、冰乙酸、丙酮 均為分析純,購自天津市大茂化學試劑廠。
Easysep-1010高效液相色譜 上海通微分析技術有限公司;SP-120-5-C18反相色譜柱(4.6 mm×250 mm,5 μm) 上海本昂科學儀器有限公司;RE-52AA旋轉蒸發器 上海亞榮生化儀器廠;TDL-5-A低速臺式離心機 上海安亭科學儀器廠;KQ5200DE型數控超聲波清洗器 昆山市超聲儀器有限公司;CR-400/410色彩色差計 柯尼卡美能達公司;SHZ-D(Ⅲ)循環水真空泵 邦西儀器科技有限公司;DF數顯集熱式磁力攪拌器 常州愛華儀器制造有限公司。
1.2 實驗方法
1.2.1 樣品制備
曬干:新鮮枸杞果實經5%食用堿進行脫蠟處理,均勻攤放于竹席,置于陰涼、通風處(以1 d為宜)。待枸杞失去部分水分后,移至通風、平整處曝曬,直至枸杞中水分含量為8%,得到曬干的枸杞干果,打粉過80目篩后備用。
烘干:新鮮枸杞果實經5%食用堿進行脫蠟處理,均勻攤放在托盤上置于45 ℃烘箱內,至枸杞中水分含量為8%,得到烘干的枸杞干果,打粉過80目篩后備用。
真空冷凍干燥:新鮮枸杞果實經5%食用堿進行脫蠟處理,于-80 ℃的超低溫冰箱預凍24 h,均勻平鋪托盤上,冷肼溫度為-35~-40 ℃,真空度為0~10 Pa,加熱板溫度為10~40 ℃(加熱板溫度初始值為10 ℃,每隔1 h升溫10 ℃直至40 ℃),至枸杞中水分含量為8%,得到凍干的枸杞干果,打粉過80目篩后備用。
1.2.2 樣品的吸濕過程 三種不同干制方式的枸杞粉均置于環境溫度為30 ℃(恒溫培養箱),環境濕度為75%(NaCl飽和鹽溶液)的條件下,同時吸濕30 d后測定各指標變化。
1.2.3 枸杞粉中活性成分含量的測定 參照GB 18672-2014方法,以葡萄糖為標準品,根據苯酚-硫酸法繪制出葡萄糖標準曲線y=10.89x+0.006,R2=0.998;枸杞總黃酮的含量測定參考文獻[11]方法,繪制出蘆丁標準曲線,y=0.0121x+0.0014,R2=0.9998;枸杞總類胡蘿卜素含量測定參考文獻[12]方法,在450 nm處測定吸光值。計算枸杞水提物中總類胡蘿卜素含量(mg/g)。公式如下:
式中:A-吸光值;V-樣液體積,mL;2480-在1 cm光程長的比色皿中1 g/L枸杞粉樣品提取液的理論吸光值;m1-枸杞粉樣品的質量,g。
1.2.4 枸杞黃酮類化合物的HPLC測定
1.2.4.1 黃酮類化合物標準曲線的繪制 精確稱取標品蘆丁2 mg、咖啡酸2 mg、阿魏酸1 mg、槲皮素1 mg、對香豆酸1 mg,用色譜級甲醇定容至10 mL容量瓶中,置于4 ℃冰箱內備用。HPLC條件參考文獻[11]修改為:流動相A:甲醇,流動相B:0.4%冰乙酸;紫外波長290 nm,柱箱溫度30 ℃,流速1.0 mL/min,梯度洗脫,洗脫程序:0~8 min,15% A;8~18 min,20% A;18~25 min,60% A;25~30 min,60% A;30~40 min,80% A;40~50 min,80% A;50~55 min,15% A。進樣量20 μL,保留時間定性,以峰面積為縱坐標,質量濃度為橫坐標采用外標法定量。
1.2.4.2 枸杞黃酮類化合物含量的測定 準確稱取枸杞粉2 g置于燒杯中,加入100 mL的80%無水乙醇,70 ℃水浴浸提3次(2 h/次),抽濾合并濾液,55 ℃真空濃縮蒸干,加入適量石油醚振蕩脫色2 min,濃縮蒸干殘余溶劑,再用適量80%甲醇超聲溶解,定容于10 mL容量瓶內,進樣前經0.45 μm微孔濾膜過濾后,按照方法1.2.4.1進行測定。
1.2.5 枸杞主要類胡蘿卜素化合物的HPLC測定
1.2.5.1 類胡蘿卜素化合物標準曲線的測定 精確稱取標準品β-胡蘿卜素、葉黃素各1.0 mg,加入少量二氯甲烷溶解,用流動相定容至10 mL容量瓶內(避光操作),避光儲藏于-25 ℃備用。按照文獻[13]的方法進行修改確定液相色譜條件為:檢測波長450 nm,柱箱溫度25 ℃,流速1.0 mL/min,流動相:乙腈∶甲醇∶二氯甲烷∶正己烷=200∶75∶100∶100(v/v),等度洗脫,測定前經0.45 μm微孔濾膜過濾,進樣量20 μL,保留時間定性,以峰面積外標法定量。
1.2.5.2 枸杞類胡蘿卜素化合物含量的測定 提取方法參考文獻[12],用流動相溶解后,經0.45 μm微孔濾膜過濾,按照方法1.2.5.1進行測定。
1.2.6 枸杞粉色澤的測定 采用色彩色差計測定法,以儀器白板色澤為標準,取吸濕前后三種干燥方式下的枸杞粉樣品各10 g,依次平鋪置于無色透明自封袋內,色差計校正后分別對樣品的a*、b*、L*值進行測定。彩色指數a*和b*,a*值大小代表樣品紅色程度,值越大則樣品色調越紅;b*值大小代表樣品黃藍程度,值越大則樣品的色調越藍;明度指數L*,代表樣品的明亮程度,值越大則樣品色調越亮[14]。L*、a*、b*表色系還可以表示兩種色調之間的差值,即色差,可用ΔE表示,它表示所測物體的L*、a*、b*值與白板之間的色差值。每批枸杞測定3次取平均值,根據ASTME308-99標準,計算公式如下[2]:
ΔL*=L*-L
Δa*=a*-a
Δb*=b*-b
式中:總色差ΔE表示相對于吸濕結塊前的枸杞粉的L、a、b值作為標準參照。
1.3 數據分析
所有數據均平行測定3次,采用SPSS 20.0、Excel 2007進行數據處理與統計分析,采用Duncan多重比較法進行差異顯著性分析,并用Origin 9.0軟件作圖。
2 結果與分析
2.1 枸杞主要活性成分的含量
2.1.1 枸杞多糖含量的測定 枸杞中存在一些能與水分子中的極性基團結合的活性羥基,這些活性羥基是影響枸杞吸濕性能的主要因素之一[15]。由于多糖中的每個糖環都具有結合分子的能力,故多糖具有較好的水合作用,還具有控制水分移動的能力。枸杞粉的吸濕特性與多糖的存在密不可分,因此把吸濕前后多糖含量的變化作為衡量枸杞中活性成分的指標之一。
環境溫度為30 ℃(恒溫培養箱),環境濕度為75%時,不同干制方式下枸杞粉吸濕前后多糖含量變化如圖1所示。可以看出吸濕結塊過程對枸杞粉的多糖含量有顯著影響(p<0.05),且不同的干制方式對枸杞粉多糖的含量也有顯著影響(p<0.05)。由圖1可知,相同干制方式下,吸濕前枸杞多糖含量均顯著(p<0.05)高于吸濕后,吸濕過程會使枸杞粉中多糖含量降低。研究表明,常溫下枸杞中的多糖含量隨著放置時間的延長呈下降趨勢[16]。這可能是因為枸杞粉在高溫高濕環境下,不斷吸收環境中的水分,粉體水分活度增加,誘導呼吸酶活性增加,呼吸作用增強,引起了多糖的消耗[17],從而導致多糖含量的降低。不同干制方式下,無論是吸濕前還是吸濕后,凍干枸杞多糖含量最高,烘干次之。從多糖含量降幅來看,降幅最小的干制方式為凍干,曬干次之。
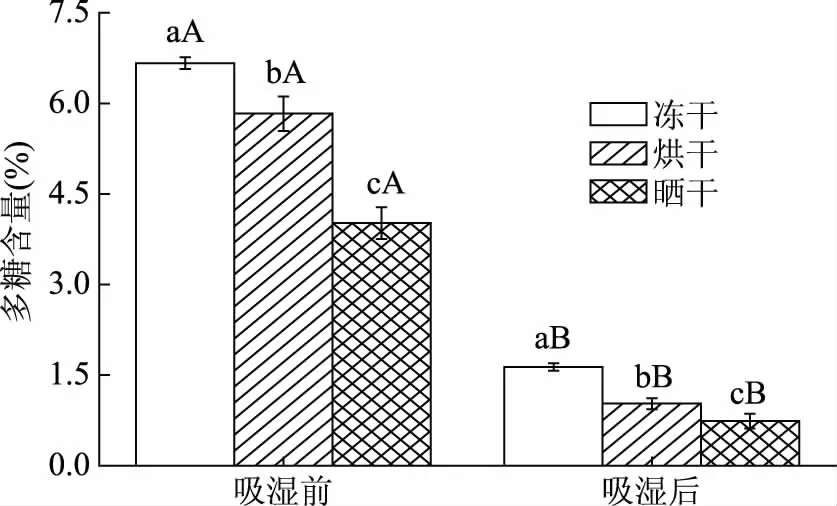
圖1 枸杞粉吸濕前后多糖含量Fig.1 The content of polysaccharides in Lycium barbarum powder before and after moisture absorption注:小寫字母為不同干制方式下多糖含量的多重比較;大寫字母為相同干燥方式下吸濕前后多糖含量的多重比較,同一指標肩上不同字母代表差異顯著(p<0.05),圖2、圖3、表5同。
2.1.2 黃酮含量的測定 由圖2可知,吸濕結塊過程對枸杞粉的黃酮含量有顯著影響(p<0.05)。相同干制方式下,吸濕后枸杞黃酮含量顯著上升(p<0.05)。不同干制方式對枸杞粉黃酮含量影響顯著(p<0.05),可以看出不同干制方式下枸杞粉黃酮含量大小為:烘干>曬干>凍干。相關研究表明,黃酮類化合物的合成與L-苯丙氨酸解氨酶(PAL)和肉桂酸-4-羥基化酶有關(C4H),而PAL和C4H的活性不僅與干制方法有關還受到干制條件影響[18]。曬干和烘干會使細胞迅速失水,失水應激會使枸杞更容易暴露在自由基和氧化環境中,從而增加枸杞的氧化應激,促使枸杞增加對抗氧化應激的相關基因表達,使PAL和C4H活性增加,從而刺激黃酮類化合物的合成[19]。
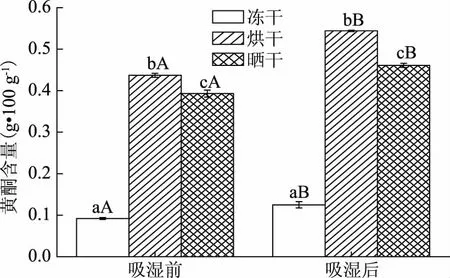
圖2 枸杞粉吸濕前后黃酮含量Fig.2 The content of flavone in Lycium barbarum powder before and after moisture absorption
2.1.3 類胡蘿卜素含量的測定 圖3顯示了三種干制方式下枸杞粉吸濕前后類胡蘿卜素的變化。發現吸濕結塊過程對枸杞粉的類胡蘿卜素含量有顯著影響(p<0.05),且不同的干制方式對枸杞粉類胡蘿卜素含量也有顯著影響(p<0.05)。總體來說凍干枸杞類胡蘿卜素含量最高,達到2.380 mg/g,烘干次之。相較凍干,烘干和曬干的枸杞細胞失水更快,導致胡蘿卜素快速降解以清除細胞失水產生的活性氧,維持細胞膜質穩定[20]。吸濕后類胡蘿卜素含量表現為下降,這可能是因為儲藏環境的溫度[21]、濕度、光照作用促進類胡蘿卜素的分解,從而導致了類胡蘿卜素的降解。

表1 5種黃酮類物質標準曲線方程Table 1 The standard curve equation for 5 kinds of flavonoids
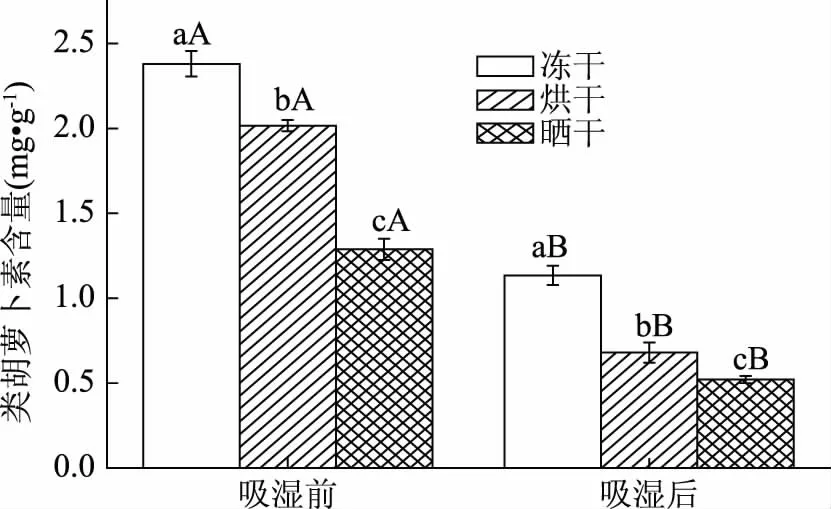
圖3 枸杞粉吸濕前后類胡蘿卜素含量Fig.3 The content of carotenoid in Lycium barbarum powder before and after moisture absorption
2.2 枸杞黃酮類化合物的HPLC分析
2.2.1 黃酮類化合物標準曲線的建立 配制好的標準品母液分別用色譜級甲醇稀釋1、5、10、100倍,按照1.2.4.1中HPLC條件進樣,重復測定3次,建立標準曲線,見表1。在對應的線性濃度范圍內,5種黃酮類化合物標準品溶液濃度的相關系數R2都大于0.9995,其質量濃度與峰面積呈良好的線性關系,可以進行定量分析。
2.2.2 不同干制方式枸杞黃酮類化合物的分析 由圖4可知,不同干制方式的枸杞粉吸濕前后黃酮類化合物各成分物質圖譜共有峰較多且相似,說明吸濕前后枸杞的黃酮類化合物組成基本一致,黃酮總含量的差別主要體現在類化合物成分含量的多少。
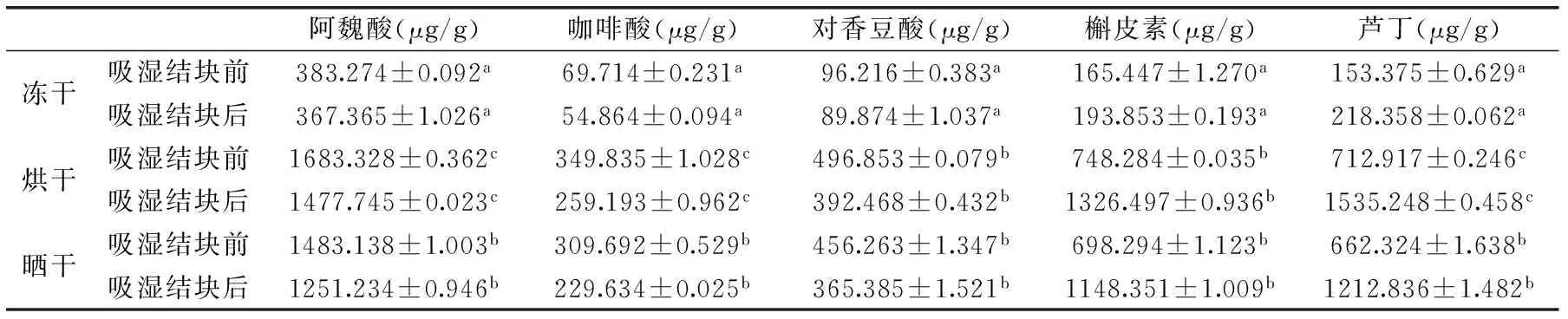
表2 不同干制方式下枸杞黃酮類化合物的含量Table 2 The content of flavonoid from Lycium barbarum under different treatment methods
注:小寫字母為不同干制方式下黃酮類化合物含量的多重比較,同一指標肩上不同字母代表差異顯著(p<0.05);表4同。

表3 2種類胡蘿卜素標準曲線方程Table 3 The standard curve equation for 2 kinds of carotenoids
由表2可知,不同干制方式下枸杞粉吸濕前后黃酮化合物含量均有所變化,其中阿魏酸、咖啡酸、對香豆酸含量減少,而槲皮素、蘆丁含量增大。
與吸濕前相比,凍干、烘干、曬干枸杞粉吸濕后的阿魏酸含量分別減少了15.909、205.583、231.904 μg/g;咖啡酸分別減少了14.85、90.642、80.058 μg/g;對香豆酸減少了6.342、104.385、90.878 μg/g。吸濕前后枸杞粉中槲皮素、蘆丁的含量變化與酸類相反,凍干、烘干、曬干枸杞粉吸濕后槲皮素含量分別增加了28.406、578.213、450.057 μg/g;蘆丁含量分別增加了64.983、802.331、550.512 μg/g;說明水分增加激活了枸杞中類黃酮代謝途徑中的黃烷酮羥基化酶的活性,使其酸類物質在該酶作用下進一步轉化為槲皮素、黃酮類物質,使槲皮素、蘆丁的含量增多,從而使得枸杞中總黃酮含量增加。
不同干制方式下黃酮類化合物的含量也有所差異,無論吸濕前后烘干和曬干枸杞粉的黃酮類化合物含量均大于凍干,這一結論與2.1.2檢測結果相符。形成這一差異可能取決于干制過程的失水應激和氧化應激,曬干和烘干刺激了合成黃酮類化合物相關基因的表達[11],導致阿魏酸、咖啡酸、對香豆酸、槲皮素和蘆丁含量比凍干枸杞粉中的多。
2.3 枸杞類胡蘿卜素的HPLC分析
2.3.1 枸杞類胡蘿卜素標準曲線的建立 將配制好的標準品母液分別用流動相稀釋成0.1、0.05、0.01、0.025、0.005 mg/mL,按照1.2.5.1中HPLC條件進樣,重復測定3次,建立標準曲線,見表3。由表3可知,在對應的線性濃度范圍內,2種類胡蘿卜素標準品溶液濃度的相關系數R2都大于0.9995,其質量濃度與峰面積呈良好的線性關系,可以進行定量分析。
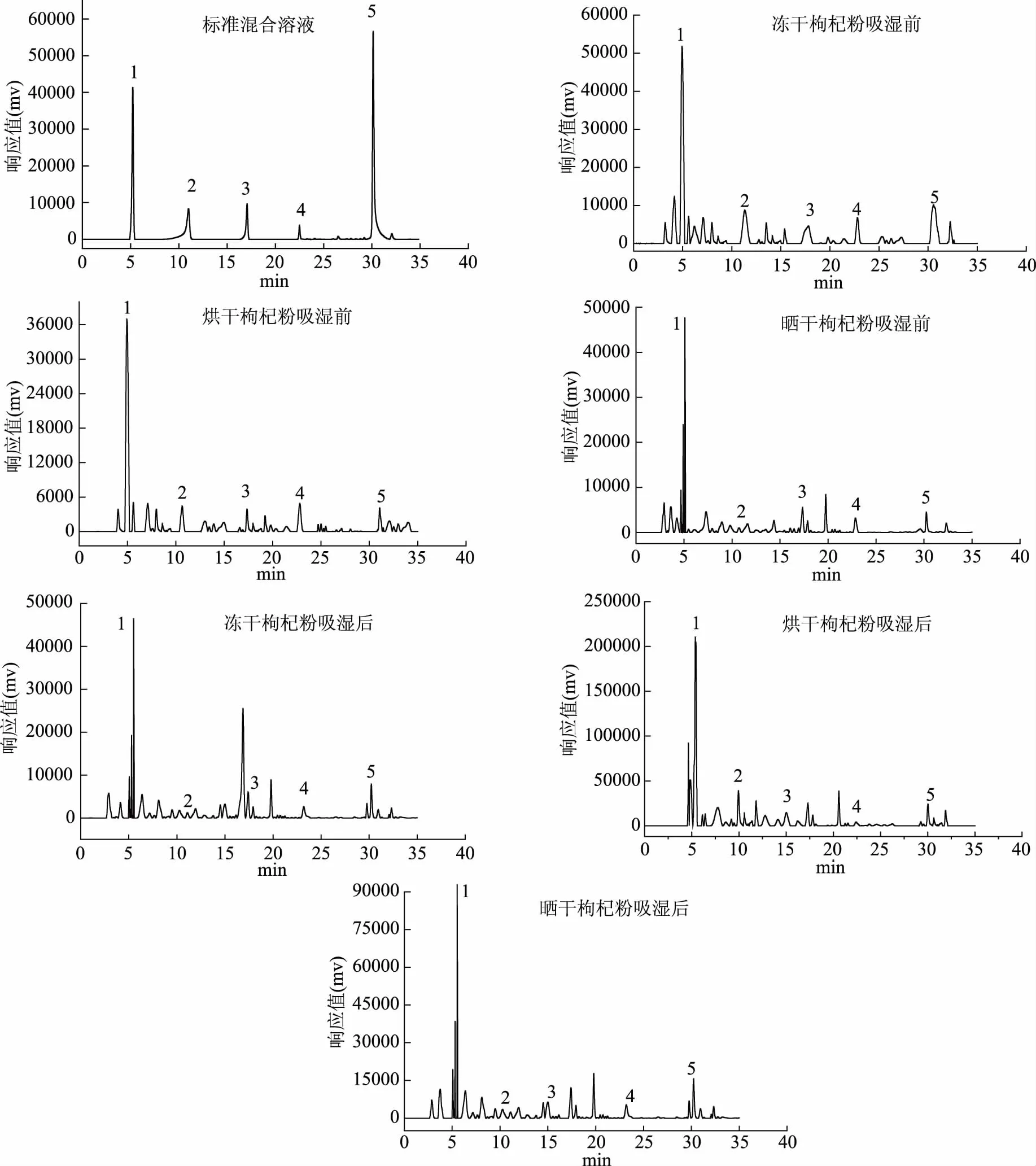
圖4 5種黃酮類物質標準混合溶液和枸杞樣品的高效液相色譜圖Fig.4 HPLC chromatograms of 5 flavonoids compounds standards and Lycium barbarum sample
2.3.2 不同處理方式枸杞類胡蘿卜素HPLC的定性和定量分析 從圖5可以看出,在實驗選取的色譜條件下,枸杞類胡蘿卜素各組分物質色譜峰與雜峰的分離度良好(均大于1.5),同時可以看出不同干制方式的枸杞粉吸濕前后枸杞類胡蘿卜素各成分物質圖譜共有峰較多且相似,說明吸濕前后枸杞類胡蘿卜素物質組成基本一致,相似峰差別主要體現在類胡蘿卜素成分含量的多少。
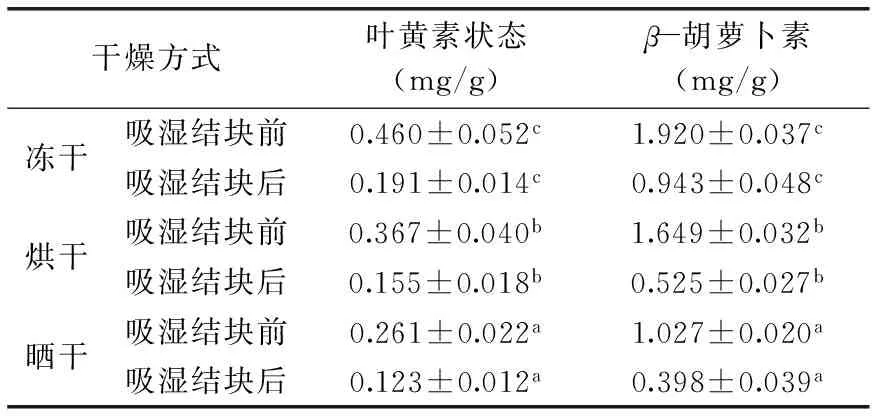
表4 不同處理方式下枸杞類胡蘿卜素化合物的含量Table 4 The content of carotenoid from Lycium barbarum under different treatment methods
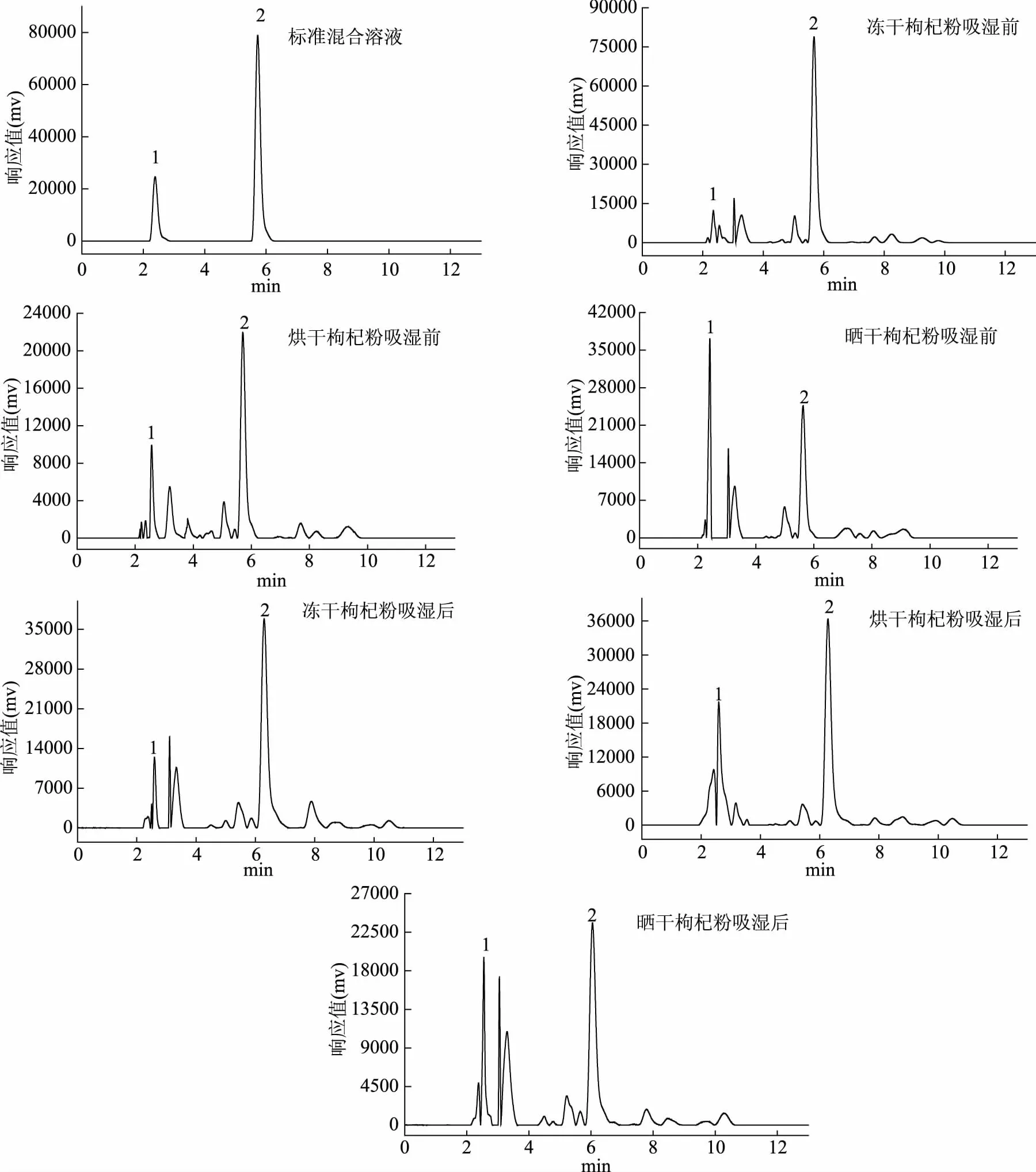
圖5 2種類胡蘿卜素物質標準混合溶液和枸杞粉樣品的高效液相色譜圖Fig.5 HPLC chromatograms of 2 carotenoids compounds standards and Lycium barbarum powder sample
由表4可知,三種不同方式處理的枸杞粉吸濕前后類胡蘿卜素各化合物含量均減少,其中凍干處理下枸杞粉吸濕前后葉黃素、β-胡蘿卜素分別減少0.269、0.977 mg/g;烘干處理下枸杞粉吸濕前后葉黃素、β-胡蘿卜素分別減少0.212、1.124 mg/g;曬干處理下枸杞粉吸濕前后葉黃素、β-胡蘿卜素分別減少0.138、0.629 mg/g。由于β-胡蘿卜素見光不穩定、易氧化被分解,所以導致含量下降。在枸杞粉吸濕結塊過程中,由于粉體長時間暴露在空氣中,引起順—反光異構化作用,造成類胡蘿卜素分子的降解,導致含量下降[22]。
凍干、烘干、曬干下枸杞粉吸濕前的類胡蘿卜素含量分別為2.380、2.016、1.288 mg/g,吸濕后含量分別為1.134、0.680、0.521 mg/g。根據類胡蘿卜素不穩定性可知,引起類胡蘿卜素降解的首要因素是氧,其次是光照,此外,高溫會導致類胡蘿卜素結構發生變化產生異構體[23-25]。凍干枸杞粉因其干制過程避光、低溫、無氧,所以吸濕前后類胡蘿卜素含量均最高。而烘干枸杞粉與曬干枸杞粉相比干制時與光接觸較少,干制時間較短,所以烘干枸杞粉類胡蘿卜素含量高于曬干枸杞粉的。
2.4 枸杞粉吸濕前后色度的測定
對吸濕前后熱風干燥、真空冷凍干燥和曬干的枸杞粉進行色澤測定,結果如表5所示,其色澤參數L*、a*、b*均有顯著變化;以吸濕前后的枸杞粉做對比,三種干制方式的枸杞粉吸濕后的L*、a*、b*值較吸濕前均顯著降低,其中曬干枸杞粉降低了56.069%、39.815%、71.204%,凍干枸杞粉降低了50.229%、45.234%、67.063%,烘干枸杞粉降低了55.050%、36.936%、67.544%。由此可得在吸濕過程中b*值變化最大,色調逐漸變黃,且吸濕后的ΔE值均小于吸濕前的值。可能是由于水分的增加引起的,水分增加后枸杞粉的亮度自然下降,含水量增大后紅色素被稀釋,致使紅色變淺,黃色程度加深[26]。
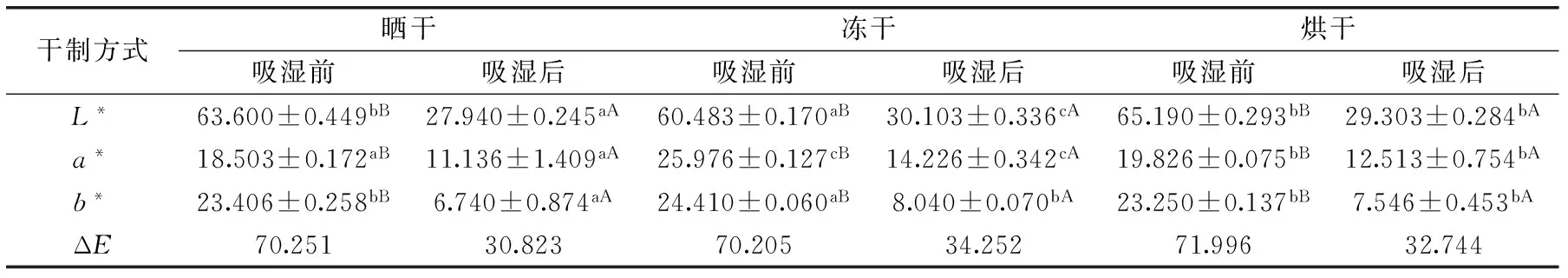
表5 不同處理方式下枸杞粉吸濕前后色度的變化Table 5 The change of chromaticity of Lycium barbarum powder before and after moisture absorption under different processing methods
不同干制方式的枸杞粉做對比,由ΔE值大小可知,吸濕前色澤差異表現為:烘干>曬干>凍干;吸濕后色澤差異表現為:凍干>烘干>曬干。相關研究表明,枸杞的色澤同其所含有的類胡蘿卜素有很大的相關性[27]。類胡蘿卜素對光、熱和氧均具有較強的敏感性,真空冷凍干燥枸杞粉是在低溫、真空、避光的條件下進行,避免了干燥過程中對類胡蘿卜素的損害;而熱風干燥過程中由于水分活度影響酶的活性,加上需要較長的時間,干燥溫度較高,很容易發生酶的褐變、色素的分解[3],最終導致熱風干燥制備的枸杞粉色澤較差,a*最小。吸濕后凍干枸杞粉色澤差異最大,可能是因為凍干過程中的低溫抑制了酶的活性,常溫下吸濕時酶的活性恢復,而曬干和烘干的溫度破壞了酶,使酶徹底失活。
3 結論
吸濕結塊對枸杞粉多糖、黃酮和類胡蘿卜素含量影響均顯著(p<0.05),吸濕后多糖和類胡蘿卜素含量顯著降低(p<0.05),黃酮含量顯著升高(p<0.05),黃酮類化合物中阿魏酸、咖啡酸和對香豆酸含量減少而槲皮素、蘆丁含量增大。
干制方式對枸杞粉中三種活性成分影響顯著(p<0.05),凍干時枸杞粉多糖和類胡蘿卜素含量均高于其他兩種干制方式,而烘干時黃酮含量高于其他兩種干制方式。干制方式影響枸杞中活性成分含量變化的原因可能是水分的變化導致酶活性的變化及其氧化應激反應,從而刺激相關基因的表達,而其具體影響過程還待進一步研究。
枸杞粉吸濕前后色度變化較為明顯,L*、a*、b*值較吸濕前均顯著降低。吸濕后的枸杞粉變暗、紅色程度減少、色澤偏黃,色澤差異表現為:凍干>烘干>曬干。主要是因為枸杞粉的色澤與類胡蘿卜素有很大關系,而類胡蘿卜素較為不穩定,易受光、熱和氧等因素的影響而降解。
[1]周禹含,畢金峰,陳芹芹,等. 不同干燥方式對棗粉品質的影響[J]. 食品科學,2014(11):36-41.
[2]于靜靜,畢金峰,丁媛媛. 不同干燥方式對紅棗品質特性的影響[J]. 現代食品科技,2011(6):610-614,672.
[3]劉光鵬,王娟,和法濤,等. 不同干燥方式對枸杞微粉品質的影響[J]. 河南農業科學,2016(11):130-134,144.
[4]Viganó J,Azuara E,Telis V R N,et al. Role of enthalpy and entropy in moisture sorption behavior of pineapple pulp powder produced by different drying methods[J]. Thermochimica Acta,2012,528:63-71.
[5]崔福德. 藥劑學(第5版)[M]. 北京:人民衛生出版社,2004:57-65.
[6]Alakali J S,Satimehin A A. Moisture Adsorption Characteristics of Bambara Groundnut(Vignasubterranea)Powders[J]. Cigr Ejournal,2007,7(5):1-15.
[7]鄭玲利,李燕,黃玲,等. 枸杞多糖的微波提取及抗氧化性分析[J]. 解放軍藥學學報,2016(1):1-4,9.
[8]于惠,康磊,張瑞,等. 枸杞中黃酮類化合物提取與分離純化工藝的研究進展[J]. 安徽農業科學,2015(5):62-64,66.
[9]吳有鋒,馬世震,譚亮,等. 柴達木枸杞類胡蘿卜素提取工藝優化及抗氧化活性研究[J]. 食品工業科技,2016(14):250-256.
[10]呂秀潔. 中藥貯藏與養護的影響因素及對策分析[J]. 內蒙古中醫藥,2017(6):105.
[11]李朋亮. 枸杞干制中黃酮類化合物變化規律及其抗氧化活性研究[D].銀川:寧夏大學,2014.
[12]李赫,陳敏,馬文平,等. 不同成熟期枸杞中類胡蘿卜素含量的變化規律[J]. 中國農業科學,2006(3):599-605.
[13]Hempel J,Schadle C N,Sprenger J,et al. Ultrastructural deposition forms and bioaccessibility of carotenoids and carotenoid esters from goji berries(LyciumbarbarumL.)[J]. Food Chem,2017,218:525-533.
[14]王友升,蔡琦瑋,谷祖臣,等. 紫外照射處理對蒜薹品質與活性氧代謝影響的多變量解析[J]. 食品科學,2014(14):223-228.
[15]景永帥,張丹參,吳蘭芳,等. 荔枝低分子量多糖的分離純化及抗氧化吸濕保濕性能分析[J]. 農業工程學報,2016(9):277-283.
[16]韓紅. 枸杞多糖GPC檢測、提取工藝優化及其穩定性研究[D].廣州:華南農業大學,2016.
[17]盧俊宇. 基于貯藏過程中生理活性狀態變化研究枸杞子“走油”機制[D].成都:成都中醫藥大學,2016.
[18]Shi X-F,Chu J-Z,Zhang Y-F,et al. Nutritional and active ingredients of medicinal chrysanthemum flower heads affected by different drying methods[J]. Industrial Crops and Products,2017,104:45-51.
[19]李朋亮,廖若宇,王旭,等. 不同干燥方式和除蠟劑對枸杞總黃酮的影響[J]. 食品科技,2014(5):79-83.
[20]李光躍,羅曉雅,孫窗舒,等. 干旱脅迫對黃芪植株生長中黃酮類成分積累的影響[J]. 西北植物學報,2017(1):138-143.
[21]Bechoff A,Chijioke U,Tomlins K I,et al. Carotenoid stability during storage of yellow gari made from biofortified cassava or with palm oil[J]. Journal of Food Composition & Analysis,2015,44:36-44.
[22]Pesek C A,Warthesen J J. Photodegradation of Carotenoids in a Vegetable Juice System[J]. Journal of Food Science,2010,52(3):744-746.
[23]Inbaraj B S,Lu H,Hung C F,et al. Determination of carotenoids and their esters in fruits ofLyciumbarbarumLinnaeus by HPLC-DAD-APCI-MS[J]. Journal of Pharmaceutical & Biomedical Analysis,2008,47(5):812-818.
[24]Li L,Liu F,Qian C,et al. Determination of organophosphorus pesticides inLyciumbarbarumby gas chromatography with flame photometric detection[J]. Journal of Aoac International,2007,90(1):271.
[25]Provesi J G,Dias C O,Amante E R. Changes in carotenoids during processing and storage of pumpkin puree[J]. Food Chemistry,2011,128(1):195-202.
[26]李瑞杰,張慜. 不同干燥方式對胡蘿卜片吸濕性及品質的影響[J]. 食品與生物技術學報,2010(3):342-349.
[27]Caparino O A,Tang J,Nindo C I,et al. Effect of drying methods on the physical properties and microstructures of mango(Philippine‘Carabao’ var.)powder[J]. Journal of Food Engineering,2012,111(1):135-148.

