響應面法優化新疆蕪菁多糖 提取工藝及體外抗氧化活性研究
王 偉,楊曉君,高 蕾,戴小華,陳 愷
(新疆農業大學食品科學與藥學學院,新疆烏魯木齊 830052)
近年來,研究表明植物源多糖是一類非常重要的生物活性物質,在經濟領域與臨床應用上逐漸引起越來越多的關注[1]。蕪菁(BrassicarapaL.),屬于十字花科(Cruciferae)蕓苔屬(Brassica)草本植物,被維吾爾族用來治療咳嗽和支氣管哮喘[2]。據報道,蕓苔屬植物含有芥子油甙、花青素、多糖、萜烯及香豆素類等生物活性物質,這些生物活性物質與阻止氧化應急、免疫調節、減少癌癥發生率等功效有關[3]。
Xie等[4]研究表明中國青海省及西藏自治區的蕪菁多糖具有抗缺氧的功效;Jafarian-Dehkordi等[5]發現不同有機溶劑的蕪菁提取液均對小鼠具有免疫調節作用。但目前對新疆蕪菁多糖生物活性的研究還未見報道。因此,本論文主要對新疆蕪菁多糖的提取工藝進行優化,并利用DPPH自由基清除能力和還原力評價其體外抗氧化能力,為今后新疆蕪菁的開發利用奠定一定的理論基礎。
1 材料與方法
1.1 材料與儀器
新疆蕪菁 新疆烏魯木齊市農貿市場;DPPH、VC美國Sigma公司;苯酚、濃硫酸、乙醇、乙醚、丙酮、氯化鐵及三氯乙酸等均為國產分析純。
HH-6數顯恒溫水浴鍋 常州普天儀器制造公司;TDZ5-WS臺式離心機 長沙湘智離心機儀器有限公司;DHG-9140A恒溫鼓風干燥箱 上海一恒科技有限公司;AY-120電子天平 日本SHIMADZU公司;SF180粉碎機 上海制藥儀器公司;OSB-2100真空旋轉蒸發儀 日本EYELA公司。
1.2 實驗方法
1.2.1 蕪菁多糖(BRP)的提取工藝 原料預處理:將新疆蕪菁洗凈、切片,30 ℃烘干,粉碎后過60目篩,然后用80%乙醇浸提24 h,反復2~3次,料渣于30 ℃烘干,置于干燥皿中備用。
在一定料液比、溫度、時間和提取次數下進行熱水浸提,浸提液抽濾取上清,50 ℃旋蒸濃縮至1/8原體積,向濃縮液加3倍體積無水乙醇后置于4 ℃冰箱過夜,3000 r/min 離心10 min取沉淀,依次用乙醚、無水乙醇和丙酮洗滌沉淀,20 ℃烘干至恒重,得到的即為蕪菁多糖,多糖得率按下式計算:
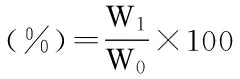
式中:W1為多糖質量,g;W0為預處理后干燥蕪菁粉末質量,g。
1.2.2 單因素實驗設計 液料比分別設置為40、50、60、70和80 mL/g,其它提取條件分別為提取溫度90 ℃,提取時間2 h,提取次數1次;提取溫度分別設置為80、85、90、95和100 ℃,其它提取條件分別為提取時間2 h,液料比70 mL/g,提取次數1次;提取時間分別設置為1、2、3、4和5 h,其它提取條件分別為提取溫度95 ℃,液料比70 mL/g,提取次數1次;提取次數分別設置為1、2、3、4和5,其它提取條件分別為提取溫度95 ℃,液料比70 mL/g,提取時間4 h。
1.2.3 響應面法(RSM)優化提取工藝 根據單因素實驗結果,選取提取溫度(X1)、液料比(X2)及提取時間(X3)三個實驗因子,在適宜范圍內,采用響應面法(RSM)的Box-Behnken design(BBD)優化新疆蕪菁多糖的提取工藝,因素水平見表1。
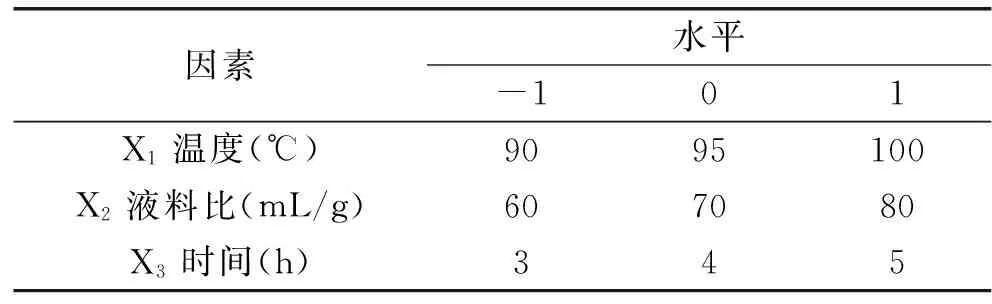
表1 Box-Behnken設計各因素的編碼及實驗水平Table 1 Code and level of factors chosen for Box-Behnken design
1.2.4 新疆蕪菁多糖的體外抗氧化活性研究
1.2.4.1 DPPH自由基清除能力的測定 DPPH自由基清除活性的測定參照報道的方法并稍作修改[6]:依次移取濃度為0.25、0.5、0.75、1.0、2.0、3.0及4.0 mg/mL的多糖溶液1.0 mL,分別加入0.4 mmol/L DPPH溶液0.5 mL,加水2.0 mL,混勻,30 ℃暗處反應30 min,于517 nm處測定吸光值。VC作為陽性對照,利用下式計算DPPH自由基清除活性:
式中:A0是對照的吸光值(即以水代替樣品),A1是樣品的吸光值,A2是樣品自身干擾的吸光值(即以水替代DPPH溶液)。
1.2.4.2 還原能力的測定 參照師萱[7]的方法并稍作修改。在2.0 mL樣品中加入0.2 mol/L磷酸鹽緩沖液(pH=6.6)2.0 mL和K3Fe(CN)6溶液(1%,w/v)2.0 mL,混勻后50 ℃反應20 min,再加2.0 mL三氯乙酸(10%,w/v),0.5 mL氯化鐵溶液(0.1%,w/v),測定700 nm吸光值。VC作為陽性對照,按下式計算還原力:
還原力=A1-A2
式中:A1是樣品的吸光值,A2是樣品干擾的吸光值(即以水代替氯化鐵溶液)。
1.3 統計分析
所有數據均以平均值±標準差(Mean±SD)表示,使用SPSS 20.0統計軟件的單因素方差分析(One-way ANOVA)和Tukey檢驗進行顯著性分析,不同字母代表差異顯著(p<0.05)。
2 結果與分析
2.1 液料比對新疆蕪菁多糖得率的影響
液料比對新疆蕪菁多糖得率的影響如圖1所示。
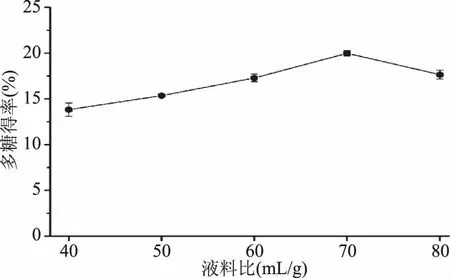
圖1 液料比對新疆蕪菁多糖得率的影響Fig.1 Effect of ratio of extraction solvent to raw material on the extraction yield of BRP
由圖1可知:當液料比從40 mL/g增加到70 mL/g時,新疆蕪菁多糖得率由13.82%增加(p<0.05)到19.97%;之后,隨著液料比繼續增加,新疆蕪菁多糖得率開始下降(p<0.05)。這種現象可能是由于液料比過小會導致多糖溶解不完全,而液料比過大會導致后續醇沉等工藝勞動強度加大[8]。因此,為了避免提取溶劑和濃縮費用的浪費,液料比為70 mL/g被選擇作為Box-Behnken design(BBD)實驗的中心點。
2.2 提取溫度對新疆蕪菁多糖得率的影響
提取溫度對新疆蕪菁多糖得率的影響如圖2所示。
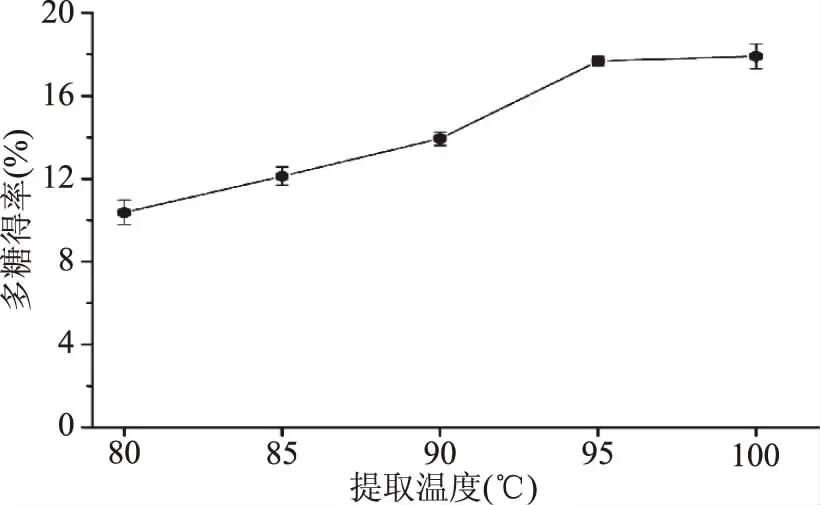
圖2 提取溫度對新疆蕪菁多糖得率的影響Fig.2 Effect of extraction temperature on the extraction yield of BRP
由圖2可知,當提取溫度從80 ℃增加到95 ℃時,新疆蕪菁多糖得率由10.37%增加(p<0.05)到17.68%;之后,隨著提取溫度繼續增加,新疆蕪菁多糖得率基本保持不變。原因可能是隨著提取溫度的升高,樣品溶液的粘度減小,溶劑可以更好的滲透到原料中,使溶劑溶解原料組分的能力提高[9];當溫度升高至100 ℃時,溶劑蒸發量和多糖濃度的增大反而不利于多糖的提取[10]。因此,選擇提取溫度95 ℃作為Box-Behnken design(BBD)實驗的中心點。
2.3 提取時間對新疆蕪菁多糖得率的影響
提取時間對新疆蕪菁多糖得率的影響如圖3所示。
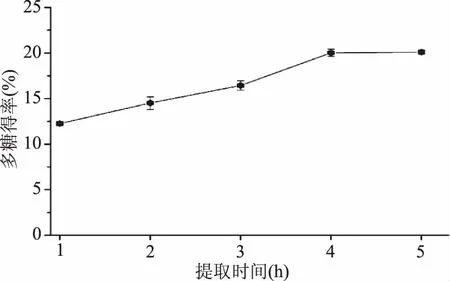
圖3 提取時間對新疆蕪菁多糖得率的影響Fig.3 Effect of extraction time on the extraction yield of BRP
由圖3可知:當提取時間從1 h增加到4 h時,新疆蕪菁多糖得率由12.26%增加(p<0.05)到20.02%;4 h之后,新疆蕪菁多糖得率基本保持不變。這種現象可能是隨著原料與提取溶劑接觸時間的延長,原料組分不斷從原料中擴散出來,但是當大部分的原料組分都通過擴散溶解到提取溶劑中后,繼續延長提取時間,反而不利于多糖得率的提高[11]。因此,提取時間4 h被選擇作為Box-Behnken design(BBD)實驗的中心點。
2.4 提取次數對新疆蕪菁多糖得率的影響
提取次數對新疆蕪菁多糖得率的影響如圖4所示。
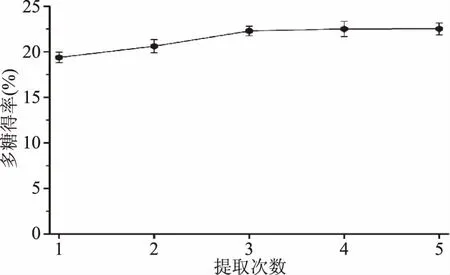
圖4 提取次數對新疆蕪菁多糖得率的影響Fig.4 Effect of extraction times on the extraction yield of BRP
由圖4可知:當提取次數從1次增加到3次時,新疆蕪菁多糖得率由19.38%增加(p<0.05)到22.29%;之后,繼續增加提取次數,新疆蕪菁多糖得率基本保持不變。另外考慮到新疆蕪菁多糖提取成本[12],選擇提取次數為3次。
2.5 響應面法優化新疆蕪菁多糖的提取工藝
根據單因素實驗結果,分別選取液料比60~80 mL/g,提取溫度90~100 ℃,提取時間3~5 h進行響應面法(RSM)的Box-Behnken design(BBD)實驗對新疆蕪菁多糖的提取工藝進行優化,實驗結果見表2,新疆蕪菁多糖得率從17.32%到23.28%不等,利用Design-Expert(Version 8.0.7)軟件對實驗結果進行多元回歸分析,Y=7.1785X1+1.6985X2+9.6775X3+0.00305X1X2+0.0695X1X3-0.10275X2X3-0.03895X12-0.010388X22-1.06875X32-415.9375。式中,Y為新疆蕪菁多糖得率的預測值;X1、X2、X3分別代表提取溫度、液料比和提取時間的編碼值。
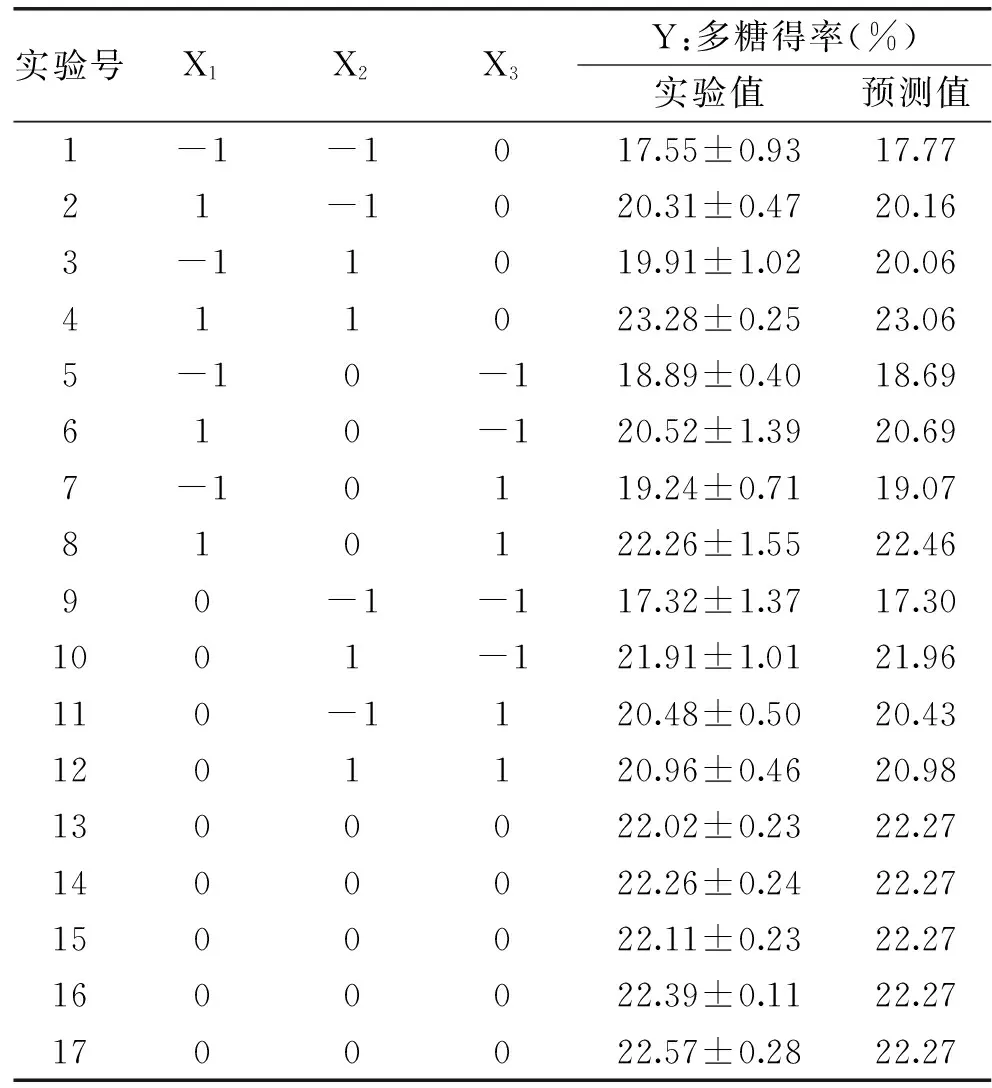
表2 新疆蕪菁多糖的Box-Behnken實驗設計及其響應值Table 2 Box-Behnken design and the response values for the yield of BRP
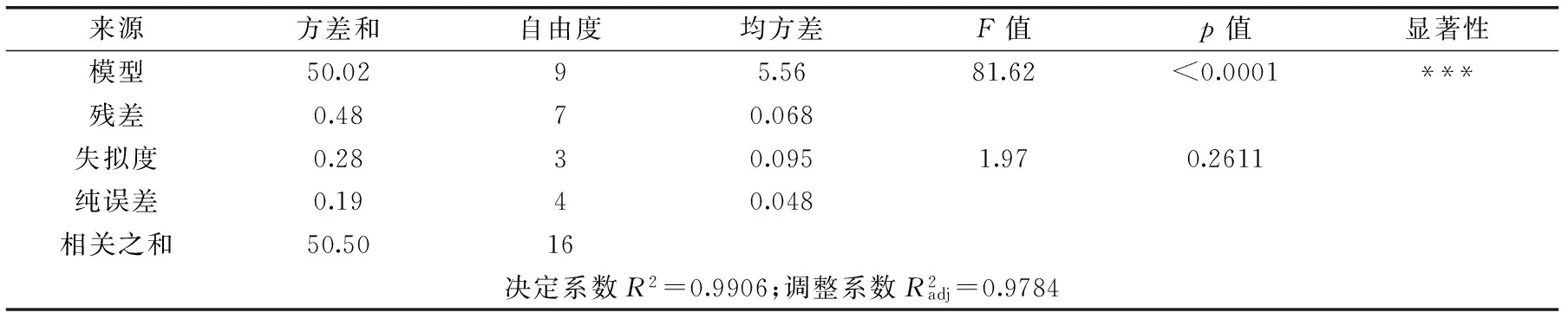
表3 多元回歸模型方差分析Table 3 ANOVA for quadratic polynomial model
注:*差異顯著(p<0.05),**差異較顯著(p<0.01),***差異極顯著(p<0.001)。

表4 響應面回歸模型的方差分析Table 4 ANOVA for response surface quadratic model
注:*差異顯著(p<0.05),**差異較顯著(p<0.01),***差異極顯著(p<0.001)。 從表4中可以看出,二次項系數(X12,X22及X32),線性系數(X1,X2及X3),實驗因子交互系數(X1X3及X2X3)都存在顯著差異(p<0.05),而其他實驗因子交互系數(X1X2)不顯著。
在各實驗因素的取值范圍內,利用Design-Expert(Version 8.0.7)軟件預測最優的提取條件為:提取溫度93.18 ℃,液料比75.11 mL/g,提取時間4.3 h,多糖得率的預測值為23.89%±0.34%。為了便于新疆蕪菁多糖提取條件的實際操作,最優的提取條件修正為:提取溫度93 ℃,液料比75 mL/g,提取時間4.3 h。在該最優提取條件下進行三次驗證實驗,測得的新疆蕪菁多糖得率為23.72%±0.33%。
2.6 新疆蕪菁多糖的體外抗氧化活性研究
2.6.1 DPPH自由基清除能力的測定 DPPH自由基能夠接受一個氫原子變成穩定的DPPH·H分子[13],因此,DPPH自由基被廣泛用于評價多糖的自由基清除能力。
由圖5可知,新疆蕪菁多糖的DPPH自由基清除能力具有量效依存關系,在該體系中的EC50值為8.55 mg/mL,多糖樣品的活性明顯低于VC(p<0.05),表明新疆蕪菁多糖具有中等的DPPH自由基清除活性。

圖5 新疆蕪菁多糖的DPPH自由基清除活性Fig.5 Scavenging activity on DPPH radical of BRP
2.6.2 還原能力的測定 多糖還原力是其抗氧化活性的重要指標,研究表明還原力與樣品的抗氧化活性緊密聯系[14],機理主要為樣品中的還原酮通過電子/氫原子給予能力,阻止自由基鏈形成,從而發揮抗氧化活性作用[15]。
由圖6可知,新疆蕪菁多糖的還原力具有量效依存關系,在該體系中的EC50值為2.25 mg/mL,表明新疆蕪菁多糖具有較強的還原力,然而,其還原力明顯低于VC(p<0.05)。
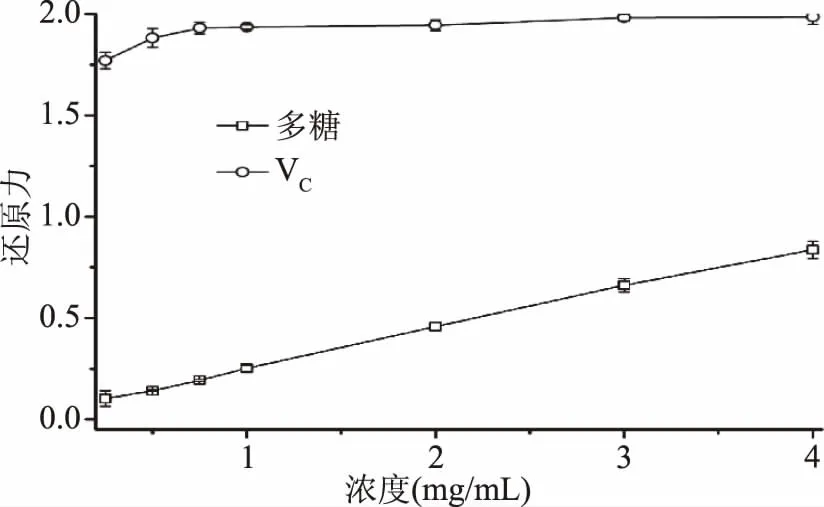
圖6 新疆蕪菁多糖的還原能力Fig.6 Reducing power of BRP
3 結論
本論文在單因素實驗結果基礎上,采用響應面法(RSM)對新疆蕪菁多糖的提取工藝進行優化,并利用DPPH自由基清除能力和還原力評價其體外抗氧化能力。利用Design-Expert(Version 8.0.7)軟件對實驗結果進行多元回歸分析,獲得的新疆蕪菁多糖二次多項回歸方程為:Y=7.1785X1+1.6985X2+9.6775X3+0.00305X1X2+0.0695X1X3-0.10275X2X3-0.03895X12-0.010388X22-1.06875X32-415.9375;最優的新疆蕪菁多糖提取條件為:提取溫度93 ℃,液料比75 mL/g,提取時間4.3 h,提取次數3次,在該提取條件下進行驗證,測得的新疆蕪菁多糖得率為23.72%±0.33%。此外,體外抗氧化實驗表明:新疆蕪菁多糖的DPPH自由基清除能力和還原力具有量效依存關系,其在兩種體系中的EC50值分別是8.55和2.25 mg/mL,表明新疆蕪菁多糖具有較強的體外抗氧化能力,可以作為天然抗氧化劑應用于功能食品或者制藥工業。
[1]HSD Santa,PRT Romao,V Sovrani,et al. Dietary polysaccharides and immune modulation[J]. Polysaccharides:Bioactivity and Biotechnology,2015:1991-2016.
[2]孫蓮,馬合木提,曾玲力,等.柱前衍生化HPLC測定新疆蕪菁多糖中的單糖[J].華西藥學雜志,2010,25(2):171-172.
[3]RM Kestwal,JC Lin,D Bagal-Kestwal,et al. Glucosinolates fortification of cruciferous sprouts by sulphur supplementation during cultivation to enhance anti-cancer activity[J]. Food Chemistry,2011,126(3):1164-1171.
[4]Y Xie,S Jiang,D Su,et al. Composition analysis and anti-hypoxia activity of polysaccharide fromBrassicarapaL.[J]. International Journal of Biological Macromolecules,2010,47(4):528-533.
[5]A Jafarian-Dehkordi,B Zolfaghari,M Mirdamadi. The effects of chloroform,ethyl acetate and methanolic extracts ofBrassicarapaL. on cell-mediated immune response in mice[J]. Research in Pharmaceutical Sciences,2013,8(3):159.
[6]譚莉,陳瑞戰,常清泉,等.淫羊藿葉多糖工藝優化及抗氧化活性[J].食品科學,2017,38(2):255-263.
[7]師萱,程曉慶,楊勇,等.響應面優化銀耳結締多糖提取工藝與抗氧化活性研究[J].食品工業科技,2017,38(2):297-301.
[8]姜曼.微波輔助提取玫瑰花多糖的工藝研究[J].食品研究與開發,2017,38(1):33-36.
[9]V Samavati. Polysaccharide extraction fromAbelmoschusesculentus:Optimization by response surface methodology[J]. Carbohydrate Polymers,2013,95(1):588-597.
[10]W Li,SW Cui,Y Kakuda. Extraction,fractionation,structural and physical characterization of wheat-D-glucans[J]. Carbohydrate Polymers,2006,63(3):408-416.
[11]段曉梅,儲維維,張燁.大理蒼山野生蕨菜多糖的提取及抗氧化性研究[J].中國食品添加劑,2015(8):79-85.
[12]J Liu,XY Wen,XQ Zhang,et al. Extraction,characterization andinvitroantioxidant activity of polysaccharides from black soybean[J]. International Journal of Biological Macromolecules,2015,72:1182-1190.
[13]S Li,NP Shah. Antioxidant and antibacterial activities of sulphated polysaccharides fromPleurotuseryngiiandStreptococcusthermophilusASCC 1275[J]. Food Chemistry,2014,165:262-270.
[14]PD Duh,PC Du,GC Yen. Action of methanolic extract of mung bean hulls as inhibitors of lipid peroxidation and non-lipid oxidative damage[J]. Food and Chemical Toxicology,1999,37(11):1055-1061.
[15]T Zhao,Q Zhang,H Qi,et al. Degradation of porphyran fromPorphyrahaitanensisand the antioxidant activities of the degraded porphyrans with different molecular weight[J]. International Journal of Biological Macromolecules,2006,38(1):45-50.
一套《食品工業科技》在手, 縱觀食品工業發展全貌

