全反式維甲酸誘導(dǎo)經(jīng)典型霍奇金淋巴瘤B細(xì)胞表型
杜 靜,宮凱凱,楊麗娟,陳微微,羅麗卿
(1.濱州醫(yī)學(xué)院附屬醫(yī)院,腫瘤研究中心,山東 濱州 256600; 2.濱州醫(yī)學(xué)院附屬醫(yī)院,血液科,山東 濱州 256600)
經(jīng)典型霍奇金淋巴瘤(classical Hodgkin Lymphoma, cHL)以無痛性、進(jìn)行性淋巴結(jié)腫大為主要臨床表現(xiàn),病理診斷可見特征性的HRS(Hodgkin’s and Reed-Sternberg cells)瘤細(xì)胞[1]。盡管目前約85%的病人預(yù)后較好,仍有部分病人因原發(fā)或繼發(fā)耐藥死亡[2]。雖然cHL細(xì)胞具有B細(xì)胞特征性的免疫球蛋白(immunoglobulin, Ig)基因重排且起源于B細(xì)胞,卻缺失了B細(xì)胞特異性標(biāo)記物如CD19,CD20等基因的轉(zhuǎn)錄和表達(dá)[3-4],同時細(xì)胞表面異常高表達(dá)B細(xì)胞非特異性抗原如CD30[5]。B細(xì)胞表型的缺失是造成霍奇金淋巴瘤細(xì)胞逃避免疫監(jiān)視和惡性轉(zhuǎn)化的關(guān)鍵因素[6-7],因此誘導(dǎo)霍奇金淋巴瘤B細(xì)胞表型轉(zhuǎn)化將有助于臨床治療。
全反式維甲酸(all trans-retinoic acid,ATRA)是維生素A的代謝產(chǎn)物,具有誘導(dǎo)細(xì)胞分化的作用,臨床上用于急性早幼粒白血病的治療。有研究證明,ATRA能夠在體內(nèi)外誘導(dǎo)淋巴母細(xì)胞向B細(xì)胞分化[8]。本研究構(gòu)建熒光素酶標(biāo)記的B細(xì)胞特異性啟動子cHL報告細(xì)胞,檢測ATRA對B細(xì)胞外源啟動子活性及相關(guān)基因表達(dá)的誘導(dǎo)作用,通過與去甲基化藥物5-Aza聯(lián)合用藥,進(jìn)一步探討ATRA重新激活cHL細(xì)胞B細(xì)胞表型的潛在作用。
1 材料和方法
1.1 細(xì)胞及主要試劑
霍奇金淋巴瘤細(xì)胞系(KMH2、L1236和L428)為本實(shí)驗室凍存。攜帶CD19啟動子載體由由Kupperschmitt教授惠贈,攜帶CD79a(mb1)、CD79b(B29)和ICSBP的質(zhì)粒由Sigvardsson教授惠贈[9-11]。
5-Aza-2’-deoxycytidine(5-Aza)、ATRA和鈣黃綠素(Calcein AM,CAM)購自Sigma 公司;Dual-Glo? Luciferase和ONE-GloTMLuciferase檢測試劑盒購自Promega;胎牛血清、1640培養(yǎng)基、胰酶購自美國Gibco 公司;質(zhì)粒構(gòu)建所需內(nèi)切酶和連接酶購自NEB公司;RNA提取及逆轉(zhuǎn)錄試劑購于Invitrogen;長片段基因擴(kuò)增所用Dream Taq Green酶購自Fermentas;質(zhì)粒提取試劑盒購自德國Qiagen 公司; 蛋白免疫印跡所用抗體購自Acris Antibodies;流式細(xì)胞染色所需CD30抗體購自BD生物有限公司。流式細(xì)胞儀購自BD 生物有限公司;電轉(zhuǎn)儀及相關(guān)緩沖試劑購自Lonza。
1.2 實(shí)驗方法
1.2.1 細(xì)胞培養(yǎng)及用藥
人的cHL細(xì)胞系懸浮培養(yǎng)于含10%胎牛血清和1%雙抗的1640 培養(yǎng)基,在含有5% CO2的培養(yǎng)箱中37℃常規(guī)培養(yǎng),根據(jù)細(xì)胞狀態(tài)每2~3 d傳代。以DMSO處理樣本為陰性對照,常規(guī)ATRA和5-Aza用藥濃度為10 μmol/L(除非特殊標(biāo)注)。
1.2.2 質(zhì)粒構(gòu)建
通過XhoI/SalⅠ雙酶切PL452質(zhì)粒并電泳膠回收得到2038 bp PGK-NEO片段,將插入片段與Sal I單酶切的B細(xì)胞啟動子pGL3熒光素酶報告載體連接,DH5α轉(zhuǎn)化后挑單克隆并小提,通過Sal I/Bgl II雙酶切鑒定陽性克隆。
1.2.3 細(xì)胞轉(zhuǎn)染及穩(wěn)定克隆篩選
提取質(zhì)粒并去除內(nèi)毒素,收集細(xì)胞,根據(jù)Nucleofector電轉(zhuǎn)儀說明選擇相應(yīng)的緩沖液和轉(zhuǎn)染程序進(jìn)行細(xì)胞轉(zhuǎn)染。KMH2和L1236細(xì)胞采用T緩沖液和T-001程序轉(zhuǎn)染, L428細(xì)胞采用L緩沖液和X-001程序進(jìn)行轉(zhuǎn)染。
1.2.4 穩(wěn)定轉(zhuǎn)染細(xì)胞篩選
瞬時轉(zhuǎn)染48 h后離心換液,以轉(zhuǎn)染eGFP的相應(yīng)細(xì)胞為平行對照進(jìn)行G418篩選,藥物濃度在KMH2、L1236和L428細(xì)胞分別為200、400和400 μg/mL,篩選2周后對照細(xì)胞全部死亡,改為G418半量維持培養(yǎng)。
1.2.5 穩(wěn)定轉(zhuǎn)染細(xì)胞的目的片段整合鑒定
提取篩選后cHL細(xì)胞基因組并進(jìn)行PCR,所用引物序列如下:pGL3 For:5’-GGAAGACGCCAAAA ACATAAAG-3’,pGL3 Rev:5’-CATCGGTCGACGGA TCCTTATC-3’
1.2.6 shRNA干擾實(shí)驗
采用pSUPER-puro 系統(tǒng)(Invitrogen)進(jìn)行ABF1瞬時和穩(wěn)定敲除,所需引物如下:ABF1 301 For:5’-GATCCCCGCCGCAGAGTGCAAGCAGTTTCAAGAGA ACTGCTTGCACTCTGCGGCTTTTTGGAAA,ABF1 301 Rev:3’-GGGCGGCGTCTCACGTTCGTCAAAGTTCTC TTGACGAACGTGAGACGCCGAAAAACCTTTTCGA;所用對照無義序列如下:Scramble For: 5’-GATCCCCCGTACGCGGAATACTTCGATTCAAGAGA TCGAAGTATTCCGCGTACGTTTTTGGAAA,Scramble Rev: 3’-GGGGCATGCGCCTTATGAA GCTAAGTTCT
CTAGCTTCATAAGGCGCATGCAAAAACCTTTTCGA
1.2.7 熒光素酶活性檢測
在96孔板每孔加入100 μL細(xì)胞懸液和10 μmol/L鈣黃綠素CAM, 室溫避光孵育10 min后檢測熒光強(qiáng)度。同時,另取100 μL細(xì)胞懸液加入100 μL One-Glo reagent, 室溫避光孵育15 min,細(xì)胞充分裂解后于560 nm檢測化學(xué)發(fā)光信號強(qiáng)度。
1.2.8 免疫印跡
提取細(xì)胞總蛋白并通過Bradford法測量濃度,加入上樣緩沖液后于95℃孵育5 min。通過SDS-聚丙烯酰胺凝膠分離蛋白并轉(zhuǎn)到0.22 μm孔徑的PVDF膜上,一抗4℃過夜孵育,辣根過氧化物酶HRP標(biāo)記的二抗室溫孵育1 h后通過ECL法顯色。
1.2.9 實(shí)時熒光定量PCR
使用TRIzol試劑提取細(xì)胞總RNA并通過Superscript II Reverse逆轉(zhuǎn)錄酶合成互補(bǔ)cDNA。以琥珀酸脫氫酶復(fù)合物亞單位A(SDHA)做內(nèi)參,使用TaqMan進(jìn)行實(shí)時熒光定量PCR檢測目的基因表達(dá)水平。所有反應(yīng)均設(shè)三個復(fù)孔,基因的相對表達(dá)量比較采用ΔΔCt法。
1.2.10 流式細(xì)胞技術(shù)
取5×105細(xì)胞于1200 r/min離心5 min,用預(yù)冷的PBS洗滌2次,抗體1∶2稀釋后避光孵育30 min, PBS洗滌后用含有1% FBS的PBS懸浮細(xì)胞,采用FL-1通道上機(jī)檢測FITC標(biāo)記的抗體,以同型IgG抗體做陰性對照。采用Flowjo軟件分析結(jié)果。
1.3 統(tǒng)計學(xué)方法
2 結(jié)果
2.1 攜帶G418抗性的B細(xì)胞特異性啟動子報告載體的構(gòu)建
對PL452質(zhì)粒進(jìn)行XhoI/SalⅠ雙酶切得到將PGK-NEO片段,插入由Sal I單酶切線性化的 B細(xì)胞啟動子pGL3載體內(nèi),構(gòu)建可用于G418穩(wěn)定篩選的CD19/CD79a/CD79b/ICSBP -pGL3-PGK-NEO質(zhì)粒(見圖1 A)。通過Sal I/Bgl II雙酶切鑒定陽性克隆,CD19-pGL3-PGK-NEO正確克隆瓊脂糖電泳應(yīng)顯示2 kb和7 kb片段,CD79a/CD79b/ICSBP-pGL3-PGK-NEO質(zhì)粒正確克隆顯示2 kb和5 kb片段,Afe I單酶切后分別產(chǎn)生9 kb和7 kb片段。
2.2 穩(wěn)定轉(zhuǎn)染克隆的篩選及其B細(xì)胞特異性啟動子的基因擴(kuò)增和功能鑒定
采用Lonza核電轉(zhuǎn)染系統(tǒng),以eGFP為陽性對照摸索出針對不同細(xì)胞系的最佳轉(zhuǎn)染條件(程序和緩沖液等詳見方法部分)。經(jīng)G418篩選穩(wěn)定轉(zhuǎn)染細(xì)胞后提取基因組,擴(kuò)增外源啟動子和熒光素酶片段以鑒定其整合,CD79a/CD79b/ICSBP-Luc序列擴(kuò)增后應(yīng)為2.2 kb, CD19-Luc序列擴(kuò)增后應(yīng)為4 kb,以104倍稀釋后的CD79a-pGL3質(zhì)粒和pGL3空載體為陽性對照,以未轉(zhuǎn)染細(xì)胞基因組為陰性對照可見,CD79a/CD79b/CD19-Luc序列穩(wěn)定整合到KMH2,L1236和L428細(xì)胞中(見圖1A)。據(jù)報道,活化的B細(xì)胞因子1(Activated B-cell Factor, ABF1)在cHL細(xì)胞內(nèi)異常高表達(dá)且與早期B細(xì)胞發(fā)育分化的關(guān)鍵轉(zhuǎn)錄因子E2A結(jié)合并抑制其功能[12]。為進(jìn)一步檢驗整合后的啟動子是否具有功能,我們通過RNA干擾技術(shù)敲除ABF1表達(dá),并在瞬時和穩(wěn)定敲除ABF1的L428熒光素酶報道細(xì)胞中檢測其對B細(xì)胞特異性啟動子活性的影響。結(jié)果證實(shí),ABF1表達(dá)沉默能夠顯著增加CD19、CD79a和CD79b啟動子的轉(zhuǎn)錄活性(見圖1B-D)。
2.3 ATRA激活cHL細(xì)胞中外源B細(xì)胞特異性啟動子的轉(zhuǎn)錄活性
我們首先采用1和10 μmol/L ATRA孵育CD19-Luc整合的L428細(xì)胞后,分別在24、48 h和72 h檢測熒光素酶強(qiáng)度,以鈣黃綠素(calcein AM,CAM)對活細(xì)胞進(jìn)行熒光標(biāo)記以排除細(xì)胞死亡造成的假陰性。結(jié)果顯示,10 μM ATRA在48 h對細(xì)胞CD19啟動子具有最大誘導(dǎo)活性(見圖2 A)。
以往研究證實(shí),CD19和免疫球蛋白重鏈基因的啟動子區(qū)域在霍奇金淋巴瘤細(xì)胞內(nèi)存在甲基化[13-14],因此我們進(jìn)一步采用5-Aza和ATRA單獨(dú)和/或聯(lián)合孵育報告細(xì)胞后進(jìn)行熒光素酶活性檢測,發(fā)現(xiàn)兩種藥物能夠在3種cHL細(xì)胞系中激活CD19啟動子活性,且二者聯(lián)合用藥時具有協(xié)同效應(yīng)(見圖2C)。此外,在KMH2和L428細(xì)胞中ATRA能夠顯著誘導(dǎo)CD79a和CD79b啟動子活性,盡管5-Aza單獨(dú)作用時對CD79a無顯著作用且對CD79b作用輕微,但是能夠增加ATRA對兩個B細(xì)胞基因的誘導(dǎo)作用(見圖2D和E)。
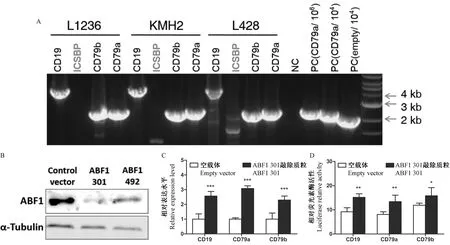
注:與空載體組比較,*P<0.05,**P<0.01,***P<0.001。圖1 穩(wěn)定轉(zhuǎn)染克隆B細(xì)胞啟動子的基因擴(kuò)增和功能鑒定Note.Compared with the empty vector group, *P<0.05,**P<0.01,***P<0.001.Fig.1 Amplification and functional verification of B-promoter reporters integrated into the host genome of cHL cell lines
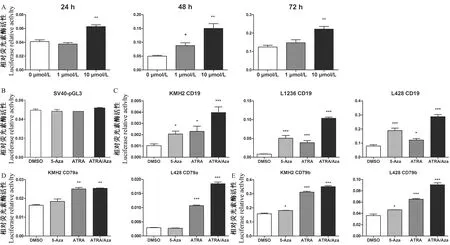
注:與對照組比較,*P<0.05,**P<0.01,***P<0.001。圖2 ATRA和5-Aza單獨(dú)和聯(lián)合用藥時對CD19、CD79a和CD79b外源啟動子活性的影響Note.Compared with the DMSO treated group, *P<0.05,**P<0.01,***P<0.001.Fig.2 Effect of single or double treatment of ATRA and 5-Aza on the activity of B-specific promoters
由于許多化合物可與熒光素酶本身結(jié)合并影響其活性,為排除5-Aza和ATRA直接作用于熒光素酶而非B細(xì)胞啟動子,我們以SV40-pGL3-PGK-NEO穩(wěn)定轉(zhuǎn)染細(xì)胞為對照,以同樣條件加入5-Aza和/或ATRA孵育發(fā)現(xiàn)兩種藥物對SV40啟動子無作用(見圖2B),證實(shí)5-Aza和ATRA可以特異性誘導(dǎo)B細(xì)胞啟動子的轉(zhuǎn)錄活性。
2.4 ATRA激活cHL細(xì)胞中內(nèi)源B細(xì)胞特異性基因轉(zhuǎn)錄和表達(dá)
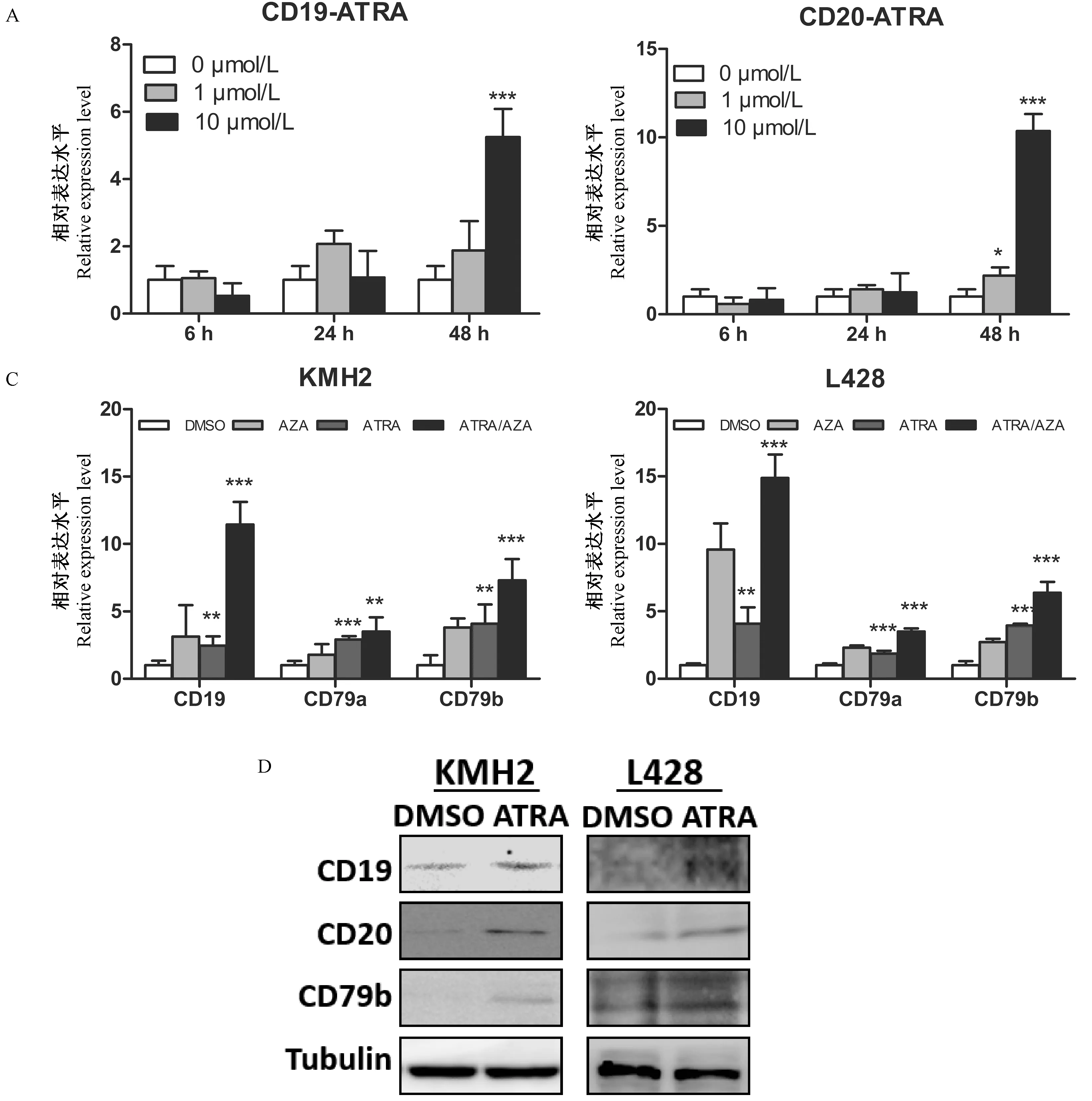
注:(C)圖中圖例DMSO、AZA、ATRA和ATRA/AZA分別代表細(xì)胞進(jìn)行DMSO(對照)、5-Aza、ATRA和聯(lián)合用藥。與對照組比較,*P<0.05,**P<0.01,***P<0.001。圖3 5-Aza和ATRA單獨(dú)和聯(lián)合用藥時對CD19、CD79a和CD79b內(nèi)源基因表達(dá)水平的影響Note.Legends in (C) represent cell treated with DMSO, 5-Aza, ATRA and combination of ATRA and 5-AZA. Compared with the DMSO treated group, *P<0.05,**P<0.01,***P<0.001.Fig.3 Effect of single or double treatment of ATRA and 5-Aza on the expression of B-specific promoters
采用1和10 μmol/L ATRA孵育L428細(xì)胞,在6、24和48 h提取RNA并反轉(zhuǎn)錄,通過RQ-PCR檢測CD19和CD20基因轉(zhuǎn)錄水平的改變。如圖3 A和B所示,ATRA呈劑量和時間依賴性的誘導(dǎo)L428細(xì)胞內(nèi)源CD19和CD20基因轉(zhuǎn)錄。用5-Aza(圖中簡寫為AZA)和/或ATRA孵育KMH2和L428細(xì)胞48 h后,檢測內(nèi)源B細(xì)胞特異性標(biāo)記物CD19、CD79a和CD79b轉(zhuǎn)錄水平發(fā)現(xiàn),5-Aza和ATRA單獨(dú)用藥時能夠誘導(dǎo)內(nèi)源cHL細(xì)胞中CD19,CD79a和CD79b轉(zhuǎn)錄,且二者具有協(xié)同效應(yīng)(見圖3C)。用10 μmol/L ATRA孵育KMH2和L428細(xì)胞后提取蛋白進(jìn)行免疫印跡,結(jié)果顯示ATRA能夠誘導(dǎo)CD19、CD20和CD79b基因在KMH2和L428細(xì)胞重新表達(dá)(見圖3D)。
2.5 ATRA下調(diào)cHL細(xì)胞表面特異性CD30抗原表達(dá)水平
為揭示ATRA對cHL細(xì)胞霍奇金特異性細(xì)胞表型的影響,我們進(jìn)一步檢測了ATRA處理對KMH2和L428細(xì)胞表面CD30抗原表達(dá)水平的作用。流式細(xì)胞染色顯示,與DMSO處理的對照細(xì)胞相比較,ATRA下調(diào)KMH2和L428細(xì)胞表面cHL特異性標(biāo)記物CD30表達(dá)水平(見圖4)。以上結(jié)果均提示ATRA能夠誘導(dǎo)B細(xì)胞表型缺失的cHL細(xì)胞重新或得B細(xì)胞表型。

圖4 ATRA對cHL細(xì)胞霍奇金細(xì)胞特異性標(biāo)記物CD30蛋白表達(dá)的影響Fig.4 Effect of ATRA on Hodgkin lymphoma cells regarding Hodgkin-cell specific gene CD30 expression
3 討論
cHL約占B細(xì)胞淋巴瘤發(fā)病率的10%,瘤細(xì)胞攜帶B細(xì)胞特征性的免疫球蛋白重鏈IgH基因重組,卻不具有B細(xì)胞特異性基因表達(dá)譜,包括CD19、CD20、B細(xì)胞表面受體復(fù)合物CD79a和CD79b等[15-16],同時異常高表達(dá)B細(xì)胞非特異性基因如CD30、NOTCH1、ABF1和ID2等[12, 17-18]。瘤細(xì)胞表型的轉(zhuǎn)變對其惡性轉(zhuǎn)化及免疫逃逸有重要作用,因此尋找霍奇金淋巴瘤B細(xì)胞表型的誘導(dǎo)劑具有潛在的臨床治療價值。
表觀遺傳修飾如啟動子甲基化是腫瘤發(fā)生和表型轉(zhuǎn)變的重要因素[14, 19-20]。以往研究發(fā)現(xiàn),cHL原代HRS細(xì)胞和商品化的細(xì)胞系中CD19和CD79b基因啟動子區(qū)域及組蛋白H3存在甲基化[13-14],提示B細(xì)胞表型缺失與B細(xì)胞特異性基因的異常甲基化修飾有關(guān)。然而,Hummel[21]和我們以往研究表明,去甲基化藥物5-Aza處理cHL細(xì)胞并未顯著誘導(dǎo)其B細(xì)胞特異性基因的表達(dá)[22],提示尚有其它因素阻遏cHL細(xì)胞內(nèi)B細(xì)胞基因的轉(zhuǎn)錄和翻譯。
以CD19為標(biāo)記,Chen等[8]發(fā)現(xiàn)ATRA能夠誘導(dǎo)小鼠和人的淋巴母細(xì)胞向B細(xì)胞分化。為進(jìn)一步探索ATRA對B細(xì)胞表型缺失的霍奇金淋巴瘤重新向B細(xì)胞分化的誘導(dǎo)作用,本研究首先建立了B細(xì)胞特異性啟動子(CD19,CD79a和CD79b)驅(qū)動熒光素酶穩(wěn)定整合的cHL報告細(xì)胞系。其中CD19啟動子包含了B細(xì)胞特異性增強(qiáng)子Eμ、B細(xì)胞特異性轉(zhuǎn)錄因子PAX5和EBF的結(jié)合位點(diǎn)和甲基化修飾位點(diǎn)[9],其穩(wěn)定整合能夠更好的模擬和反映內(nèi)源CD19啟動子活性狀態(tài)。同時,為驗證外源啟動子功能的完整性,我們敲除了在cHL中異常高表達(dá)的轉(zhuǎn)錄因子ABF1,發(fā)現(xiàn)ABF1沉默可以顯著提高CD19、CD79a和CD79b啟動子驅(qū)動的熒光素酶活性,證明外源啟動子能夠忠實(shí)的反應(yīng)相應(yīng)內(nèi)源基因啟動子的轉(zhuǎn)錄活性。
以B細(xì)胞啟動子報告細(xì)胞和親本cHL細(xì)胞為模型,我們發(fā)現(xiàn)ATRA能夠誘導(dǎo)CD19、CD20、CD79a和CD79b的轉(zhuǎn)錄與表達(dá),同時降低細(xì)胞表面霍奇金細(xì)胞特異性CD30抗原表達(dá)水平,提示ATRA能夠激活cHL內(nèi)B細(xì)胞特異性轉(zhuǎn)錄程序并誘導(dǎo)其重新向B細(xì)胞轉(zhuǎn)化。去甲基化藥物5-Aza聯(lián)合應(yīng)用能夠進(jìn)一步提高B細(xì)胞特異性基因的表達(dá)水平。臨床上,抗CD20的單克隆抗體治療在具有B細(xì)胞表型的非霍奇金淋巴瘤病人上取得了顯著療效,此外有大量靶向CD19的抗體在淋巴瘤治療的相關(guān)研究[23-25]。由于表型缺失,CD20單抗在cHL病人治療中的療效受到了限制,ATRA對cHL細(xì)胞中CD19和CD20表達(dá)的誘導(dǎo)或可促進(jìn)單克隆抗體對復(fù)發(fā)或耐藥cHL病例中的應(yīng)用。
綜上所述,我們建立了穩(wěn)定整合B細(xì)胞特異性啟動子驅(qū)動熒光素酶的cHL細(xì)胞系,該報告細(xì)胞可用于后續(xù)B細(xì)胞表型誘導(dǎo)藥物的篩選。本研究發(fā)現(xiàn)ATRA能有誘導(dǎo)去分化的cHL細(xì)胞重獲B細(xì)胞表型,具有增敏cHL對靶向B細(xì)胞表型單抗治療的潛在作用。
[1] Br?uninger A, Schmitz R, Bechtel D, et al. Molecular biology of Hodgkin’s and Reed/Sternberg cells in Hodgkin’s lymphoma [J]. Int J Cancer, 2006, 118(8): 1853-1861.
[2] Townsend W, Linch D. Hodgkin’s lymphoma in adults [J]. Lancet, 2012, 380(9844): 836-847.
[3] Küppers R, Rajewsky K, Zhao M, et al. Hodgkin disease: Hodgkin and Reed-Sternberg cells picked from histological sections show clonal immunoglobulin gene rearrangements and appear to be derived from B cells at various stages of development [J]. Proc Natl Acad Sci U S A, 1994, 91(23): 10962-10966.
[4] Marafioti T, Hummel M, Foss HD, et al. Hodgkin and Reed-Sternberg cells represent an expansion of a single cloneoriginating from a germinal center B-cell with functional immunoglobulin gene rearrangements but defective immunoglobulin transcription [J]. Blood, 2000, 95(4): 1443-1450.
[5] Slovak ML, Bedell V, Hsu YH, et al. Molecular karyotypes of Hodgkin and Reed-Sternberg cells at disease onset reveal distinct copy number alterations in chemosensitive versus refractory Hodgkin lymphoma [J]. Clin Cancer Res, 2011, 17(10): 3443-3454.
[6] 劉曉健, 龍志國, 喬忠杰. 經(jīng)典型霍奇金淋巴瘤表觀遺傳學(xué)異常及其對免疫逃逸的影響 [J]. 實(shí)用腫瘤學(xué)雜志, 2017, 31(1): 73-77.
[7] Steidl C, Connors JM, Gascoyne RD. Molecular pathogenesis of Hodgkin’s lymphoma: Increasing evidence of the importance of the microenvironment [J]. J Clin Oncol, 2011, 29(14): 1812-1826.
[8] Chen X, Esplin BL, Garrett KP, et al. Retinoids accelerate B lineage lymphoid differentiation [J]. J Immunol, 2008, 180(1): 138-145.
[9] Sirven A, Ravet E, Charneau P, et al. Enhanced transgene expression in cord blood cd34(+)-derived hematopoietic cells, including developing T cells and NOD/SCID mouse repopulating cells, following transduction with modified trip lentiviral vectors [J]. Mol Ther, 2001, 3(4): 438-448.
[10] Sigvardsson M, Clark DR, Fitzsimmons D, et al. Early B-cell factor, e2a, and pax-5 cooperate to activate the early B cell-specific mb-1 promoter [J]. Mol Cell Biol, 2002, 22(24): 8539-8551.
[11] Akerblad P, Rosberg M, Leanderson T, et al. The b29 (immunoglobulin beta-chain) gene is a genetic target for early B-cell factor [J]. Mol Cell Biol, 1999, 19(1): 392-401.
[12] Mathas S, Janz M, Hummel F, et al. Intrinsic inhibition of transcription factor E2A by HLH proteins ABF-1 and Id2 mediates reprogramming of neoplastic B cells in Hodgkin lymphoma [J]. Nat Immunol, 2006, 7(2): 207-215.
[13] Ushmorov A, Leith?user F, Sakk O, et al. Epigenetic processes play a major role in B-cell-specific gene silencing in classical Hodgkin lymphoma [J]. Blood, 2006, 107(6): 2493-2500.
[14] Ushmorov A, Ritz O, Hummel M, et al. Epigenetic silencing of the immunoglobulin heavy-chain gene in classical Hodgkin lymphoma-derived cell lines contributes to the loss of immunoglobulin expression [J]. Blood, 2004, 104(10): 3326-3334.
[15] Mathas S. The pathogenesis of classical Hodgkin’s lymphoma: A model for B-cell plasticity [J]. Hematol Oncol Clin North Am, 2007, 21(5): 787-804.
[16] 李銀珍, 王芳, 邵瓊, 等. Igh基因單克隆重排檢測及其在B細(xì)胞性非霍奇金淋巴瘤診斷中的應(yīng)用 [J]. 中國病理生理雜志, 2012, 28(11): 1994-1998.
[17] Jundt F, Acikg?z O, Kwon SH, et al. Aberrant expression of notch1 interferes with the B-lymphoid phenotype of neoplastic B cells in classical Hodgkin lymphoma [J]. Leukemia, 2008, 22(8): 1587-1594.
[18] Renné C1, Martin-Subero JI, Eickernj?ger M, et al. Aberrant expression of Id2, a suppressor of B-cell-specific gene expression, in Hodgkin’s lymphoma [J]. Am J Pathol, 2006, 169(2): 655-664.
[19] Losman JA. Cancer therapy: The leukaemia epigenome targeted [J]. Nature, 2017, 543(7647): 634-635.
[20] 張玲,盛樹力,秦川. 表觀遺傳學(xué)藥物的研究進(jìn)展 [J]. 中國藥理學(xué)通報, 2013, 29(3): 297-303.
[21] Ehlers A, Oker E, Bentink S, et al. Histone acetylation and DNA demethylation of B cells result in a Hodgkin-like phenotype [J]. Leukemia, 2008, 22(4): 835-841.
[22] Du J, Neuenschwander M, Yu Y, et al. Pharmacological restoration and therapeutic targeting of the B-cell phenotype in classical Hodgkin lymphoma [J]. Blood, 2017, 129(1): 71-81.
[23] Viardot A, Goebeler ME, Hess G, et al. Phase 2 study of the bispecific T-cell engager (bite) antibody blinatumomab in relapsed/refractory diffuse large B-cell lymphoma [J]. Blood, 2016,127(11):1410-1416.
[24] Pérez-Callejo D, González-Rincón J, Sánchez A, et al. Action and resistance of monoclonal CD20 antibodies therapy in B-cell Non-Hodgkin lymphomas [J]. Cancer Treat Rev, 2015, 41(8): 680-689.
[25] Bander NH, Czuczman MS, Younes A. Antibody-drug conjugate technology development for hematologic disorders [J]. Clin Adv Hematol Oncol, 2012,10(8 Suppl 10): 1-16.

