大鼠Pig-a基因突變試驗中N-乙基-N-亞硝基脲和環磷酰胺量-效關系的優化
劉香梅,李培寧,劉冬虹,黃宇鋒,龐增雄,陳梓靈,徐穎愉,丘智峰
(廣州質量監督檢測研究院,廣州 511447)
Pig-a基因位于X染色體上,作為管家基因,其同源基因編碼區的結構和功能在人、大鼠、小鼠都有高度的保守性,該基因位點的突變可間接導致細胞表面錨蛋白(GPI-AP)的缺失,如CD59、CD55等,提示我們Pig-a基因突變試驗可用于檢測體內基因突變終點遺傳毒性試驗。
目前,常用的遺傳毒性試驗陽性物,如乙基亞硝基脲(ethylnitrosourea,ENU)、4-硝基喹啉-N-氧化物(4NQO),環磷酰胺(cyclophosphamide, CP),苯并芘等也可作為Pig-a基因突變試驗陽性物開展試驗[1-3],但是致突變的效果不同。研究發現,多能干細胞及成熟的血細胞均可發生Pig-a基因突變而導致的GPI-AP缺失,因此外周血是最早用于研究Pig-a基因突變,而外周血中不同細胞的受累程度不同,紅細胞較少發生GPI-AP的自發缺失,因此可以將外周血紅細胞表面CD59缺失率作為Pig-a基因體內突變試驗檢測終點[4]。傳統遺傳毒性試驗具有周期長、成本較高、且大多不能有效反映基因突變終點,從而造成其體外和體內試驗結果的一致性也欠佳等缺陷,而利用Pig-a基因突變試驗原理建立的致突變檢測方法則可以解決這些問題。
本試驗研究不同劑量的ENU和CP對SD大鼠外周血紅細胞表面錨蛋白CD59缺失的影響,從而篩選適合于遺傳毒性試驗的優選陽性物及劑量,確定實驗周期,以優化Pig-a基因突變試驗檢測方法,用于化妝品致突變性安全評價。
1 材料和方法
1.1 實驗動物
SPF級SD大鼠,雄性24只,180~200 g,40~50日齡,購自南方醫科大學實驗動物中心[SCXK(粵)2016-0041],倫理審查編號:2017-01-07。大鼠飼養于本單位屏障實驗室[SYXK(粵)2014-0137],自由進食進水,實驗室溫度20℃~26℃,濕度40%~70 %。
1.2 主要試劑及儀器
ENU,CAS:759-73-9,LOT# MKBX 4322 V,Sigma;CP,批號:SJ0121RA14,上海源葉生物科技有限公司;DPBS,LOT:1546333,2017-02,Gibco;胎牛血清(FBS),批號:141012,杭州四季青生物工程材料有限公司。FITC Mouse Anti-Rat CD59,貨號:550976,批號:4233743;PE Mouse Anti-Rat CD45抗體,貨號:554878,批號:7054649,BD公司;
BD FACSCanto II 流式細胞儀;KDC 1044低速離心機。
1.3 實驗方法
動物經檢疫合格后,將SD大鼠按體重和外周血RBCCD59-隨機分為4組,即溶媒對照組,ENU 10 mg/kg給藥組,ENU 40 mg/kg給藥組和CP 40 mg/kg給藥組,每組6只。采用腹腔注射染毒,各組染毒1次,溶媒對照組注射PBS溶液。在染毒前和染毒后7、14、28、42、56 d進行眼眶靜脈叢采血,采用乙醚麻醉,稱重并采抗凝血,置于冰上保存備用。
吸取1.5 μL抗凝血,加入200 μL含1%胎牛血清的PBS溶液的流式管中,輕微震蕩數秒。加入2.5 μL anti-CD45和1 μL anti-CD59,輕輕轉動,使抗體混合均勻,室溫暗處避光孵化約30 min。離心棄上清液,加入約0.5 mL含1%胎牛血清的PBS溶液,輕輕轉動,上流式細胞儀檢測,每個樣本檢測100萬個紅細胞[5-7],分析大鼠外周血RBCCD59-發生率。
1.4 統計學方法
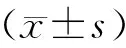
2 結果
2.1 ENU和CP對大鼠體重的影響
與溶媒對照組比較,ENU 10 mg/kg給藥組和ENU 40 mg/kg給藥組各時間點體重及體重增量均無明顯影響(P> 0.05),CP 40 mg/kg給藥組給藥后時間點體重及體重增量均下降(P< 0.05)。說明ENU 10 mg/kg和40 mg/kg劑量對大鼠體重沒有影響,而40 mg/kg劑量的CP可降低大鼠體重。結果見表1、圖1。

表1 ENU和CP對各時間點大鼠體重的影響結果
注:與溶媒對照組比較,*P< 0.05,**P< 0.01。
Note.Compared with the control group,*P< 0.05,**P< 0.01.

圖1 ENU和CP對各時間點大鼠體重的影響結果Fig.1 Effect of ENU and CP on the body weight of rats at different time points
2.2 ENU和CP對大鼠外周血RBCCD59-發生率的影響
與溶媒對照組比較,CP 40 mg/kg給藥組給藥后第28、42和56天,ENU 10 mg/kg給藥組給藥后第42、56天,ENU 40 mg/kg給藥組給藥后第7、14、21、28、42和56天外周血RBCCD59-發生率均升高(P< 0.05)。與ENU 10 mg/kg給藥組比較,ENU 40 mg/kg給藥組給藥后第7、21、28、42和56天外周血RBCCD59-發生率均升高(P< 0.05)。結果見表2、圖2。
3 討論
隨著科學研究的發展,如何最大限度減少實驗動物的使用數量,快速又準確的得出遺傳基因的改變是現階段研究的重點。在Pig-a基因突變檢測方法建立的過程中,國內外研究發現,Pig-a基因突變造成外周血紅細胞表面CD59的缺失是一個逐漸累積的過程,這對檢測有微弱遺傳毒性的物質是一種很有意義的方法。目前的研究主要集中在陽性誘變劑ENU、4NOQ、EMS等的篩選、檢測指標的種類及相關性等方面。而CP作為傳統遺傳毒性試驗檢測方法中最常見的陽性致突變劑,在Pig-a基因突變試驗中研究卻甚少。本試驗主要研究CP傳統遺傳毒性試驗常用劑量 40 mg/kg和同劑量下的ENU,以ENU 10 mg/kg劑量,于給藥后第7~56天對外周血RBCCD59-發生率的影響。

表2 ENU和CP對各時間點大鼠外周血RBCCD59-發生率的影響結果
注:與溶媒對照組比較,*P< 0.05,**P< 0.01;與ENU10 mg/kg給藥組比較,#P< 0.05,##P< 0.01。
Note.Compared with the control group,*P< 0.05,**P< 0.01. Compared with the ENU 10 mg/kg group,#P< 0.05,##P< 0.01.

注:A:空白對照FSC-A/SSC-A圖;B:空白對照PE-A/SSC-A圖;C:空白對照FITC-A/SSC-A圖;D:溶媒對照組;E:CP 40 mg/kg給藥組;F:ENU 10 mg/kg給藥組;G:ENU 40 mg/kg給藥組。圖2 ENU和CP對大鼠外周血RBCCD59-發生率的影響結果Note.A: FSC-A/SSC-A chart of the blank group. B: PE-A/SSC-A chart of the blank group. C:FITC-A/SSC-A chart of the blank group. D: Control group. E: CP 40 mg/kg group. F: ENU 10 mg/kg group. G: ENU 40 mg/kg group.Fig.2 Effect of ENU and CP on the loss rate of RBCCD59- at different time points
試驗結果顯示,CP 40 mg/kg給藥組給藥后第28天出現陽性結果,至給藥后第56天仍有顯著性差異,檢出陽性結果的時間較ENU時間延后,且引起大鼠體重的下降較為明顯,不推薦作為該實驗的陽性致突變物。ENU 40 mg/kg給藥組和10 mg/kg給藥組分別于給藥后第7、42天出現穩定的陽性結果,且ENU40 mg/kg劑量較10 mg/kg劑量引起外周血RBCCD59-發生率高,但對大鼠體重沒有影響。可以得出,相同劑量下,ENU引起大鼠外周血RBCCD59-發生率升高效果優于CP,且40 mg/kg劑量優于10 mg/kg劑量,檢驗周期以28 d為宜。
ENU和CP作為常用烷化劑類致突變誘變劑,可直接與DNA發生交叉聯結,干擾DNA和RNA功能,進而導致基因突變。ENU引起外周血紅細胞表面蛋白CD59缺失率高于CP,猜想可能是ENU和CP對造血干細胞和有限自我更新能力的定向細胞的影響程度不同[9]。ENU是常用的有效的致突變劑,大量的文獻報道其可引起Pig-a基因突變發生率的增加[2,7,9-10],我們的試驗結果也驗證了這一結果。CP作為常用的遺傳毒性試驗陽性物,Kimoto等[8]研究發現,連續10 d給予大鼠5 mg/kg劑量的CP,外周血RBCCD59-未見統計學差異,而Walker等[11]研究發現給予大鼠20 mg/kg的CP 8周后,外周血RBCCD59-是對照組的2~3倍,和我們的試驗結果保持一致。但總的來說,CP引起外周血RBCCD59-效果并不明顯,至少不會引起X染色體上Pig-a或者Hprt基因的明顯突變。
但本試驗不足之處在于,未能從多方面全面評價陽性致突變物引起的大鼠外周血Pig-a基因突變,后期試驗可以增加對網織紅細胞表面CD59缺失率,網織紅細胞微核率等相關指標的研究[12],采用多指標聯合評價該方法靈敏度。
在本試驗條件下,綜合大鼠體重和外周血RBCCD59-發生率兩個指標,我們得出ENU 40 mg/kg劑量引起大鼠外周血Pig-a基因突變的效果更優,采用流式細胞術方法,能夠利用小樣本量相對迅速地得到較為精確的結果,具有連續、動態監測等優點,該方法可以考慮應用到常規毒性研究中,用于化學物、化妝品等的急性、慢性暴露引起的遺傳毒性篩查。
[1] Bhalli JA, Shaddock JG, Pearce MG, et al. Sensitivity of the Pig-a assay for detecting gene mutation in rats exposed acutely to strong clastogens [J]. Mutagenesis, 2013, 28(4): 447-455.
[2] Dobo KL, Fiedler RD, Gunther WC, et al. Defining EMS and ENU dose-response relationships using the Pig-a mutation assay in rats [J]. Mutat Res, 2011, 725(1-2): 13-21.
[3] Kenyon MO, Coffing SL, Ackerman JI, et al. Compensatory erythropoiesis has no impact on the outcome of the in vivo Pig-a mutation assay in rats following treatment with the haemolytic agent 2-butoxyethanol [J]. Mutagenesis, 2015, 30(3): 325-334.
[4] 鄧媛媛, 郭雋, 王雪, 等.Pig-a基因突變檢測方法在藥物遺傳毒性評價中的應用及研究進展 [J]. 中國新藥雜志, 2012, 21(24): 2895-2898.
[5] 鄧媛元. 體內Pig-a基因突變檢測方法研究 [D]. 中國食品藥品檢定研究院, 2012.
[6] Dertinger SD, Phonethepswath S, Avlasevich SL, et al. Efficient monitoring of in vivo Pig-a gene mutation and chromosomal damage: summary of 7 published studies and results from 11 new reference compounds [J]. Toxicol Sci, 2012, 130(2): 328-348.
[7] Dertinger SD, Phonethepswath S, Franklin D, et al. Integration of mutation and chromosomal damage endpoints into 28-day repeat dose toxicology studies [J]. Toxicol Sci, 2010, 115(2): 401-411.
[8] Kimoto T, Chikura S, Suzuki-Okada K, et al. Effective use of the Pig-a gene mutation assay for mutagenicity screening: measuring CD59-deficient red blood cells in rats treated with genotoxic chemicals [J]. J Toxicol Sci, 2012, 37(5): 943-955.
[9] Phonethepswath S, Franklin D, Torous DK, et al. Pig-a mutation: kinetics in rat erythrocytes following exposure to five prototypical mutagens [J]. Toxicol Sci, 2010, 114(1): 59-70.
[10] Cammerer Z, Bhalli JA, Cao X, et al. Report on stage Ⅲ Pig-a mutation assays using N-ethyl-N-nitrosourea-comparison with other in vivo gentoxicity endpoint [J]. Environ Mol Mutagen, 2011, 52 (9): 721-730.
[11] Walker DM, Seilkop SK, Scott BR, et al. Hprt mutant frequencies in splenic T-cells of male F344 rats exposed by inhalation to propylene [J]. Environ Mol Mutagen, 2004, 43 (4): 265-272.
[12] Stankowski LF Jr, Roberts DJ, Chen H, et al. Integration of Pig-a, micronucleus, chromosome aberration, and comet assay endpoints in a 28-day rodent toxicity study with 4-nitroquinoline-1-oxide [J]. Environ Mol Mutagen, 2011, 52(9): 738-747.

