酸棗仁湯對PCPA失眠大鼠大腦皮質代謝型谷氨酸受體和受體后cAMP、PKA的干預作用?
王 慧,藏印竹,武 靜,陳天琪
(貴陽中醫學院基礎醫學院,貴陽 550002)
谷氨酸(Glu)是中樞神經系統內廣泛存在的興奮性遞質,谷氨酸作用的受體有兩類,一類是促離子型谷氨酸受體(包括NMDA受體、AMPA受體及Kainic acid受體),另一類是促代謝型谷氨酸受體(mGluRs),研究表明,mGluRs與睡眠-覺醒周期有非常重要的關系[1-4]。5-羥色胺(5-HT)是一個經典的與睡眠和覺醒密切相關的神經遞質,它與腦內其他神經遞質、受體有著密切的功能聯系,5-HT和Glu系統都能調節大腦皮質的興奮性,但兩者是否有相互作用目前還不清楚。PCPA是5-HT合成酶-色氨酸羥化酶的抑制劑,能夠阻斷腦內5-HT 的合成,減少腦內5-HT的含量,從而使動物出現嚴重失眠[5]。本研究通過建立PCPA失眠模型大鼠,同時用酸棗仁湯進行干預,采用Real-time PCR法檢測大腦皮質3組不同mGluR受體活動的變化及受體后cAMP/PKA信號通路活動變化情況,探索PCPA失眠機制中5-HT與Glu遞質系統的關系,并從不同層次和水平揭示酸棗仁湯的作用機理。
1 材料與方法
1.1 材料
1.1.1 實驗動物 健康成年清潔級SD雄性大鼠42只,體質量200~220 g,由重慶騰鑫生物技術有限公司提供(許可證號SCXK(渝)2007-0008)。置于安靜,溫度保持恒定(22±2) ℃,避免強光的環境中飼養7 d。
1.1.2 藥物、主要試劑與器材 PCPA(DL-4-Chlorophenylalanine)(Sigma),5-HTP(Sigma),酸棗仁、知母、茯苓、川芎、甘草均購自貴陽中醫學院第一附屬醫院中藥房,經貴陽中醫學院藥學院汪毅教授鑒定為正品。Trizol RNA提取試劑盒(Aidlab),M-MLV反轉錄酶(GeneCopoeia),RNase抑制劑(TransGen),50×ROX Reference Dye(VAZVME),All-in-one tm qPCR Mix(VAZVME),Premix Ex Taq(TAKARA),DL2000 DNA Marker(TAKARA)。實時熒光定量PCR儀(illumina eco),熒光定量PCR管(illumina),分光光度計(上海舜宇恒科學儀器有限公司),PCR儀(東勝創新生物科技有限公司),紫外分析儀(北京君意東方電泳設備有限公司)。
1.2 方法
1.2.1 藥物制備 酸棗仁湯(SZRD)組成:酸棗仁18 g,知母10 g,茯苓10 g,川芎5 g,甘草3 g,稱取以上5味藥材386 g,加8倍量水浸泡1 h后煎煮,沸后30 min濾過,藥渣加6倍水煎煮,沸后20 min濾過,合并濾液濃縮成150%濃度的水提物,分裝滅菌,4 ℃冰箱儲存備用。PCPA用生理鹽水配制成0.35 g/L的溶液,5-HTP用生理鹽水配制成2.5 mg/mL的溶液,4 ℃冰箱儲存備用。
1.2.2 模型復制 根據本實驗室前期實驗結果(見參考文獻15),按350 mg/kg體質量以10 ml/kg體積腹腔注射PCPA,于每日上午8∶00~9∶00進行,每天1次,持續3 d,每日連續8 h(10∶00 am. 至 6∶00 pm.)觀察實驗動物的活動度,動物在第一次注射后30~32 h出現晝夜節律消失,白天也活動不停、躁動不安,表明模型復制成功。
1.2.3 動物分組與給藥方法 實驗動物按隨機數字表法分為空白對照組、模型組、SZRD大劑量組、SZRD中劑量組、SZRD小劑量組、SZRD對照組、5-HTP組(5-HTP為5-HT合成的前體物質)7組各6只。空白對照組第1、2、3天腹腔注射生理鹽水(10 ml/kg),從第1天下午2∶30~3∶30 pm(以下同)開始灌胃生理鹽水(10 ml/kg),每天1次,連續7 d;模型組第1、2、3天腹腔注射PCPA(350 mg/kg),從第1天下午開始灌胃等體積生理鹽水,每天1次,連續7 d;酸棗仁湯大、中、小劑量組第1、2、3天腹腔注射PCPA,從第1天下午開始,SZRD 大、中、小劑量組分別給予15 g/(kg·d)、7.5 g/(kg·d)、3.75 g/(kg·d)的酸棗仁湯灌胃,給藥體積10 ml/kg,連續7 d;SZRD對照組第1、2、3天腹腔注射等體積生理鹽水,從第1天下午開始按7.5 g/(kg·d)的酸棗仁湯灌胃,連續7 d;5-HTP組第1、2、3天腹腔注射5-HTP(25 mg/kg),從第1天下午開始灌胃等體積生理鹽水,每天1次,連續7 d。
1.2.4 取材方法 各組末次給藥后,于次日上午8∶00給予過量戊巴比妥鈉麻醉處死大鼠,冰上快速取出大腦皮質組織,放入做好標記的EP管中,置入液氮中迅速冷凍后轉入-80 ℃冰箱中保存備用。
1.2.5 實時熒光定量PCR檢測mRNA 表1顯示, 取-80 ℃冰箱中保存的新鮮冰凍組織50 mg,Trizol法提取RNA,紫外分光光度計測定OD值以計算RNA的純度和濃度。根據吸光光度值按下列公式計算樣品RNA的濃度:總RNA濃度(μg/μl)=OD260×40×200×10-3。將RNA加入逆轉錄反應體系(按試劑盒說明),逆轉錄成cDNA。引物為北京擎科生物公司合成。

表1 引物序列表
1.2.6 半定量RT-PCR檢測 反應體系為內參F (10 μmol/L)0.5 μL,內參R (10 μmol/L)0.5 μL,dNTP (2.5 mmol/L)2 μL,Ex Taq0.25 μL,10×Ex Taq E buffer2.5 μL,cDNA 1μL,ddH2O加至 25 μL。反應條件94 ℃ 4 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 25 s,30cycles;72 ℃ 4 min,4 ℃ 4 min。PCR 產物電泳分析,瓊脂糖凝膠電泳顯示,擴增目的基因片段大小與設計的目的基因片段大小一致。
1.2.7 實時熒光定量PCR檢測 反應體系為cDNA(10倍稀釋)4 μL,Forward Primer (100 μmol/L)0.4 μL,Reverse Primer (100 μmol/L)0.4 μL,SYBR Green/Flourescein qPCR Master Mix(2×)10 μL,純水5.2 μL。反應條件:50℃ 2 min, 95℃ 10 min,95℃ 30 s,60℃ 30 s,40個循環,最終數據以2-△△Ct進行分析。
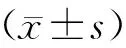
2 結果
2.1 大鼠一般活動情況
在適應性喂養期間,所有大鼠晝夜節律正常,活動良好,進食飲水正常。大鼠在第1次注射PCPA后30~32 h出現晝夜節律消失,白天也活動不停、躁動不安,與空白對照組比較有明顯不同,表明模型復制成功。酸棗仁湯治療組與模型組比較,大鼠白天活動度減少,晝夜節律有明顯恢復。5-HTP組和酸棗仁湯對照組大鼠的白天活動度和睡眠情況與空白對照組比較無明顯改變。
2.2 PCPA對大腦皮質mGlu1、mGlu2及mGlu7受體基因mRNA及受體后信號PKA、cAMPmRNA表達的影響及酸棗仁湯的干預作用
表2顯示,與空白對照組比較,PCPA模型組mGlu1、mGlu2及mGlu7受體mRNA表達量明顯增加,差異有統計學意義(P<0.001);PCPA模型組PKA及cAMP mRNA表達量明顯下降,差異有統計學意義(P<0.001)。
表2顯示,與模型組比較,酸棗仁湯大劑量組和中劑量組的mGlu1、mGlu2及mGlu7受體mRNA表達量下降,差異有統計學意義,其中大劑量組作用較強;而酸棗仁湯小劑量組上述mGlu受體的mRNA表達量與模型組比較差異無統計學意義,提示酸棗仁湯對大腦皮質mGlu1、mGlu2及mGlu7受體mRNA表達量改變呈現一定劑量的依賴性;酸棗仁湯大劑量組的PKA及cAMP基因mRNA表達量上升,差異有統計學意義(P<0.001,P<0.05);酸棗仁湯中劑量組PKAmRNA表達量增加,差異有統計學意義(P<0.05);小劑量組PKAmRNA的表達差異無統計學意義,而酸棗仁湯中劑量組與小劑量組cAMP mRNA表達量變化差異無統計學意義。
酸棗仁湯對照組的mGlu1、mGlu2及mGlu7受體mRNA、受體后的PKAmRNA、cAMPmRNA表達量與空白對照組比較差異無統計學意義。5-HTP組與空白對照組比較,皮質的mGlu1、mGlu2mRNA表達顯著增加(P<0.05),但mGlu7受體mRNA表達量變化無顯著性變化;PKAmRNA和cAMP mRNA的表達量下降,差異有統計學意義(P<0.01)。

表2 各組大鼠大腦皮質mGluR1、mGluR2及mGluR7受體及受體后cAMP及PKAmRNA的表達量
注:與空白對照組比較:△P<0.05,△△P<0.01,△△△P<0.001; 與模型組比較:※P<0.05,※※P<0.01,※※※P<0.001
3 討論
PCPA失眠模型是研究失眠機制及失眠藥物研發的常用實驗動物模型。實驗證實,腹腔注射PCPA能導致大鼠大腦皮質5-HT濃度下降約80%[5]。PCPA大鼠失眠模型復制過程簡便,可重復性強,是目前國內外較為公認的失眠模型。本實驗研究大鼠腹腔注射PCPA 后,白晝睡眠的晝夜節律消失,白天活動不停、躁動不安,顯示失眠大鼠造模成功。實驗發現,PCPA能導致皮質組織mGluR1、mGluR2及mGluR7mRNA表達量明顯上升,酸棗仁湯能減少PCPA所致失眠動物的mGluR1、mGluR2及mGluR7mRNA表達量,呈現出一定的劑量依賴性,同時PCPA能引起受體后PKA mRNA和cAMP mRNA表達量明顯下降。酸棗仁湯可使PCPA所致失眠動物大腦皮質PKA mRNA和cAMP mRNA表達量上升,也表現出一定的劑量依賴性。為檢測酸棗仁湯本身是否能引起皮質代謝型谷氨酸受體及受體后信號活動變化,本實驗設立了酸棗仁湯對照組。結果發現,酸棗仁湯對正常大鼠mGluR1、mGluR2及mGluR7mRNA表達量及受體后PKA mRNA和cAMP mRNA表達量無顯著影響。
Glu是腦內的興奮性遞質,與睡眠-覺醒的關系密切。谷氨酸作用的受體有促離子型受體和促代謝型受體兩大類,腦內的促離子型谷氨酸受體主要是調節快速的興奮性突觸傳遞,而代謝型谷氨酸受體(mGluR)主要是發揮調節作用,參與多種中樞神經系統疾病過程。mGluRs 屬于G蛋白偶聯的谷氨酸受體,現已克隆出8種亞型,即mGluR1-8。根據其序列相似性及細胞內信號傳導機制又可分為3組,第1組由mGluR1、5組成,可通過G蛋白的介導作用直接與離子通道偶聯,抑制K+、Ca2+開放,使K+外流減少,從而使細胞緩慢去極化,增加細胞的興奮性。第2組和第3組分別由mGluR2、3和mGluR4、6、7、8組成,主要通過抑制性G蛋白(Gi)介導,抑制腺苷酸環化酶(AC)活性,降低細胞內cAMP含量發揮生物效應[6]。
cAMP是經典的第二信使,在信號傳導中,cAMP上游信號傳導分子主要包括G蛋白、G蛋白偶聯受體和腺甘酸環化酶(AC)。其中G蛋白包括興奮性G蛋白(Gs)和抑制性G蛋白(Gi)。而cAMP下游信號傳導分子主要是蛋白激酶A(PKA)和蛋白磷酸酶。通常細胞內cAMP水平升高,可以促進許多基因的表達,這些基因的調控序列中都含有一個由8肽核苷酸組成的順式反應元件,即環磷酸腺苷反應元件結合蛋白(cAMP response element-binding protein,CREB)。CREB位于細胞核內,當配體與受體結合,激活腺苷酸環化酶(AC),導致cAMP依存性蛋白激酶(PKA)的激活,PKA的4個亞基分離,其中催化亞基攜帶高能量進入細胞核,使核內基因調節蛋白CREB磷酸化,生成CREB-1。CREB-1與DNA分子的cAMP反應元件(CRE)結合,激活即刻反應基因(IEG),從而啟動新的蛋白(調節因子、受體、離子通道等)合成。因此,通過AC-cAMP-PKA信號通路的激活,神經通路發生結構上的精細修飾,使神經元之間的信息傳遞功能發生變化。
本研究選取3種代謝型谷氨酸受體作為研究對象,即第1組的mGluR1、第2組的mGluR2和第3組的mGluR7。當PCPA造成腦內5-HT合成量下降后,這3種受體基因的mRNA表達量增加,受體后cAMP mRNA和PKA mRNA表達量明顯下降。腦內不同部位谷氨酸受體具有不同的作用,第1組mGluR的激活通常能減少腦內不同部位的谷氨酸遞質的釋放[7]。研究發現,mGlu1能監測細胞外谷氨酸遞質的濃度,通過負反饋調節谷氨酸的釋放,從而保持細胞外谷氨酸濃度的穩定[8]。mGlu2受體能增強包括皮質在內的幾個神經元群體NMDA受體的功能,不僅如此,mGlu2受體還能調節丘腦-皮層神經環路的多種功能[9]。mGlu7廣泛分布在興奮性和抑制性突觸前,能調節谷氨酸和GABA遞質的釋放[10],并在睡眠調節中起重要作用[11]。最新的研究還表明,mGlu7還參與了學習與記憶的功能[12]。由于代謝型谷氨酸受體在中樞神經系統中的重要作用,極有可能成為藥物作用的靶點[13]。有研究表明,PCPA能導致丘腦Glu遞質含量增加[14]。本實驗室前期的實驗發現,PCPA失眠大鼠腦內的神經膠質細胞被激活[15],而神經膠質細胞與腦內的Glu具有密切的功能聯系,實驗證實膠質細胞可以釋放Glu[16],因此PCPA所致腦內5-HT合成障礙可能導致Glu遞質釋放異常增加,引起mGlu受體活動變化,抑制受體后信號通路cAMP和PKA基因的表達,并通過這種途徑調節Glu的釋放。酸棗仁湯可作用于PCPA失眠大鼠大腦皮質mGlu1、mGlu2和mGlu7受體,并影響受體后cAMP/PKA信號通路活動,這可能是酸棗仁湯臨床療效作用機制的環節之一。5-HTP為5-HT合成的前體物質。本實驗發現,5-HTP能引起mGlu1和mGlu2受體活動發生變化,導致受體后cAMP/PKA信號通路活動改變,但對mGlu7受體活動沒有顯著影響,提示其作用可能與mGlu7受體活動關系不大。神經遞質在腦內的轉化及作用機制復雜,PCPA和5-HTP對代謝型谷氨酸受體及受體后信號基因表達的作用并沒有顯示完全相反的效應。且最近研究表明,PCPA所致失眠大鼠可出現血清中內分泌激素水平的異常變化[17-19],如促腎上腺皮質激素含量的下降,褪黑素、甲狀腺素水平的增加等,這些激素都與大腦皮質興奮性活動密切相關。PCPA所致腦內的5-HT含量下降與這些激素分泌的調節具有關聯性,但腦內5-HT的變化是如何與上述激素水平的調節系統相互作用,這些激素分泌的調節是否與腦內谷氨酸受體的活動有關?其具體機制值得進一步的研究。
綜上所述,腦內5-HT合成障礙能導致大腦皮質mGlu1、2、7受體mRNA及受體后信號分子cAMP和PKA mRNA表達變化,酸棗仁湯對上述變化具有明顯的干預作用。本研究為新型失眠藥物的研發及酸棗仁湯的臨床運用提供了實驗依據。
[1] KOHLMEIER KA, CHRISTENSEN MH, KRISTENSEN MP,et al. Pharmacological evidence of functional inhibitory metabotrophic glutamate receptors on mouse arousal-related cholinergic laterodorsal tegmental neurons[J]. Neuropharmacology,2013, 66:99-113.[2] AHNAOU A, DAUTZENBERG FM, GEYS H, et al. Modulation of group II metabotropic glutamate receptor (mGlu2) elicits common changes in rat and mice sleep-wake architecture[J]. Eur J Pharmacol, 2009, 603(1-3):62-72.
[3] TRABANCO AA, CID JM, LAVREYSEN H, et al. Progress in the developement of positive allosteric modulators of the metabotropic glutamate receptor 2[J]. Curr Med Chem, 2011,18(1):47-68.
[4] TADAVARTY R, RAJPUT PS, WONG JM, et al. Sleep-deprivation induces changes in GABABand mGlu receptor expression and has consequences for synaptic long-term depression[J]. PLoS One, 2011,6(9):e24933.
[5] NIMGAONKAR VL, GOODWIN GM, DAVIES CL, et al. Down-regulation of beta-adrenoceptors in rat cortex by repeated administration of desipramine, electroconvulsive shock and clenbuterol requires 5-HT neurones but not 5-HT[J]. Neuropharmacology, 1985, 24(4):279-283.
[6] 李國彰.神經生理學[M]. 北京: 人民衛生出版社, 2007: 148-156.
[7] WHITE AM, KYLANPAA RA, CHRISTIE LA, et al. Presynaptic group I metabotropic glutamate receptors modulate synaptic transmission in the rat superior colliculus via 4-AP sensitive K(+) channels[J]. Br J Pharmacol,2003, 140:1421-1433.
[8] GOVINDAIAH G, WANG T, GILLETTE MU, et al. Activity-dependent regulation of retinogeniculate signaling by metabotropic glutamate receptors[J]. J Neurosci, 2012, 12(37):12820-12831.
[9] WALKER AG, CONN PJ.GroupI and group II metabotropic glutamate receptor allosteric modulators asnovel potential antipsychotics[J]. Curr Opin Pharmacol, 2015,20:40-45.
[10] X, XI ZX, MARKOU A.Metabotropic glutamate 7 (mGlu7) receptor: a target for medication developmentfor the treatment of cocaine dependence[J].Neuropharmacology,2013,66:12-23.
[11] CAVAS M, SCESA G, NAVARRO JF. Positive allosteric modulation of mGlu7 receptors by AMN082 affects sleep and wakefulness in the rat[J]. Pharmacol Biochem Behav, 2013,103(4):756-63.
[12] KLAR R, WALKER AG, GHOSE D, et al. Activation of metabotropic glutamate receptor 7 is required for induction of long-term potentiation at SC-CA1synapses in the hippocampus [J].J Neurosci, 2015,35(19):7600-7615.
[13] NICOLETTI F, BRUNO V, NGOMBA RT, et al. Metabotropic glutamate receptors as drug targets: what’s new? [J] Curr Opin Pharmacol, 2015, 20:89-94.
[14] 高家榮,季文博,姜輝,等. 酸棗仁-五味子藥對醇水雙提物對PCPA 致失眠大鼠氨基酸類神經遞質的影響[J]. 中藥材,2013, 36 (10):1635-1639.
[15] 王慧,羅坤,武靜. 酸棗仁湯對失眠大鼠中腦中縫背核神經膠質細胞的影響[J].中國實驗方劑學雜志, 2012,18(21): 235-239.
[16] HALASSA MM, HAYDON PG. Integrated Brain Circuits: Astrocytic Networks Modulate Neuronal Activity and Behavior[J]. Annu Rev Physiol, 2010, 72: 335-355.
[17] 顧思臻,竇丹波. 中醫中藥對 PCPA 失眠大鼠模型 HPA 軸相關單胺類神經遞質及激素影響的研究進展[J].上海中醫藥大學學報,2015, 29(1): 83-86.
[18] 肖愛嬌,王河寶,劉海云. 熱敏灸對失眠大鼠模型血清內分泌激素水平的影響[J]. 江西中醫學院學報, 2013, 25 (4):32-35.
[19] 劉臻,趙娜,謝晨,等. 電針對失眠大鼠睡眠-覺醒晝夜節律及褪黑素節律的影響[J]. 中華中醫藥雜志,2016, 31(9):3695-3699.

