益氣養陰清熱化瘀方對免疫性血小板減少癥小鼠Notch信號通路的影響?
謝東杰,王愛迪,王偉濤,張 樂,張 珊,劉寶山△
(1. 天津醫科大學總醫院,天津 300052; 2. 天津中醫藥大學第一附屬醫院,天津 300193)
免疫性血小板減少癥(immune thrombocytopenic purpura, ITP)是一種由免疫異常介導的以血小板減少、骨髓巨核細胞成熟障礙為特性的自身免疫性疾病[1]。血小板減少所致的凝血障礙使出血風險顯著增加,血小板極度減少時(<10×109/L)可出現多處黏膜及內臟出血,顱內出血可給患者帶來致命性的威脅。Notch信號通路通過影響巨核細胞的生成及免疫細胞的分化而直接參與ITP的發病進程[2-3]。益氣養陰清熱化瘀方是由犀角地黃湯、當歸補血湯、二至丸組合而成,長期臨床實踐證明該方在治療ITP時療效確切,但其發揮作用的藥理機制并未得以充分揭示[4]。本研究以Notch信號為靶點,旨在探索該方在治療ITP的可能機制。
1 材料
1.1 動物
BALB/c雌性小鼠60只,6~7周齡,購自北京華阜康生物科技股份有限公司(SCXK(京)2014-0004),適應性喂養1周。
1.2 主要藥物及試劑
益氣養陰清熱化瘀方組成:生黃芪50 g,當歸10 g,女貞子15 g,旱蓮草15 g,水牛角粉(先煎)30 g,生地黃25 g,白芍10 g,丹皮10 g。所有中藥均購自天津中醫藥大學第一附屬醫院中藥房并由藥劑科鑒定;醋酸潑尼松片:天津力生制藥;大鼠抗小鼠CD41單克隆抗體(MWReg30單抗):BD Biosciences 公司;RPMI1640培養基、PBS緩沖液:美國Gibco公司;柱式Trizd總RNA提取試劑盒:上海生工生物工程技術服務有限公司;Realtime PCR試劑盒:東洋紡生物科技有限公司;5%BSA 封閉液:上海碧云天生物技術公司;SDS-PAGE凝膠制備試劑盒、PVDF 膜、10×麗春紅染色液:北京索萊寶科技公司;Notch1-4、Jagged1、Jagged2單克隆抗體購自英國 Abcam 公司;BCA 蛋白濃度測定試劑盒:北京康為世紀生物科技公司;生物素標記羊抗兔 IgG、DAB 顯色試劑盒:武漢博士德生物公司。
1.3 主要儀器
CO2培養箱:美國THERMO公司;自動平衡離心機:北京醫用離心機廠;電泳儀PS3000:美國Hoefer Scientific Instruments,RealtimePCR儀:美國Stratagene;凝膠成像儀:Biorad;恒溫水浴箱HXS-H:哈爾濱東聯公司;蒸汽壓力滅菌器:山東新華安得醫療用品公司。
2 方法
2.1 藥物制備
將干燥的藥材粉碎并過40目篩,按劑量配比稱取各飲片后加入70%乙醇(10倍量)浸泡過夜,超聲提取1 h,濾過再次提取40 min,2次濾液合并最后濃縮成濃度2 g/ml的溶液。用蒸餾水將醋酸潑尼松片(5 mg/片)配制為濃度為1 mg/ml的溶液,將制備好的各組藥液均置4 ℃冰箱中備用。
2.2 ITP模型的建立
將60只小鼠按隨機數字表法分為正常組10只,ITP模型組50只。結合文獻[5]采用針對血小板表面膜糖蛋白GPIIb/IIIa的被動免疫法,將模型組小鼠腹腔每日注射含2 μg 大鼠抗小鼠CD41單克隆抗體(MWReg30單抗)的磷酸鹽緩沖液200 μL共21 d,造成持續的血小板減少癥,建立ITP小鼠模型,正常組則注射等量生理鹽水。
2.3 血液采集
造模前及造模后第1、3、5、7天,分別通過尾靜脈取20 μL 靜脈血測量血小板數量評估造模情況。藥物干預2周后,抽取外周血檢測血小板計數,評估藥物提升血小板效果。
2.4 給藥方法
第8天將ITP小鼠模型按隨機數字表法分為模型組、中藥(益氣養陰清熱化瘀方)低、中、高劑量組、西藥對照組(以醋酸潑尼松對照)各10只,并按照《實驗動物學》中人與動物體表面積換算公式計算所得給藥劑量進行藥物干預。中藥低劑量組25 g/kg,中劑量組50 g/kg,高劑量組100 g/kg,西藥對照組0.2 ml/只,正常組和ITP模型組給予生理鹽水0.2 ml/只,每日2次,灌服2周。
2.5 骨髓單個核細胞(BMMNC)分離及培養
治療結束后,采用頸椎脫臼法處死小鼠分離出雙側股骨,剪斷股骨兩端,用2 ml的血清反復沖洗骨髓腔,將收集到的骨髓細胞離心,上清液置于含有10%胎牛血清、100 U/ml青霉素和100 Pg/ml鏈霉素的RPMI1640完全培養基中,再分別加入T淋巴細胞活化劑PHA和不加PHA2組,充分混勻后在37 ℃、 5%CO2、飽和濕度下培養48 h,臺盼藍染色計數,細胞濃度調整為5.0×105/ml備用。
2.6 Real-time PCR檢測Notch信號分子基因的表達
表1顯示,按TRIzol說明提取BMMNS的總RNA,用轉錄試劑盒將200 ng RNA 按逆轉錄反應體系合成cDNA,并通過ABI 7900 qPCR 體系對cDNA定量;PCR 擴增體系20 μL,其中所測目的基因的引物序列;擴增條件為:預變性:95 ℃,2 min;變性:94 ℃,20 s;退火:65 ℃, 20 s;延伸:72 ℃ 30 s,共40個循環。以GAPDH 作為內參,基于Ct值來確定目的基因的相對表達量(基因的表達量RQ=2—△△Ct)。

表1 Notch信號分子引物序列
2.7 Western blot檢測Notch信號分子蛋白的表達
使用裂解液將BMMNS 裂解獲取總蛋白樣本,采用BCA法測定蛋白濃度。SDS-PAGE分離蛋白,電泳、轉膜,用5%BSA封閉液封閉1 h,加入一抗4 ℃反應過夜,TBST洗滌3次,加入二抗孵育1 h,TBST洗膜,ECL法顯影,使用Quantity one軟件處理,以GAPDH 為內參分析目的條帶的光密度值。
2.8 統計學方法
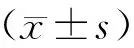
3 結果
3.1 ITP模型的建立
圖1顯示,正常組血小板水平波動無顯著性變化;與正常組比較,ITP模型組在注射CD41單克隆抗體(MWReg30單抗)1 d后便引起血小板顯著減少,3 d后下降趨勢逐漸平穩,第7天達到最低水平,符合ITP模型鼠的血小板特征。

圖1 ITP小鼠模型的建立
3.2 益氣養陰清熱化瘀方對ITP模型鼠血小板的影響
表2顯示,治療結束后外周血血小板計數顯示,與ITP模型組比較,中藥各劑量組血小板數值均有不同幅度的升高(P<0.05)),其中中藥中、高劑量組效果接近西藥對照組,組間比較差異無統計學意義(P>0.05)。
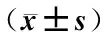
表2 治療結束后各組小鼠PLT計數比較
注:與正常組比較:△P<0.05;與模型組比較:☆P<0.05,☆☆P<0.01;與西藥對照組比較:*P<0.05

表3 各組小鼠Notch分子基因表達水平比較
注:與正常組比較:△△P<0.01;與模型組比較:☆☆P<0.01
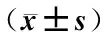
表4 各組小鼠Notch分子蛋白表達水平比較
注:與正常組比較:△P<0.05;與模型組比較:☆P<0.05
3.3 益氣養陰清熱化瘀方對Notch信號分子基因表達的影響
表3顯示,模型組Jagged1、Jagged2、Notch1、Notch2、Notch3、Notch4的基因表達與正常組比較均異常升高(P<0.01);與模型組比較,各治療組基因表達水平均有不同程度的降低(P<0.01),其中中藥中劑量組的降低趨勢與高、低劑量組比較更加明顯。
3.4 益氣養陰清熱化瘀方對Notch信號分子蛋白表達的影響
表4顯示,為進一步驗證Notch分子基因轉錄的改變最終導致翻譯水平的變化,Western blot用于檢測蛋白的表達水平。與Notch分子基因表達變化相一致,模型組Notch1-4和Jagged1 2蛋白水平與正常組比較異常增高(P<0.05);經藥物干預后,各治療組的蛋白表達水平與模型組比較均降低(P<0.05),其中中藥中劑量組與高、低劑量組比較降低程度較為顯著。
4 討論
作為一種異質性疾病,ITP從癥狀到治療反應都表現出較大的差異性[6]。目前治療可選擇的藥物也較單一,糖皮質激素作為ITP標準的一線治療方案,能快速提升血小板,減少出血傾向。然而一旦停藥復發率高,且長期服藥帶來的一系列并發癥可能超過其治療本身[1]。脾切除也要面臨終生的感染風險,甚至增加腫瘤的患病幾率[7];其他治療如利妥昔單抗、TPO-RA由于多種原因,在臨床使用中也存在較大的局限性。考慮到西藥治療面臨的多種問題,從中醫理論中探索新的治療方法則具有較大的優勢。
ITP屬于中醫學“紫癜”“血證”范疇,其病機可概括為“熱、虛、瘀”三端,是以“氣陰兩虛為本,熱毒瘀血為標”的虛實錯雜性疾病。本虛標實、虛實夾雜、瘀血貫穿于始終是本病的病理特點[8]。根據法隨證立、方從法出的治則,確定益氣養陰、清熱化瘀為其治療大法。本實驗以戴錫孟多年經驗效方為基礎,選用當歸補血湯、二至丸及犀角地黃湯組合為益氣養陰清熱化瘀方,方中以當歸補血湯合二至丸補氣養陰和血,以針對ITP發病之本虛,犀角地黃湯清熱涼血化瘀,治其血熱瘀滯之標實,三方合用標本兼顧,共奏益氣養陰、清熱化瘀之功,同時效《血證論》之補血、止血、凝血、消瘀的治血四大原則。本研究通過MWReg30單抗成功誘導出ITP小鼠模型,經益氣養陰清熱化瘀方治療后血小板水平持續升高,且中、高劑量與西藥比較差異無統計學意義,證明該方有確切的升血小板作用。
總的來說,血小板產生減少和破壞增加是ITP血小板持續減少的兩大原因。Notch信號在分化上高度保守,廣泛存在于機體的多種細胞中,由Notch受體、Notch配體、CSL蛋白和細胞內效應分子組成。在哺乳動物中,Notch受體包含Notch1-Notch4 4種類型;Notch配體分屬2個家族,即Delta like 家族(Delta-like1,3,4)和Jagged家族(Jagged1-2)。Notch信號通過經典和非經典途徑對細胞各個階段、多種功能(細胞增殖、分化、激活、凋亡)進行調控[9]。在造血系統中,Notch信號能夠在造血干/祖細胞水平影響巨核細胞分化,從而與血小板的生成直接相關[2];另一方面在免疫系統中,Notch信號通過與其他通路間的“cross-talk”,可對多種免疫細胞的分化與功能起重要的調節作用,特別是能控制活化CD4+T細胞的效應表型,從而調控著機體的免疫狀態[3]。病理狀態下,Notch 信號的異常活化與多種自身免疫性疾病及血液疾病密切相關[10-11]。先前的研究已經顯示出ITP患者Notch分子呈現出異常的表達[12]。本研究顯示,ITP模型組Notch分子-受體Notch1-4和配體Jagged1-2 的基因與蛋白表達水平均異常升高。可以看出,Notch信號通路參與ITP的發病進程,上調的Notch信號可能通過直接影響巨核細胞的成熟或造成機體免疫失衡而使血小板生成減少、破壞增加,最終導致血小板減少癥。本試驗顯示,益氣養陰清熱化瘀方連續治療2周后可使異常增高的Notch信號分子顯著下降。另外,Notch分子下降的幅度與增加的血小板計數呈顯著相關性,表明益氣養陰清熱化瘀方可能通過影響Notch信號的表達而起到升血小板作用。
綜上所述,Notch信號通路參與ITP的病理進程,益氣養陰清熱化瘀方能夠影響ITP小鼠Notch受體、配體的表達,而抑制Notch信號的過度激活,進一步調節巨核細胞的成熟及多種免疫細胞的分化和功能,最終影響血小板的生成與破壞,對ITP 產生積極的治療作用。
[1] PROVAN D, STASI R, NEWLAND A C, et al. International consensus report on the investigation and management of primary immune thrombocytopenia[J]. Blood, 2010, 115(2): 168-186.
[2] MERCHER T, COMEJO M G, SEARS C, et al. Notch signaling specifies megakaryocyte development from hematopoietic stem cells[J]. Cell Stem Cell, 2008, 3(3): 314-326.
[3] RADTKE F, MACDONALD H R, TACCHINI-COTTIER F. Regulation of innate and adaptive immunity by Notch[J]. Nature Reviews Immunology, 2013, 13(6): 427-437.
[4] 田翠時,宋廣杰,戴錫孟. 中西藥對照治療特發性血小板減少性紫癜28例[J]. 陜西中醫, 2006(9): 1078-1079.
[5] CROW A R, SONG S, SEMPLE J W, et al. A role for IL-1 receptor antagonist or other cytokines in the acute therapeutic effects of IVIg?[J]. Blood, 2007, 109(1): 155-158.
[6] CINES D B, BUSSEL J B, LIEBMAN H A,et al. The ITP syndrome: pathogenic and clinical diversity[J]. Blood, 2009, 113(26): 6511-6521.
[7] RODEGHIERO F, RUGGERI M. Short- and long-term risks of splenectomy for benign haematological disorders: should we revisit the indications?[J]. British Journal of Haematology, 2012, 158(1): 16-29.
[8] 楊小艷,劉寶山. 中醫對原發性血小板減少性紫癜的病機認識索微[J]. 遼寧中醫雜志, 2010(S1): 326-327.
[9] KOPAN R, ILAGAN M X G. The Canonical Notch Signaling Pathway: Unfolding the Activation Mechanism[J]. Cell, 2009, 137(2): 216-233.
[10] TEACHEY D T, SEIF A E, BROWN V I, et al. Targeting Notch signaling in autoimmune and lymphoproliferative disease[J]. Blood, 2008, 111(2): 705-714.
[11] ASTER J C, BLACKLOW S C, PEAR W S. Notch signalling in T-cell lymphoblastic leukaemia/lymphoma and other haematological malignancies[J]. The Journal of Pathology, 2011, 223(2): 263-274.
[12] MA D, DAI J, ZHU X, et al. Aberrant expression of Notch signaling molecules in patients with immune thrombocytopenic purpura[J]. Annals of Hematology, 2010, 89(2): 155-161.

