特應性皮炎不同中醫證型外周血T細胞亞群及其相關細胞因子表達的研究
趙一丁,楊 潔,閆小寧,郎 娜
(1. 陜西省中醫醫院,西安 710003; 2. 陜西省中醫藥研究院,西安 710003; 3. 中國中醫科學院西苑醫院,北京 100091)
特應性皮炎(atopic dermatitis, AD)是一種慢性、復發性、瘙癢性、炎癥性皮膚病,初發于嬰兒期,呈慢性經過,常伴有哮喘或過敏性鼻炎,部分患者病情可以遷延至成年,嚴重影響患者及其家庭成員的生活質量。目前AD的病因及發病機制尚未完全明確,一般認為是在一定遺傳背景和(或)環境因素作用下,造成機體皮膚屏障功能障礙或直接引起機體的免疫反應失調,導致變應性或非變應性炎癥反應。T細胞亞群及其相關細胞因子在AD炎性反應的發生發展過程中起重要作用。本研究擬通過探討AD患者外周血T細胞亞群相關細胞因子水平與中醫證型之間的關系,以期為AD的中醫辨證提供微觀科學依據。
1 資料與方法
1.1 臨床資料
1.1.1 診斷標準 西醫診斷符合Hanifin與Rajka診斷標準[1],中醫證型診斷符合國家中醫藥管理局四彎風辨證分型標準[2],將患者分為風濕蘊膚證和血虛風燥證2型。其中風濕蘊膚證主癥:皮膚潮紅;瘙癢劇烈;糜爛滲出;丘疹水皰;次癥:神倦便溏;遇風濕加重;舌淡苔薄膩;脈弦滑;血虛風燥證主癥:皮膚干燥;肥厚或苔蘚樣變;瘙癢抓痕血痂;病程久,反復發作;次癥:食后腹脹,便秘或溏;皮膚色暗或色素沉著;舌質淡胖;苔白脈滑;當患者符合以上證候中主癥3項或3項以上,同時具備次癥任何2項或2項以上即可診斷為該證型。
1.1.2 納入和排除標準 2歲≤年齡≤60歲,性別不限,符合西醫診斷標準及中醫辨證分型標準,無嚴重心、腦、肝、腎等系統性疾病,排除妊娠及哺乳期婦女,近2周內未接受系統性糖皮質激素、免疫抑制劑治療。
1.1.3 病例來源 表1顯示,選取2015年5月至2017年4月陜西省中醫醫院皮膚科的54例就診病理患者,其中男性30例,女性24例,年齡4~35歲,平均年齡(19.40±8.41)歲;病程4~17年,平均病程(10.01±3.69)年;辨證屬風濕蘊膚證者20例,血虛風燥證者34例;招募健康志愿者20例對照組,其中男性11例,女性9例,年齡13~32歲,平均年齡(20.40±4.54)歲,2組受試者性別、年齡比較差異無統計學意義(P>0.05)。

表1 一般資料特征
1.2 方法
1.2.1 主要試劑和儀器 CD4/CD8/CD3檢測試劑盒、Treg檢測試劑盒,美國Beckman-Coulter公司;人白介素-4(IL-4)酶聯免疫分析試劑盒、人白介素-12 (IL-12/P70)酶聯免疫分析試劑盒、人白介素-10(IL-10)酶聯免疫分析試劑盒,武漢華美生物工程有限公司;流式細胞儀,美國Beckman-Coulter公司,EPICS XL;自動板式酶標儀,北京航宇浪琴醫療設備有限公司ZS-3;臺式離心機,濟南來寶醫療器械有限公司,TD-5 M;電熱恒溫培養箱,黃石市恒豐醫療器械有限公司SKP-02.600);超低溫冰箱,日本SANYO公司MDF-192等。
1.2.2 檢測方法 分別抽取納入患者及健康志愿者空腹外周靜脈血9 ml(肝素抗凝),分別注入3個試管中,每管3 ml。
第1管用于細胞因子IL-4、IL-12及IL-10的檢測,采用ELISA法檢測。待檢標本離心(1200 r/min,5 min)吸取上層血清注入EP管中;加樣:分別設空白孔、標準孔、待測樣品孔。空白孔加樣品稀釋液100 μL,余孔分別加標準品或待測樣品100 μL,將樣品加于酶標板孔底部,37 ℃反應120 min,棄去液體甩干,不用洗滌,每孔加生物素標記抗體工作液100 μL,37 ℃溫育60 min,棄去孔內液體甩干,洗板3次,每次浸泡1~2 min,200 μL/孔甩干。每孔加辣根過氧化物酶標記親和素工作液100 μL,37 ℃溫育60 min,棄去孔內液體甩干,洗板5次,每次浸泡1~2 min,200 μL /孔甩干,依序每孔加底物溶液90 μL,37 ℃避光顯色,依序每孔加終止溶液50 μL,終止反應,用酶聯儀在450 nm波長依序測量各孔的光密度。
第2管以肝素抗凝,用于CD3+、CD4+、CD8+的檢測,采用流式細胞儀。取1支流式管作為樣品測試管,將100 μL抗凝全血(EDTA)加入試管中,在管中加入10μLCD45-FITC/CD3-PC5/CD4-RD1/CD8-ECD抗體,渦旋混勻后室溫避光孵育15 min取出試管,每管加入500 μL紅細胞裂解液OptiLyse C,渦旋混勻室溫避光10 min,1200 r/min離心5 min,棄去上清液每管加入2 mlPBS,渦旋混勻1200 r/min離心5 min棄去上清液,每管加入500 μLPBS混勻,4 ℃避光1 h內上機檢驗。
第3管用于CD4+CD25highCD127lowTreg的檢測,采用流式細胞儀。取2支流式管,編號1(同型對照管)和2(樣品測試管)分別加入50 μL EDTA,在管1中加入10μLCD4-FITC、10μLIgG1-PC5、10μLIgG1-PE抗體,渦旋混勻后,室溫避光孵育20 min,在管2中加入10μLCD4-FITC、10μLCD25-PC5、5μLCD127-PE抗體,渦旋混勻后,室溫避光孵育15 min取出試管,每管加入500 μL紅細胞裂解液OptiLyse C,渦旋混勻室溫避光10 min,1200rpm離心5 min,棄去上清液,每管加入2mlPBS渦旋混勻,1200rpm離心5 min,棄去上清液,每管加入500μLPBS混勻,4 ℃避光1 h內上機檢驗。
在淋巴細胞中以CD3設門,CD4設門,可在以CD3為橫坐標、CD4為縱坐標的二維散點圖上把淋巴細胞分為CD3+CD4+T細胞和CD3+CD4-T細胞;以CD3設門,CD8設門,可在以CD3為橫坐標、CD8為縱坐標的二維散點圖上把淋巴細胞分為CD3+CD8+T細胞和CD3+CD8-T細胞,以CD3+CD4+T細胞和CD3+CD8+T細胞各占CD3+T細胞的比例作為CD4+T細胞和CD8+T細胞的表達水平;以CD4設門,可在以CD4為橫坐標、側向散射角(SSC)為縱坐標的二維散點圖上把淋巴細胞分為CD4+T淋巴細胞和CD4-T淋巴細胞。在CD4+T的淋巴細胞中,以CD25、CD127設門,將CD4+CD25+細胞群平均熒光強度10倍的亞型細胞群定義為CD4+CD25highT細胞,獲取設門內細胞團并保存數據,分析CD4+CD25highCD127low淋巴細胞比例,將CD4+CD25highCD127low淋巴細胞作為Treg的水平。
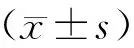
2 結果
2.1 特應性皮炎不同證型外周血T淋巴細胞亞群表達比較
表2圖1~8顯示,風濕蘊膚證及血虛風燥證AD患者外周血CD4+T細胞水平均高于對照組(P<0.05),但兩證型比較差異無統計學意義(P>0.05);血虛風燥證AD患者外周血CD8+T細胞水平高于風濕蘊膚證AD患者及對照組(P<0.05),風濕蘊膚證AD患者外周血CD8+T細胞水平與對照組比較差異無統計學意義(P>0.05);風濕蘊膚證及血虛風燥證AD患者外周血CD4+CD25highCD127lowTreg細胞水平均明顯低于對照組(P<0.01),且風濕蘊膚證AD患者外周血CD4+CD25highCD127lowTreg細胞水平低于血虛風燥證(P<0.05);各組AD患者外周血CD3+T細胞水平及CD4+/CD8+比較差異無統計學意義(P>0.05)。

表2 各組外周血T淋巴細胞亞群占總淋巴細胞比值比較
注:與對照組比較:※P<0.05,※※P<0.01;與風濕蘊膚證組比較:#P<0.05,##P<0.01

圖1 風濕蘊膚證組CD3+流式直方圖

圖2 血虛風燥證組CD3+流式直方圖

圖3 風濕蘊膚證組CD4+流式散點圖注:C2為CD4+T淋巴細胞

圖4 血虛風燥證組CD4+流式散點圖注:C2為CD4+T淋巴細胞

圖5 風濕蘊膚證組CD8+流式散點圖注:D2為CD8+T淋巴細胞

圖6 血虛風燥證組CD8+流式散點圖注:D2為CD8+T淋巴細胞

圖7 風濕蘊膚證組Treg流式散點圖 注:D門內為CD4+CD25highCD127lowTreg

圖8 血虛風燥證組Treg流式散點圖 注:D門內為CD4+CD25highCD127lowTreg
2.2 特應性皮炎不同證型外周血IL-4、IL-12、IL-17、IL-10水平比較
表2顯示,風濕蘊膚證及血虛風燥證AD患者外周血IL-4、IL-17水平均高于對照組(P<0.05),且風濕蘊膚證AD患者外周血IL-4、IL-17水平均高于血虛風燥證(P<0.05);風濕蘊膚證及血虛風燥證AD患者外周血IL-12水平明顯低于對照組(P<0.01),并且風濕蘊膚證AD患者外周血IL-12水平明顯低于血虛風燥證(P<0.01),血虛風燥證AD患者外周血IL-12水平與對照組比較差異無統計學意義(P>0.05),血虛風燥證AD患者外周血IL-10水平高于風濕蘊膚證患者及對照組(P<0.05),風濕蘊膚證AD患者外周血IL-10水平與對照組比較差異無統計學意義(P>0.05)。

表2 各組血清IL-4、IL-12、IL-10水平比較
注:與對照組比較:※P<0.05,※※P<0.01;與風濕蘊膚證組比較:#P<0.05,##P<0.01
3 討論
中醫學并無特應性皮炎的病名記載,根據其發病部位、臨床特征及形態,常包括在“浸淫瘡”“四彎風”“奶癬”“胎瘡”“血風瘡”等疾病中[3]。中醫學認為,本病由先天稟賦不足、胎毒遺熱、熱郁肌膚而致;或由后天飲食不節、喂養失當導致脾失健運,復感風濕熱毒,邪毒蘊結肌膚而致;反復發作、遷延日久或后天情志內傷,可致脾虛氣血生化乏源,陰血、元氣耗傷則血虛風燥、肌膚失養。1994年國家中醫藥管理局制定的《中華人民共和國醫藥行業標準·中醫病證診斷療效標準》將本病分為風濕蘊膚證和血虛風燥證兩型[2]。本研究按照此辨證分型標準,通過對2種證型AD患者外周血T淋巴細胞亞群及相關細胞因子的檢測,探討AD中醫辨證的微觀證據。
現代醫學認為,T淋巴細胞亞群、Th1/Th2及Th17/Treg細胞網絡失衡在AD的發病過程中有重要作用。有研究顯示,AD患者外周血CD4+和CD4+/CD8+水平增高,CD8+水平下降,導致體液免疫功能亢進,細胞免疫功能低下[4]。本研究結果顯示,AD患者外周血CD4+T細胞水平均高于對照組,血虛風燥證AD患者外周血CD8+T細胞水平高于風濕蘊膚型AD患者及對照組,說明AD患者體內T細胞的輔助與抑制功能存在失衡。AD急性期主要為Th2細胞活化引起免疫應答,產生IL-4、IL-5及IL-13等,表現為紅斑、丘疹、水皰甚至黃水浸淫、糜爛、結痂,可伴有煩躁不安、大便干結或黏膩、小便短黃、舌紅苔黃膩、脈滑數等,證屬風濕(熱)蘊膚,慢性期免疫反應則向Th1細胞占優勢的免疫應答轉變,IL-12及GM-CSF呈過表達[5],表現為皮膚肥厚、苔蘚化、干燥、瘙癢劇烈,伴有倦怠乏力、食少腹脹、舌質淡紅少津、苔少、脈沉弦等,證屬血虛風燥。有研究顯示,(風)濕熱蘊膚征象表現越明顯,IL-4、IL-17表達越高,而病久耗傷陰血、血虛風燥,逐漸成為慢性期表現,此時相對較高的IFN-γ表達增加[6],與本研究結果相符。
Treg細胞是新型CD4+T細胞亞群,主要通過細胞間接觸抑制和分泌抑制性細胞因子如TGF-β、IL-10而發揮免疫調節作用[7],它與Th17細胞平衡失調可引起AD皮損向急性期發展,Treg細胞可分為CD4+Treg細胞、CD8+Treg細胞、NKT Treg細胞和雙陰性Treg細胞,其中CD4+Treg細胞與特應性皮炎的發病密切相關,CD25是CD4+Treg細胞的分子標志物,但效應性T細胞也表達CD25,只有高表達CD25的CD4+Treg細胞才具有免疫調節作用,而CD127在CD4+Treg細胞表面特異性低表達,檢測時不用破壞細胞膜[8],因此本研究采用CD4+CD25highCD127low作為篩選Treg細胞的標準。研究結果顯示,AD患者外周血Treg細胞低于健康對照組,說明AD患者體內存在Treg細胞數減少導致免疫抑制效應的不足[9],且風濕蘊膚證患者外周血Treg水平低于血虛風燥證患者,IL-17水平高于血虛風燥證患者,可能說明慢性期平衡轉向Treg、Th1方向,IL-10呈高表達。在辨證論治過程可以從IL-4、IL-12、IL-17、IL-10水平的高低及CD4+、CD8+、Treg細胞的數量初步判斷患者的病情階段及中醫辨證分型,從而為遣方用藥提供依據。
[1] HANIFIN JM,RAJKA G.Diagnosic features of atopic dermatitis[J].Acta Derm Venereol (Stockh),1980,Suppl 92:44-47.
[2] 國家中醫藥管理局.中醫病證診斷療效標準[M].南京:南京大學出版社,1994:147.
[3] 劉熾,溫曉文,黃楚君,等.古代中醫對特應性皮炎疾病特征的認識鉤玄[J].新中醫, 2011,43(40):127-128.
[4] 曾迎紅,湯建萍,葉志純,等.特應性皮炎患兒外周血T細胞亞群與總IgE水平的相關性研究[J].皮膚病與性病, 2010,32(3):1-2.
[5] CHEN L, MARTINEZ O, OVERBERGH L, et al. Early up-regulation of Th2 cytokines and late surge of Th1cytokines in an atopic dermatitis model [J].Clin Exp Immunol, 2004, 138(3):375-387.
[6] 徐張杰, 覃永健, 吳志洪. 特應性皮炎患兒外周血淋巴細胞亞群及相關因子與中醫證候關聯研究[J]. 時珍國醫國藥,2015,26(11):2801-2804.
[7] RODRIGUES FM, COELHO NETO GT, MENEZES JG, et al. Expression of Foxp3, TGF-β and IL-10 in American cutaneous leishmaniasis lesions[J]. Arch Dermatol Res, 2014, 306(2):163-171.[8] LIU W, PUTNAM AL, XU-YU Z, et al. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+T reg cells[J]. J Exp Med, 2006, 203(7):1701-1711.
[9] 蔣有讓, 刁慶春, 史丙俊, 等. 特應性皮炎患者血清中Th17和Treg相關細胞因子的檢測[J].臨床皮膚科雜志, 2016,45(6):411-413.

