基于SCoT標記的陜西茶樹種質資源遺傳多樣性分析
王 令,李 佼,席彥軍,吳軍艦,郭明星,李秀峰,張 羽
(1.陜西理工大學 生物科學與工程學院,陜西漢中 723000;2.陜西省漢中市農業科學研究所,陜西漢中 723000)
茶樹[Camelliasinensis(L.) O. Kuntze]屬山茶科(Theaceae)山茶屬(CamelliaL.),起源于中國西南地區,作為重要的經濟作物,其已有3 000多年的栽培歷史[1]。茶樹種質資源是茶樹遺傳改良、種質創新等工作的物質基礎,開展茶樹種質資源遺傳研究,對收集利用優異茶樹種質資源和促進茶葉科技創新具有重要意義[2]。陜西茶區毗鄰古茶樹發源地四川,歷經千年的自然演化和人工栽培,擁有豐富的茶樹種質資源,根據20世紀80年代的資源調查結果,陜西茶樹地方品種大體分為7大群體和28個品種[3]。但早期分類主要依據地域、栽培歷史和茶樹形態等宏觀指標,缺乏生理生化和分子遺傳等微觀水平研究,利用分子標記技術深入了解地方茶樹遺傳背景和親緣關系,為茶樹分類和種質創新等研究提供技術支撐。
SCoT(start codon targeted polymorphism)分子標記是根據植物基因中的起始密碼子(ATG)側翼序列具有較高保守特性,設計單引物對基因組進行擴增,產生偏向候選功能基因區的顯性多態性標記。該技術具有操作簡便、多態信息豐富、成本低廉、引物通用性廣等諸多優點,已在油菜、柑橘、西瓜和柿等多種植物中建立了PCR體系并成功開展遺傳研究[4-8]。陳熙等[9]首次利用SCoT標記分析了部分陜西茶樹遺傳背景,但未對SCoT-PCR體系做優化試驗。本研究通過優化SCoT-PCR體系,建立茶樹SCoT標記技術,并分析‘陜茶一號’及其他陜西地方群體茶樹材料的遺傳背景和親緣關系,為茶樹資源遺傳多樣性研究奠定基礎。
1 材料與方法
1.1 材 料
供試茶樹品種為‘陜茶一號’。其余21份茶樹品種來自本地群體種資源圃(表1)。供試材料取自陜西省漢中市農業科學研究所茶葉綜合試驗站,選取無病蟲害、幼嫩的茶樹1芽1葉,-80 ℃保存。
試驗所用SCoT引物由北京奧科生物公司合成,TaqDNA聚合酶和DNA提取試劑盒購于大連寶生物工程有限公司。
1.2 DNA提取與檢測
采用DNA提取試劑盒提取茶葉DNA,加TE緩沖液保存。用紫外分光光度計檢測DNA純度和質量濃度,稀釋至50 ng/μL。采用8 g/L的瓊脂糖凝膠檢測茶葉基因組DNA。

表1 本研究所用試驗材料Table 1 Materials used in this study
1.3 SCoT反應體系的優化
1.3.1 正交試驗設計 體系優化試驗以‘陜茶一號’茶樹DNA為模板,SCoT25為擴增引物,采用L16(45)正交試驗設計,對反應體系中的Mg2+、dNTPs、引物、Taq酶和DNA 模板5個影響因素分別設置4個水平共16 個組合(表2),重復3次,總反應體系為20 μL。擴增反應程序:94 ℃預變性3 min;35個循環( 94 ℃變性30 s,50 ℃退火30 s,72 ℃延伸2 min);72 ℃延伸10 min,4 ℃保存。擴增產物用15 g/L瓊脂糖凝膠電泳檢測。
1.3.2 單因素試驗 在正交試驗結果基礎上,以直觀分析的最佳水平為標準,分別對20 μL反應體系中Mg2+、dNTPs、引物、Taq酶和DNA 模板5個因素進行單因素分析試驗,濃度水平梯度同正交試驗。
1.4 對22份茶樹材料的PCR擴增
應用優化的SCoT-PCR 反應體系,選取22條SCoT引物對茶樹材料進行擴增。擴增產物用8%的非變性聚丙烯酰胺凝膠電泳檢測,銀染法顯色并統計條帶。
1.5 數據統計與處理
每條引物檢測到的每條多態性帶視為1個等位變異,將電泳圖有帶賦值為“1”,無帶賦值為“0”。利用NTSYS-pc2.10e系統軟件中DICE法計算遺傳相似系數,用UPGMA進行聚類分析。
2 結果與分析
2.1 PCR體系優化
2.1.1 正交試驗結果 SCoT-PCR擴增結果顯示16個組合的條帶數量和清晰度差異很大(圖1)。其中組合11和12擴增的條帶數最多,且清晰度高。參考韓國輝等[10]的方法對擴增的條帶進行分析,即根據電泳條帶的多少及清晰度對16個組合從1~16進行打分,結合評分做直觀分析。直觀分析的極差R值反映該因素對試驗結果影響的程度,R越大說明該因素對試驗結果影響越大。由表3可知,茶樹SCoT-PCR 反應體系中各因素的影響依次為Mg2+>Taq酶>dNTPs>DNA>引物。根據直觀分析中各因素不同水平的均值(K)大小,表明各因素單一 最 佳 水 平 分 別 為Mg2+2.5 mmol/L,Taq酶0.75 U,dNTPs 0.25 mmol/L,DNA 30 ng,引物0.8 μmol/L。
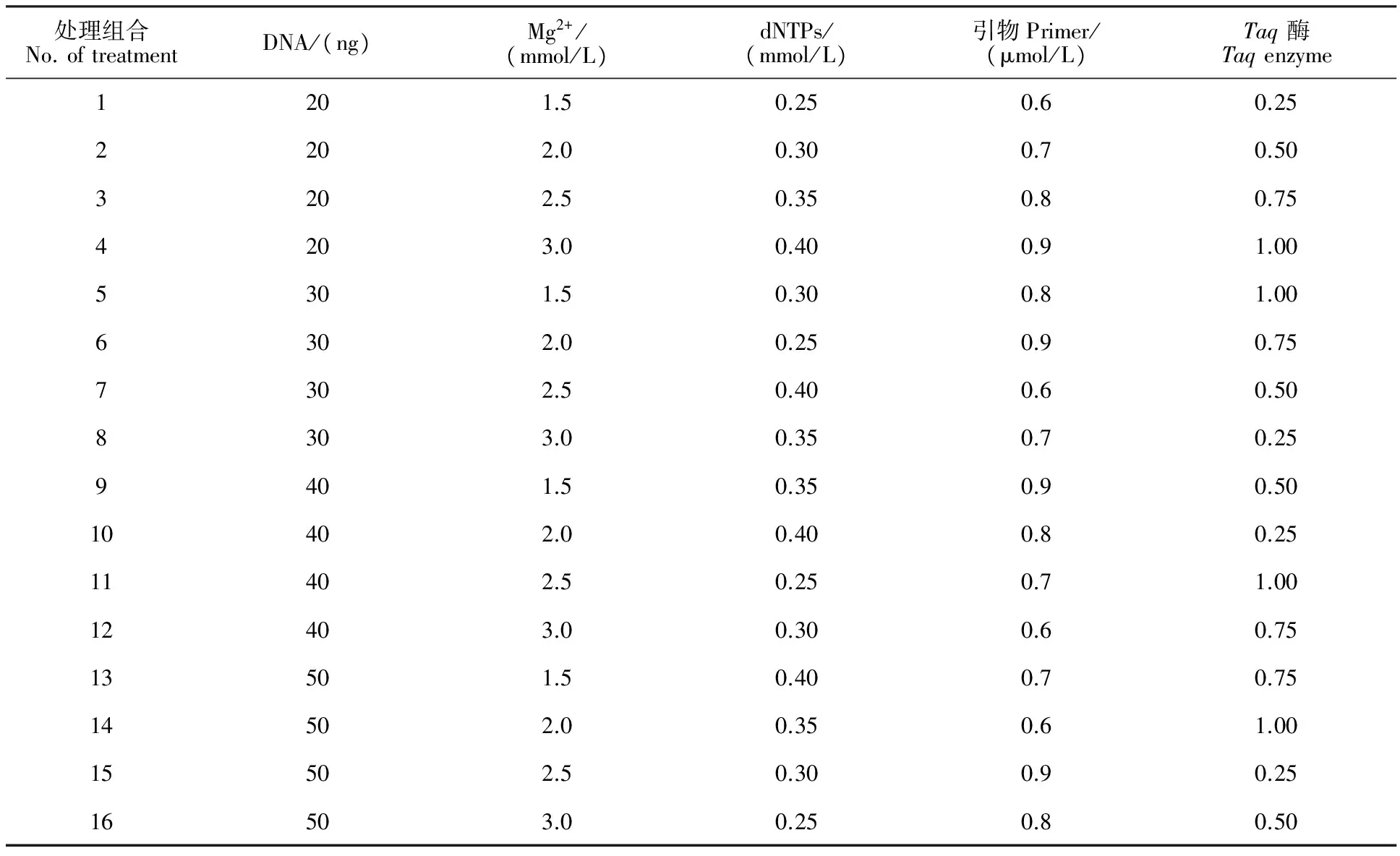
表2 茶樹SCoT-PCR L16(45)正交試驗設計Table 2 L16(45)orthogonal design for SCoT-PCR system in tea
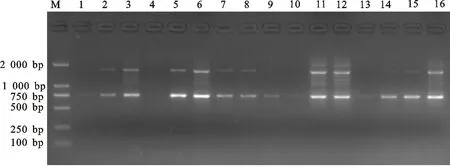
M.Marker DL 2000 ; 1~16.16個正交試驗設計組合擴增結果 The PCR result of L16(45) orthogonal design products
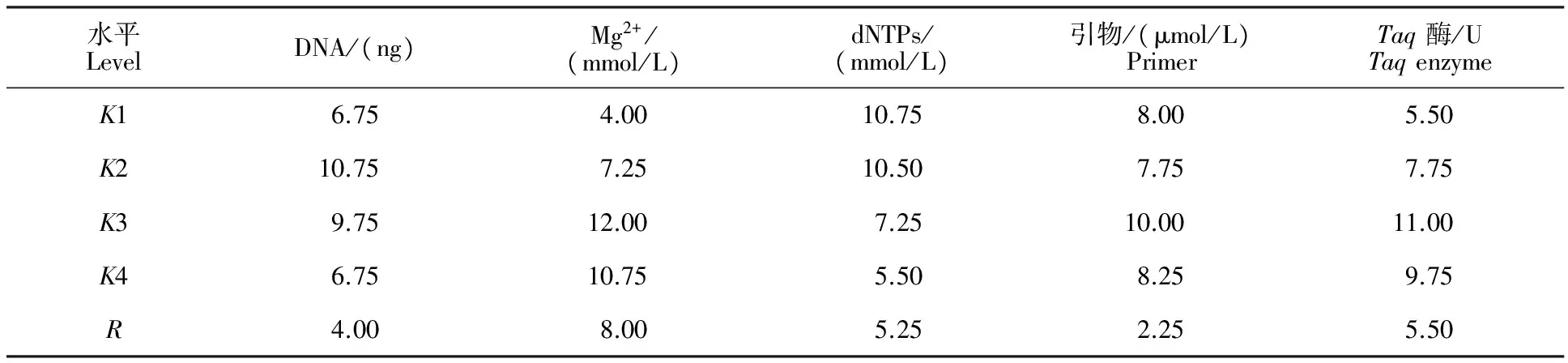
水平LevelDNA/(ng)Mg2+/(mmol/L)dNTPs/(mmol/L)引物/(μmol/L)PrimerTaq酶/UTaqenzymeK16.754.0010.758.005.50K210.757.2510.507.757.75K39.7512.007.2510.0011.00K46.7510.755.508.259.75R4.008.005.252.255.50
2.1.2 單因素試驗結果 影響茶樹SCoT-PCR擴增最大的因素是 Mg2+,Mg2+濃度太低會降低Taq酶的活性,減少擴增條帶,太高則會增加非特異性擴增[11],從圖2中5~8泳道看出,Mg2+濃度為1.5 mmol/L時,條帶非常少,當濃度提高到2.5 mmol/L時,擴增質量最佳。
PCR 反應中DNA模板濃度過低可能導致條帶太弱甚至無條帶,過多則會增加非特異性擴增。由圖2中1~4泳道看出,4個模板用量都能擴增出豐富的譜帶,其中30 ng擴增效果最好,與正交試驗的結果相吻合。
dNTPs濃度對PCR反應影響較大,由圖2可知,隨著濃度的增加,擴增條帶逐漸減少,說明高濃度的dNTPs 不利于擴增,故選擇0.25 mmol/L為dNTPs 的最佳濃度。
引物4個水平的濃度均可以擴增出清晰的條帶,但是高濃度的引物會提高引物二聚體形成機率,引起非特異性擴增,故選擇濃度低且條帶最清晰的0.7 μmol/L水平為最適濃度。
從圖2看出,隨著TaqDNA 聚合酶用量的增大,條帶亮度提高且更加清晰,0.75 U和1.0 U擴增條帶亮度基本一致,從經濟角度考慮,選擇0.75 U為最佳Taq酶用量。
在正交設計試驗的基礎上,綜合單因素試驗結果,最終確定茶樹SCoT-PCR總體積為20 μL時,最佳體系為Mg2+2.5 mmol/L,Taq酶0.75 U,引物0.7 μmol/L,dNTPs 0.25 mmol/L,DNA 30 ng。
2.2 22個茶樹材料的SCoT 分析
2.2.1 SCoT 標記的等位變異數和擴增片段多態性 應用優化的SCoT-PCR體系對‘陜茶1號’及21個陜西本地群體種質材料進行PCR擴增和電泳檢測,結果表明擴增條帶多且清晰。統計分析結果如表4所示,22條引物在22個材料中共檢測出241個等位位點,其中多態性位點228個,多態性比率為94.6%,平均每個引物可擴增11個條帶,引物SCoT 18擴增出最多的23個條帶(圖3)。SCoT位點的PIC值變化在0.57~0.92間,都為高度多態基因座。
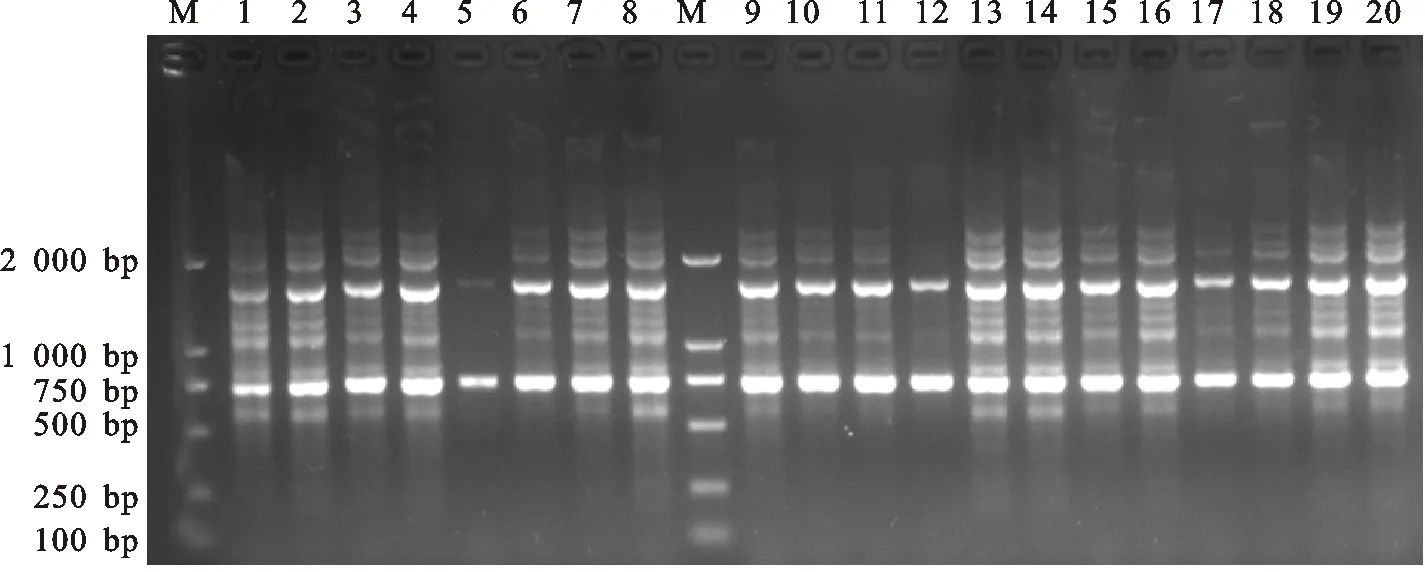
1~4.DNA模板用量為20 ng、30 ng、40 ng、50 ng 1-4 DNA template 20 ng,30 ng,40 ng,50 ng;5~8.Mg2+濃度為1.5、2.0、2.5、3.0 mmol/L Mg2+concentration 1.5、2.0、2.5、3.0 mmol/L;9~12.dNTPs濃度為0.25、0.3、0.35、0.4 mmol/L dNTPs concentration 0.25,0.3,0.35,0.4 mmol/L;13~16.引物濃度為0.6、0.7、0.8、0.9 μmol/L Primer concentration 0.6、0.7、0.8、0.9 μmol/L;17~20.Taq聚合酶0.25、0.5、0.75、1.0 UTaq0.25、0.5、0.75、1.0 U
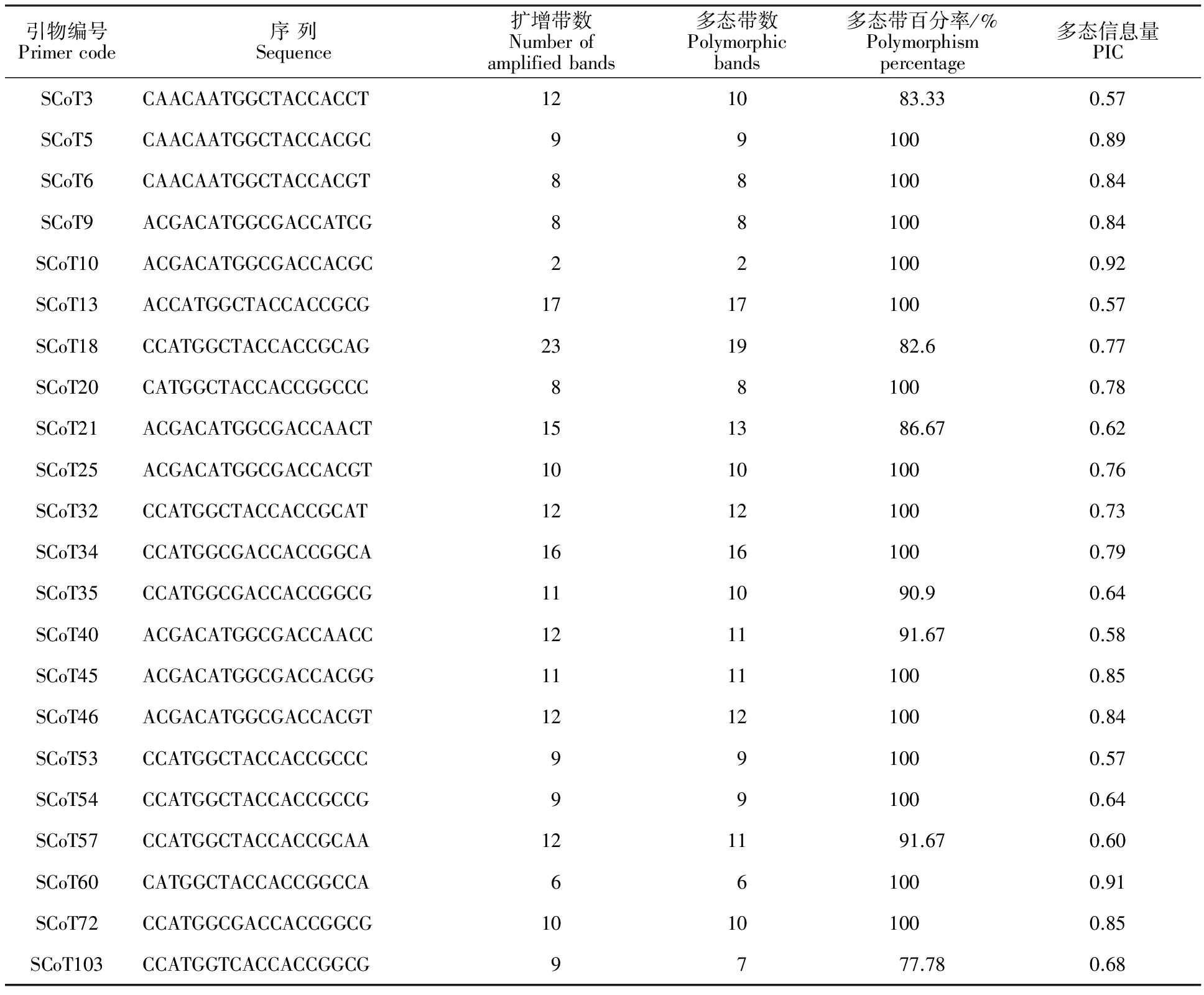
圖2 單一因素不同濃度對SCoT-PCR反應的影響Fig.2 Effect of single parameter with different concentrations on SCoT-PCR reaction
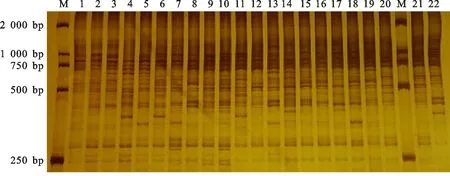
M.Marker DL 2000; 1~22.22個材料的PCR擴增結果 PCR results of 22 different materials as templates
2.2.2 供試材料間的遺傳相似系數 基于22條SCoT引物擴增結果,利用NTSYS-pc 2.10e軟件的DICE法計算遺傳相似系數。如圖4所示,22個材料間的相似系數為0.58~0.89,平均相似系數0.72。其中‘X14-2’和‘X13-1’間的相似系數最小,‘N13-8’和‘M2’間的相似系數最大,達到0.89。
2.2.3 聚類分析 用UPGMA構建22個茶樹材料的聚類圖(圖5)。結果顯示在相似系數0.67處,‘X14-2’單獨聚為一組,其余21份材料在相似系數0.69處分成3類。第1類包括‘Z14-3’‘陜茶1號’和‘N14-3’等3個材料。第2類包括‘Z14-25’‘B11-5’和‘B13-6’等16個材料。第3類包括‘X13-1’和‘X13-11’2個材料。聚類結果與品種所在茶區地理分布無明顯規律。
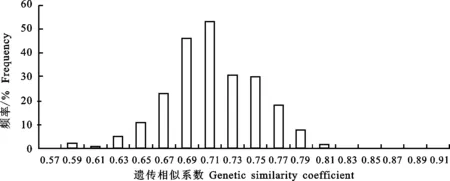
圖4 供試材料間遺傳相似系數的頻率分布Fig.4 Distribution of genetic similarity between materials
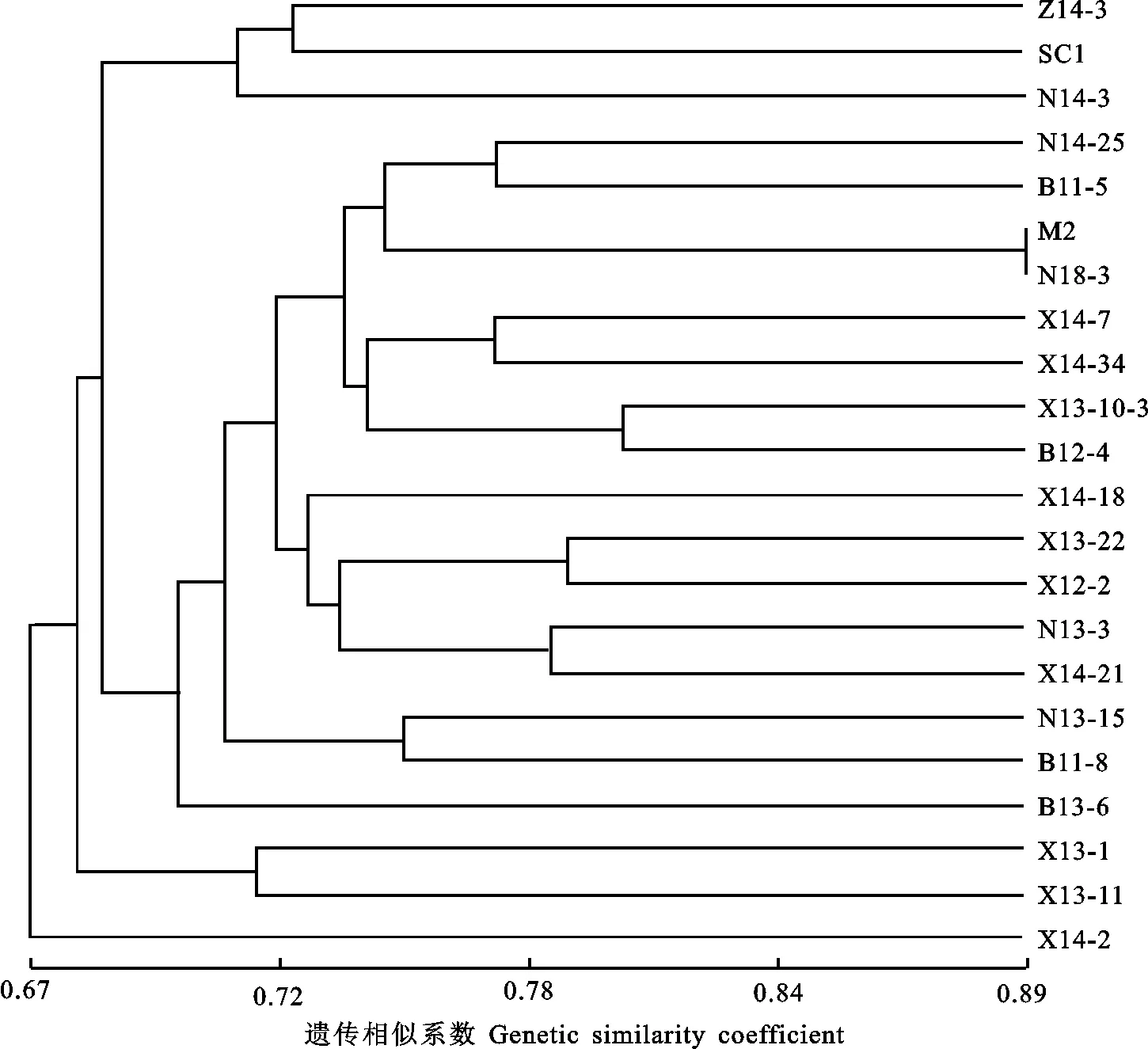
圖5 22份茶樹材料的SCoT標記聚類分析圖Fig.5 Dendrogram of 22 tea materials based on SCoT markers
3 討 論
SCoT 標記具有引物通用性廣、能有效產生和性狀連鎖的標記、操作簡便、穩定性好、多態性高、方便分子標記輔助育種等優點,因而在茶樹遺傳研究中有極大的潛力和良好的應用前景[12-13]。由于該技術是基于PCR的標記,其結果易受反應體系的影響,在使用前需要對SCoT-PCR體系進行優化[14]。利用正交試驗設計進行PCR優化能夠綜合考察各因素交互作用,快速得到理想結果,減少工作量,被大多數體系優化試驗所采用[15-17]。本研究結合正交試驗和單因素試驗對反應體系中的5個因素濃度進行優化,建立了茶樹SCoT-PCR體系。與牡丹、薺菜、草莓等材料的已有研究一致,其中,Mg2+濃度對反應體系的影響最大,但各因素濃度都略有差異,說明使用SCoT時應先優化體系,以達到理想的擴增結果[18-19]。
本研究利用SCoT 標記分析了22份來自陜西不同茶區的茶樹材料,22條引物共檢測出241個等位位點,多態性位點為228個,多態性比率為94.6%,其中15條引物的多態性比率為100%, 22份材料的相似系數為0.58~0.89,反映出所選材料遺傳多樣性豐富,陜西漢中地區群體種遺傳背景較寬,是開展茶樹系統選育的資源寶庫。同時也表明,優化的SCoT 標記能夠有效地應用于茶樹遺傳多樣性分析。
親緣關系分析是開展遺傳改良和種質創新的基礎。SCoT標記具有高多態性并能夠跟蹤性狀,是直接與性狀相關聯的分子標記,能夠用于物種親緣關系分析,揭示種質的遺傳背景。陳虎等[20]利用SCoT標記聚類多個龍眼品種,結果說明SCoT標記數據在一定程度上反映品種的地理分布情況。趙夢然等[21]對新疆野生白靈菇聚類分析,其結果也與地理分布大體一致。本研究聚類分析結果表明,茶樹材料之間并沒有按照地理聚類,這是由于材料所處的幾個茶區距離上相對較近,茶區間相互引種,茶樹種質交流較頻繁所致。玄參品種的遺傳分析結果也存在不以地理距離聚類的情況[22]。陜西茶樹種質資源的類型劃分目前沿用20世紀80年代的調查結果,根據群體種茶樹地理分布、葉片大小和葉型分為7大群體28個品種[3]。本研究獲得的聚類結果說明單純根據地理分布不能準確劃分茶樹品種,進一步結合材料葉型特征分析發現,聚類在一起的材料其葉片大小、葉形亦有一定差別,而來源相同且大小、葉形相似的材料也未聚在一處。其中,聚類結果與葉片特征有一定相關性,如都具有葉面平、葉緣微波、葉身稍內折特征的‘X14-7’和‘X14-34’2個材料聚在一起;同樣葉面平、葉緣微波的‘X13-22’‘B12-2’‘N13-3’和‘Z14 -21’聚類在一起;而葉面微隆的‘N13-15’與‘B11-8’、‘X13-1’與‘X13-11’、‘X13-10-3’與‘B12-4’兩兩聚在一起。這表明基于SCoT標記的聚類可能與茶樹葉片形態有很大的相關性。但本研究中由于材料樣本較少,尚未完全涵蓋所有群體品種,利用SCoT標記對陜西茶樹群體種分類還需后續更多試驗深入研究。
分子標記分析茶樹親緣關系的新手段可以補充完善傳統的茶樹種群劃分,對研究茶樹現有群體品種有很大的幫助,為開展茶樹系統選種和雜交育種奠定良好的理論基礎。
Reference:
[1] 馬建強,姚明哲,陳 亮.茶樹種質資源研究進展[J].茶葉科學,2015,35(1):11-16.
MA J Q,YAO M ZH,CHEN L.Research progress on germplasms oftea plant (Camelliasinensis) [J].JournalofTeaScience,2015,35(1):11-16.
[2] 席春奕,唐 茜,吳永勝,等.30份四川茶樹種質資源遺傳多樣性與親緣關系的SRAP分析[J].貴州農業科學,2013,41(2):6-9.
XI CH Y,TANG Q,WU Y SH,etal.Genetic diversity and relationship of 30 tea plant germplasms in Sichuan revealed by SRAP marker[J].GuizhouAgricuhuralSciences,2013,41(2):6-9 .
[3] 胡 歆.陜西茶樹種質資源研究進展[J].安徽農業科學,2012,40(1):51-52,57.
HU X.Research progress and prospect of tea germplasm in Shaanxi province[J].JournalofAnhuiAgriculturalScience,2012,40(1):51-52,57.
[4] 張 羽,張曉娟,李 英,等.SCOT分子標記在油菜遺傳多樣性研究中的應用[J].西南農業學報,2015,28(6):2395-2400.
ZHANG Y,ZHANG X J,LI Y,etal.Application of SCoT markers on studying onBrassicanapusgenetic diversity[J].SouthwestChinaJournalofAgriculturalSciences,2015,28(6):2395-2400 .
[5] 吳秀蘭,鄭福慶,徐呈祥,等.SCoT分子標記在沙糖橘遺傳多樣性分析中的應用[J].AgriculturalScience&Technology,2016,17(1):34-37,68.
WU X L,ZHENG F Q,XU CH X,etal.Genetic diversity analysis of shatangju mandarin(Citrusreticulata) by SCoT-PCR[J].AgriculturalScience&Technology,2016,17(1):34-37,68.
[6] 夏樂晗,楊婷婷,楊 勇,等.柿SCoT-PCR體系優化及品種遺傳多樣性分析[J].西北植物學報,2014,34(3):473-480.
XIA L H,YANG T T,YANG Y,etal.System optimization of SCoT-PCR and analysis on genetic diversity of persimmion(DiospyroskakiThunb.)[J].ActaBotanicaBoreali-occidentaliaSinica,2014,34(3):473-480.
[7] 楊 靜,王 萍,石 磊.籽用西瓜SCoT-PCR反應體系優化及引物篩選[J].西北農業學報,2016,25(6):889-896.
YANG J,WANG P,SHI L.Optimization for SCoT-PCR system and primer selection of seed-used watermelon[J].ActaAgriculturaeBoreali-occidentalisSinica,2016,25(6):889-896.
[8] 袁王俊,馬寅峰,董美芳,等.桂花SCoT標記體系的建立及其在遺傳多樣性分析中的應用[J].園藝學報,2015,42(3):569-575.
YUAN W J,MA Y F,DONG M F,etal.Establishment and genetic diversity analysis of SCoT molecular marker system forOsmanthusfragrans[J].ActaHorticulturaeSinica,2015,42 (3):569-575.
[9] 陳 熙,張 羽,李 佼,等.SCoT標記分析陜西茶樹資源的遺傳多樣性[J].茶葉科學,2016,36(2):131-138.
CHEN X,ZHANG Y,LI J,etal.Genetic diversity analysis of tea germplasm in Shaanxi province based on SCoT marker [J].JournalofTeaScience,2016,36(2):131-138.
[10] 韓國輝,向素瓊,汪衛星,等.柑橘SCoT分子標記技術體系的建立及其在遺傳分析中的應用[J].園藝學報,2011,38(7):1243-1250.
HAN G H,XIANG S Q,WANG W X,etal.Establishment and application of SCoT molecular marker system forCitrus[J].ActaHorticulturaeSinica,2011,38(7):1243-1250.
[11] 侯小改,王 娟,賈 甜,等.牡丹SCoT分子標記正交優化及引物篩選[J].華北農學報,2011,26(5):92-96.
HOU X G,WANG J,JIA T,etal.Orthogonal optimization of SCoT-PCR system and primer screening of tree peony[J].ActaAgriculturaeBoreali-Sinica,2011,26(5):92-96.
[12] COLLARD B C Y AND MACKILL D J.Start codon targeted (SCoT) polymorphism:A simple,novel DNA marker technique for generating gene-targeted markers in plants[J].PlantMolecularBiologyReporter,2009,27(1):86-93.
[13] 李 佼,李秀峰,陳 曦,等.SCoT分子標記的研究現狀及在茶樹育種中的應用前景[J].茶葉通訊,2015,42(3):8-12.
LI J,LI X F,CHEN X,etal.Research advance of SCoT marker and prospect of its application in tea breeding[J].JournalofTeaCommunication,2015,42(3):8-12.
[14] 陳 虎,何新華,羅 聰,等.龍眼SCoT-PCR反應體系的優化[J].基因組學與應用生物學,2009,28(5):970-974.
CHEN H,HE X H,LUO C,etal.The optimization of SCoT-PCR system of longan(Dimocarpuslongan) [J].GenomicsandAppliedBiology,2009,28(5):970-974.
[15] 郭大龍,張君玉,李 猛,等.葡萄SRAP反應體系優化及引物篩選[J].基因組學與應用生物學,2010,29(2):379-384.
GUO D L,ZHANG J Y,LI M,etal.Optimization of SRAP-PCR system in grape and primers screening[J].GenomicsandAppliedBiology,2010,29(2):379-384..
[16] 蘇亞春,凌 輝,王恒波,等.甘蔗SCoT-PCR反應體系優化與多態性引物篩選及應用[J].應用與環境生物學報,2012,18(5):810-818.
SU Y CH,LING H,WANG H B,etal.Optimization of SCoT-PCR reaction system,and screening and utilization of polymorphic primers in sugarcane[J].ChinaJournalApplyEnvironmentBiology,2012,18(5):810-818.
[17] 韓國輝,龍治堅,范理璋,等.藍莓SCoT標記分析體系的建立與優化[J].中國農學通報,2014,30(25):136-141.
HAN G H,LONG ZH J,FAN L ZH,etal.Establishment and optimization of SCoT system in blueberry[J].ChineseAgriculturalScienceBulletin,2014,30(25):136-141.
[18] 秦國新,何 橋,梁國魯,等.草莓屬植物SCoT分析體系的建立及優化[J].果樹學報,2012,29(3):393-397.
QIN G X,HE Q,LIANG G L,etal.Establishment and optimization of SCoT-PCR system inFragaria[J].JournalofFruitScience,2012,29(3):393-397.
[19] 龍治堅,王 瑩,韓國輝,等.芥菜SCoT分析體系的建立與優化[J].西南大學學報(自然科學版),2013,35(4):20-25.
LONG Z J,WANG Y,HAN G H,etal.Establishment and optimization of SCoT system of mustard[J].JournalofSouthwestUniversity(NaturalScience),2013,35(4):20-25.
[20] 陳 虎,何新華,羅 聰,等.龍眼24個品種的SCoT遺傳多樣性分析[J].園藝學報,2010,37(10):1651-1654.
CHEN H,HE X H,LUO C,etal.Analysis on the genetic diversity of 24 longan(Dimocarpus longan) accessions by SCoT markers[J].ActaHorticulturaeSinica,2010,37(10):1651-1654.
[21] 趙夢然,陳 強,黃晨陽,等.中國野生白靈菇遺傳多樣性的SCoT分析[J].園藝學報,2012,39(12):2475-2482.
ZHAO M R,CHEN Q,HUANG CH Y,etal.SCoT analysis of genetic polymorphism for wild germplasm ofPleurotuseryngiivar.tuoliensisfrom China[J].ActaHorticulturaeSinica,2012,39(12):2475-2482.
[22] 陳大霞,張 雪,王 鈺,等.應用SCoT標記分析玄參種質資源的遺傳多樣性[J].中國中藥雜志,2012,37(16):2368-2372.
CHEN D X,ZHANG X,WANG Y,etal.Genetic diversity ofScrophularianingpoensisbased on SCoT analysis[J].ChinaJournalofChineseMateriaMedica,2012,37(16):2368-2372.

