大麗輪枝菌VdLac基因克隆與功能分析
曹亞松,王春生,李海源,徐小鴻,商文靜,楊家榮,胡小平
(西北農林科技大學 植保學院/旱區作物逆境生物學國家重點實驗室,陜西楊凌 712100)
大麗輪枝菌(VerticilliumdahliaeKleb.)屬半知菌類輪枝孢屬真菌,寄主范圍廣泛,能危害660多種植物,其中農作物184種[1],且其寄主范圍還在繼續擴大[2]。微菌核是大麗輪枝菌在土壤中的主要存活結構,是黃萎病的主要初侵染來源[3-4]。大麗輪枝菌微菌核具有很強的抗逆性,可以在沒有寄主存在的條件下在土壤中存活14 a[5],這與其含有豐富的黑色素密切相關[6]。
黑色素是由吲哚類或酚類物質氧化聚合而形成的一種帶有負電荷的疏水性生物大分子物質[7]。黑色素增加真菌對紫外照射[8-10]、酶解[11]以及極端溫度的抗性[8,12]。黑色素還影響真菌的致病力,在甘藍鏈格孢中與致病力有關的基因中就包括幾類黑色素合成必需的基因[13]。水稻稻瘟病菌(Magnaporthegrisea)、瓜類炭疽病菌(Colletotrichumlagenarium)、菜豆炭疽病(Colletotrichumlindemuthianum)和禾生炭疽病菌(Colletotrichumgraminicola)等侵入寄主均需要黑色素的參與,黑色素缺失突變菌株喪失穿透寄主表皮的能力[14-15]。
漆酶是黑色素合成途徑的一種關鍵酶,它不僅可以催化DHN-黑色素的合成,也可以催化DOPA-黑色素的合成[7]。漆酶是一種含銅的多酚氧化酶與抗壞血酸氧化酶,與哺乳動物血漿銅藍蛋白同源,都屬于藍色多銅氧化酶家族[16],最早是由日本學者Yoshida[17]從日本紫膠漆樹(Rhusverniciflua)漆液中發現的。漆酶廣泛分布于植物、真菌、昆蟲和細菌中[18],它能夠催化一系列有機(尤其是芳香族)或無機化合物的氧化反應[7]。漆酶在真菌中起到多種作用,比如形態發生、壓力防御、致病力以及木質素降解等[19-21]。Lv等[22]研究表明,Scleromitrulashiraiana中的Sh-lac基因參與菌絲生長和黑色素合成,且有可能與致病力相關。Duressa等[23]用RNA-seq的方法分析大麗輪枝菌微菌核形成過程中基因的表達情況,發現編碼漆酶的 VDAG_00189基因在微菌核形成過程中表達量較高,但該基因在大麗輪枝菌中的生物學功能仍不清楚。
本研究以大麗輪枝菌JY菌株DNA為基礎,通過基因克隆技術獲得 VDAG_00189基因的序列,構建敲除質粒和互補質粒,并利用農桿菌介導的遺傳轉化(ATMT)[24-25]和PEG介導的原生質體轉化方法[25-26]對 VDAG_00189進行基因敲除和功能回復,得到敲除突變體 △VdLac-52、 △VdLac-54、 △VdLac-59、 △VdLac-61和互補突變體 △VdLac-C。通過觀察突變體和野生型的菌落形態和生長速率、壓力敏感以及致病力等功能變化,來了解該基因在黑色素合成和致病等過程中的作用。
1 材料與方法
1.1 供試菌株及載體
pA-Hyg-OSCAR(攜帶潮霉素抗性質粒)和pOSCAR(骨架質粒)購自真菌遺傳保藏中心(www.fgsc.net)。大腸桿菌DH5α購自TaKaRa公司。大麗輪枝菌涇陽菌株JY、棉花感病品種‘冀棉11’和農桿菌菌株EH105由西北農林科技大學土傳病害實驗室提供。大腸桿菌DH10B和構建互補質粒所需的酵母菌株XK1-25(Trp營養缺陷型)、穿梭載體pFL2(含有GFP和Trp合成基因),均由西北農林科技大學許金榮教授實驗室饋贈。
1.2 培養基及緩沖液
試驗用到的培養基有PDA培養基、LB培養基、CM培養基[27]、Czapek(查氏)培養基、YEPD培養基、YPD培養基、TB3培養基、SD-Trp培養基、STC buffer。培養基中抗生素和對應的質量濃度分別為潮霉素(Hyg) 50 mg·L-1、頭孢霉素(Cef) 200 mg·L-1、利福平(Rif) 50 mg·L-1、氨芐青霉素(Amp) 50 mg·L-1、G418 100 mg·L-1。
1.3 基因克隆和生物信息學分析
在NCBI網站搜索VdLac( VDAG_00189)基因的氨基酸序列,使用BLASTP(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp&PAGE_TYPE=BlastSearc&LINK_LOC=blasthome)程序在nr數據庫進行同源性搜索,選取同源的真菌蛋白序列,用MEGA 6.0軟件以鄰接法(neighbor-joining method)構建系統發育樹。
1.4 敲除質粒的構建及敲除突變體的篩選
以VdLac基因序列為敲除片段,設計引物。以野生型菌株JY基因組DNA為模板,擴增VdLac基因上游的1 043 bp序列片段和下游的908 bp序列片段,通過一步法[28]將基因的上、下游片段和潮霉素基因連接到骨架質粒pOSCAR上,構建敲除質粒pOSCAR-Lac。利用農桿菌介導的遺傳轉化方法,將構建好的敲除質粒轉入野生型菌株JY中,經過潮霉素(50 mg·L-1)抗性篩選,以及潮霉素基因檢測引物Hyg-F和Hyg-R目的基因檢測引物Lac-F和Lac-R對敲除轉化子進行PCR驗證(表1),得到該基因的敲除突變體。
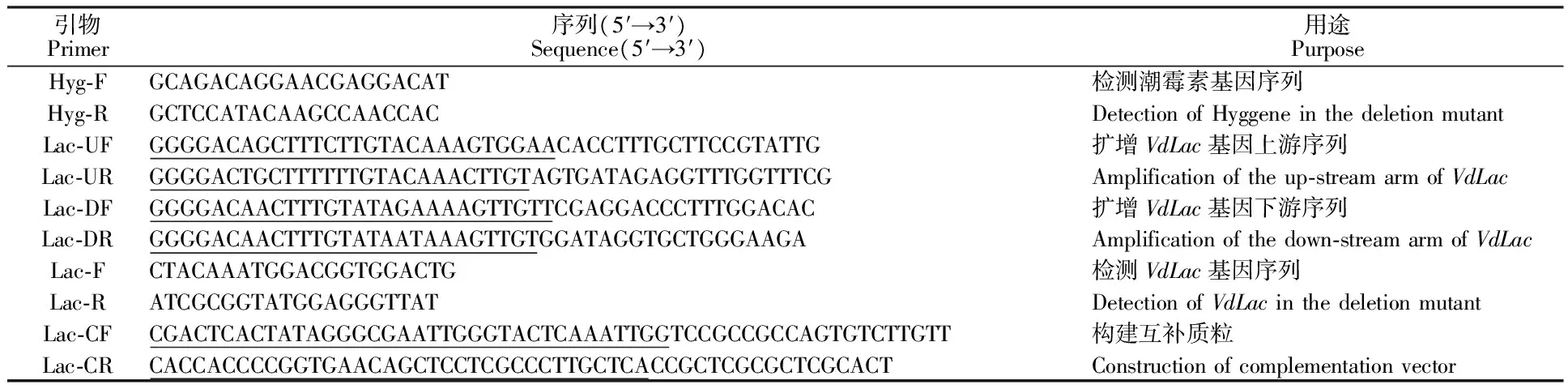
表1 引物信息Table 1 Information of primers
注:Lac-UF、Lac-UR、Lac-DF和Lac-DR引物中帶有下劃線的序列表示載體構建時添加到每個引物5′端的attB重組序列[28];Lac-CF和Lac-CR引物中帶有下劃線的序列代表載體構建時添加的XhoⅠ限制性內切酶位點兩端的同源序列。
Note:Underlined text in primer sequences of Lac-UF, Lac-UR, Lac-DF and Lac-DR indicate the attB recombination sequence added to the 5′end of primers[28]; underlined text in primer sequences of Lac-CF and Lac-CR represent the added homologous sequences to both ends of the restriction enzyme cutting sites ofXhoⅠ.
1.5 敲除突變體的功能回復
以野生型JY菌株基因組DNA為模板,利用Lac-FC和Lac-RC引物,擴增VdLac基因上游序列和編碼序列并連接到質粒pFL2上,構建互補質粒pFL2-Lac。采用PEG介導的原生質體轉化方法,將互補質粒轉化敲除突變體得到互補突變體,經過G418抗性篩選和表型測定,并使用目的基因檢測引物Lac-F和Lac-R進行PCR驗證,得到該基因的互補突變體。
1.6 菌落形態及菌落生長速率的測定
在培養7 d的野生型JY菌株,敲除突變體 △VdLac-52、 △VdLac-59、 △VdLac-61菌株以及互補突變體 △VdLac-C菌株的菌落邊緣打菌餅(d=7 mm),分別接種到CM平板中央,25 ℃黑暗條件下培養20 d后觀察菌落特征,并在菌落生長的第5、10、15和20天,用“十字”交叉法測量菌落直徑。每個處理3個皿,重復3次。
1.7 產孢量測定
以野生型JY菌株為對照,配制濃度為1×107mL-1的敲除突變體 △VdLac-52、 △VdLac-59、 △VdLac-61菌株和互補突變體 △VdLac-C菌株的孢子懸浮液。吸取200 μL孢子懸浮液,接種至裝有50 mL Czapek的液體培養基中,于25 ℃條件下120 r·min-1黑暗搖培7 d后,在顯微鏡下用血球計數板測量孢子懸浮液濃度。重復3次。
1.8 壓力敏感性測定
在培養7 d的野生型、敲除突變體以及互補突變體的菌落邊緣打菌餅(d=7 mm),分別接種到含有H2O2(w=0.03%)(氧化壓力)、20 μm·mL-1SDS(細胞壁壓力)、1.2 mol·L-1山梨醇(滲透壓力)、NaCl(鹽脅迫)(0.7 mol·L-1、1.5 mol·L-1)、5 mmol·L-1NaNO2(硝化壓力)、10 mmol·L-1EDTA·Na2(螯合劑壓力)、CuSO4(重金屬脅迫)(250 μmol·L-1、500 μmol·L-1、1 mmol·L-1、2.5 mmol·L-1、5 mmol·L-1)的CM平板上,25 ℃黑暗培養20 d后觀察菌落特征,并分別在菌落生長的第5、10、15和20天用“十字”交叉法測量菌落直徑。每個處理3皿,重復3次。
1.9 漆酶顯色反應
參考Shin等[29]的方法,利用ABTS作為漆酶的特異性底物,將野生型菌株、敲除突變體菌株和互補突變體的菌餅(d=7 mm)分別接種在含有0.3 g·L-1ABTS和3 g·L-1KNO3的CM和Czapek培養基平板中心,25 ℃黑暗培養10 d。每隔2 d觀察一次培養基顏色變化情況。每個處理3個皿,重復3次。
1.10 致病力測定
野生型及突變體菌株的接種方法參照水培棉花孢子懸浮液浸根接種法[30]。待棉花幼苗長到2片真葉平展時,將棉苗小心取出,用清水清洗干凈,浸在孢子濃度為3×106mL-1的懸浮液中30 min,以無菌水作為空白對照。接種21 d后,采用5級分級標準[31]記錄發病級別。病害調查的分級標準如下。
0級:棉株健康,無病葉,生長正常;1級:棉株1/4以下葉片發病,變黃萎蔫;2級:棉株1/4以上、1/2以下葉片發病,變黃萎蔫; 3級:棉株1/2以上、3/4以下葉片發病,變黃萎蔫;4級:3/4以上葉片發病,或葉片全部脫落,棉株枯死。
病情指數=[∑各級病株數×相應病級/(調查總株數×最高病級)]×100
1.11 數據分析
采用SAS(Statistical Analysis System)8.1軟件的TTEST和ANOVA對數據進行差異顯著性分析。
2 結果與分析
2.1 VdLac蛋白的生物信息學分析
根據NCBI上已公布的大麗輪枝菌VdLs.17的基因組序列,克隆得到 VDAG_00189序列,該基因全長1 978 bp,cDNA序列全長1 713 bp,包含5個外顯子和4個內含子,編碼570個氨基酸,將其命名為漆酶。將VdLac基因編碼的氨基酸序列提交NCBI進行BLASTP同源性比對,分析表明該漆酶與已知的Verticilliumalfalfae的親緣關系最近,同源性為96%(圖1)。
2.2 敲除及互補突變體的獲得
提取從潮霉素(Hyg)抗性平板上篩選到的敲除轉化子DNA和從G418抗性平板上篩選到的互補轉化子DNA,用Hyg基因的特異引物Hyg-F和Hyg-R、目的基因特異引物Lac-F和Lac-R進行PCR檢測。4個敲除突變體都能擴增得到大小為896 bp的Hyg基因條帶,而野生型菌株JY沒有相應條帶(圖2-A);從敲除突變體中均無法擴增得到目的基因條帶,而JY和互補突變體 △VdLac-C能擴增出目標條帶(圖2-B)。選取其中3個敲除突變體進行后續研究。
2.3 突變體及野生型菌株的產孢量和致病力測定
在Czapek液體培養基中培養7 d后,3個突變體的產孢量與野生型及互補突變體間無顯著差異(數據略)。接種棉花21 d后,突變體與野生型接種的植株表現出典型的黃萎病癥狀,但病情指數無顯著差異(數據略)。說明VdLac基因不影響菌株的產孢及致病力。
2.4 突變體和野生型菌株的生長速率和壓力敏感性測定
在CM平板中培養20 d后,3個敲除突變體 與野生型和互補突變體在培養基的顏色都為黑色(數據略)。敲除突變體 △VdLac-52、 △VdLac-59、 △VdLac-61與野生型JY和互補突變體 △VdLac-C在CM平板上培養20 d后,其生長速率間無明顯差異;而在含有5 mmol·L-1NaNO2的CM平板上,3個突變體的菌落直徑明顯小于野生型及互補突變體的菌落直徑;H2O2(w=0.03%)、1.2 mol·L-1山梨醇、10 mmol·L-1EDTA·Na2和NaCl(0.7 mol·L-1、1.5 mol·L-1)對突變體和野生型的菌絲生長雖都有抑制作用,但抑制效果不明顯(表2)。此外,20 μg·mL-1SDS和CuSO4(250 μmol·L-1、500 μmol·L-1、1 mmol·L-1)對敲除突變體和野生型以及互補突變體的生長均無抑制作用,當CuSO4濃度為2.5 mmol·L-1和5 mmol·L-1時,敲除突變體、野生型和互補突變體均不能生長(表2)。
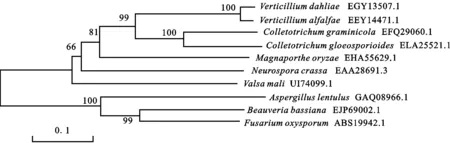
圖1 大麗輪枝菌 VdLac漆酶蛋白系統發育分析Fig.1 Phylogenetic analysis of VdLac of Verticillium dahliae
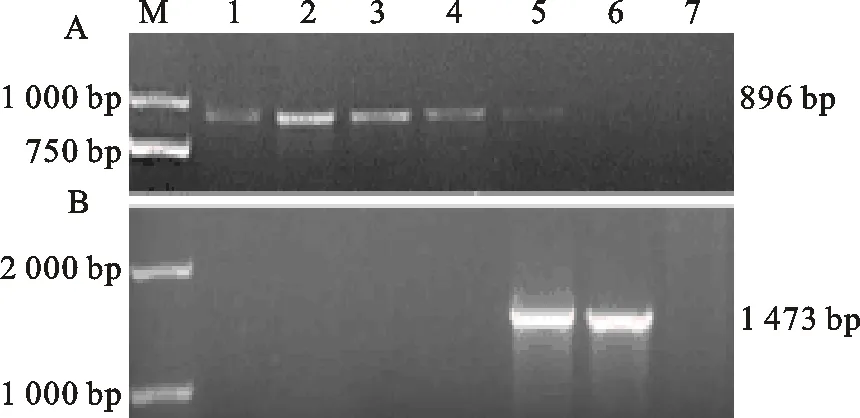
A:Hyg基因的PCR擴增 Amplification ofHyggene by PCR; M.D 2000 marker;1-4.敲除突變體 Deletion mutants △VdLac-52、 △VdLac-54、 △VdLac-59、 △VdLac-61;5.pA-Hyg-OSCAR質粒 pA-Hyg-OSCAR plasmid;6.JY;7.無菌水Sterile water
B:目的基因VdLac的PCR擴增 Amplification ofVdLacgene by PCR; M.D 2000 marker;1-4.敲除突變體 Deletion mutants △VdLac-52、 △VdLac-54、 △VdLac-59、 △VdLac-61;5. △VdLac-C;6.JY;7.無菌水 Sterile water
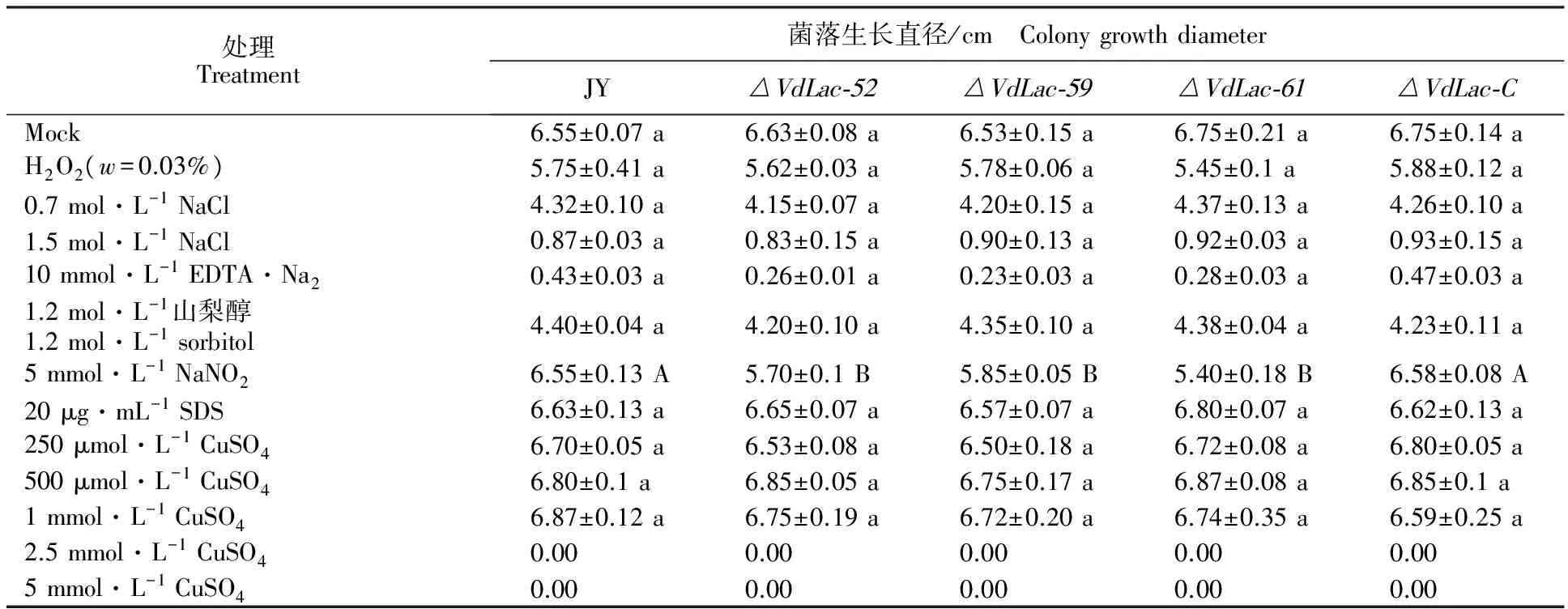
圖2 △VdLac突變體的PCR檢測結果Fig.2 PCR detection of △VdLac mutants
注:數據為“平均數±標準誤”。所有菌株均在CM培養基中黑暗條件下25 ℃,培養20 d后測量菌落直徑。所有菌株均與野生型進行比較。同行數據不同小寫字母表示在P<0.05的水平上有差異;同行數據不同大寫字母表示在P<0.01的水平上有差異。
Note:Data in the table are “Average±SE”.All the strains were cultivated at 25 ℃ in dark on CM plates.The colony diameters were measured at 20d after inoculation.All the strains were compared with wild type strain.Different lowercase letters in each row mean significant difference at the level ofP<0.05; Different uppercase letters in each row mean significant difference at the level ofP<0.01.
2.5 漆酶顯色反應
敲除突變體 △VdLac-52、 △VdLac-59、 △VdLac-61和野生型JY及互補突變體 △VdLac-C在含有ABTS的CM培養基中培養10 d,菌落邊緣可以觀察到藍色的漆酶顯色圈,但野生型和互補突變體的顯色圈明顯比敲除突變體的大,說明敲突變體在CM培養基上仍然可以產生漆酶,但漆酶的含量較低;而在查氏培養基上,所有的菌株都未產生顯色圈(圖3)。
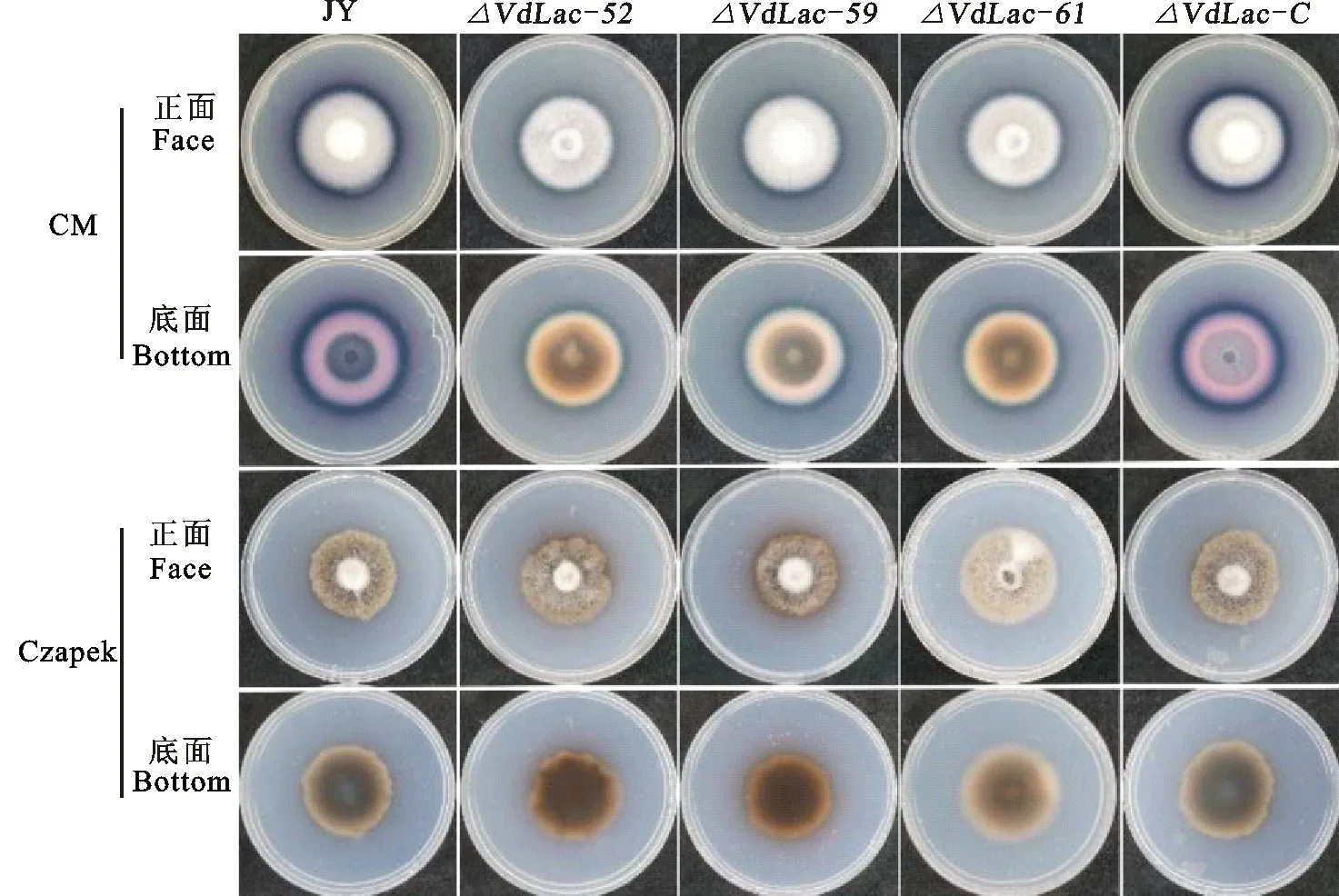
所有菌株均接種在含有0.3 g·L-1ABTS和3 g·L-1KNO3的CM(上圖)和Czapek(下圖)平板上,25 ℃黑暗條件下培養10 d。
All the strains grow on CM(above) and Czapek(below) plates containing 0.3 g·L-1ABTS and 3 g·L-1KNO3at 25 ℃ in dark for 10 d.
圖3突變體及野生型菌株在CM和Czapek培養基上的漆酶顯色反應
Fig.3ThechromogenicreactionoflaccaseinmutantsandwildtypestrainonCMandCzapekplates
3 討 論
真菌漆酶具有各種各樣的功能,包括木質素降解、色素合成、子實體形成、解毒作用、形態發生以及致病力[32]。構巢曲霉和煙曲霉中的漆酶在分生孢子發育和萌發過程參與色素的生成[33]。馬爾尼菲青霉中編碼漆酶的pbrB基因對分生孢子DHN-黑色素的合成是必須的[7]。西瓜炭疽病菌的 △Lac1突變體黑色素含量略有減少、漆酶酶活卻有所升高,而 △Lac2突變體黑色素含量下降、分生孢子顏色變淺并喪失致病力[34-35]。然而,本研究結果表明,大麗輪枝菌的VdLac基因不影響菌株營養生長(表2)、產孢、以及致病力(數據略)。本研究也檢測突變體及野生型菌株對不同壓力的敏感性,發現突變體對NaNO2敏感(表2),說明VdLac基因編碼的漆酶能保護菌株免受硝化壓力的傷害。
植物病原真菌產生多基因編碼的漆酶同工酶[36]。擔子菌Trametesgallica中存在2個漆酶基因,子囊菌Podosporaanserina中存在3個漆酶基因,白腐菌Physisporinusrivulosus中存在4個漆酶基因,擔子菌Coprinopsiscinerea中存在8個漆酶基因[37-40]。大麗輪枝菌中鑒定得到6個編碼漆酶的基因,其中本研究用到的 VDAG_00189(VdLac)基因在微菌核形成過程中上調表達[41]。本研究中 △VdLac與野生型相比菌落顏色和形態沒有發生明顯變化(數據略);漆酶顯色反應表明 △VdLac仍然存在漆酶活性,但含量降低(圖3)。由此推測大麗輪枝菌VdLac基因不參與DHN 黑色素的合成。但大麗輪枝菌中其他漆酶基因是否參與黑色素的合成,在黑色素合成過程中不同漆酶基因之間是否存在協同或補充作用,還需要通過單基因以及多基因敲除進行深入研究。
在植物病原真菌漆酶產生篩選過程中,根據病原菌在含有ABTS的基本培養基平板上的顯色情況可以估計產漆酶活性,通過顯色圈與菌落直徑的相對差值,以及顏色深淺可用于初步估計產漆酶量的高低[42]。本研究表明,在含有ABTS的CM培養基中培養,野生型菌株的顯色圈明顯大于缺失突變體的(圖3),說明 △VdLac的漆酶含量降低。并且缺失突變體和野生型菌株在含有ABTS的CM和Czapek培養基上培養時表現出顯色差異(圖3)。Shleev等[43]在研究中發現,同一種病原菌在不同培養條件下產漆酶活力差異很大,特別是培養基組中的碳和氮源是影響真菌漆酶產量的重要因素[44],糙皮側耳菌Pleurotusostreatus漆酶活性隨葡萄糖濃度的增加而增加[45];有機氮比無機氮更利于疣孢漆斑菌MyrotheciumverrucariaNF-05菌株產漆酶[44]。本試驗中,CM培養基與Czapek培養基的配方相比,主要是碳源與氮源不同,CM培養基的碳源是葡萄糖,而Czapek培養基則是蔗糖,CM培養基的氮源除無機氮外還有酵母提取物,酸水解酪蛋白和蛋白胨。推測可能是葡萄糖、酵母提取物、酸水解酪蛋白或蛋白胨能刺激大麗輪枝菌產生漆酶。
Reference:
[1] BHAT R G,SUBBARAO K V.Host range specificity inVerticilliumdahliae[J].Phytopathology,1999,89(12):1218-1225.
[2] KLOSTERMAN S,JATALLAH Z K,VALLAD G E.Diversity,pathogenicity,and management ofVerticilliumspecies[J].AnnualReviewofPhytopathology,2009,47(1):39-62.
[3] MENZIES J D,GRIEBEL G E.Survival and saprophytic growth ofVerticilliumdahliaein uncropped soil[J].Phytopathology,1967,57(2):703-709.
[4] POWELSON R L.Significance of Population Level ofVerticilliumin Soil[M]∥Root Diseases and Soil-borne Pathogens.University of California Press,Berkeley,USA,1970:31-33.
[5] WILHELM S.Longevity ofVerticilliumwilt fungus in the laboratory and field[J].Phytopathology,1955,45(3):180-181.
[6] NOSANCHUK J D,CASADEVALL A.The contribution of melanin to microbial pathogenesis[J].CellularMicrobiology,2003,5(2):203-223.
[7] SAPMAK A,BOYCE K J,ANDRIANOPOULOS A,etal.ThepbrBgene encodes a laccase required for DHN-Melanin synthesis in conidia ofTalaromyces(Penicillium)marneffei[J].PloSOne,2015,10(4):1-16.
[8] KAWAMURA C,TSUJIMOTO T,TSUGE T.Targeted disruption of a melanin biosynthesis gene affects conidial development and UV tolerance in the Japanese pear pathotype ofAlternariaalternate[J].MolecularPlant-MicrobeInteractions,1999,12(1):59-63.
[9] REHNSTROM A L,FREE S J.The isolation and characterization of melanin-deficient mutants of Monilinia fructicola[J].PhysiologicalandMolecularPlantPathology,1996,49(5):321-330.
[10] WANG Y,CASADEVALL A.Decreased susceptibility of melanizedCryptococcusneoformansto UV light[J].AppliedandEnvironmentalMicrobiology,1994,60(10):3864-3866.
[11] HYAKUMACHI M,YOKOYMA K,UI T.Role of melanin in susceptibility and resistance ofRhizoctoniasolanito microbial lysis[J].TransactionsoftheBritishMycologicalSociety,1987,89(1):27-33.
[12] ROSAS A L,CASADEVALL A.Melanization affects susceptibility ofCryptococcusneoformansto heat and cold[J].FEMSMicrobiologyLetters,1997,153(2):265-272.
[13] YANGRAE C,AKHIL S,ROBIN A,etal.Transcription factorAmr1 induces melanin biosynthesis and suppresses virulence inAlternariabrassicicola[J].PLoSPathogens,2012,8(10):1-17.
[14] ZHANG C Q,ZHU G N,MA Z H.Isolation,characterization and preliminary genetic analysis of laboratory tricyclazole-resistant mutants of the rice blast fungus,Magnaporthegrisea[J].JournalofPhytopathology,2006,154(2):392-397.
[15] ELIAHU N,IGBARIA A,ROSE M S.Melanin biosynthesis in the maize pathogenCochliobolusheterostrophusdepends on two mitogen-activated protein kinases,Chk1 and Mps1,and the transcription factor Cmr1[J].EukaryoticCell,2007,6(2):421-429.
[16] NINA H,LAURA-LEENA K,KRISTIINA K.Crystal stucture of a laccase formMelanacarpusalbomyceswith an intact trinuclear copper site[J].NatureStructuralBiology,2002,9(8):601-605.
[17] YOSHIDA H.Chemistry of lacquer(urushi)[J].JournaloftheChemicalSociety,1883,43:472-486.
[18] WIDSTEN P,Kandelbauer A.Laccase applications in the forest products industry:A review[J].EnzymeandMicrobialTechnology,2008,42(4):293-307.
[19] BALDRIAN P.Fungal laccases occurrence and properties[J].FEMSMicrobiologyReviews,2006,30(2):215-242.
[20] SHEKHER R,SEHGAL S,KAMTHANIA M,etal.Laccase:microbial sources,production,purification,and potential biotechnological applications[J].EnzymeResearch,2011,2011:1-11.
[21] GIARDINA P,FARACO V,PEZZELLA C,etal.Laccases:a never-ending story[J].CellularandMolecularLifeSciences,2010,67(3):369-385.
[22] LV Z,KANG X,XIANG Z,etal.A laccase gene Sh-lac is involved in the growth and melanin biosynthesis ofScleromitrulashiraiana[J].Phytopathology,2017,107(3):353-361.
[23] DURESSA D,ANCHIETA A,CHEN D.etal.RNA-seq analyses of gene expression in the microsclerotia ofVerticilliumdahliae[J].BioMedCentralGenomics,2013,14(1):607-624.
[24] DOBINSON K F.Genetic transformation of the vascular wilt fungusVerticilliumdahliae[J].CanadianJournalofBotany,1995,73(5):710-715.
[25] FAN R,KLOSTERMAN S J,WANG C H,etal.Vayg1 is required for microsclerotium formation and melanin production inVerticilliumdahliae[J].FungalGeneticsandBiology,2017,98:1-11.
[26] WEI Y,SHEN W,DAUK M,etal.Targeted genedisruption of glycerol-3-phosphate dehydrogenase inColletotrichumgloeosporioidesreveals evidence that glycerol is a significant transferrednutrient from host plant to fungal pathogen[J].JournalofBiologicalChemistry,2004,279(1):429-435.
[27] 王光輝.禾谷鐮刀菌AMT1基因的功能研究[D].陜西楊凌:西北農林科技大學,2010.
WANG G H.Fubctional characterization ofAMT1 genes inFusariumgriaminearium[D].Yangling Shaanxi:North West Agriculture and Forestry University,2010.
[28] PAZ Z,GARCíA-PEDRAJAS M D,ANDREWS D L,etal.One step construction ofAgrobacterium-recombination-ready-plasmids(OSCAR),an efficient and robust tool forATMTbased gene deletion construction in fungi[J].FungalGeneticsandBiology,2011,48(7):677-684.
[29] SHIN K S,LEE Y J.Purification and characterization of a new member of the laccase family from the white-rot basidiomyceteCoriolushirsutus[J].ArchivesofBiochemistryandBiophysics,2000,384(1):109-115.
[30] 彭 姍,呂學蓮,高 峰,等.一種新的棉花黃、枯萎病快速接種方法的研究[J].棉花學報,2008,20(3):174-178.
PENG SH,Lü X L,GAO F,etal.Study on a new rapid inoculation method forVerticilliumwilt andFusariumwilt of cotton[J].CottonScience,2008,20(3):174-178.
[31] 簡桂良,孫文姬,馬 存,等.棉花抗病蟲性評價技術規范:第5部分:黃萎病 GB/T 22101.3-2009[S].北京:中國標準出版社,2009:2.
JIAN G L,SUN W J,MA C,etal.Technical specification for evaluating resistance of cotton to diseases and insect pests:part 5:Verticilliumwilt[S].Beijing: Standards Press of China,2009:2.
[32] JANUSZ G,CZURYLO A,FRC M,etal.Laccase production and metabolic diversity amongFlammulinavelutipesstrains[J].WorldJournalofMicrobiologyandBiotechnology,2015,31(1):121-133.
[33] TSAI H F,WHEELER M H,CHANG Y C,etal.A developmentally regulated gene cluster involved in conidial pigment biosynthesis inAspergillusfumigatus[J].JournalofBacteriology,1999,181(20):6469-6477.
[34] TSUJI G,FUJIKAWA J,ISHIDA H.Laccase gene LAC1 ofColletotrichumlagenariumis not essential for melanin biosynthesis and pathogenicity[J].JournalofGeneralPlantPathology,2001,67(3):182-190.
[35] LIN S Y,OKUDA S,IKEDA K,etal.Lac2 encoding a secreted laccase is involved in appressorial melanization and conidial pigmentation inColletotrichumorbiculare[J].MolecularPlant-MicrobeInteractions,2012,5(12):1552-1561.
[37] KILARU S,HOEGGER P J,KES U,etal.The laccase multi-gene family inCoprinopsiscinereahas seventeen different members that divide into two distinct subfamilies[J].CurrentGenetics,2006,50(1):45-60.
[38] DONG J L,ZHANG Y W,ZHANG R H,etal.Influence of culture condition laccase production and isozyme patterns in the white-rot fungusTrametesgallica[J].JournalofBasicMicrobiology,2005,45(3):190-198.
[39] HILDEN K,HAKALA T K,MAIJALA P,etal.Novel thermotolerent laccase produced by the white-rot fungusPhysisporinusrivulosus[J].AppliedMicrobiologyandBiotechnolgy,2007,77(2):301-309.
[40] DURRENS P.The phenoloxidases of the ascomycetePodosporaanserina:the three forms of the major laccase activity[J].ArchivesofMicrobiology,1981,130(2):121-124.
[41] 肖書笑,田呈明,王永林.黃櫨枯萎病菌漆酶基因的鑒定及其在微菌核形成過程中的表達研究[J/OL].中國科技論文在線,2013:1-7[2013-12-20].http:/ /www.paper.edu.cn /releasepaper /content /201312-625.
XIAO SH X,TIAN CH M,WANG Y L.Genome-wide identification,phylogeny and expression profiling during microsclerotia formation in smoke tree wilt fungusVerticilliumdahliae[J/OL].Sciencepaper online,2013:1-7[2013-12-20].http:/ /www.paper.edu.cn /releasepaper /content /201312-625.
[42] 莫佳琳,付時雨,詹懷宇.貝殼狀革耳菌誘變提高產漆酶能力及其生物漂白的研究[J].中國造紙學報,2006,21(4):29-32.
MO J L,FU SH Y,ZHAN H Y.Improving laccase activity ofPanusconchatusby mutagenesis and used for biobleaching[J].TransactionsofChinaPulpandPaper,2006,21(4):29-32.
[43] SHLEEV S V,MOROZOVA O V,NIKITINA O V,etal.Comparison of physico-chemical characteristics of four laccases from different basidiomycetes[J].Biochimie,2004,86(9):693-703.
[44] 趙 丹.疣孢漆斑菌漆酶的產生、特性及應用研究[D].哈爾濱:東北林業大學,2012.
ZHAO D.The production,properties and applications ofMyrothciumverrucariaNF-05[D].Harbin Heilongjiang:Northeast Forestry University,2012.
[45] PERIASAMY R,PALVANNAN T.Optimization of laccase production byPleurotusostreatusIMI 395545 using the Taguchi DOE methodology[J].JournalofBasicMicrobiology,2010,50(6):548-556.

