黃連素抑制直腸癌SW480細胞增殖的實驗研究*
彭洪 林中超 彭明沙 祝秀華 劉娟(南充市中心醫院中西醫結合肛腸科, 四川 南充 637000)
結直腸癌是亞太地區最常見的惡性腫瘤之一, 死亡率較高[1], 其病因尚不明確。目前外科手術是直腸癌的主要治療方式, 但是30%的患者術后可出現復發或轉移[2]。因此探索新的治療方式, 已成為治療直腸癌的熱點。
黃連素是一種喹啉生物堿, 很多重要的藥用植物比如刺芒和紫葉小檗都含有黃連素, 并且黃連素還具有止瀉、降壓、降血糖和抗炎等作用[3-5]。近年的研究發現黃連素對多種腫瘤細胞均表現出抗腫瘤效果, 如神經膠質瘤、食管癌、肺癌、前列腺癌和卵巢癌[6-10]。黃連素可通過誘導細胞凋亡, 抑制腫瘤細胞增殖和阻止腫瘤侵襲、轉移來發揮抗癌作用, 這些研究結果提示黃連素未來在臨床上有望作為一種化療藥物而加以使用。但黃連素抗腫瘤的具體作用機制卻知之甚少。本研究的目的是觀察黃連素對直腸癌SW480細胞增殖的抑制效果并探討其可能的作用機制。
1 材料與方法
1.1 細胞培養與試劑 人直腸癌SW480細胞株購自重慶醫科大學基礎研究所, 在含有10%胎牛血清, 1%青霉素和1%鏈霉素的RPMI-1640培養基里培養。黃連素(C20H18ClNO4)購自圣元公司(鄭州, 河南)。Ang-2 ELISA試劑盒購自晶美生物工程有限公司(深圳, 中國)。
1.2 方法
1.2.1 細胞增殖檢測 直腸癌SW480細胞株以每孔1×105個接種于96孔板, 培養24小時后分別加入濃度為0mol/L、25μmol/L、50μmol/L、100μmol/L、150μmol/L、200μmol/L的黃連素, 繼續培養48小時。每孔加MTT 20ul, 4小時后棄上清液。然后每孔加二甲基亞砜(DMSO)150ul, 震蕩10分鐘后于490nm處測定吸光度(A)值。實驗重復進行3次。抑制率公式: 抑制率(%)=(對照組A值-治療組A值)/對照組A值×100%。治療組黃連素濃度分為6個亞型, 分別為0mol/L 、25μmol/L、50μmol/L、100μmol/L、150μmol/L、200μmol/L, 并計算不同亞型的抑制率。結果示黃連素作用48小時后的最佳抑制濃度為150μmol/L, 因此在后續實驗中我們選用150μmol/L的黃連素作為治療組用藥。
1.2.2 細胞周期檢測 直腸癌SW480細胞株以每孔2×105個接種于6孔板過夜, 當細胞80%融合時治療組用150μmol/L黃連素干預48小時, 對照組用RPMI-1640培養基。48小時后收集各組細胞, 按照說明進行流式細胞分析。
1.2.3 細胞凋亡檢測 直腸癌SW480細胞株以每孔2×105個接種于6孔板過夜, 當細胞80%融合時治療組用150μmol/L黃連素干預48小時, 對照組用RPMI-1640培養基。48小時后收集各組細胞, 參照說明書, 按照Annexin V凋亡分析法進行染色(碧云天生物技術有限公司, 上海, 中國)。然后凋亡指數通過計算Annexin V陽性細胞(紅染色)數進行分析, 每組10個樣本。
1.2.4 免疫印跡分析 直腸癌SW480細胞株以每孔2×105個接種于6孔板過夜, 當細胞80%融合時用不同方式進行處理。治療組用150μmol/L黃連素干預48小時, 對照組用RPMI-1640培養基。48小時后收集各組細胞, 按照說明進行免疫印跡分析。Livin、Ykl-40、AKT and Cyclin D1蛋白的表達用Quantity One圖像分析軟件進行吸光度分析。
1.2.5 Ang-2 表達的檢測 直腸癌SW480細胞株以每孔2×105個接種于24孔板過夜, 當細胞80%融合時治療組用150μmol/L黃連素作用48小時, 對照組用RPMI-1640培養基。48小時后按照說明進行酶聯免疫吸附測定。于450nm處測定吸光度(A)值。以標準品濃度為橫坐標、A值作縱坐標繪制標準曲線。通過標準品的A值可在標準曲線上查出Ang-2的濃度。
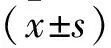
2 結果
2.1 細胞增殖比較 隨著黃連素作用濃度的增高(0~200μmol/L), SW480細胞增殖率明顯降低。但是當黃連素作用濃度在150~200μmol/L之間時, 抑制率無明顯差異(P>0.05), 說明黃連素作用于SW480細胞48小時后最佳抑制濃度為150μmol/L, 因此在后續實驗中選用150μmol/L的黃連素作為治療組的用藥, 見表1。

Table1CellproliferationafterculturewithdifferentBBRconcentration

組別OD值抑制率(×10-2)0mol/L0.68±0.04(-)25μmol/L0.58±0.0314.750μmol/L0.48±0.0429.4100μmol/L0.40±0.0241.2150μmol/L0.36±0.0247.1200μmol/L0.34±0.0250.0
2.2 兩組細胞周期比較 結果顯示治療組中78.98%的細胞被阻滯在G1期, 而對照組有65.76%的細胞被阻滯在G1期。說明黃連素可通過阻滯細胞周期在G1期而抑制SW480細胞增殖, 見表2、圖1。

表2 細胞周期分析Table 2 Cell cycle analysis

圖1 細胞周期分析Figure 1 Cell cycle analysis注:A.治療組;B.對照組
2.3 兩組細胞凋亡比較 結果顯示, 與對照組相比, 治療組細胞存在更大比例的凋亡。結果說明黃連素對SW480細胞具有明顯的抑制作用, 見表3、圖2。

表3 SW480細胞凋亡率Table 3 Apoptpsis index of SW480 cells

圖2 SW480細胞凋亡Figure 2 Apoptpsis of SW480 cells注: A.治療組; B.對照組
2.4 兩組YKL-40、AKT、Cyclin D1蛋白表達比較 進一步研究是否YKL-40/AKT/Cyclin D1信號通路參與黃連素介導的細胞周期阻滯, 結果顯示與對照組相比, 治療組中YKL-40(幾丁質酶-3樣蛋白-1)、pAKT(phosphorylated protein kinase B, 磷酸化蛋白激酶B, 為AKT的活性形式)、Cyclin D1(特異性周期蛋白D1)在SW480細胞內的表達明顯下降, 但是總AKT(protein kinase B, 蛋白激酶B)表達無明顯變化。結果說明YKL-40/AKT/Cyclin D1信號通路參與黃連素介導的SW480細胞周期阻滯及抑制細胞增殖,見圖3。

圖3 YKL-40 表達AKT及pAKT、Cyclin D1 表達
Figure3YKL-40expression,AKTexpressionandCyclinD1expression
注:A、C、F為對照組;B、D、E為治療組
2.5 兩組Livin蛋白表達比較 為進一步研究黃連素誘導細胞凋亡的機制, 檢測凋亡相關基因表達。結果顯示與對照組相比, 抗凋亡基因Livin(凋亡抑制蛋白)在治療組細胞中的表達明顯下降。說明黃連素可通過抑制Livin蛋白的表達而誘導細胞凋亡,見圖4。

圖4 Livin 表達Figure 4 Livin expression注:A.治療組.B.對照組
2.6 兩組Ang-2表達水平比較 用ELISA方法檢測兩組Ang-2(血管生成素-2)表達情況, 結果顯示治療組中Ang-2表達水平(28.9±2.47)ng/mL明顯較對照組(40.2±2.35)ng/mL下降(t=10.49,P<0.05), 上述結果證實抑制腫瘤血管的生成是黃連素抗腫瘤的作用機制之一。
3 討論
既往研究證實黃連素對多種腫瘤均具有明顯的抑制作用。但其抑制直腸癌SW480細胞的具體作用機制卻罕見。本研究結果顯示隨著黃連素作用濃度的增加(25~200μmol/L), SW480細胞增殖率明顯降低, 其部分原因可能是因為78.98%的SW480細胞被阻滯在G1期。接下來我們研究了導致細胞周期阻滯的具體機制。YKL-40是哺乳動物甲殼質酶樣蛋白家族的一員, 現有研究證實其與多種腫瘤(包括直腸癌)的發病密切相關[11-15]。近來有研究發現Brp-39(小鼠YKL-40基因所編碼的蛋白)能直接作用于管狀細胞啟動PI 3-K/Akt信號通路, 同時有研究證實在結腸上皮細胞中YKL-40的幾丁質結合域可特異性激活AKT信號通路[16-17]。并且沉默YKL-40基因可通過阻滯細胞在G1期而抑制細胞增殖[18]。所以我們推測是否YKL-40/AKT信號通路參與了黃連素介導的SW480細胞周期阻滯。本實驗中黃連素可明顯抑制YKL-40、AKT和它的靶基因Cyclin D1蛋白的表達, 其結果證實了黃連素可通過抑制YKL-40/AKT/Cyclin D1信號通路阻滯SW480細胞周期。有研究發現低劑量的YKL-40作用于SW480細胞可導致明顯的β-catenin核轉位并激活c-Myc和cyclin D1等靶基因的轉錄, 隨后通過調節細胞周期G0/G1期從而促進SW480細胞的增殖[19]。總的說來, 我們的研究證實黃連素可抑制SW480細胞增殖, 其機制可能部分通過抑制YKL-40/AKT/Cyclin D1信號通路和誘導細胞周期阻滯而實現的。
誘導細胞凋亡是腫瘤治療的重要方法之一。在本實驗中我們發現黃連素作用后的SW480細胞凋亡率明顯高于對照組, 其作用機制可能歸因于Livin基因表達的下調。Livin是凋亡抑制蛋白(IAP)家族的新成員, 其可選擇性的和凋亡調節因子比如caspase-3, caspase-7, 和caspase-9等結合最后阻止細胞凋亡[20-21]。Livin在多種腫瘤組織中高表達, 但在正常組織中卻幾乎不表達, 并且它和細胞的增殖、侵襲及運動密切相關[22-25]。既往研究發現在體內和體外實驗中siRNA介導的livin表達下調可誘導結腸癌細胞的凋亡, 不僅如此, 沉默Livin基因還可以增強結腸癌細胞的化療敏感性[26-27]。但是黃連素與livin表達之間的關系尚卻未見報道。本研究證實黃連素誘導SW480細胞凋亡, 至少部分是通過Livin所介導的。這些研究結果說明Livin在直腸腫瘤的發病中扮演著重要的角色, 增加Livin的表達可作為直腸腫瘤治療的新策略之一。
血管生成是結直腸癌發生發展所必需的[28]。Ang-2是血管生成素家族的一員, 其可與內皮特異性受體酪酸激酶2(Tie2)結合, 通過調節血管穩定性來維持正常血管功能[29]。Ang-2在肺癌、口腔癌、鼻咽癌和腎癌等多種腫瘤中均呈明顯的高表達[30-33]。Ang-2的表達在結腸癌患者及結直腸動物模型中均明顯升高, 并且血清中Ang-2水平對于預測轉移性結直腸癌不良預后具有重要意義[34-35]。Ang-2在腫瘤進展期能夠誘導無序血管重新組織, 并且還可以快速增加毛細血管直徑, 重構基底膜, 促進內皮細胞的增殖和轉移和刺激新生血管的生成[36-37]。同時Ang-2還可通過誘導異常上皮-間質轉化促進腫瘤的遷移和侵襲[38]。Ang-2在多種人類惡性腫瘤中均高表達, 但是在正常人群中卻沒有明顯表達, 這為抗腫瘤治療提供了新的靶向目標。在動物模型中阻斷Ang/Tie2信號通路可以防止髓細胞的招募, 而阻斷Ang-2的功能則可限制腫瘤的轉移[39-40]。目前一種阻斷Ang-2的功能用于治療卵巢癌的抗體目前已進入第三期臨床試驗[41]。近來研究證實黃連素是一種抗血管生成因子, 它不僅可降低乳腺腫瘤的血管密度, 并且還可以通過抑制PI-3K/AKT信號通路阻止TPA誘導的血管內皮生長因子(VEGF)的生成[42-43]。但是關于黃連素和Ang2之間相互作用機制的研究卻未見報道。本實驗結果顯示黃連素能明顯下調SW480細胞中Ang2的表達水平, 證實了抑制腫瘤血管的生成是黃連素抗腫瘤的作用機制之一。
4 結論
本文資料顯示, 黃連素具有抗腫瘤作用, 不僅能夠抑制SW480細胞的增殖, 還可以阻滯細胞周期, 誘導細胞凋亡及抑制腫瘤血管生成。抑制YKL-40/AKT/Cyclin D1信號通路, 下調Livin和Ang-2的表達可能是黃連素抗腫瘤的重要作用機制。但還需要采用動物實驗評價黃連素的抑癌效果, 其具體的作用機制也有待進一步研究。
[1]Zhiqin W, Palaniappan S, Raja AR.Inflammatory Bowel Disease-related Colorectal Cancer in the Asia-Pacific Region: Past, Present, and Future[J].Intestinal Res, 2014, 12(3): 194-204.
[2]Aklilu M, Eng C.The current landscape of locally advanced rectal cancer[J].Nat Rev Clin Oncol, 2011, 8(11): 649-659.
[3]Amripal S, Sanjiv D, Navpreet K,etal.Berberine: alkaloid with wide spectrum of pharmacological activities[J].J Nat Prod, 2010, 3: 64-75.
[4]Abd El-Wahab AE, Ghareeb DA, Sarhan EE,etal.In vitro biological assessment of Berberis vulgaris and its active constituent, berberine: antioxidants, anti-acetylcholinesterase, anti-diabetic and anticancer effects[J].BMC Complement Altern Med, 2013, 9(13): 218.
[5]Qadir SA, Kwon MC, Han JG,etal.Effect of different extraction protocols on anticancer and antioxidant activities of Berberis koreana bark extracts[J].J Biosci Bioeng, 2009, 107(3): 331-339.
[6]Chen Q, Qin R, Fang Y,etal.Berberine Sensitizes Human Ovarian Cancer Cells to Cisplatin Through miR-93/PTEN/Akt Signaling Pathway[J].Cellular physiology and biochemistry, 2015, 36(3): 956-965.
[7]Liu Q, Xu X, Zhao M,etal.Berberine induces senescence of human glioblastoma cells by downregulating the EGFR-MEK-ERK signaling pathway[J].Molecular cancer therapeutics, 2015, 14(2): 355-363.
[8]Lu JJ, Fu L, Tang Z,etal.Melatonin inhibits AP-2beta/hTERT, NF-kappaB/COX-2 and Akt/ERK and activates caspase/Cyto C signaling to enhance the antitumor activity of berberine in lung cancer cells[J].Oncotarget, 2016, 7(3): 2985-3001.
[9]Mishan MA, Ahmadiankia N, Matin MM,etal.Role of Berberine on molecular markers involved in migration of esophageal cancer cells[J].Cellular and molecular biology (Noisy-le-Grand, France), 2015, 61(8): 37-43.
[10] Tian Y, Zhao L, Wang Y,etal.Berberine inhibits androgen synthesis by interaction with aldo-keto reductase 1C3 in 22Rv1 prostate cancer cells[J].Asian journal of andrology, 2015, 18(4): 607-612.
[11] Chiang YC, Lin HW, Chang CF,etal.Overexpression of CHI3L1 is associated with chemoresistance and poor outcome of epithelial ovarian carcinoma[J].Oncotarget, 2015, 6(37): 39740-39755.
[12] Zheng X, Xing S, Liu XM,etal.Establishment of using serum YKL-40 and SCCA in combination for the diagnosis of patients with esophageal squamous cell carcinoma[J].BMC Cancer, 2014, 7(14): 490.
[13] K rankaya Güne A, Gül , Tutar N,etal.The place of YKL-40 in non-small cell lung cancer[J].Tuberk Toraks, 2014, 62(4): 273-278.
[14] Vom Dorp F, Tschirdewahn S, Niedworok C,etal.Circulating and Tissue Expression Levels of YKL-40 in Renal Cell Cancer[J]. J Urol, 2016, 195(4): 1120-1125.
[15] Johansen JS, Christensen IJ, J rgensen LN,etal. Serum YKL-40 in risk assessment for colorectal cancer: a prospective study of 4, 496 subjects at risk of colorectal cancer[J].Cancer Epidemiol Biomarkers Prev, 2015, 24(3): 621-626.
[16] Schmidt IM1, Hall IE, Kale S,etal.Chitinase-Like Protein Brp-39/YKL-40 Modulates the Renal Response to Ischemic Injury and Predicts Delayed Allograft Function[J].J Am Soc Nephrol, 2013, 24(2): 309-319.
[17] Chen CC, Llado V, Eurich K,etal.Carbohydrate-binding motif in chitinase 3-like 1 (CHI3L1/YKL-40) specifically activates Akt signaling pathway in colonic epithelial cells[J].Clin Immunol, 2011, 140(3): 268-275.
[18] Zhang W, Kawanishi M, Miyake K,etal.Association between YKL-40 and adult primary astrocytoma[J].Cancer, 2010, 116(11): 2688-2697.
[19] .Eurich K, Segawa M, Toei-Shimizu S,etal.Potential role of chitinase 3-like-1 in inflammation-associated carcinogenic changes of epithelial cells[J].World J Gastroenterol, 2009, 15(42): 5249-5259.
[20] Chang H, Schimmer AD.Livin/melanoma inhibitor of apoptosis protein as a potential therapeutic target for the treatment of malignancy[J].Mol Cancer Ther, 2007, 6(1): 24-30.
[21] Salvesen GS, Duckett CS.IAP proteins: blocking the road to death’s door[J].Nat Rev Mol Cell Biol, 2002, 3(6): 401-410.
[22] Xi RC, Sheng YR, Chen WH,etal.Expression of survivin and Livin predicts early recurrence in non-muscle invasive bladder cancer[J].J Surg Oncol, 2013, 107(5): 550-554.
[23] Choi J, Hwang YK, Sung KW,etal.Expression of Livin, an antiapoptotic protein, is an independent favorable prognostic factor in childhood acute lymphoblastic leukemia[J].Blood,2007, 109(2): 471-477.
[24] Xiang Y, Yao H, Wang S,etal.Prognostic value of Survivin and Livin in nasopharyngeal carcinoma[J].Laryngoscope, 2006, 116(1): 126-130.
[25] Liu H, Wang S, Sun H,etal.Inhibition of tumorigenesis and invasion of hepatocellular carcinoma by siRNA-mediated silencing of the livin gene[J].Mol Med Rep, 2010, 3(6): 903-907.
[26] Oh BY, Lee RA, Kim KH.siRNA targeting Livin decreases tumor in a xenograft model for colon cancer[J].World J Gastroenterol, 2011, 17(20): 2563-2571.
[27] Ding ZY, Liu GH, Olsson B,etal.Upregulation of the antiapoptotic factor Livin contributes to cisplatin resistance in colon cancer cells[J].Tumour Biol, 2013, 34(2): 683-693.
[28] Mihalache A, Rogoveanu I.Angiogenesis factors involved in the pathogenesis of colorectal cancer[J].Curr Health Sci J, 2014, 40(1): 5-11.
[29] Hu B, Cheng SY.Angiopoietin-2: Development of inhibitors for cancer therapy[J]. Curr Oncol Rep, 2009, 11(2): 111-116.
[30] Fawzy A, Gaafar R, Kasem F,etal.Importance of serum levels of angiopoietin-2 and survivin biomarkers in non-small cell lung cancer[J].J Egypt Natl Cancer Inst, 2012, 24(1): 41-45.
[31] Li C, Sun CJ, Fan JC,etal. Angiopoietin-2 expression is correlated with angiogenesis and overall survival in oral squamous cell carcinoma[J].Med Oncol, 2013, 30(2): 571.
[32] Chen HH, Weng BQ, Cheng KJ,etal. Effect of the vascular endothelial growth factor expression level on angiopoietin-2-mediated nasopharyngeal carcinoma growth[J].Vasc Cell, 2014, 6(1): 4.
[33] Rautiola J, Lampinen A, Mirtti T,etal.Association of Angiopoietin-2 and Ki-67 Expression with Vascular Density and Sunitinib Response in Metastatic Renal Cell Carcinoma[J].PloS One, 2016, 11(4) : e0153745.
[34] Goede V, Coutelle O, Neuneier J,etal.Identification of serum angiopoietin-2 as a biomarker for clinical outcome of colorectal cancer patients treated with bevacizumab-containing therapy[J].Br J Cancer, 2010, 103(9): 1407-1414.
[35] Liu WX, Gu SZ, Zhang S,etal.Angiopoietin and vascular endothelial growth factor expression in colorectal disease models[J].World J Gastroenterol, 2015, 21(9): 2645-2650.
[36] Falcon BL, Hashizume H, Koumoutsakos P,etal.Contrasting actions of selective inhibitors of angiopoietin-1 and angiopoietin-2 on the normalization of tumor blood vessels[J].Am J Pathol, 2009, 175(5): 2159-2170.
[37]Lobov IB, Brooks PC and Lang RA.Angiopoietin-2 displays VEGF-dependent modulation of capillary structure and endothelial cell survival in vivo[J].Proc Natl Acad Sci U S A, 2009, 99(17): 11205-11210.
[38] Li C, Li Q, Cai Y,etal.Overexpression of angiopoietin 2 promotes the formation of oral squamous cell carcinoma by increasing epithelial-mesenchymal transition-induced angiogenesis[J].Cancer Gene Ther, 2016, 23(9): 295-302.
[39] Huang H, Lai J-Y, Do J,etal.Specifically targeting angiopoietin-2 inhibits angiogenesis, Tie2-expressing monocyte infiltration, and tumor growth[J].Clin Cancer Res, 2011, 17(5): 1001 - 1011.
[40] Mazzieri R, Pucci F, Moi D,etal.Targeting the ANG2/TIE2 axis inhibits tumor growth and metastasis by impairing angiogenesis and disabling rebounds of proangiogenic myeloid cells[J].Cancer cell, 2011, 19(4): 512-526.
[41] Monk BJ, Poveda A, Vergote I,etal.Anti-angiopoietin therapy with trebananib for recurrent ovarian cancer (TRINOVA-1): a randomised, multicentre, double-blind, placebo-controlled phase 3 trial[J].Lancet Oncol, 2014, 15(8): 799 - 808.
[42] Pierpaoli E, Damiani E, Orlando F,etal.Antiangiogenic and antitumor activities of berberine derivative NAX014 compound in a transgenic murine model of HER2/neu-positive mammary carcinoma[J].Carcinogenesis, 2015, 36(10): 1169-1179.
[43] Kim S, Oh SJ, Lee J,etal.Berberine suppresses TPA-induced fibronectin expression through the inhibition of VEGF secretion in breast cancer cells[J].Cell Physiol Biochem, 2013, 32(5): 1541-1550.

