QX200微滴式數字PCR方法檢測轉基因大豆GTS-40-3-2
吳 瀟,呂貝貝*,蔣 瑋,王金斌,4,白 藍,武國干,胡為一,唐雪明**
(1上海市農業科學院生物技術研究所,上海201106;2農業部轉基因植物環境安全監督檢驗測試中心(上海),上海201106;3上海市農業遺傳育種重點實驗室,上海201106;4上海瑞豐農業科技有限公司,上海201106;5上海安景科技有限公司,上海200051)
微滴式數字PCR(Droplet digital PCR,ddPCR)是近年來迅速發展起來的一種突破性地檢測和定量核酸的技術,其基本原理是通過將模板極度稀釋,將所有樣品在相同條件下進行PCR擴增,實現理論上的單分子擴增,有PCR擴增熒光信號記為1,無熒光信號記為0,反應結果采用泊松概率分布公式,便可計算出樣本的原始濃度[1-5]。
外源基因的檢測是轉基因生物安全評價的重要評價指標之一[6]。目前,外源基因拷貝數和含量分析多采用實時熒光定量PCR技術(Real-time Quantitative PCR,qPCR)。qPCR技術在分析外源基因拷貝數時必須依賴于已知拷貝數的內參基因和標準曲線的建立,是一種相對定量方法,且標準曲線的建立易受到模板純度、引物和探針的濃度等諸多因素影響[7]。與qPCR方法相比,微滴式數字PCR技術不依賴于標準曲線,實現了DNA檢測從相對定量到絕對定量的飛躍[8-14]。QX200微滴式數字PCR系統(QX200TMDroplet DigitalTMPCR)獲得了歐盟體外診斷(in vitro diagnostic,IVD)產品 CE認證(CE IVD marking),這是該領域首個獲得CE認證的數字PCR系統。QX200 ddPCR系統可以直接從分析器同時讀取外源基因和內標基因的拷貝數,快速計算出外源基因的百分含量,測定過程更為方便和快捷。
目前,尚無QX200 ddPCR技術應用于轉基因生物外源基因檢測分析的相關報道。本試驗研究轉基因大豆GTS-40-3-2的微滴式數字QX200 PCR檢測方法,以期為轉基因生物中外源基因拷貝數和外源基因含量的精確測定提供一種新方法。
1 材料與方法
1.1 材料
轉基因大豆GTS-40-3-2陽性品(100%)和轉基因大豆GTS-40-3-2標準品(轉基因大豆GTS40-3-2含量為10%)購于European Reference Materials公司,Quant-iTTMPicoGreen?dsDNA Kit購于美國Invitrogen公司,ddPCR Master Mix、Droplet Generation Oil、Droplet Reader Oil購于美國 Bio-Rad公司,DNeasy Plant Mini Kit購于天根生化科技有限公司。
1.2 儀器
Nanodrop ND-1000核酸蛋白定量儀(Thermo Scientific,美國),QX200TMDroplet DigitalTMPCR系統(Bio-Rad,美國,包括微滴生成儀和微滴分析儀),ABI StepOne Plus定量 PCR儀(Applied Biosystem,美國)。
1.3 方法
1.3.1 DNA提取和純化
轉基因大豆標準品使用DNeasy Plant Mini Kit純化,具體步驟見試劑盒說明書。提取的基因組DNA使用Nanodrop ND-1000核酸蛋白定量儀測定純度和濃度(步驟略)。
1.3.2 引物和探針
涉及的PCR擴增引物和探針序列參照GB/T 19495.5—2004《轉基因產品檢測核酸定量PCR檢測方法》,由生工生物工程(上海)股份有限公司合成,具體序列見表1。

表1 引物和探針序列Table 1 Sequences of primers and probes
1.3.3 qPCR反應體系和條件
轉基因大豆GTS40-3-2陽性品提取的DNA含量為1.762×105copies/μL,按照10倍梯度稀釋為:1.762×104copies/μL、1.762×103copies/μL、1.762×102copies/μL、1.762×101copies/μL,用于構建實時熒光定量PCR標準曲線。實時熒光定量PCR反應體系和反應條件參見GB/T 19495.5—2004《轉基因產品檢測核酸定量PCR檢測方法》。每個模板重復3個平行擴增。
1.3.4 ddPCR反應體系和條件
ddPCR反應分為4個步驟:PCR體系配制、微滴生成、PCR擴增和微滴分析。ddPCR擴增體系為20μL,包含10μL 2×ddPCR Master Mix,10μmol/L正向引物和反向引物各1.8μL(2對)、探針0.5μL(2條),DNA模板1μL,H2O 0.8μL。將20μL PCR Mix和70μL微滴生成油加入微滴生成卡中生成微滴,將生成的微滴混合液加入96孔板中,用錫箔紙密封后置入ABI-PCR儀中運行。PCR擴增程序:95℃預變性10 min;94℃變性30 s,59℃退火1 min,40個循環;98℃固化10 min。每個模板重復3個平行檢測。擴增結束后,將96孔板置入微滴讀取儀中讀取信號,有熒光信號的微滴為陽性,無熒光信號的為陰性,軟件統計每個樣品里陽性和陰性微滴數,并使用軟件QuantaSoft Version 1.7分析數據。
1.3.5 實時熒光定量PCR計算轉基因成分的含量
內標基因拷貝數已知,因此首先根據內標基因的熒光數據構建標準曲線,按照公式:轉基因成分的含量=外源基因拷貝數/內標基因拷貝數,計算出轉基因成分的含量[15]。用10%的標準品作為待測樣品進行測定。
1.3.6 ddPCR計算外源基因拷貝數和含量
ddPCR采用直接計數的方法進行拷貝數分析。PCR擴增結束后,認為有熒光信號反應單元中至少包含1個拷貝的目標分子,整體符合泊松分布[2,16-17]。根據數字PCR反應總微滴數和有熒光信號的微滴數以及樣品的稀釋倍數,就可以得到樣本最初的濃度和拷貝數。用10%的標準品作為待測樣品進行測定。
2 結果與分析
2.1 qPCR拷貝數分析結果
根據不同濃度模板測得的熒光值構建標準曲線,如圖1所示。內標基因標準曲線的回歸方程為:C t=-3.2318x+36.631,線性相關系數R2為0.999。外源基因標準曲線的回歸方程為:C t=-3.3251x+37.082,線性相關系數R2為0.998。把待測標準品測得的C t值代入兩個標準曲線中,再通過1.3.5的公式計算出轉基因大豆的含量為10%,與標準品實際轉基因成分的含量一致。

圖1 內標基因和結構特異性基因的標準曲線Fig.1 Standard curves of the endogenous reference gene and structure-specific gene
2.2 ddPCR分析
2.2.1 ddPCR信號識別
有效的微滴生成數目是ddPCR的關鍵,只有生成的微滴數大于8 000時,目標分子的分布才能適用于泊松分布的統計學原理,才能準確計算出目標分子的拷貝數[18-20]。ddPCR通過擴增形成的陽性微滴和陰性微滴如圖2和表2所示。由表2可見,反應中形成的微滴數為10 863—13 859,均大于10 000,滿足ddPCR微滴的分析要求。由圖2可見,陰性微滴和陽性微滴明顯分為兩個區域,ddPCR系統可準確檢測出陽性微滴和陰性微滴的數目。根據每個反應生成的微滴數來看,本研究建立的ddPCR體系微滴生成穩定,具有良好的重復性,能夠用于轉基因大豆GTS40-3-2外源基因拷貝數的分析。
2.2.2 轉基因含量分析
根據軟件讀取的外源基因和內標基因的微滴數,便可計算出外源基因和內標基因的濃度,通過1.3.5的公式,計算出外源基因的拷貝數,分析最低檢測限;同時可計算出待測樣品轉基因成分的含量(表2)。
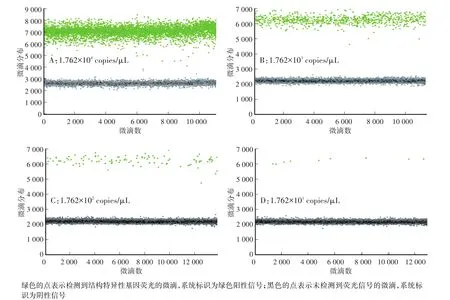
圖2 微滴式數字PCR測定結構特異性基因Fig.2 Detection of structure-specific gene by ddPCR

圖3 微滴式數字PCR測定Lectin基因Fig.3 Detection of Lectin gene by ddPCR
從表2可見,生成的微滴數最少為10 863,最多為13 859,完全滿足ddPCR數據分析的需要,并且可計算出ddPCR方法的最低檢出限約為2個拷貝/(20μL)。在4個稀釋梯度下,均能測出轉基因成分的含量,前3個稀釋梯度的轉基因成分的含量非常接近10%,最后一個稀釋梯度由于模板含量太低,轉基因成分含量的計算值出現一定的偏差。如果外源基因和內標基因的拷貝數關系為1∶1,那么可以從微滴讀取器的界面通過微滴數直接算出轉基因成分的含量。如本研究中,測定外源結構特異性基因的微滴數為78,測定內標基因Lectin的微滴數為774,待測樣品的含量為78/774=10.07%.

表2 ddPCR基因拷貝數分析結果Table 2 Genetic copy number analysis by ddPCR
3 討論
隨著轉基因技術的廣泛應用,如何精準測定轉基因植物、動物的外源基因拷貝數以及計算轉基因成分的含量,已經成為現今轉基因產品檢測技術研究的一個關鍵點[19-20]。傳統的Southern Blot方法分析基因拷貝數所需的周期長、工作量大、準確性較差。qPCR是目前最常用的轉基因成分檢測技術[21],使用qPCR進行外源基因的拷貝數分析必須依賴標準品或者構建標準質粒分子,PCR體系也需要摸索和優化,對未知品濃度的計算依賴于標準曲線的構建,因此是一種相對定量的分析方法,結果并非十分精確[20]。
本研究同時使用qPCR和ddPCR對10%的標準品進行了轉基因成分含量的測定。相比ddPCR方法,qPCR需要更多的模板量和引物,加樣的數量也比較多,容易發生錯誤。采用QX200TMDroplet DigitalTMPCR系統,將兩套引物和探針加入到同一PCR管中,減少了加樣數量,也節省了模板量。在數據分析方面,qPCR方法需要根據熒光數值構建標準曲線,然后通過計算獲得基因的拷貝數和轉基因成分的含量;而ddPCR方法可以在電腦的分析軟件上直接讀取數據,相比之下,ddPCR方法所需時間更短,獲取數據也簡單便捷。此外,ddPCR方法檢測限可以達到2個拷貝/(20μL),ddPCR在線性范圍、檢測極限和定量極限等方面都更勝qPCR。ddPCR方法的優點獲得越來越多的認可[22-24],在臨床方面為癌癥、腫瘤等疾病檢測提供了新的診斷工具,被用于基因拷貝數變化分析、基因突變檢測、基因的分型等,并取得了突破性的進展[25-30]。
在轉基因檢測方面,Corbisier等[11]利用數字PCR分析了玉米種子DNA中外源基因的拷貝數,顯示與利用qPCR方法檢測的結果相同。姜羽等[20]利用ddPCR技術分析了轉基因水稻T1c-19和轉人乳鐵蛋白基因山羊134外源基因的拷貝數,并與qPCR和Southern Blot方法的檢測結果進行比較,結果表明:T1c-19殺蟲晶體蛋白基因的qPCR和ddPCR測定結果比較一致,約為2個拷貝;轉人乳鐵蛋白基因山羊134的qPCR和ddPCR的分析結果比較一致,HLF基因的拷貝數約為1[20]。
本研究通過建立的QX200 ddPCR體系,分析了轉基因大豆GTS-40-3-2外源構建特異性基因。ddPCR不依賴標準曲線,能夠通過不同熒光的微滴數目直接獲得靶基因的拷貝數,并精確計算出轉基因成分的含量;能夠有效節省試劑和樣品、具有更高的靈敏度,是一種精確、靈敏的轉基因生物外源基因拷貝數分析和含量測定的新方法。
[1]HINDSON B,NESSK,MASQUELIER D,et al.High-throughput droplet digital PCR system for absolute quantitation of DNA copy number[J].Analytical Chemisty,2011,83(22):8604-8610.
[2]林彩琴,姚波.數字 PCR技術進展[J].化學進展,2012,24(12):2415-2423.
[3]SANDERSR,HUGGETT JF,BUSHELLCA,et al.Evaluation of digital PCR for absolute DNA quantification[J].Analytical Chemistry,2011,83(17):6474-6484.
[4]ZIMMERMANN B G,GRILL S,HOLZGREVE W,et al.Digital PCR:a powerful new tool for noninvasive prenatal diagnosis[J].Prenatal Diagnosis,2008,28(12):1087-1093.
[5]HINDSON CM,CHEVILLET JR,BRIGGSH A,et al.Absolute quantification by droplet digital PCR versus analog real-time PCR[J].Nature Methods,2013,10(10):1003-1005.
[6]VAUCHERETH,BECLIN C,ELMAYAN T,et al.Transgene-induced gene silencing in plants[J].The Plant Journal,1998,16(6):651-659.
[7]CANKAR K,?TEBIH D,DREO T,et al.Critical points of DNA quantification by Real-time PCR-effects of DNA extractionmethod and sample matrix on quantification of geneticallymodified organisms[J].BMC Biotechnology,2006,6(4):37-52.
[8]柳方方,張玲,王晶,等.數字PCR測定DNA含量及測量結果不確定度評定[J].化學分析計量,2013,22(1):18-22.
[9]BURNSM J,BURRELL A M,FOY C A.The applicability of digital PCR for the assessment of detectionlimits in GMO analysis[J].Eur Food Res Technol,2010,231(3):353-362.
[10]HUA Z S,JEREMY L R,ALLEN E,et al.Multiplexed real-Time polymerase chain reaction on a digital microfluidic platform[J].Analysis Chemical,2011,82(6):2310-2316.
[11]PHILIPPEC,SOMANATH B,LINA P,etal.Absolute quantification of geneticallymodified MON810maize(Zeamays L.)by digital polymerase chain reaction[J].Anal Bioanal Chem,2010,396(6):2143-2150.
[12]PINHEIRO L B,COLEMAN V A,HINDSON CM,et al.Evaluation of a droplet digital polymerase chain reaction format for DNA copy number quantification[J].Anal Chem,2012,84(2):1003-1011.
[13]李亮,隋志偉,王晶,等.基于數字PCR的單分子DNA定量技術研究進展[J].生物化學與生物物理進展,2012,39(10):1017-1023.
[14]胡偉,陳榮華,張晨,等.微滴式數字PCR技術用于生物樣品種屬鑒定和絕對定量[J].法醫學雜志,2014,30(5):342-345.
[15]WENG H,PAN A,YANG L,et al.Estimating number of transgene copies in transgenic rapeseed by Real-time PCR assay with HMG I/Y as an endogenous reference gene[J].Plant Molecular Biology Reporter,2004,22(3):289-300.
[16]洪來法.基于核酸精準檢測的微滴式數字PCR檢測技術[C]//新發傳染病研究熱點研討會論文集.2012.
[17]HINDSON B J,NESSK D,MASQUELIER D A,etal.High-throughput droplet digital PCR system for absolute quantitation of DNA copy number[J].Anal Chem,2011,83(22):8604-8610.
[18]MORISSETD,STEBIH D,MILAVECM,et al.Quantitative analysis of food and feed sampleswith droplet digital PCR[J].PLoSOne,2013,8(5):e62583.
[19]ZHANG D,GUO J.The development and standardization of testingmethods for geneticallymodified organisms and their derived products[J].Journal of Integrative Plant Biology,2011,53(7):539-551.
[20]姜羽,胡佳瑩,楊立桃.利用微滴數字PCR分析轉基因生物外源基因拷貝數[J].農業生物技術學報,2014,22(10):1298-1305.
[21]仇有文,高學軍,張明輝,等.抗除草劑轉基因大豆插入拷貝數及其旁側序列分析[J].生物技術,2011,21(6):31-35.
[22]萬艷,李麗玲,陳小佳.應用實時熒光定量PCR檢測外源基因拷貝數的新方法[J].暨南大學學報(自然科學與醫學版),2009,30(3):310-312.
[23]HAYDEN R,GU Z,INGERSOLL J,etal.Comparison of droplet digital PCR to Real-time PCR for quantitative detection of cytomegalovirus[J].Journal of Clinical Microbiology,2013,51(2):540-546.
[24]SEDLAK R,JEROME K.Viral diagnostics in the era of digital polymerase chain reaction[J].Diagnostic Microbiology and Infectious Disease,2013,75(1):1-4.
[25]WHALE A,HUGGETT J,COWEN S,et al.Comparison of microfluidic digital PCR and conventional quantitative PCR for measuring copy number variation[J].Nucleic Acids Research,2012,40(11):e82.
[26]董蓮華,張玲,姜君,等.大腸桿菌 O157:H7微滴數字 PCR定量方法的建立[J].分析化學研究報告,2015,43(3):319-324.
[27]楊冬燕,楊永存,李浩,等.雙重 PCR鑒別牛、羊肉摻假[J].中國衛生檢驗雜志,2014,24(23):3379-3382.
[28]王珊,李志娟,苗麗.微滴式數字PCR與實時熒光PCR檢測羊肉制品中羊源和豬源性成分方法的比較[J].肉類工業,2015(7):38-41.
[29]王青,劉寶瑞.液滴數字PCR在腫瘤個體化治療方面的應用[J].現代腫瘤醫學,2015,23(12):1771-1774.
[30]吳斌,申翠翠,張晨曦,等.數字RT-PCR檢測鯉春病毒血癥的方法建立與應用[J].中國動物檢疫,2015,32(7):72-76.

