重組酶聚合酶擴增技術快速檢測轉基因玉米Bt11
劉 靜,武國干,吳 瀟,劉 華,王金斌,呂貝貝,蔣 瑋,唐雪明,3,4*
(1上海海洋大學食品學院,上海200090;2上海市農業科學院生物技術研究所,上海201106;3農業部轉基因植物環境安全監督檢驗測試中心(上海),上海201106;4上海市農業遺傳育種重點實驗室,上海201106)
隨著轉基因技術研究與應用的快速發展,轉基因產品檢測技術的研究已成為全球轉基因生物安全管理的重要組成部分。PCR技術在轉基因檢測中有著廣泛的應用,但是常規的PCR檢測需要精密的熱循環儀以及復雜的實驗程序,難以滿足非實驗室環境下轉基因核酸成分快速篩查和檢測的需求。近年來,核酸等溫擴增技術得到了較快的發展。與常規PCR相比,核酸等溫擴增技術不需要熱循環儀器,可在恒溫條件下快速擴增出目的片段,具有簡便、靈敏的特點。目前,主要的等溫擴增技術有環介導等溫擴增技術(Loop-mediated isothermal amplification,LAMP)、滾環擴增技術(Rolling circle amplification,RCA)以及重組酶聚合酶擴增技術(Recombinase ploymerase amplification,RPA)等[1-2]。
RPA技術原理是模擬生物體內DNA復制,由重組酶介導、在37℃下對目標片段進行等溫擴增,實現單分子核酸檢測。RPA最大的特點是不需要通過高低溫度循環來實現核酸解鏈和退火,只需要1對引物即可在37℃恒溫、30 min以內完成模板核酸的擴增,與其他等溫擴增技術相比具有明顯優勢。該技術對硬件設備的要求較低,特別適合用于體外診斷、食品安全、生物安全、農業等領域[3]。目前,該技術在轉基因農產品檢測領域研究的還很少,但極具發展潛力。
全球已經商業化和正在研究的轉基因植物中,大多數與食品和飼料有關,主要有大豆、玉米、油菜、馬鈴薯、番茄等。玉米是世界上重要的糧食作物之一,基因工程技術最早應用在玉米上是開發具有抗蟲和抗除草劑特性的轉基因玉米品系。瑞士先正達公司研發的轉基因玉米Bt11兼具抗蟲及耐除草劑兩種特性,其轉入的耐草丁膦除草劑基因是草丁膦乙酰轉移酶基因(Phosphinothricin acetyl transferase gene,PAT)。本研究基于RPA技術,根據外源基因PAT與載體骨架相連區段,設計上下游引物,特異性擴增轉基因玉米Bt11的邊界序列,擬建立轉基因玉米Bt11的特異性RPA檢測方法。
1 材料與方法
1.1 材料
轉基因玉米Bt11含量5%、1%、0.1%的標準品,轉基因玉米GA21、Bt176、NK603均購自上海宜醇化工科技有限公司;非轉基因玉米購自國內市場。
RPA凝膠檢測試劑盒(TwistAmp DNA Amplification Basic Kits)購自蘇州達麥迪生物醫學科技有限公司;DNA提取試劑盒購自北京康為世紀生物科技有限公司。DNA Ladder Marker購自大連寶生物公司。RPA引物由上海生工生物技術有限公司合成。
1.2 方法
1.2.1 基因組DNA的提取
植物種子粉末作為DNA提取材料,依照康為植物基因組提取試劑盒的操作手冊,進行植物總DNA的提取,并測其濃度,于-20℃保存備用。
1.2.2 引物設計與篩選
引物設計是RPA擴增成功的關鍵因素,要求引物長度在30—35 bp,擴增片段控制在100—200 bp[4-5]。本研究根據轉基因玉米Bt11外源基因PAT與載體骨架相連區段,依照RPA凝膠檢測試劑盒引物設計說明,設計6對引物用于篩選、建立檢測方法(表1)。

表1 RPA方法檢測轉基因玉米Bt11引物序列Table 1 Primers of RPA assay for GM maize Bt11
1.2.3 RPA反應
RPA的反應體系是50μL,向含有凍干酶粉的0.2 mL TwistAmp Basic反應管中加入水合緩沖液(Rehydration Buffer)29.5μL,去離子水 12.2μL,上下游引物各 2.4μL(10μmol/L),植物基因組 DNA 1μL,最后加入醋酸鎂溶液2.5μL(280 mmol/L),充分混勻后將反應試管放在37℃金屬浴中,恒溫反應30 min。取反應產物經酚/氯仿抽提純化后,在2%瓊脂糖凝膠上以120 V恒壓電泳25 min,利用凝膠成像系統進行鑒定[6-7]。
1.2.4 轉基因玉米Bt11特異性驗證
以轉基因玉米品系GA21、Bt176、NK603、Bt11的DNA為模板,驗證所篩選引物檢測Bt11的特異性。
1.2.5 RPA反應時間和溫度優化
時間優化:以轉基因玉米Bt11的DNA為模板,配置反應體系,于37℃金屬浴中反應,控制反應時間分別為5 min、10 min、15 min、20 min、30 min、40 min。反應結束后立即加酚/氯仿抽提純化。
溫度優化:以轉基因玉米Bt11的DNA為模板,配置反應體系,控制反應時間為20 min,反應溫度設定圍繞37℃,以5℃為梯度展開,分別設置為17℃、22℃、27℃、32℃、37℃、42℃、47℃、52℃。反應結束后立即加酚/氯仿抽提純化。
1.2.6 靈敏度試驗
將已測定濃度的各樣品基因組 DNA用滅菌水稀釋成含量分別為1 000拷貝/μL、500拷貝/μL、200拷貝/μL、100拷貝/μL、50拷貝/μL及10拷貝/μL的溶液,作為模板進行RPA擴增,進行絕對檢測限試驗。
轉基因玉米Bt11含量5%、含量1%、含量0.1%的DNA為直接提取所購標準品。用相同濃度的非轉基因玉米DNA將含量0.1%的Bt11玉米DNA稀釋成含量為0.05%、0.01%的DNA樣品,得到5%、1%、0.1%、0.05%、0.01%5個含量梯度的模板,進行RPA擴增,確定其相對檢測限。研究中所有擴增的目標片段均經過測序驗證。
2 結果與分析
2.1 特異性檢測Bt11引物篩選
如圖1所示,引物對F1/R1、F2/R2和F3/R3均未擴增出目的條帶;F4/R4擴增的條帶不明確;F5/R5出現目的條帶,但擴增效率低;F6/R6出現明顯的目的條帶,且擴增效率較高。
2.2 特異性檢測轉基因玉米Bt11驗證
對篩選的特異性引物對F6/R6進行特異性驗證。如圖2所示,不含模板的空白和陰性對照(非轉基因玉米)中均無擴增條帶,表明試驗過程無污染。只有含轉基因玉米Bt11的反應體系中出現188 bp的目的條帶,其他轉基因玉米品系GA21、Bt176、NK603中均無擴增條帶。

圖1 特異性檢測Bt11引物篩選結果Fig.1 Screening of primers for specific detection of GM Bt11
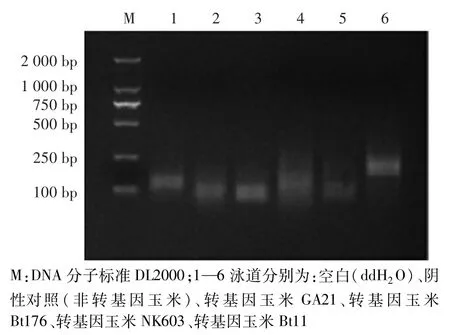
圖2 特異性檢測轉基因玉米Bt11驗證Fig.2 Verification of specific detection of GM maize Bt11
2.3 反應時間優化和溫度優化
如圖3所示,隨著反應時間的延長,目的條帶亮度逐漸增強。反應15 min時,已出現明顯的目的條帶;反應20 min時,目的條帶更亮;反應30 min和40 min,亮度與20 min相似,表明RPA反應在20 min時,就已經大量擴增。
如圖4所示,反應溫度在17℃、22℃與52℃時,無擴增;在27℃與47℃時,有微弱擴增;在32℃、37℃與42℃時均有擴增,37℃與42℃時擴增效率較高。
2.4 靈敏度檢測
分別取1.2.6所述6個濃度梯度的轉基因玉米Bt11 DNA稀釋液1μL作為模板,進行RPA絕對檢測限檢測。如圖5所示,當 DNA含量為1 000拷貝/μL、500拷貝/μL、200拷貝/μL、100拷貝/μL時,均有188 bp的目的條帶;DNA含量為50拷貝/μL及10拷貝/μL時,無目的條帶;表明本試驗建立的RPA特異性檢測Bt11的絕對檢測限約為100拷貝/μL。
將1.2.6中5個百分含量梯度的Bt11作為模板,進行RPA相對檢測限檢測。如圖6所示,當Bt11的含量為5%、1%、0.1%時,出現188 bp的目的條帶;當Bt11含量為0.05%、0.01%時,無目的條帶;表明建立的RPA反應特異性檢測Bt11的相對檢測限約為0.1%。

圖3 反應時間優化Fig.3 Optim ization of reaction time

圖4 反應溫度優化Fig.4 Optim ization of reaction temperature

圖5 絕對靈敏度檢測Fig.5 Detection of absolute sensitivity

圖6 相對靈敏度檢測Fig.6 Detection of relative sensitivity
3 討論
隨著國際轉基因產品商業化推廣的迅猛發展,為了搶占農業生物技術的制高點,我國在“十三五”規劃中重點強調了加強轉基因產品的研究和推進商業化進程。為了保障轉基因產品安全有效的研發和管理,研究和應用新型快速的轉基因產品檢測技術是主管部門用于市場監管和例行監測的重要手段,也是落實我國轉基因產品標識制度的有力技術支撐。
轉基因產品成分的檢測根據檢測的靶標不同分為4個層次,分別是通用元件篩選檢測、基因特異性檢測、構建特異性檢測和品系特異性檢測。其中,構建特異性檢測是在外源基因與載體骨架連接區序列設計引物[8]。本研究根據轉基因玉米Bt11外源基因PAT與載體骨架相連區段設計引物,屬于構建特異性檢測方法。
RPA方法檢測的特異性、靈敏度與引物設計有很大關系,為建立更靈敏的RPA方法,根據不同的轉基因產品的靶標序列,需要進行引物篩選。作為一項新興的技術,目前在農產品檢測中,RPA引物的設計還沒形成可供參考的設計規則,傳統的PCR引物是不適用的,RPA引物比傳統PCR引物長,引物太短會影響重組率和擴增效率[9]。本研究的經驗:RPA引物的長度為30—35個核苷酸較適宜;擴增片段長度為100—200 bp,擴增效果較好;5’端的3—5個核苷酸應當避免聚鳥嘌呤,胞嘧啶在這里是有益的,能促進片段的重組;對于3’端的3個核苷酸來說,鳥嘌呤和胞嘧啶有助于聚合酶的穩定結合,可以提升引物的擴增性能;其他規則類似于普通PCR引物設計。
本研究顯示,RPA技術在37℃下擴增時間為20 min時,就能出現明顯的條帶,并且只需要1對引物。相比較而言,LAMP需要在靶基因6個區域設計4—6種特異引物,且設計方法復雜,60℃下反應60 min左右;而RPA操作簡單,反應更快速,溫度要求低,不需要熱循環儀,只需簡單的恒溫加熱器,更適合應用于條件較簡陋的基層衛生機構及野外條件下轉基因的檢測。本研究首次對轉基因玉米Bt11初步建立了RPA特異性檢測方法,在20min內37℃下就可完成擴增,其絕對檢測限約為100拷貝/μL,相對檢測限約為0.1%,遠低于歐盟國家設定的轉基因最低限量0.9%,靈敏度高,可滿足相關行業的日常檢測需求。
本研究建立的特異性檢測轉基因玉米Bt11的RPA方法,短時間內能實現對目的片段的指數擴增,特異性強、靈敏性高,對環境設備要求低,操作簡便,在轉基因產品成分檢測領域具有廣闊的推廣應用前景。
[1]GURINDER J R,RASHMI C,MONIKA S.Multiplex PCR-based simultaneous amplification of selectable marker and reporter genes for the screening of geneticallymodified crops[J].J.Agric.Food Chem.,2009,57(12):5167-5172.
[2]XU C,LIL,JINW J,et al.Recombinase Polymerase Amplification(RPA)of CaMV-35S Promoter and nos Terminator for Rapid Detection of Genetically Modified Crops[J].International Journal of Molecular Sciences,2014,15:18197-18205.
[3]XIA X M,YU Y X,WEIDMENN M,et al.Rapid Detection of Shrimp White Spot Syndrome Virusby Real Time,Isothermal Recombinase Polymerase Amplification Assay[J].PLOSONE,2014,9(8):e104667.
[4]MEKURIA T A,ZHANG S,EASTWELL K C.Rapid and sensitive detection of little cherry virus 2 using isothermalreverse transcriptionrecombinase polymerase amplification[J].Journal of Virological Methods,2014,205:24-30.
[5]AMER H M,WAHED A A E,SHALABYM A,etal.A new approach for diagnosis of bovine coronavirus using a reverse transcription recombinase polymerase amplification assay[J].Journal of Virological Methods,2013,193:337-340.
[6]MILENA E,WANG Y J,PETER O,et al.Recombinase polymerase amplification assay for rapid detection of Francisella tularensis[J].Journal of Clinical Microbiology,2012,50(7):2234-2238.
[7]KR?LOV K,FROLOVA J,TUDORAN O,et al.Sensitive and Rapid Detection of Chlamydia trachomatis by Recombinase Polymerase Amplification Directly from Urine Samples[J].The Journal of Molecular Diagnostics,2014,16(1):127-135.
[8]LU X B,WU H B,WANGM,etal.Developing amethod of oligonucleotidemicroarray for event specific detection of transgenicmaize(Zeamays)[J].Acta Agron Sin,2009,35(8):1432-1438.
[9]BOYLE D S,MCNERNEY R,TENG L H,et al.Rapid Detection of Mycobacterium tuberculosis by Recombinase Polymerase Amplification[J].PLOSONE,2014,9(8):e103091.

