外源腸道菌和玉米抗性淀粉對小鼠結腸菌群發酵產酸的影響
楊玥熹 俞東寧 方建東 顧振宇
(浙江省食品微生物技術重點實驗室;浙江工商大學食品與生物工程學院1,杭州 310018)(國家級食品工程與質量安全實驗教學中心2,杭州 310018)
隨著生活水平的不斷提高,高脂肪、高熱量食品的攝入量增大,人類健康正受到肥胖、糖尿病等“富貴病”的威脅。已有研究表明,抗性淀粉(resistant starch,RS)能夠抵抗α-淀粉酶分解并且不被小腸吸收[1],具有預防便秘,控制血糖,調節脂類和膽固醇代謝的作用[2]。目前,根據其來源和物理化學性質的不同可將其分為5類:RS1(物理包埋淀粉)、RS2(抗性淀粉顆粒)、RS3(回生淀粉)、RS4(化學改性淀粉)和RS5(淀粉-脂類復合物)[3]。回生淀粉(RS3)是食品中最常見的一類抗性淀粉。淀粉食物經蒸煮后再冷卻,會有部分形成回生淀粉,熱加工工藝條件對回生淀粉的形成量及其結構有影響,壓熱法是制備回生淀粉(RS3)的常用方法[4]。國際市場上現有的幾種抗性淀粉產品價格昂貴,如美國National starch Chemical Corporation、英國Opta food Ingredients、日本Matsutani Chemical Industry Corporation生產的抗性淀粉產品,皆為RS3型抗性淀粉。
近些年,已有研究初步證明,抗性淀粉可在人體大腸中被微生物發酵所利用,產生短鏈脂肪酸[6],進而對腸道微環境起到調節作用。Qin等[7]指出2型糖尿病患者均有中等程度的腸道微生態紊亂,且表現為產丁酸細菌種類的缺乏。由此推測,通過抗性淀粉對腸道菌群的調節,從而控制腸道中短鏈脂肪酸的產量,可對2型糖尿病進行控制。
國內外已經對抗性淀粉的發酵特性進行了一定的研究,包括體外模擬和體內實驗[8-9]。謝濤等[10]利用紅薯抗性淀粉進行體外發酵,發現抗性淀粉能夠選擇性的促進人糞便中乳酸桿菌、雙歧桿菌群、糞鏈球菌群等益生菌的增殖。研究發現,抗性淀粉經腸道菌群的發酵產生短鏈脂肪酸(SCFAs),SCFAs的成分受到抗性淀粉原料種類及發酵菌種的影響[11-13]。在已有的體外模型中,人和動物糞便的懸濁液常被用于模擬腸道環境[14-16],而腸道內容物懸濁液由于取樣不易而較少使用;腸道有益菌,尤其是乳酸菌屬發酵抗性淀粉的研究較多,而有關來源于不同菌屬的混合菌利用抗性淀粉發酵的研究較少。本研究用小鼠結腸內容物懸液模擬結腸環境,研究玉米抗性淀粉體外發酵產酸的特性以及多種外源菌對產酸的影響,進一步推動抗性淀粉與腸道菌群相互調節作用的研究發展,以期為抗性淀粉和益生菌制劑的開發利用提供一定的理論基礎。
1 材料和方法
1.1 材料
玉米抗性淀粉(由高直鏈玉米淀粉制備的RS3型抗性淀粉,抗性淀粉含量≥80%):上海國民淀粉公司。
營養肉湯:青島海博生物技術有限公司;分析純的偏磷酸、磷酸二氫鉀、磷酸二氫鈉、甲酰胺、尿素、冰醋酸、無水乙醇、氫氧化鈉、甲醛、氯化鉀、氯化鈉、甘油、瓊脂糖:杭州匯普化學試劑有限公司。
嗜酸乳桿菌(Lactobacillusacidophilus)、大腸埃希氏菌(Escherichiacoli.)、青春雙歧桿菌(Bifidobacteriumadolescentis)、糞腸球菌(Enterococcusfaecalis):中國普通微生物菌種保藏管理中心,編號分別為1.1878、1.3344、1.2190、1.2024。
1.2 儀器與設備
WH-1微型漩渦混合器:上海瀘西分析儀器廠有限公司;GC-2010氣相色譜儀:日本島津公司;SW-CJ-1FD潔凈工作臺:蘇州安泰空氣技術有限公司;LRH智能生化培養箱:上海一恒科技有限公司。
1.3 實驗方法
1.3.1 小鼠腸道內容物處理
將24只28日齡健康昆明小鼠進行斷頸處理,解剖后將其結腸內容物迅速裝入已滅菌的50 mL帶蓋離心管中并稱重,鼓入高純二氧化碳5 min后密封,置于-20 ℃冰箱內保存。
參照朱翠蘭[17]的方法制備小鼠結腸內容物菌懸液,略有修改。首先根據結腸內容物的質量,用無菌生理鹽水按1:10比例稀釋結腸內容物,旋渦震蕩2 min;之后用4層紗布過濾,所得濾液為小鼠結腸內容物菌懸液。依照表1中的條件,分別用LBS瓊脂培養基、BBL瓊脂培養基、紫紅膽鹽葡萄糖培養基、腸球菌培養基測定小鼠結腸內容物懸液中乳酸桿菌、雙歧桿菌、腸桿菌和腸球菌的數量。
1.3.2 菌種的活化與培養
將保存在甘油中的嗜酸乳桿菌、大腸埃希菌埃希氏菌、青春雙歧桿菌、糞腸球菌分別以2%(V/V)的接種量接種到相應的培養基中,培養條件見表1。待菌種活化3次完全恢復活力后,進行活菌計數并用于后續實驗。
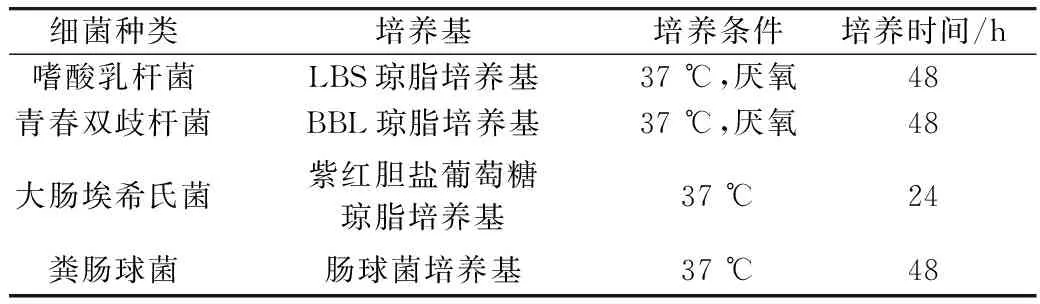
表1 細菌培養基種類及其培養條件
1.3.3 活菌計數
在超凈工作臺中,吸取0.5 mL經活化后的菌懸液加入到4.5 mL的無菌生理鹽水中,搖勻,作10-1~10-7稀釋梯度,用移液槍移取100 μL稀釋液,分別用無菌的涂布棒均勻地涂布于選擇性培養基上,并在相應條件下培養,培養條件如表1所示。取長有20~200個菌落的平板進行計數及統計分析。
1.3.4 體外模擬發酵
根據表2所示實驗設計配制含有玉米抗性淀粉的肉湯培養基,分裝于250 mL錐形瓶中,每瓶分裝量100 mL。滅菌后鼓入高純CO2氣體,20 min后旋緊橡膠塞蠟封。用無菌注射器將1 mL小鼠結腸內容物懸液(處理方法見1.3.1)注入各瓶培養基中,再依表2實驗設計用無菌注射器注入外源菌懸液,搖勻后用注射器吸取5 mL的發酵液作為發酵0 min的檢測樣本,之后放入37 ℃厭氧培養箱中,以80~100 r/min速度振搖,在6、12、18、24、30 h時吸取發酵液5 mL作為檢測樣本,用于短鏈脂肪酸(SCFAs)含量的測定。
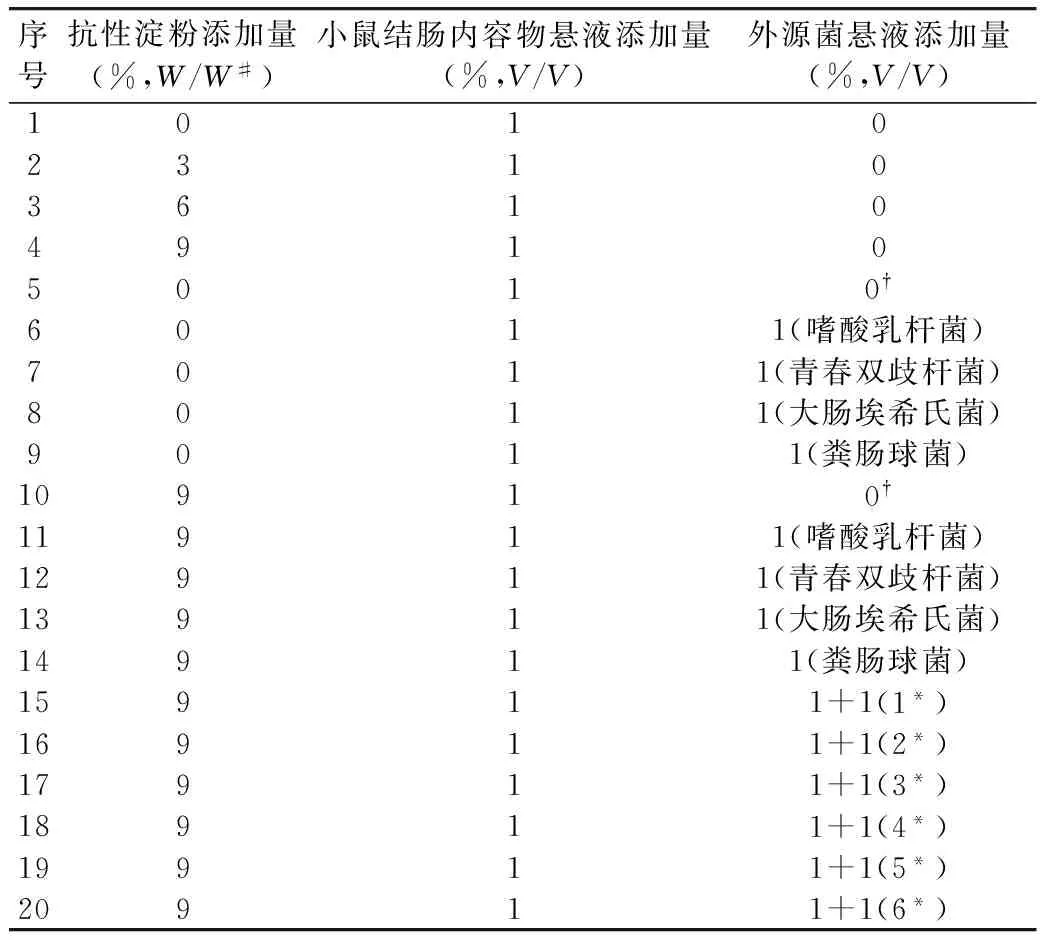
表2 體外模擬發酵實驗設計
注:W/W#:玉米抗性淀粉干重/營養肉湯培養基干重;0?:未注入外源菌懸液而注入1 mL無菌蒸餾水;1*:嗜酸乳桿菌+青春雙歧桿菌;2*:嗜酸乳桿菌+大腸埃希氏菌;3*:嗜酸乳桿菌+糞腸球菌;4*:青春雙歧桿菌+大腸埃希氏菌;5*:青春雙歧桿菌+糞腸球菌;6*:糞腸球菌+大腸埃希氏菌。
1.3.5 短鏈脂肪酸(SFCAs)含量測定
樣品預處理:將0.2 g樣品和0.2 mL正己酸加入到1.6 mL無菌蒸餾水,混勻后加入0.4 mL的硫酸(質量分數約50%)和2 mL的無水乙醚,并放置于搖床上混勻30 min,接著3 000 r/min離心5 min。加入無水CaCl2除去殘留水分,移取上清液用于氣相色譜(GC)測定。GC測定參照連曉蔚[18]的方法,略有修改。檢測器為氫火焰檢測器(FID);色譜柱為DB-FFAP;載氣為N2,分流比為10:1,流速為2 mL/min;燃燒爐溫度為240 ℃,進樣量為2 μL;升溫程序:起始溫度120 ℃保持5 min,以10 ℃/min升溫至250 ℃并保留1 min。采用外標法,乙酸標準曲線為:Y=14.03X-0.405;丙酸標準曲線為:Y=30.37X+0.784;丁酸標準曲線為:Y=45.66X+2.048;上述標準曲線中Y代表峰面積,X代表短鏈脂肪酸濃度(mmol/L),線性擬合顯示R2>0.999。
1.3.6 數據處理
實驗數據均是3次平行實驗的平均值,采用SPSS 21.0軟件對數據進行顯著性分析和OriginPro 9.0軟件作圖。
2 結果與分析
2.1 活菌計數
采用梯度稀釋平板涂布法測定的活化后用于培養基注射的外源菌液中的活菌數,平均測定3次,計算平均值,見表3。
小鼠結腸內容物懸液中,乳酸桿菌為(4.36±0.04)×108CFU/mL,雙歧桿菌為(1.54±0.02)×109CFU/mL,腸桿菌為(1.62±0.01)×108CFU/mL,腸球菌為(8.12±0.03)×107CFU/mL。4種外源菌液中活菌數都顯著高于小鼠結腸內容物懸液中相應的各類細菌的活菌數。

表3 外源菌液的活菌計數
2.2 抗性淀粉含量對小鼠結腸菌群發酵產酸的影響
由圖1a、圖1b和圖1c中可見,添加3%的抗性淀粉后,相比于未添加抗性淀粉的組(實驗設計見表2中序號1~4),在發酵的各時間點,乙酸、丙酸和丁酸的含量都有顯著性(P<0.05)的增長。隨著抗性淀粉含量的增加,短鏈脂肪酸的產量也提高。在發酵12 h后,添加9%抗性淀粉的組與添加3%、6%抗性淀粉的組相比,乙酸、丙酸和丁酸的含量都有顯著性(P<0.05)差異。添加3%和6%抗性淀粉的組在發酵18 h后,乙酸、丙酸和丁酸的含量沒有顯著性(P>0.05)差異。添加9%抗性淀粉的組,發酵18 h后丁酸仍有顯著增長(P<0.05)。相較于3種短鏈脂肪酸,各取樣時間點,乙酸的含量要高于丙酸和丁酸的含量。在12 h前,丙酸的含量要高于丁酸,而在發酵后期丁酸的含量要高于丙酸。說明抗性淀粉能夠被腸道微生物利用,發酵產短鏈脂肪酸,與汪婕等[19]探究結果相似。Haenen等[20]給公豬喂養抗性淀粉后,發現公豬的腸道微生物變化具有顯著性差異,其中丁酸的產生菌增殖率有明顯的增加,因而腸道中丁酸的含量增加。
2.3 單一外源菌對小鼠結腸菌群發酵產酸的影響
由圖2a、圖2b和圖2c中可見,在肉湯培養中添加各實驗外源菌后(實驗設計見表2中序號5-9,序號5為空白組),在各取樣時間點與空白組相比,丙酸的含量沒有顯著性變化(P>0.05);添加大腸埃希氏菌組的乙酸含量在6、12 h顯著下降(P<0.05),添加糞腸球菌組的乙酸含量在6 h顯著下降(P<0.05);添加大腸埃希氏菌組的丁酸含量在各測試時間點都有顯著下降(P<0.05),添加嗜酸乳桿菌組的丁酸含量在6、12、18、30 h也有顯著下降(P<0.05)。
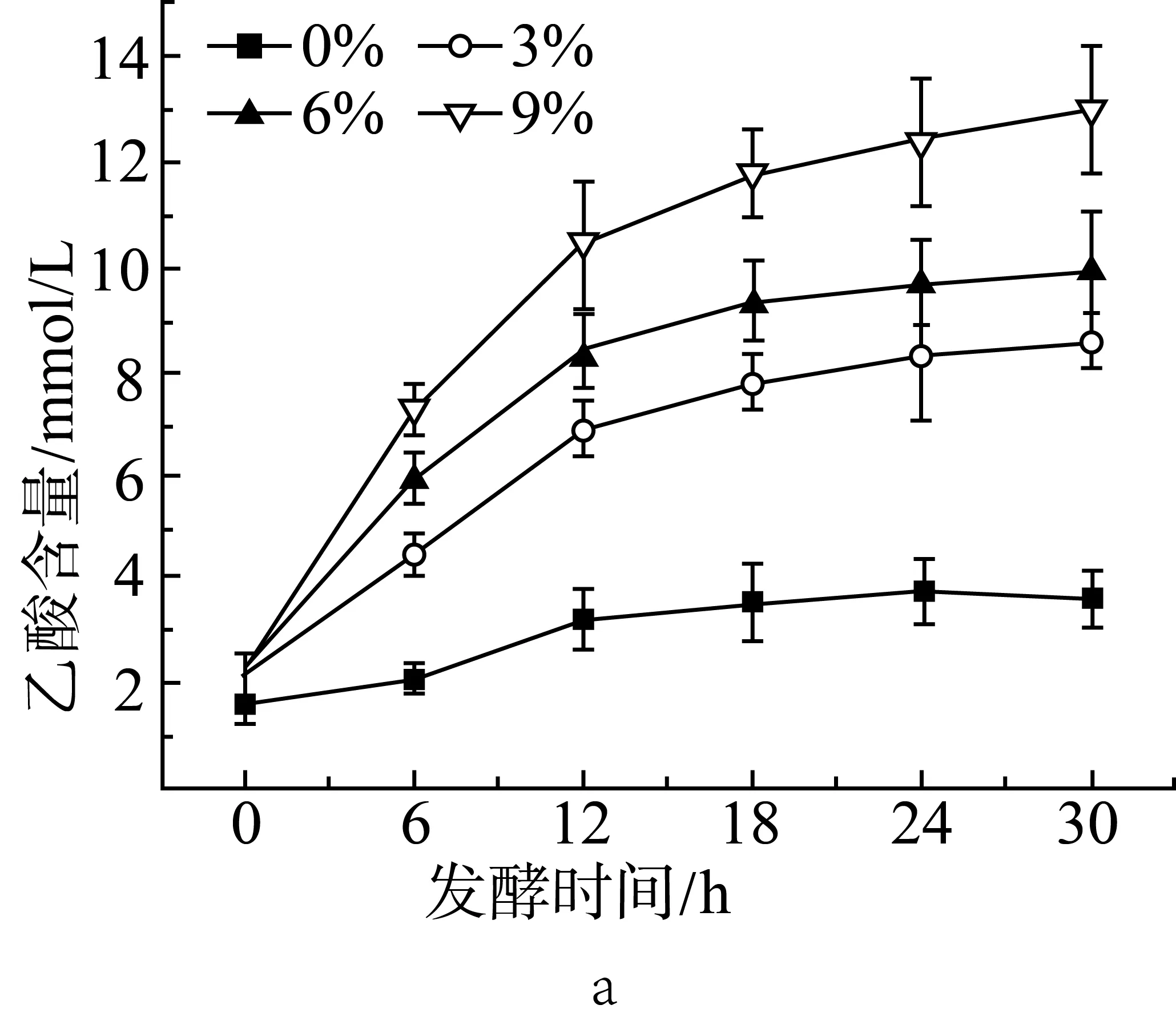
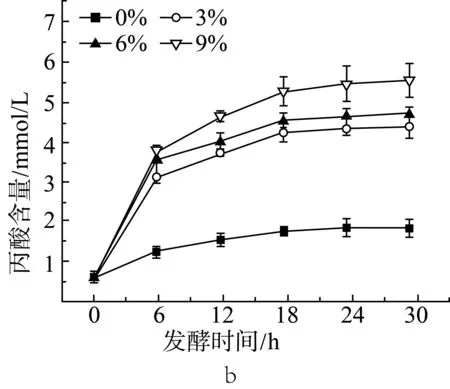
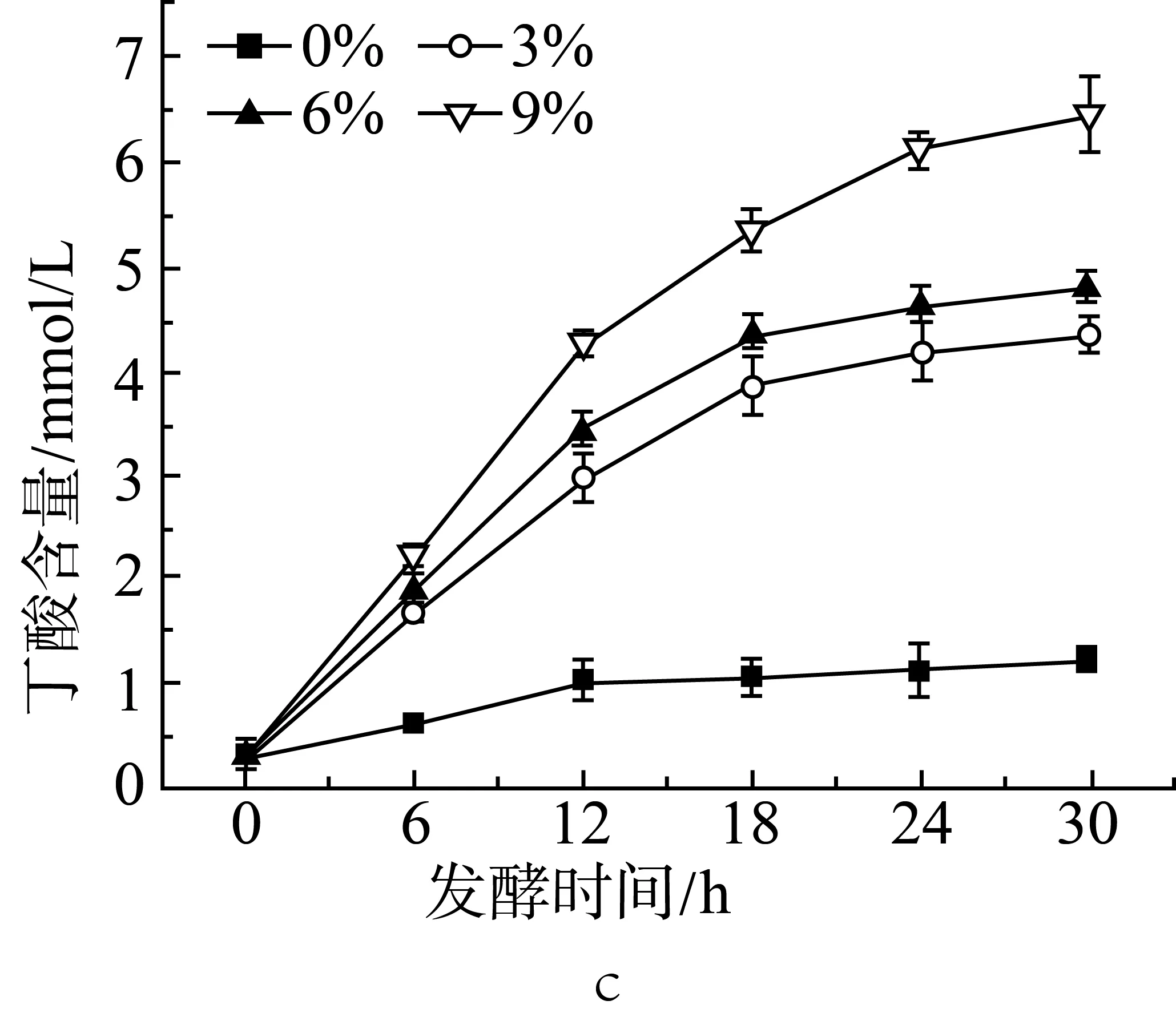
圖1 抗性淀粉添加量對小鼠結腸菌群發酵產乙酸(a)、丙酸(b)和丁酸(c)的影響
由此可見,單獨添加本實驗中的某一種外源菌并不能顯著提升發酵產物中短鏈脂肪酸的含量,甚至產生反效果。
2.4單一外源菌對小鼠結腸菌群利用抗性淀粉發酵產酸的影響
為了研究外源菌對于小鼠結腸菌群利用抗性淀粉發酵產酸的影響,在含抗性淀粉的培養基中加入小鼠結腸懸濁液后,再加入不同的單一外源菌種(實驗設計見表2中序號10-14)。如圖3a所示,未添加外源菌的抗性淀粉在模擬結腸環境中單獨發酵,產生的乙酸含量最高可達12.96 mmol/L,但是當發酵體系中添加嗜酸乳桿菌后,乙酸的含量顯著增加,最高時為24.26 mmol/L。與未添加外源菌組相比,在添加青春雙歧桿菌、大腸埃希氏菌和糞腸球菌后,發酵產物中的乙酸含量變化不大。朱翠蘭[17]也研究發現通過外援乳酸菌和人體的糞便共同體外模擬腸道發酵也有相同影響產生短鏈脂肪酸的情況,添加乳酸桿菌能夠促進乙酸含量的增加。
如圖3b所示,未添加外源菌的抗性淀粉在模擬結腸環境中單獨發酵,產生的丙酸含量最高可達5.19 mmol/L。與未添加外源菌組相比,當發酵體系中添加雙歧桿菌或糞腸球菌后,丙酸的含量顯著增加(P<0.05),最高時分別達可9.57和9.14 mmol/L;在添加嗜酸乳桿菌時,發酵產物中的丙酸含量在6、12 h沒有顯著性變化;18 h及以后有顯著性的增長。在添加大腸埃希氏菌的發酵體系中,產生的丙酸含量與未添加外源菌組相比,沒有顯著性差異(P>0.05)。綜上可知,青春雙歧桿菌和糞腸球菌能夠協同腸道微生物發酵玉米抗性淀粉產生丙酸,而其他的外源菌不具有此種發酵特性。
如圖3c所示,未添加外源菌的抗性淀粉在模擬結腸環境中單獨發酵,產生的丁酸含量最高可達6.44 mmol/L。但是當發酵體系中添加雙歧桿菌和糞腸球菌后,丁酸的含量增加,最高時分別為9.81 mmol/L和7.89 mmol/L。與未添加外源菌組相比,添加嗜酸乳桿菌后,發酵產物中的丁酸含量在發酵6 h后顯著增加,在12 h后減少,且在12、18 h時有顯著性差異(P<0.05)。添加大腸埃希氏菌的發酵體系中產生的丙酸含量顯著低于未添加外源菌組,在18 h后其含量約外源菌組的50%。因此,可以得知青春雙歧桿菌和糞腸球菌能夠協同腸道微生物發酵玉米抗性淀粉產生丁酸,而其他的外源菌不具有此種發酵特性。但是其中大腸埃希氏菌作為發酵優勢菌時會抑制腸道微生物發酵抗性淀粉產丁酸。
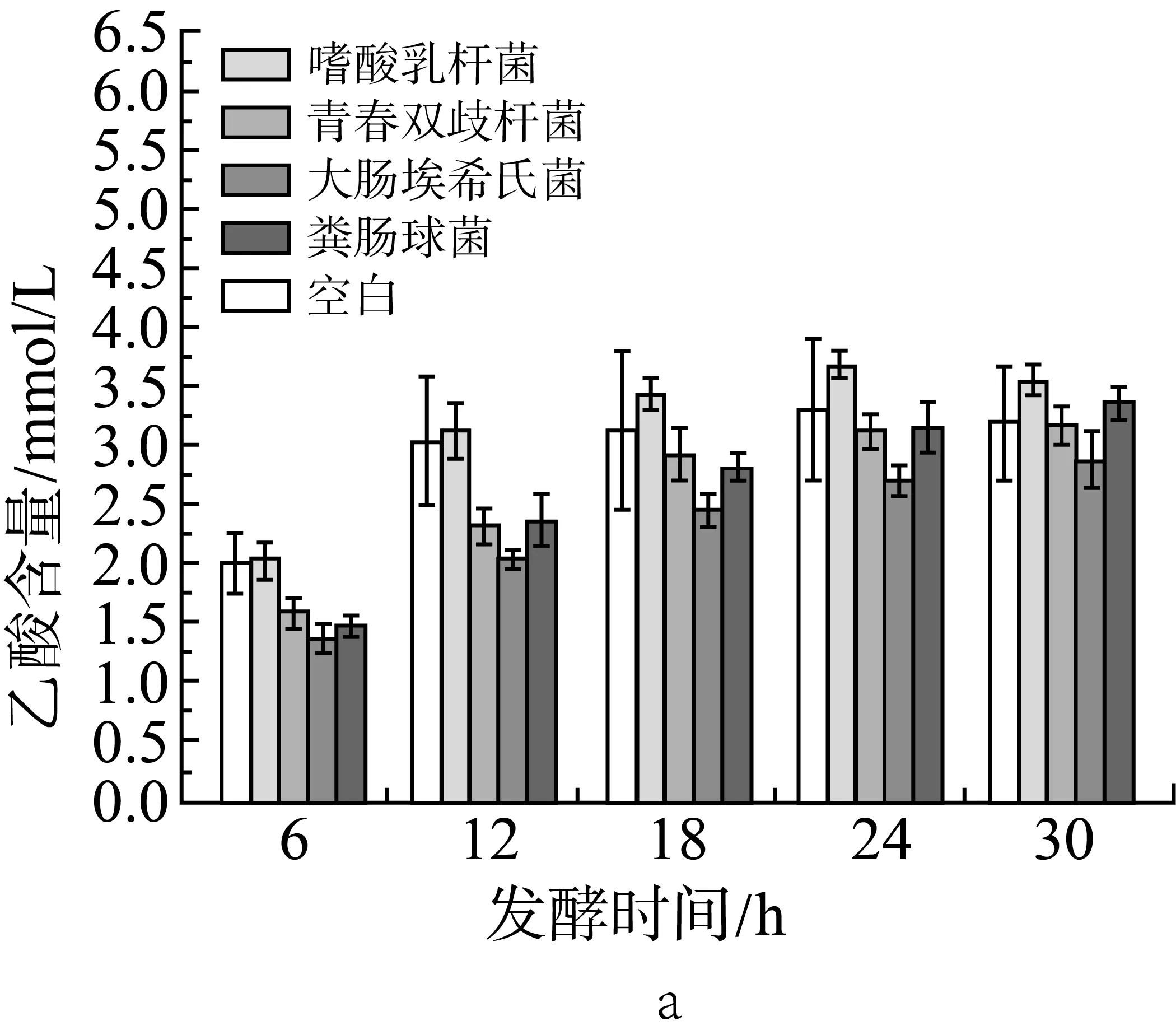
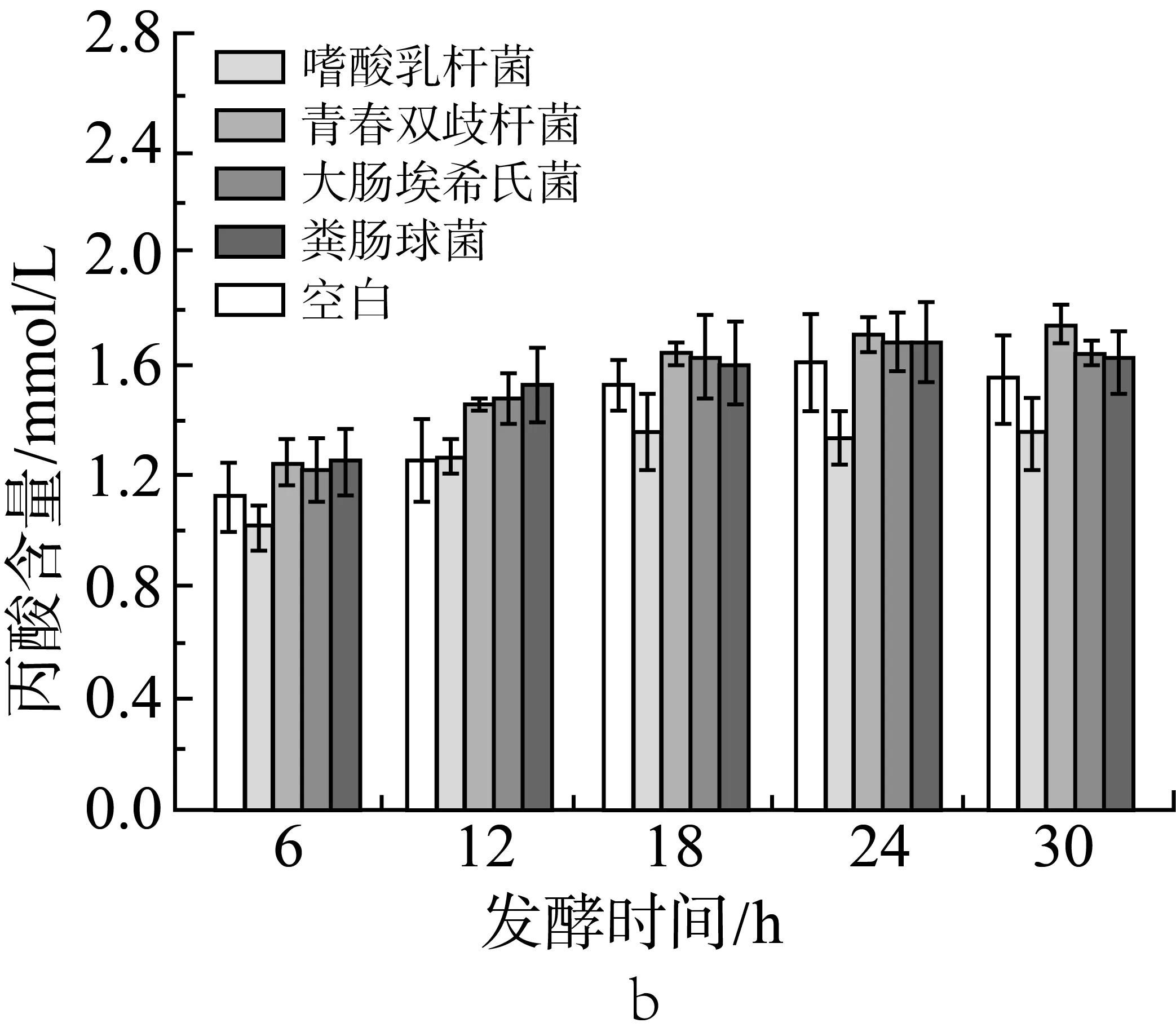
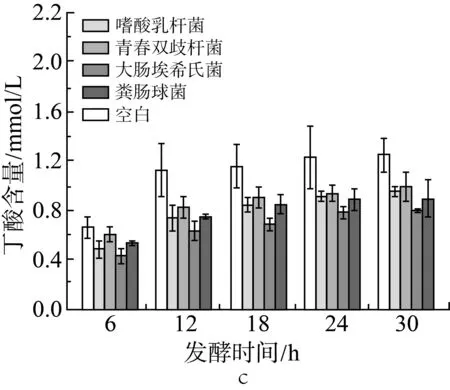
圖2 單一外源菌對小鼠結腸菌群發酵產乙酸(a)、丙酸(b)和丁酸(c)的影響
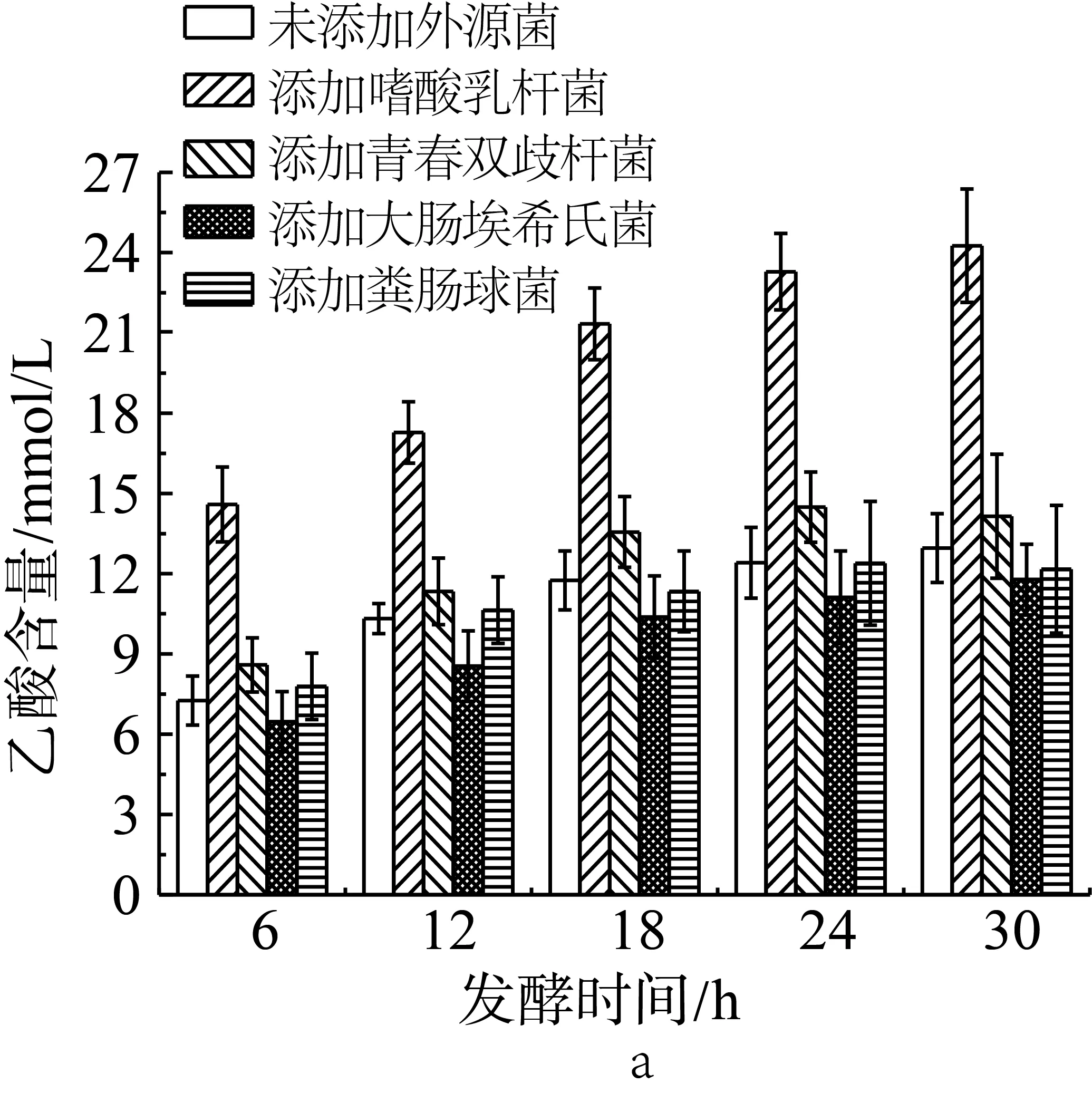
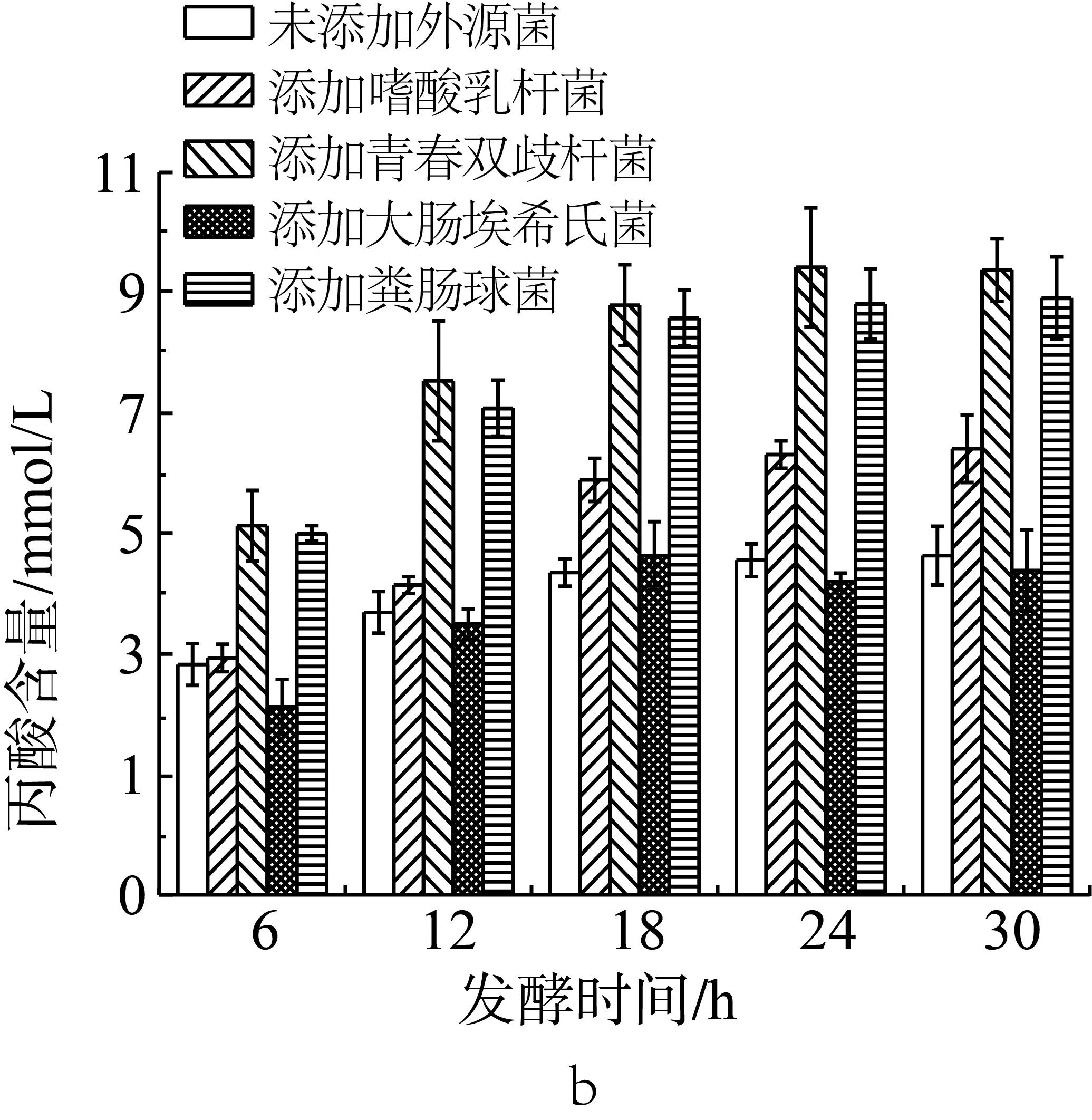

圖3 單一外源菌對小鼠結腸菌群利用抗性淀粉發酵產乙酸(a)、丙酸(b)和丁酸(c)的影響
2.5混合外源菌對小鼠結腸菌群利用抗性淀粉發酵產酸的影響
腸道微生物是一個包含種類繁多的微生物的復雜生態系統,不同菌種之間相互制約,相互依存或是相互促進,對于相同的發酵底物,通過不同的菌群發酵,發酵產物組成將會發生變化。因此,本研究嘗試將兩種不同的外源菌混合添加到抗性淀粉發酵體系中,檢測發酵產物中短鏈脂肪酸(乙酸、丙酸、丁酸)的變化(實驗設計見表2中序號15-20)。如圖4a所示,在發酵體系中嗜酸乳桿菌和青春雙歧桿菌混合添加時,其發酵產物乙酸含量最高為29.86 mmol/L,對比圖2a可得,明顯高于嗜酸乳桿菌單一發酵時乙酸的產量;嗜酸乳桿菌與大腸埃希氏菌,或是嗜酸乳桿菌和糞腸球菌混合添加時,乙酸含量相比于嗜酸乳桿菌單一發酵時略有下降,但差異不顯著;相比于大腸埃希氏菌或糞腸球菌單獨發酵時有顯著提高(P<0.05)。其他混合菌群相對于各自單獨添加時,乙酸產量沒有顯著的變化。因此可以推斷,青春雙歧桿菌與嗜酸乳桿菌在發酵抗性淀粉產乙酸時有一定的協同作用。
由圖4b和圖4c可知,在體外發酵體系中添加青春雙歧桿菌和嗜酸乳桿菌,或是青春雙歧桿菌和糞腸球菌時,其發酵產物丙酸含量最高值分別為13.45 mmol/L和12.12 mmol/L,顯著高于青春雙歧桿菌單一發酵時丙酸含量的最高值(P<0.05),增加了大約40.5%和26.6%;青春雙歧桿菌和嗜酸乳桿菌混合后其發酵產物丁酸含量也顯著性高于青春雙歧桿菌單一發酵時產生的量(P<0.05),青春雙歧桿菌和糞腸球菌混合后丁酸的含量高青春雙歧桿菌單一發酵時產生的量,但增幅有限。嗜酸乳桿菌和糞腸球菌組合發酵時丙酸和丁酸含量比嗜酸乳桿菌單獨發酵時高,比糞腸球菌單獨發酵時低。相較于嗜酸乳桿菌、青春雙歧桿菌單一菌種發酵,當嗜酸乳桿菌、青春雙歧桿菌分別與大腸埃希氏菌組合后,在各時間點的丙酸和丁酸的產量都呈現顯著性下降(P<0.05),下降最明顯的是嗜酸乳桿菌和大腸埃希氏菌組合,其丁酸產量低至大腸桿菌單獨發酵產酸的水平;青春雙歧桿菌與大腸埃希氏菌組合后丁酸含量的下降幅度大于丙酸含量的下降幅度。糞腸球菌與大腸埃希氏菌組合后,在各測試時間點較未糞腸球菌發酵時的丙酸產量有顯著性下降(P<0.05),丁酸含量有也有下降但并不顯著(P>0.05)。由此可以推斷,青春雙歧桿菌與嗜酸乳桿菌或糞腸球菌發酵在產丙酸、丁酸能力上有一定的協同作用,而大腸埃希氏菌會抑制其他菌種發酵產丙酸和丁酸,抑制效果依其他菌種不同而不同,對嗜酸乳桿菌的抑制效果最強。
3 結論
在通過營養肉湯和小鼠結腸菌懸液構建的模擬結腸環境中,添加玉米抗性可以顯著提升乙酸、丙酸和丁酸的生成量。抗性淀粉體外發酵產酸模式與腸道菌群種類相關,嗜酸乳桿菌、青春雙歧桿菌和糞腸球菌在一定程度上能夠促進發酵體系中短鏈脂肪酸的產生,而大腸埃希氏菌則會抑制發酵體系中乙酸、丙酸和丁酸的產生。上述菌種在兩兩組合后,又顯示出不同的作用效果。嗜酸乳桿菌、青春雙歧桿菌產乙酸、丙酸和丁酸的協同增效作用最為明顯;大腸埃希氏菌顯示出較強的抑制產酸作用,尤其在和嗜酸乳桿菌組合時。
綜上可見,通過調節腸道菌群可以調控抗性淀粉發酵產短鏈脂肪酸,嗜酸乳桿菌和青春雙歧桿菌組合在發酵玉米抗性淀粉產乙酸、丙酸和丁酸顯示出較好地協同作用。進一步還需要還需通過研究菌群結構動態變化、菌群來源性差異等,解釋不同菌種或菌種組合間發酵抗性淀粉產生短鏈脂肪酸差異的原因,以推動抗性淀粉和益生菌類功能食品的開發及效用的提升。
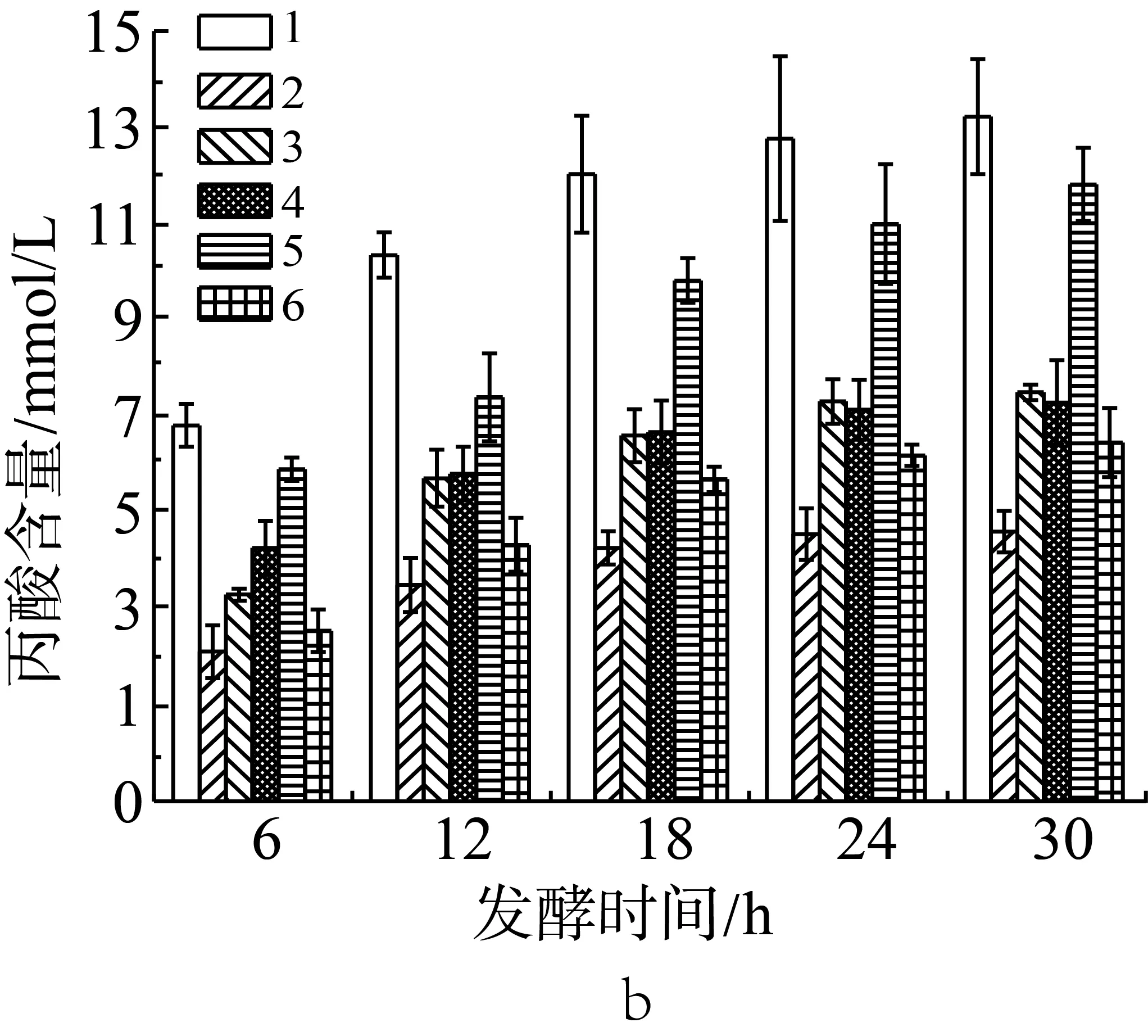
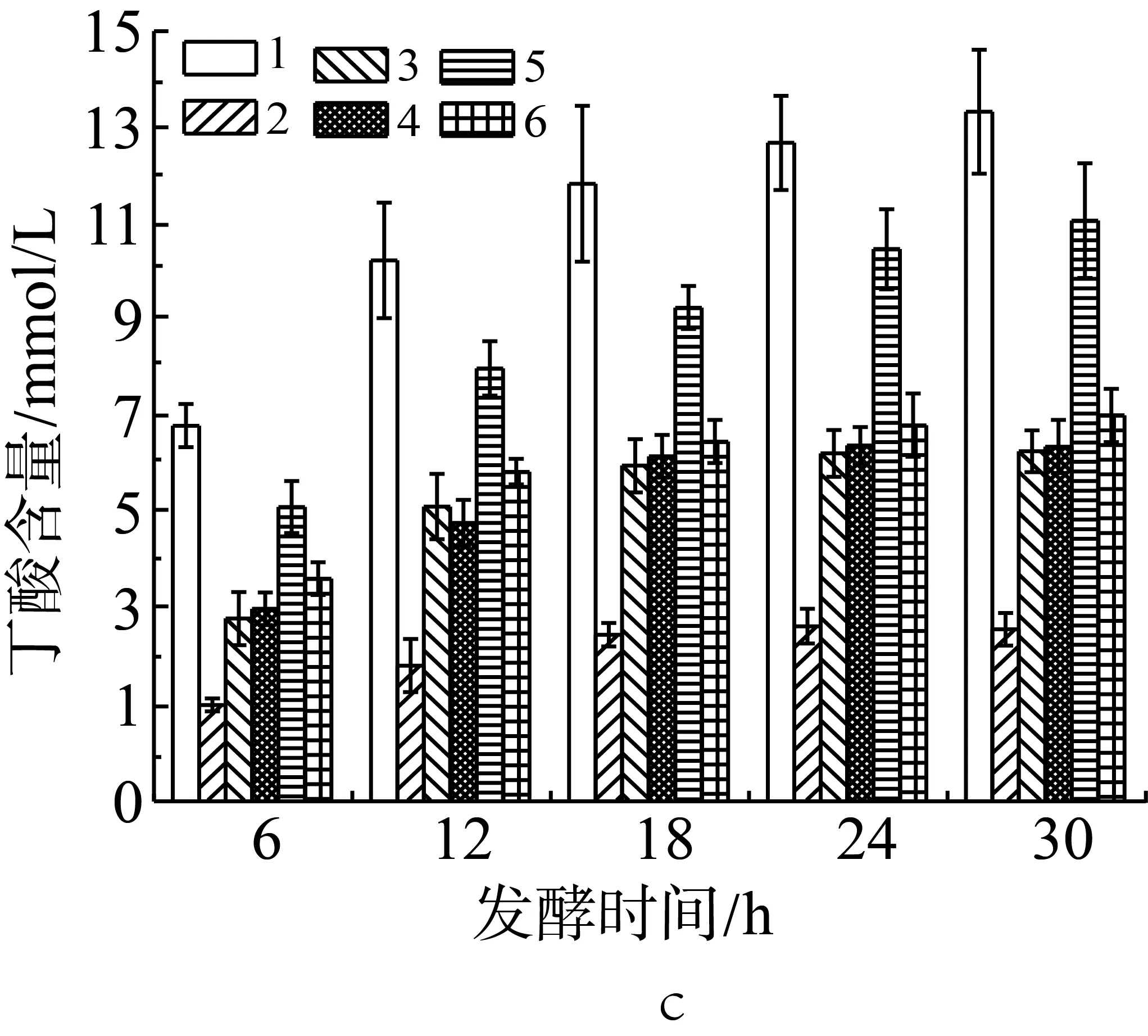
注:1:嗜酸乳桿菌+青春雙歧桿菌;2:嗜酸乳桿菌+大腸埃希氏菌;3:嗜酸乳桿菌+糞腸球菌;4:青春雙歧桿菌+大腸埃希氏菌;5:青春雙歧桿菌+糞腸球菌;6:糞腸球菌+大腸埃希氏菌。
圖4 混合外源菌對小鼠結腸菌群利用抗性淀粉發酵產乙酸(a)、丙酸(b)和丁酸(c)的影響
[1]ENGLYST H N,CUMMINGS J H.Digestion of the polysaccharides of some cereal foods in the human small intestine[J].American Journal of Clinical Nutrition,1985,42(5):778-87
[2]FUENTES-ZARAGOZA E,RIQUELME-NAVARRETE M J,SáNCHEZ-ZAPATA E,et al.Resistant starch as functional ingredient:a review[J].Food Research International,2010,43(4):931-942
[3]朱平,孔祥禮,包勁松.抗性淀粉在食品中的應用及功效研究進展[J].核農學報,2015,29(2):327-336
ZHU P,KONG X L,BAO J S.Current progress on the applications and health benefits of resistant starch in foods[J].Acta Agriculturae Nucleatae Sinica,2015,2:327-336
[4]REDDY C K,HARIPRIYA S,MOHAMED A N,et al.Preparation and characterization of resistant starch III from elephant foot yam(Amorphophallus paeonifolius)starch[J].Food Chemistry,2014,155(5):38-44
[5]SANKHON A,YAO W R,WANG H Y,et al.The yield of improvement of resistant starches from Africa Locust(Parkia biglobosa):the influence of heat-moisture,autoclaving-cooling and cross-linking treatments[J].American Journal of Food Technology,2012,7(7):386-397
[6]TAN Z N,ROSMA A,NAPISAH H,et al.Characteristics of metroxylon sagu resistant starch type III as prebiotic substance[J].Journal of Food Science,2015,80(4):H875-H882
[7]CHATELIER E L,NIELSEN T,QIN J,et al.Richness of human gut microbiome correlates with metabolic markers[J].Nature,2013,500(7464):541-546
[8]MAHADEVAMMA S,SHAMALA T R,THARANATHAN R N.Resistant starch derived from processed legumes:in vitro and in vivo fermentation characteristics[J].International Journal of Food Science and Nutrition,2004,55(5):399-405
[9]VINCENT Lebet,EVA Arrigoni,RENATO Amadò.Measurement of fermentation products and substrate disappearance during incubation of dietary fibre sources with human faecal flora[J].Academic Press,1998,31(5):473-479
[10]謝濤,張淑遠,王美桂,等.重結晶紅薯淀粉體外消化前后益生作用與結構變化[J].農業機械學報,2013,44(8):202-206
XIE T,ZHANG S Y,WANG M G,et al.Probiotic functions and structure changes of recrystallized sweet potato starch before and after in vitro digestion[J].Transactions of the Chinese Society of Agricultural Machinery,2013,44(8):202-206
[11]ZHANG H Z,XU X M,JIN Z Y.Fermentation characteristics of resistant starch from maize prepared by the enzymatic method in vitro[J].International Journal of Biological Macromolecules,2012,51(5):1185-8
[12]HEDEMANN M S,KNUDSEN K E B.Resistant starch for weaning pigs:Effect on concentration of short chain fatty acids in digestion and intestinal morphology[J].Livestock Science,2007,108(1):175-177
[13]龐秋芳,彭喜春,歐仕益,等.直腸菌群對兩種抗性淀粉的體外發酵研究[J].食品工業科技,2011(4):148-151
PANG Q F,PENG X C,OU S Y,et al.Study on fermentation of two resistant starch by colon microflora in vitro[J].Science and Technology of Food Industry,2011(04):148-151
[14]王志凡,楊秀琳,陳旺盛,等.抗性淀粉對飲食誘導肥胖大鼠排便狀況及腸道菌群的影響[J].動物營養學報,2016,28(5):1626-1632
WANG Z F,YANG X L,CHEN W S,et al.Effects of resistant starch on defecation and intestinal microflora of diet induced obesity rats[J].Chinese Journal of Animal Nutrition,2016,28(5):1626-1632
[15]謝濤,曾紅華,汪婕,等.4種抗性淀粉的益生作用及結構變化[J].中國糧油學報,2014,29(10):23-27
XIE T,ZENG H H,WANG J,et al.Probiotic functions and structural changes of 4 resistant starches[J].Journal of the Chinese Cereals and Oils Association,2014,29(10):23-27
[16]彭真福,陳慶發,白永亮,等.雙歧桿菌對香蕉抗性淀粉的體外發酵研究[J].食品科技,2015(1):2-5
PENG Z F,CHEN Q F,BAI Y L,et al.Fermentation of banana resistant starch by bifidobacterium in vitro[J].Food Science and Technology,2015(1):2-5
[17]朱翠蘭.玉米抗性淀粉的模擬腸道發酵產酸與外源乳酸菌關聯性[D].哈爾濱:東北農業大學,2012
ZHU C L.Acid production of crude maize resistant starch in the simulated fermentation in vitro and the Impacts of some exogenous lactic acid bacteria added[D].Haerbin:Northeast Agricultural University,2012
[18]連曉蔚.腸道菌群利用幾種膳食纖維體外發酵產短鏈脂肪酸的研究[D].廣州:暨南大學,2011
LIAN X W.Gut microbiota in vitro fermenting destarched dietary fiber to produce SCFA[D].Guangzhou:Jinan University,2011
[19]汪婕,謝濤.錐栗抗性淀粉消化前后的益生作用及結構變化研究[J].食品工業科技,2014,35(13):61-65
WANG J,XIE T.Probiotic functions and structural changes of castanea henryi resistant starch before and after digestion[J].Science and Technology of Food Industry,2014,35(13):61-65
[20]HAENEN D,SOUZAD S C,ZHANG J,et al.Resistant starch induces catabolic but suppresses immune and cell division pathways and changes the microbiome in the proximal colon of male pigs[J].Journal of Nutrition,2013,143(12):1889-1898.

