辣椒抗蚜品種‘豬大腸’的抗蚜性遺傳分析
梁曉 伍春玲 陳青
(中國熱帶農業科學院環境與植物保護研究所 農業部熱帶作物有害生物綜合治理重點實驗室 海南省熱帶作物病蟲害生物防治工程技術研究中心 海南省熱帶農業有害生物監測與控制重點實驗室,海口 571101)
蚜蟲的種類很多,有菜蚜、棉蚜、豆蚜、麥蚜等,均屬同翅目蚜科[1]。當前辣椒生產中為害的蚜蟲主要為桃蚜(Myzus persicae(sulzer))[2]。桃蚜不僅能以成、若蚜群集于寄主的葉背、頂芽、嫩莖等處刺吸汁液,直接造成寄主葉片皺縮或卷曲,被害植株生長緩慢甚至停止等,而且是一種非常重要的媒介昆蟲,能傳播多種病毒,導致病毒病的發生與流行,造成作物嚴重減產[3-4]。隨著瓜菜生產的快速發展,桃蚜在辣椒、瓜類等作物上的發生與危害也日趨嚴重,嚴重制約了瓜菜高效、優質、高產栽培與生產。目前,瓜菜生產中對于桃蚜的防治仍依賴于化學防治,但化學防治過程中存在諸多問題,如施藥技術落后帶來的農藥的有效利用率不足、農藥的使用頻率及使用劑量不斷加大、劇毒、高毒農藥的盲目使用等,必將導致害蟲產生抗藥性、農產品質量安全受到威脅、產地生態環境惡化等嚴重問題[5]。因此,尋求安全高效的防治措施成為辣椒產業可持續發展亟需解決的重大問題。
利用作物抗蟲性防治害蟲被認為是最經濟、有效、簡便的措施[6],其中抗蟲品種的篩選和培育是作物抗蟲性實際應用的最主要手段[7]。在辣椒抗蚜品種的研究方面,Frantz等[8]從50份辣椒種質中篩選出6份抗桃蚜種質。Bosland 和Ellington[9]測定比較了抗蚜和感蚜辣椒種質的生理生化差異,發現非選擇性的排拒作用(Nonpreference antixenosis)是辣椒種質產生抗性的主要機制之一。作物品種的抗蟲性首先表現在遺傳特性上,是作物抗蟲遺傳特性、害蟲危害遺傳特性與環境等多種因素相互作用的結果[10]。了解作物的抗蟲遺傳特性對選育抗蟲品種具有重要的指導意義,然而迄今為止尚未見辣椒抗蚜性遺傳分析的相關報道。本研究將抗蚜辣椒品種‘豬大腸’與感蚜辣椒品種‘大羊角椒’配置組合,通過F1代抗性鑒定和F2代分離群體抗感分離比例分析,以期明確其抗蚜基因的組成及遺傳特點,并測定分離后代辣椒群體在蚜蟲為害前后過氧化物酶(Peroxide enzyme,POD)和多酚氧化酶(Polyphenol oxidase,PPO)的活性差異,為抗蚜基因標記奠定基礎,為辣椒抗蚜新品種選育提供理論依據。
1 材料與方法
1.1 材料
桃蚜采自中國熱帶農業科學院環境與植物保護研究所害蟲研究室盆栽煙草植株。以遺傳穩定的抗蚜辣椒品種‘豬大腸’和感蚜辣椒品種‘大羊角椒’為親本材料。
1.2 方法
1.2.1 雜交后代群體的抗蚜性鑒定 采用實驗室前期建立的辣椒品種溫室苗期鑒定方法[11]對正反雜交雜種后代F1、F2進行抗性評價(圖1),將待測品種隨機排列,播種于育苗用營養缽中,每品種1行,每行10株,行長60 cm,行距、株距均為6 cm。在辣椒苗4-6葉期進行人工接蚜。方法是剪取布滿蚜蟲的辣椒葉片,均勻設三點置于待測苗的行間,令其自然轉移。接蚜8 d后進行查蚜。查蚜方法為計數法。每行查蚜10株,以每株的平均蚜量定級,共分5級(表1)。每品種抗性鑒定重復3次F1代采用群體評級,F2代采用單株評級。

圖1 抗蚜辣椒品種‘豬大腸’和感蚜辣椒品種‘大羊角椒’正反雜交

表1 辣椒抗蚜性溫室苗期抗性評級標準
1.2.2 辣椒POD和PPO酶活分析 從‘豬大腸’和‘大羊角椒’正反雜交的F2代群體中各選取10株經過抗性鑒定的抗、感蚜辣椒用于辣椒POD和PPO酶活分析。POD和PPO的酶活分析方法參照Xiao等[12]的方法進行。
1.2.3 數據分析 采用SPSS軟件進行數據分析,顯著性差異分析采用One-Way ANOVA-Fisher中的LSD方法,所有數據均為3個生物學重復的平均值,顯著性檢測水平為α=0.05。
2 結果
2.1 辣椒抗蚜性的遺傳分析
抗蚜性鑒定結果表明,‘豬大腸’和‘大羊角椒’正反雜交后代F1表型均沒有出現抗、感性分離,平均每株蚜量分別為0.59頭和0.78頭,表現為高抗(HR)。F1自交所得F2表型出現抗、感性分離,抗蚜與感蚜植株分離比經χ2測驗符合3∶1分離規律(表2)。上述結果說明,辣椒抗蚜性由單顯性核基因控制,且能穩定遺傳。此外,圖2結果表明,感蚜辣椒植株在接種桃蚜8 d后癥狀明顯,而抗蚜辣椒植株只表現出輕微的桃蚜為害癥狀。
2.2 蚜蟲侵害前后抗、感蚜辣椒植株葉組織內PPO活性變化
2.3 蚜蟲侵害前后抗、感蚜辣椒植株葉組織內POD活性變化
表3結果表明,無論對于辣椒親本及其F1、F2代群體,抗蚜品種在接蚜初期和后期植株葉組織內PPO活性并無顯著差異,但與未接蚜相比均顯著升高(P<0.05),升高倍數在2.01倍-3.07倍之間,而感蚜品種PPO活性在接蚜前后均無顯著差異(P<0.05)。此外,接蚜前抗、感蚜辣椒品種PPO活性也無顯著差異,而抗蚜品種接蚜初期、后期葉組織內PPO活性也分別顯著高于感蚜品種(P<0.05)。

表2 辣椒抗蚜性遺傳分析

圖2 典型的抗、感蚜辣椒植株接種前后癥狀對比圖
表4結果表明,無論對于辣椒親本及其F1、F2代群體,抗蚜品種在接蚜初期和后期植株葉組織內POD活性并無顯著差異,但與未接蚜相比均顯著升高(P<0.05),升高倍數在2.00倍-2.31倍之間,而感蚜品種POD活性在接蚜前后均無顯著差異(P<0.05)。此外,接蚜前抗、感蚜辣椒品種PPO活性也無顯著差異,而抗蚜品種接蚜初期、后期葉組織內PPO活性均分別顯著高于感蚜品種(P<0.05)。
3 討論
作物與有害生物的互作是一個長期進化中互相影響的過程,當我們利用植物在長期進化中積累的抗性來培育抗蟲品種時,抗性的長期穩定遺傳是我們首先要考慮的問題[13]。單基因抗性遺傳簡單,便于操作,而多基因抗性由于隨著代數的增加而逐漸分散,使抗性削弱。對春小麥[14]、桃樹[13]、高粱[15]、苜蓿[16]等作物的抗蚜性遺傳分析表明,其抗蚜性均為質量性狀遺傳,其抗性各由一對顯性單基因控制。本研究發現F1自交所得F2表型出現抗感性分離,抗蟲與感蟲植株分離比經χ2測驗符合3∶1分離規
律,表明辣椒抗蚜性由單顯性核基因控制,且能穩定遺傳。在大羊角椒×豬大腸的F2代分離群體中,感蟲植株的數量比預期3∶1分離比率略高,根據Zhang等[17]的解釋,此現象可能是由于感蟲品種中存在一個修飾基因,改變了顯性基因的抗性。
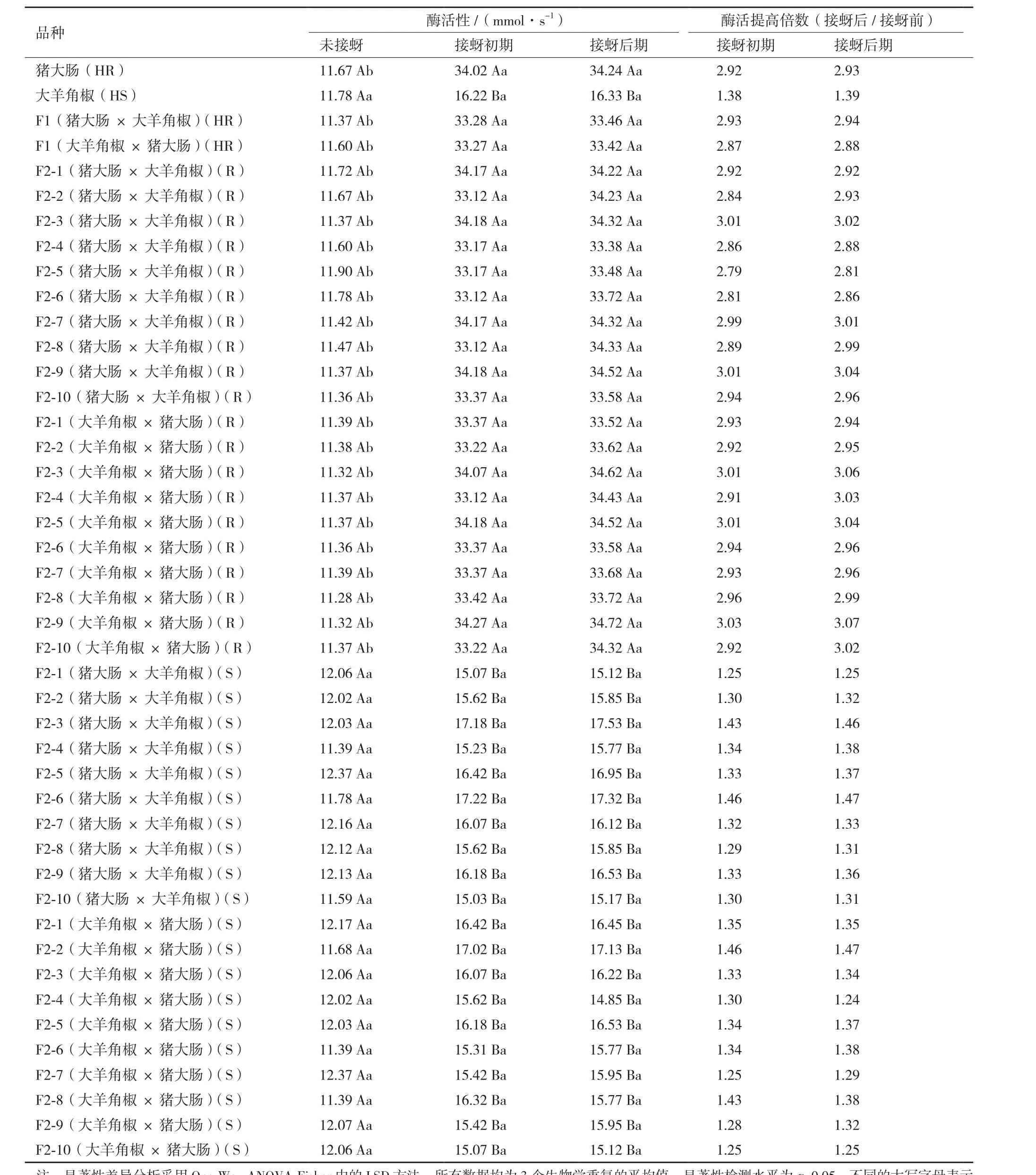
表3 蚜蟲侵害前后抗、感蚜辣椒品種葉組織內PPO活性變化
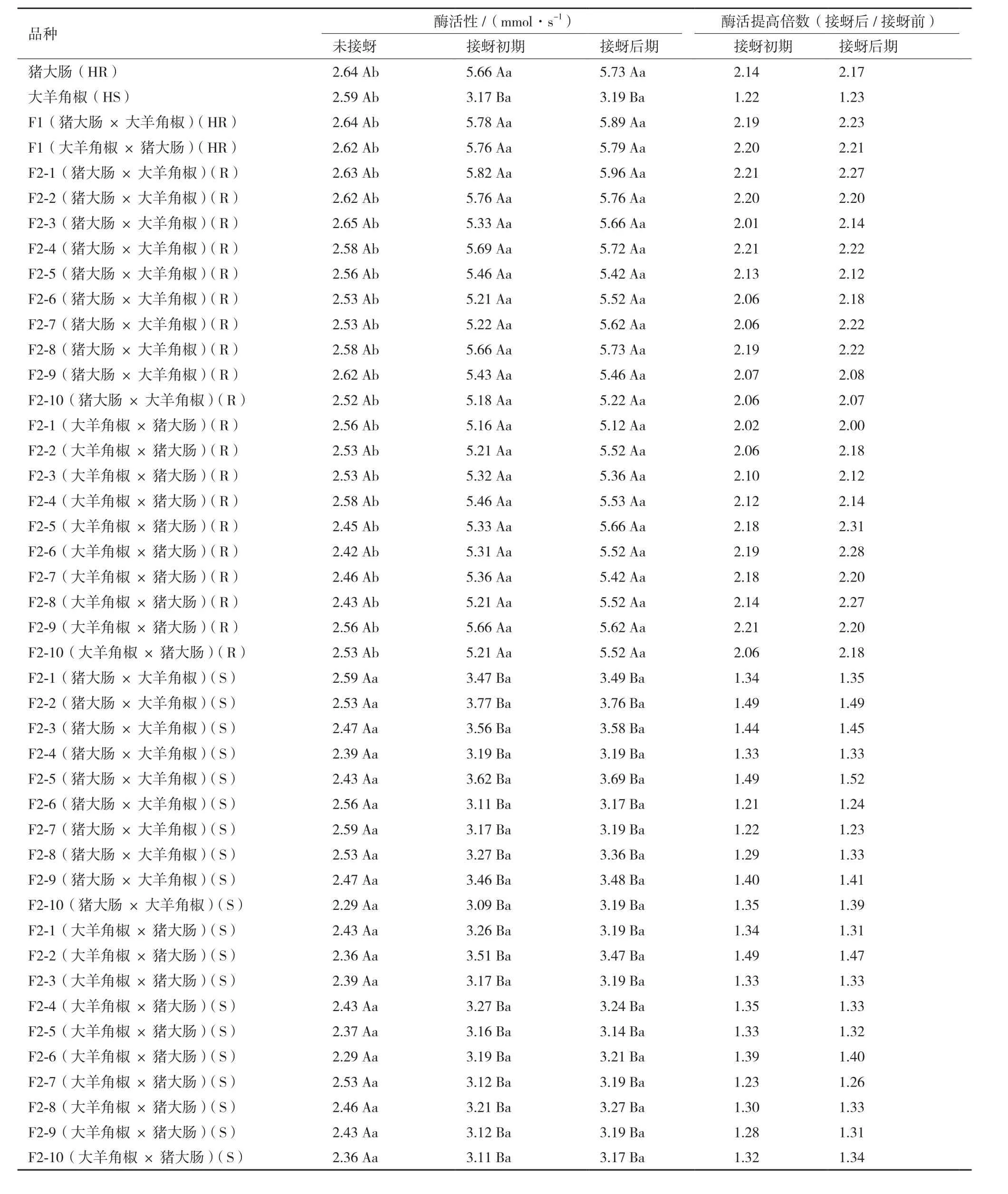
表4 蚜蟲侵害前后抗、感蚜辣椒品種葉組織內POD活性變化
PPO和POD參與植物的防御反應,其活性顯著升高可有效提高植物抗蟲性水平[18-19]。PPO和POD不僅可通過清除活性氧而抵御昆蟲對植物的侵害,還可作為次生代謝途徑中的重要酶,調控和影響寄主植物次生代謝物質的產生,從而增強植物的抗蟲性[20-21]。研究發現,蟲害脅迫的茶樹葉片PPO和POD等含量升高,活性增強,對昆蟲及其誘發的一系列病害有防御作用[19,22]。麥長管蚜為害可誘導抗性小麥葉組織中PPO和POD活性顯著升高,而敏感種質中卻無顯著變化[18]。桃蚜為害可誘導甘藍體內PPO和POD活性的升高,且隨桃蚜為害時間的延長而增加[23]。蚜蟲為害后,抗性高梁種質體內PPO和POD活性比感蚜前顯著升高,并與蚜蟲的誘導相關[24]。蚜蟲取食可誘導棉花體內的PPO和POD活性升高,其升高速度及峰值高低與棉花抗蚜性呈正相關關系[25]。本研究針對PPO和POD酶活分析結果與前人相似,抗性辣椒種質受蚜蟲為害初期葉組織PPO和POD活性不僅顯著高于為害前水平,而且顯著高于感蚜品種,并且可以將酶活維持在一個穩定的高水平至接蚜后期,表明辣椒PPO和POD活性增加幅度與辣椒抗蚜性具有顯著相關性。
4 結論
針對辣椒抗蚜品種‘豬大腸’的抗蚜性遺傳分析結果表明,辣椒抗蚜性由顯性單基因控制,能夠穩定遺傳。PPO和POD酶活性受桃蚜為害后顯著升高與抗蚜辣椒品種的抗性顯著相關。
[1] 湯秋玲, 馬康生, 高希武. 蔬菜蚜蟲抗藥性現狀及抗性治理策略[J]. 植物保護 , 2016, 42(6):11-20.
[2] 陳青. 幾種生化物質與辣椒抗蚜性的相關性[J]. 園藝學報,2002, 29(6):533-536.
[3] 任廣偉, 王鳳龍, 彭世陽. 馬鈴薯Y病毒與介體蚜蟲傳毒的關系研究進展[J]. 煙草科技, 2006, (10):56-61.
[4] 王佳, 王亞峰, 蒲頗, 陳媛, 劉映紅. 煙草感染兩種病毒對煙蚜種群增長、寄主選擇與傳毒的影響[J]. 西南大學學報:自然科學版, 2017, 39(3):23-27.
[5] 鐘秀明, 武雪萍. 我國農田污染與農產品質量安全現狀、問題及對策[J]. 中國農業資源與區劃, 2007, 28(5):27-32.
[6] 趙善歡, 張興. 植物自身控制害蟲的作用[J]. 華南農業大學學報 , 1985, 6(2):79-89.
[7] Sarath BB, Pandravada SR, Rdvj PR, et al. Global sources of pepper genetic resources against arthropods, nematodes and pathogens[J]. Crop Protection, 2011, 30(4):389-400.
[8] Frantz JD, Gardner J, Hoffmann MP, et al. Greenhouse screening of Capsicum accessions for resistance to green peach aphid(Myzus persicae)[J]. HortScience, 2004, 39(6):1332-1335.
[9] Bosland PW, Ellington JJ. Comparison of Capsicum annuum and C. pubescens for antixenosis as a means of aphid resistance[J].HortScience, 1996, (6):1017-1018.
[10] 孫蕾, 程須珍, 王素華, 等. 栽培綠豆V2709抗豆象特性遺傳分析[J]. 植物遺傳資源學報, 2007, 8(2):209-212.
[11] 陳青. 辣椒抗蚜性的生化基礎及其RAPD分析[D]. 海口:海南大學, 2002.
[12] Liang X, Chen Q, Lu H, et al. Increased activities of peroxidase and polyphenol oxidase enhance cassava resistance to Tetranychus urticae[J]. Exp Appl Acarol, 2017, 71(3):195-209.
[13] 牛良, 魯振華, 曾文芳, 等. ‘粉壽星’對桃綠蚜抗性的遺傳分析[J]. 果樹學報 , 2016(5):578-584.
[14] 胡秉芬 , 馬小樂 , 師桂英 , 等 . 春小麥抗蚜品系‘J-31’和‘J-48’的抗性遺傳分析[J]. 甘肅農大學報, 2009, 44(3):58-63.
[15] 常金華, 夏雪巖, 張麗, 等. 高梁抗蚜基因的遺傳分析和SSR標記定位[J]. 草業學報, 2006, 15(2):113-118.
[16] 郭素敏. 蒺藜苜蓿抗蚜蟲的遺傳分析[D]. 南京:南京林業大學, 2011.
[17] Zhang XP, Rhodes B. Inheritance of resistance to races 0, 1, and 2 of Fusarium oxysporum f. sp. niveum in watermelon(Citrullus sp.PI 296341)[J]. Report-Cucurbit Genetics Cooperative, 1993, 21(6):121-132.
[18] Ying H, Yu W, Bi JL, et al. Constitutive and induced activities of defense-related enzymes in aphid-resistant and aphid-susceptible cultivars of wheat[J]. J Chemi Ecol, 2009, 35(2):176-183.
[19] Yang ZW, Duan XN, Jin S, et al. Regurgitant derived from the tea geometrid Ectropis obliqua suppresses wound-Induced polyphenol oxidases activity in tea plants[J]. J Chem Ecol, 2013, 39(6):744-751.
[20] Van Damme EJM. Induced Plant Resistance to Herbivory[M].2nd ed. New York:Springer, 2008.
[21] Zhurov V, Navarro M, Bruinsma KA, et al. Reciprocal responses in the interaction between Arabidopsis and the cell-content-feeding chelicerate herbivore spider mite[J]. Plant Physiology, 2014,164(1):384-392.
[22] 王丹, 陳亮. 茶樹對茶尺蠖抗性機制研究[J]. 茶葉科學,2014, (6):541-547.
[23] 張春妮. 甘藍苗期對桃蚜Myzus persicae(Sulzer)抗性的生化機制研究[D]. 楊陵:西北農林科技大學, 2005.
[24] 張麗, 常金華, 羅耀武. 不同高粱基因型感蚜蟲前后POD、PPO、PAL酶活性變化分析[J]. 中國農學通報, 2005, 21(7):40-48.
[25] 李潤植, 毛雪, 李彩霞, 等. 棉花誘導抗蚜性與次生代謝相關酶活性的關系[J]. 山西農業大學學報:自然科學版, 1998,(2):165-168.

