原發性肝癌外周血免疫抑制細胞表達與中醫辨證關系*
張 巍,邵明亮,苗同國,吳宗耀,王 蕊
(1.石家莊市第五醫院研究中心 石家莊 050000;2.河北中醫學院 石家莊 050000)
原發性肝癌(Primary liver cancer,PLC)是一種多因素綜合形成的惡性腫瘤之一,是世界范圍內發病率第六位,死亡率第四位的腫瘤[1]。東亞地區病毒性肝炎(包括慢性乙型肝炎、丙型肝炎),脂肪性肝病構成肝癌發病最重要的病原因素。慢性乙型肝炎病毒(Hepatitis B virus,HBV)感染者經過長期抗病毒治療仍然不能徹底清除病毒,乙肝病毒進一步整合到宿主基因,組形成共價閉合環狀結構DNA(covalently closed circular DNA,cccDNA),導致HBV感染慢性化,將近35%-60%風險發為乙型肝炎病毒相關肝硬化、肝功能衰竭和肝細胞癌(Hepatocellular carcinoma,HCC)。免疫功能調節與HBV感染控制及疾病進展密切相關。免疫抑制細胞(MDSC)是一類的參與炎癥、腫瘤過程的重要免疫細胞,能夠強烈抑制細胞應答功能,近年來成為研究腫瘤免疫逃逸中的作用的熱點[2]。
中醫根據肝癌主要的癥狀、體征及臨床發展過程,與“黃疸”、“脅痛”、“積聚”、“鼓脹”、“疫毒”、“郁證”、“肝瘟”、“血證”等病證的記載密切關聯[3]。“濕、熱、瘀、痰、毒、虛”構成本病的病因,個體表現各異,呈現一個動態變化的發展過程,諸多醫家因此界定肝癌中醫基本證候為血瘀、脾氣虛、肝膽濕熱、肝氣郁結、肝陰虛、腎陰虛的六證。肝癌病機包括肝郁、氣滯、脾虛、痰濕、血瘀、腎陰虛,隨著病情的加重,證型有所不同。肝癌隨著臨床分期以及病情的加重,證型表現為為肝郁脾虛證-氣滯血瘀證-濕瘀互結-肝腎陰虛證改變。我們長期臨床觀察發現原發性肝癌屬本虛標實之證,以正虛為本,血瘀濁毒壅絡為標。素體本虛,邪氣則乘虛侵入而發病;病邪侵襲,又傷正氣,互為因果。病程初期邪毒內蘊侵及肝膽,導致肝失調達、肝失疏泄,繼則濕熱氣滯,濕、毒、痰、氣相互壅結,濕阻痰盛,痰氣郁滯,氣血不通,而致虛實夾雜之證[5]。關注臨床的腫瘤分期,腫瘤進展相關的免疫機制、免疫分子表達與中醫辨證分型存在內在的聯系,正是本課題的研究目的。旨在通過分析肝癌患者中醫辨證分型是否與MDSC表達以及相關免疫細胞、因子水平有關,便于盡早預警腫瘤病情進展,提高患者生存率。
1 研究對象及方法
選取2011年5月至2015年1月于石家莊市第五醫院接受治療的HBV相關肝癌患者237例。其中男性151例,女性86例(性別比1.75∶1),年齡59.36±6.57歲(30-77歲);按照BCLC分期A期98例,B期139例。所有病例均為初診病例,未采用抗腫瘤治療。
1.1 納入標準
①診斷符合原發性肝癌診療規范(2011年版)[4];②病例資料記錄完整者;③患者可以持續隨訪者。
1.2 排除標準
①非原發性性肝癌的患者:如肉瘤、惡性淋巴瘤、轉移性肝癌等;②臟器功能嚴重衰竭,頑固性大量腹水,明顯的惡液質,意識障礙等已不再適合治療的患者;③病例資料記錄不完善者;④患者無法再次隨訪者。
1.3 主要試劑和儀器
人淋巴細胞分離液(Ficoll)購于天津灝洋生物制品科技有限公司;FBS購于美國Gibco公司,人單克隆熒光抗體CD33-PE-Cy5購于美國Biolegend公司,CDll b/Mac-1-PE-Cy7、HLA—DR-APC、CDl4-F1TC、CD3-FITC、CD4-PE-Cy5、CD8-PE-Cy7、同型對照抗體均購于美國BD公司;Centrifuge 5810R臺式高速離心機,購于德國Eppendorf公司;BD FACS TM流式細胞儀購于美國BD公司。
1.4 外周血分離PBMC及抗體標記
術后6個月抽取患者外周靜脈血10 mL血于EDTA抗凝管,2 h內18℃2000 r·min-1(離心半徑9.5 cm)離心8 min。取血細胞加PBS稀釋至18 mL,分兩支管,每只管加4.5 mL Ficoll,將稀釋的血細胞緩慢加到Ficol液面上方,18℃2000 r·min-1(離心半徑9.5 cm)離心20 min。
吸取100 mL細胞懸液于流式管中,加入單克隆熒光抗CD33-PE-Cy5 5 μL、CD11b/Ma-1-PE-Cy7 5 μL、HLA-DR—APC 20 μL、CDl4一FITC 20 μL,同型對照管中加入同型對照抗體防止非特異性染色。輕彈流式管管底,混勻細胞與抗體,置于冰上避光溫育30 min后,加PBS洗滌細胞2次,1500 r·min-1(離心半徑9.5 cm)離心6 min。棄上清液,加300 μL PBS重懸細胞,再用流式細胞儀檢測MDSC在單個核細胞中的表達頻率。
1.5 HBV免疫學、腫瘤標志物檢查
乙肝五項定量采用上海實業科華生物技術有限公司試劑盒常規酶聯免疫方法檢測。HBV-DNA檢測采用羅氏公司熒光定量PCR法,檢測靈敏度為>500IU/L。AFP采用化學發光法檢測,正常值<10 mg·L-1。
1.6 Child-pugh評分
Child-pugh評分以ALB>35 g·L-1(1分),Tbil<34.2 μmol(1分),無腹水(1分),凝血時間延長1-3 s(1分),無肝性腦病(1分),總分<6分為A級,7-9分為B級,>10分為C級。
1.7 中醫臨床癥狀分型
腫瘤相關體格檢查,如:是否伴肝區疼痛、消瘦乏力、伴發腹水、肝性腦病、黃疸等;中醫分型標準參考衛生部年頒發的《中藥新藥臨床研究指導原則(試行》標準[6],脾虛證:神疲乏力,納呆食少,腹脹,腹瀉,舌淡,有齒痕,脈細弦。肝郁:情緒激動,脈弦,噯氣不爽,矢氣較多;氣滯證:右脅悶脹竄痛,胸悶,易怒,右脅助下痞塊舌苔薄膩,脈弦。血瘀證:脅痛引背,納差食少,便血,腹內包塊,痛處不移,拒按,形體消瘦,舌質紫暗,脈沉細。陰虛證:腰膝酸軟,五心煩熱,排便困難,舌紅少苔,脈細而數。
1.8 統計學方法
患者基線臨床資料應用描述性分析,組間計數資料比較Fisher精確概率法,計量資料進行Shapiro-Wilk正態分布檢驗,用χ±s表示。非正態分布組間比較用秩和檢驗。采用SPSS17.0錄入數據并進行統計學分析,P<0.05為差異有顯著性。
2 結果與分析
2.1 患者的基線資料
對入組患者的情況統計資料(表1),男性患者(63.71%),年齡≥60歲(53.59%),具有肝癌家族史占(54.85%),Child-pugh B期占55.7%,肝硬化代償期占(72.99%),未發生乙肝血清學轉換占(77.63%),AFP ≥ 400 ng?mL-1占(56.55%)。
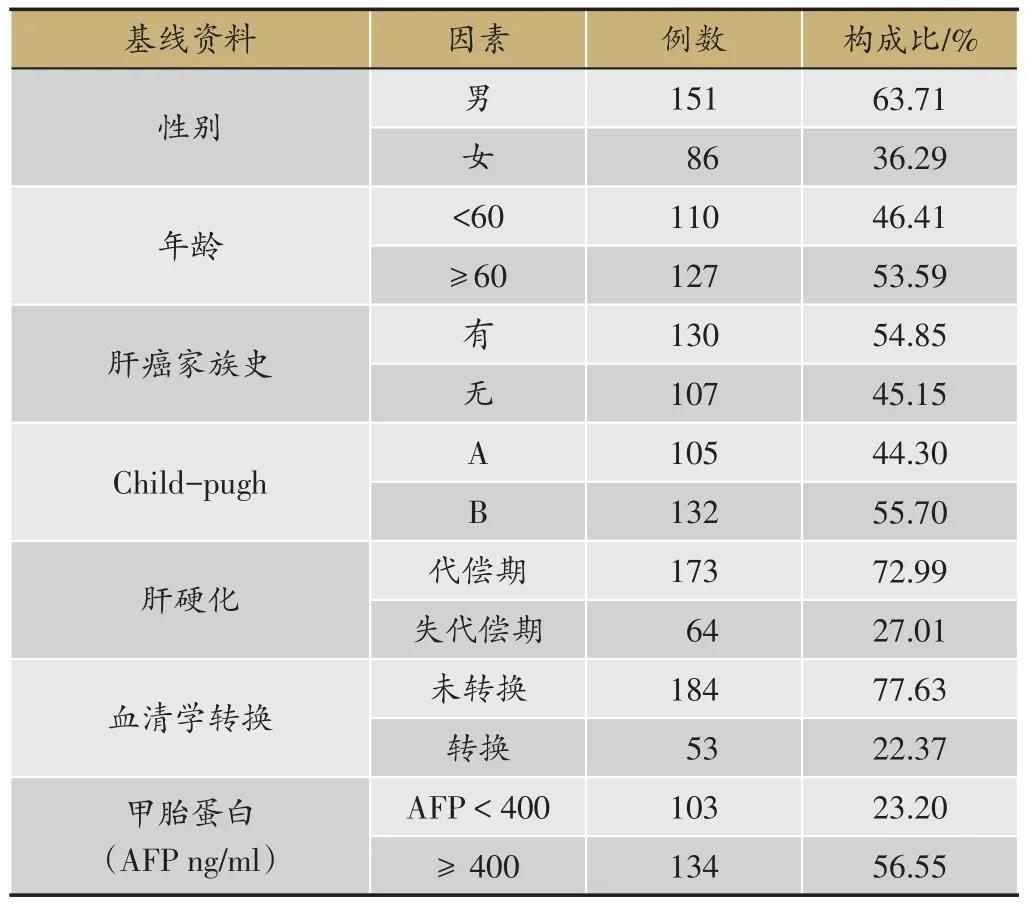
表1 237例原發性肝癌患者一般資料
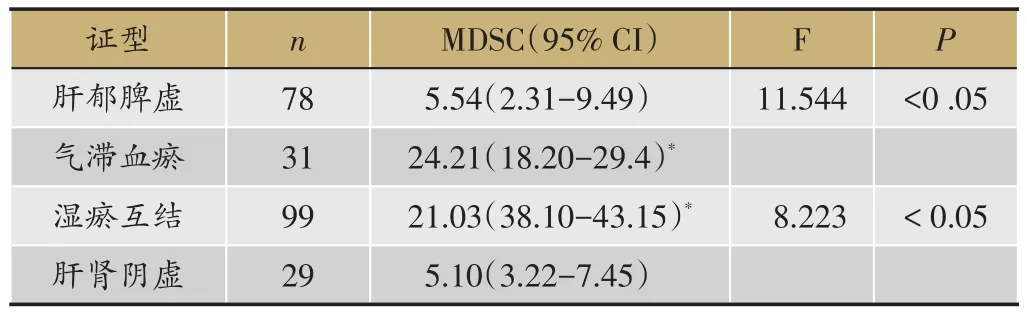
表2 肝癌患者不同證型影響MDSC分析

表3 肝癌患者中醫證型影響Th1/Th2分析
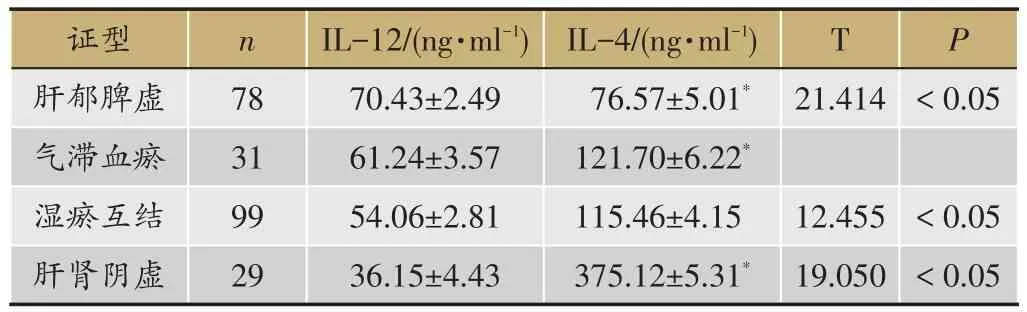
表4 肝癌患者IL-12/IL-4表達分析
2.2 肝癌患者不同證型影響MDSC分析
肝癌早期氣滯血瘀證MDSC(24.21%)明顯高于肝郁脾虛證(5.54%)差異具有顯著性(Χ2=11.544,P<0.05)(表2)。肝癌進展期濕瘀互結證MDSC(21.03%)表達高于肝腎陰虛證(5.10%)差異具有顯著性(Χ2=8.223,P < 0.005)
2.3 肝癌患者中醫證型影響Th1/Th2分析
氣滯血瘀證Th2表達高于肝郁脾虛組,組間比較具有顯著性差異(t=10.341,P < 0.05)(表3)。濕瘀互結證Th2表達高于肝腎陰虛組,組間比較具有顯著性差異(t=16.307,P < 0.01)。
2.4 肝癌患者中醫證型影響IL-12/IL-4表達分析
氣滯血瘀組IL-4(121.70±6.22)高于肝郁脾虛組(76.57±5.01);組間比較具有顯著性差異(t=21.414,P < 0.05)(表4)。肝腎陰虛組IL-4(375.12± 5.31)高于濕瘀互結(115.46±4.15)組間比較具有顯著性差異(t=12.455,P <0.05)。肝腎陰虛組IL-12(36.15±4.43)低于肝郁脾虛組(70.43±2.49),組間比較具有顯著性差異(t=19.050,P<0.05)。
3 討論
《內經》云:“正氣存內,邪不可干”,“邪之所湊,其氣必虛”。《靈樞·百病始生》日:“虛邪之中人也…….留而不去,息而成積,或著孫絡,或著輸脈,或著于伏沖之脈,或著于膂筋,或著于胃腸之募原,上連于緩筋,邪氣淫溢,不可勝論。”外邪之所以能侵入;而對人體而致瘤,關鍵還在于正虛,可見正氣是維系人體正常生命活動、抗御外邪及防治疾病的基本物質。原發性肝癌發病機制極其復雜,病情發展與固有免疫和適應性免疫系統調節異常均有關[7]。本研究結果顯示,肝癌患者氣滯血瘀證MDSC(24.21%)明顯高于肝郁脾虛(5.54%),肝癌進展期(>5 cm)濕瘀互結MDSC(21.03%)表達高于肝腎陰虛(5.10%)。同類研究顯示,肝癌患者進行短期隨訪觀察后發現,外周血MDSC頻率與患者病死率有關,可作為預測該類患者病死率潛在的指標。提示肝癌增殖過程中,突破細胞免疫防御同時[8],“形諸于外”在中醫體征上,發生辨證的改變,證實辨證分型更替具備免疫調節基礎。
長期的慢性病毒性肝炎以及肝硬化病史致使肝癌患者肝臟內環境長期處于慢性炎癥的狀態,殺傷性T細胞被大量耗竭,肝臟處于免疫抑制狀態。多種免疫細胞如T淋巴細胞、單核細胞、DC、Thl7細胞、Treg均被認為在HBV相關肝癌的發生、發展中起到了重要的作用[9]。原發性肝癌患者血清中展期肝癌組患者MDSC的比例明顯高,Th1相關細胞因子IL-12、IL-2、IFN-γ的濃度明顯升高,Th2相關細胞因子IL-4的水平顯著升高。
MDSC分為兩個亞型,即粒細胞樣MDSC(G-MDSC)和單核細胞樣MDSC(M-MDSC)。在早期腫瘤發生階段,MDSC具有抗腫瘤免疫效果,進展期則轉變為抗腫瘤免疫抑制,進而發揮負性作用[10]。多項研究證實,多個器官來源腫瘤細胞及骨髓來源細胞分泌的酶類通過MDSC有促進腫瘤的惡性化和侵襲(invasion)的作用[11]。一方面腫瘤細胞的生命活動受到周圍“新生的”微環境中因子的調控,另一方面腫瘤細胞也通過自身的分泌活動影響周圍的微環境。MDSC具有明顯的免疫抑制功能,不僅能夠抑制機體自身的抗腫瘤免疫,還可能削弱免疫治療的效果。MDSC可能通過抑制抗腫瘤免疫反應促進了原發性肝癌的發生和進展。MDSC調節腫瘤免疫紊亂機制表現為:①MDSC通過募集前列腺素E、干細胞因子、巨噬細胞集落刺激因子、IL-6等細胞因子誘導活化T淋巴細胞;②經過γ-干擾素、IL-4、IL-10、TGF等細胞因子激活后,通過分泌精氨酸酶1(Ar91)與一氧化氮合成酶,或誘導Treg的產生;③同時產生大量活性氧自由基和氧化亞硝酸鹽,抑制T淋巴細胞功能,發揮間接免疫抑制作用。細胞因子的“級聯激活”,造成全身炎癥反應綜合征(SIRS),患者機體存在類敗血癥樣的免疫麻痹現象,導致細胞免疫抑制[12]。
本研究進一步分析,氣滯血瘀證組Th2表達高于肝郁脾虛組,濕瘀互結Th2表達高于肝腎陰虛組。氣滯血瘀組IL-4(121.70±6.22)高于肝郁脾虛組(76.57±5.01)肝腎陰虛證組IL-4(375.12±5.31)高于濕瘀互結組(115.46±4.15)組間比較具有顯著性差異。相關研究證實代謝性肝病中氣陰兩虛證IL-4高于痰濁遏阻證,痰濁遏阻證Th1/Th2高于氣陰兩虛證組,細胞免疫通過多種免疫相關機制參與肝臟病理生理功能調節[13]。T細胞亞群是反映機體免疫功能的主要標志,腫瘤細胞可直接激活或誘導CD8+T細胞,使其含量上升抑制細胞免疫反應,進而導致CD4+T細胞水平及CD4+/CD8+比值均下降。當機體免疫功能降低,腫瘤細胞得以逃避免疫監視而呈進行性生長。
在肝細胞癌發生、發展過程中存在Th1/Th2比值下降Th2型細胞功能亢進而合成分泌大量的抑制性細胞因子,直接導致機體免疫功能下降,該比值及對應的指標在兩組人群中的差別表明肝癌的發生與機體免疫功能有密切關系IL-4主要由Th2細胞分泌,隨患者病情進展而逐漸升高,調控體液免疫反應,IL-4能增強肝癌細胞的免疫原性,更有效地激活特異性細胞毒T細胞對腫瘤細胞的殺傷作用,能上調肝癌細胞ICAM-1表達,下調肝癌細胞表面CIM4的表達,與細胞外基質中的透明質酸、膠原蛋白、纖黏蛋白、層黏蛋白等基質分子結合,參與細胞的遷移運動。與細胞骨架蛋白結合,啟動腫瘤細胞浸潤和轉移,并抑制肝癌細胞對細胞外基質成分纖維連接蛋白和Ⅳ型膠原的親和力[14]。
本研究揭示在氣滯血瘀組中IL-4與痰濕、血瘀體征密切有關,推斷在腫瘤局部具有微小栓塞形成保護腫瘤細胞免受免疫系統的攻擊,提高腫瘤細胞在血管內皮上黏附的效率,促進腫瘤細胞成功外滲進入遠端組織與組織內環境相互作用。多數研究認為原發性肝癌患者體內Th1/Th2細胞及相關細胞因子的失衡是肝癌發生發展的可能機制之一[15]。隨著對細胞因子在原發性肝癌中作用機制的研究逐步深入,腫瘤炎性微環境中存在大量細胞因子,如IL-1、IL-6、TNF-α、IL-12、IL-17、IL-10和TGF-β等。它們不僅可以引起血管擴張,募集炎性細胞到腫瘤部位,放大炎癥效應,還可促進腫瘤細胞生長,刺激血管、淋巴管生成以及促進腫瘤的浸潤和轉移示。
血清IL-2、IL-4濃度的動態變化可反映原發性肝癌的發生及發展過程,為原發性肝癌療效及預后評估提供重要依據16。IL-12主要由活化的巨噬細胞、樹突狀細胞和中性粒細胞產生,促使NK細胞活性增加,淋巴細胞數量的上升,與靶細胞的結合力增加,清除肝炎病毒,但同時也導致免疫損傷,影響趨化因子炎性局部浸潤。IL-12增強免疫防御效應,相對正常健康者,慢性肝炎、肝肝硬化患者顯著上升。癌癥患者體內IL-12能夠刺激NK細胞的增殖,在腫瘤免疫中起到重要作用。IL-12水平升高調節肝細胞癌患者Th1細胞功能降低和Th2細胞功能亢進現象,而這將導致患者機體免疫功能降低,并引起腫瘤細胞免疫逃逸。
中醫腫瘤學臨床實踐是典型的實施個體化醫療的過程,體現在由復雜的外在局部的病變表現結合整體推斷內在機制進行辨證論治,證候是辨證論治的核心,抓住證候才能推出治法,指導組方用藥,實現腫瘤個體化治療。但是中醫辨證又是參雜醫者一個的主觀實踐過程,在某種程度上會受到就診當時人為因素的影響,中醫證候確立客觀化依據、量化指標仍缺乏。因此,對肝癌證候的生物學標志和分子免疫學甄別確定尤其重要。總結上述研究結果可以發現氣滯血瘀證、肝腎陰虛證存在明顯的細胞免疫功能抑制,通過MDSC調節IL-4表達,上調Th2細胞,參與腫瘤增殖,侵襲,轉移過程。可以推斷肝癌的體征變化導致了MDSC細胞免疫系統調節通過參與分子水平的變化,進一步觀察免疫分子、細胞變化深入研究各個證型的演變機制,提高中 醫辨證的精確性具有重要的臨床價值。

