組織化胰腺的體外構建及其在細胞移植中的作用
楊戰鋒 李曉勇 周百中 陳升陽 尚文俊
(鄭州大學第五附屬醫院肝膽胰腺外科,河南 鄭州 450052)
臨床對糖尿病的治療主要通過藥物或胰島素注射控制血糖水平,但并不能完全控制血糖及并發癥的發生。胰島細胞移植研究已有30多年,成為近年來治療胰島素依賴型糖尿病的一種很有前途的治療方法〔1~4〕。組織工程是結合生命、工程科學,以生物相容性良好的載體,與細胞結合而成的細胞-支架復合體,不但具有全新、獨特的組織結構,而且仍然保持擁有生物活性,使復合體可應用于多種組織或器官損傷的修復。本實驗采用在微重力環境下共培養大鼠胰島和辜丸支持細胞,形成胰島-睪丸支持細胞復合物,同時使其擁有內分泌功能及免疫豁免特性。通過移植于糖尿病大鼠體內,探討組織工程化胰腺的體外構建及其在細胞移植中的實驗研究。
1 材料與方法
1.1實驗動物 2月齡SD大鼠60只,其中8只用于睪丸組織細胞及胰島的分離,由軍事醫學科學院動物中心提供。實驗中對大鼠的處置符合國家標準〔5〕。
1.2主要試劑及設備 旋轉壁式生物反應器(美國),恒溫培養箱、無菌操作臺(上海一恒),臺式冷凍高速離心機(日本),BM-V型生物組織包埋機(北京佳源興業科技有限公司),M199培養基(Sigma公司),大鼠胰島素試劑盒、兔抗Fas-L抗體、小鼠抗胰島素單克隆抗體(上海藍基生物科技有限公司)。
1.3方法
1.3.1SD大鼠胰島細胞的分離、純化與培養 取SD大鼠,注射戊巴比妥鈉進行腹腔麻醉,處死后打開腹腔,摘取完整胰腺組織,放于培養瓶中,37℃消化30 min,用解剖剪剪碎胰腺組織,加入0.5 mg/ml的膠原酶4 ml,37℃震蕩消化8 min,經60目篩網過濾,置于預冷的Hank鹽溶液(含有滅活胎牛血清)終止消化。消化后,2 000 r/min低溫離心10 min,除去上清液,加入25% Dextran溶液,均勻后置于EP離心管中,然后依次加入25%、20%、10% Dextran溶液,然后2 000 r/min低溫離心10 min,吸取細胞層,立即用適量培養基潤洗2遍,得到的胰島中加入培養基(含10%胎牛血清),于培養基中進行培育。
1.3.2支持細胞的分離、純化與培養 將1周齡大鼠麻醉后處死,75%乙醇滅菌后,于腹股溝處解剖,摘取大鼠睪丸組織,輕輕除去附睪和脂肪,稱重,置于預冷的Hank鹽溶液中,慢慢剝離外層白膜,用解剖剪將睪丸剪成糊狀,加入1 mg/ml膠原酶溶液,37℃震蕩消化8 min,過200目篩網過濾,置于預冷的Hank鹽溶液(含有滅活胎牛血清)中終止消化。1 500 r/min低溫離心10 min,輕輕吸去上清液,加入0.5 mol/L低滲緩沖液1 ml,靜置1 min,1 500 r/min低溫離心5 min,吸去上清液,加入M199培養基(含10%體積分數滅活胎牛血清),混勻后接種培養瓶中,于培養箱中進行培養,觀察貼壁情況,及時除去未貼附細胞,培養1 d后,加入0.5 mol/L低滲緩沖液3 ml處理5 min,純化細胞。
1.3.3細胞復合體的制備和檢測 取純化的2 000 IEQ胰島與5.0×106原代睪丸支持細胞接種共培養于旋轉壁式生物反應器中,以20 r/min為初始速度,置于培養箱中培養6 d,隨著支持細胞-胰島復合物的增大,逐步提高旋轉壁式生物反應器轉速。分別取細胞復合物進行DTZ染色及HE染色,于光鏡下觀察其形態學。同時,以同樣方法培養胰島、原代睪丸支持細胞作為對照組。
1.3.4糖尿病大鼠模型的建立及細胞復合物移植 建模方法參考文獻〔6〕。取SD雄性大鼠,禁食12 h后,以體質量6 mg/100 g腹腔注射50 mg/ml鏈脲佐菌素檸檬酸鈉溶液,連續腹腔注射5 d,每日檢測血糖變化,當連續7 d檢測大鼠血糖>16.7 mmol/L時,表明大鼠糖尿病建模成功。將模型大鼠禁食12 h后,乙醚麻醉后于大鼠腎被膜下移植復合物(胰島量為2 000 ICQ/只)。采用同樣方法將新鮮胰島、單獨培養的胰島,睪丸支持細胞分別移植入模型大鼠作為移植對照組,未移植模型大鼠作為空白對照組。
1.3.5移植后各組大鼠血糖監測及葡萄糖耐受實驗 各組移植后,經大鼠尾靜脈采血,1次/2 d,監測各組大鼠血糖水平:(1)血糖連續2次均<7.0 mmol/L為正常;(2)血糖連續2次均>11.4 mmol/L為糖尿病復發。對血糖恢復正常并保持20 d的大鼠,禁食8 h后進行葡萄糖耐受試驗,按體質量200 mg/100 g腹腔內注射25%葡萄糖溶液,每15 min檢測1次血糖(檢測至2 h)。
1.3.6移植物檢測與鑒定 移植后,檢測各組大鼠血糖水平,摘取血糖30 d以上保持正常水平的大鼠腎臟組織,清洗后,用Bouin溶液固定,包埋、切片,進行HE染色,顯微下觀察,并進行Fas-L、胰島素免疫組化法染色,對大鼠移植物進行鑒定。
1.4統計學分析 采用SPSS17.0軟件行t檢驗。
2 結 果
2.1胰島形態學檢測結果 摘取SD大鼠胰島組織,經化學方法純化,顯微鏡下觀察結果顯示:胰島細胞團結構完整,表面光滑,可見胰島被膜,染色后顏色顯示豐富,表明實驗純化得到的胰島純度很高。采用DTZ特異性染色分離純化得到的胰島呈不透光的鮮紅色。見圖1。

圖1 胰島細胞團形態學檢測結果
2.2睪丸支持細胞形態學檢測結果 睪丸細胞貼壁后于培養箱中繼續培養24 h,細胞基本已全部貼壁生長,細胞立體感較強,顯微鏡下可見極少量球形精細胞貼附于睪丸細胞上,經臺盼籃染色后活細胞透亮,總數占95%以上,少數死細胞染成藍色。HE染色可見細胞生長旺盛,形態呈寬大柱狀或纖維樣,排列緊密,多個同時存在時融合成片,界限不清,呈單層膜狀,一般有3~4個突起,突起相互連接,胞質鋪展較大,可見有多量大小不一的空泡狀結構。見圖2。
2.3支持細胞-胰島復合物形態學檢測結果 培養24 h后,睪丸支持細胞-胰島球形細胞復合物逐步形成。培養5 d后,細胞復合物結構穩定且致密,HE染色后,顯微鏡下可見細胞復合物呈球形,且無壞死細胞;DTZ染色后顯微鏡下可見復合物被支持細胞包裹;Fas-L免疫組織切片染色后,可見在整個細胞復合物中,支持細胞呈陽性,胰島素陽性的β細胞檢測結果與透射電鏡觀察結果一致,結果顯示共培養的胰島生長狀態相對較好。見圖3。

圖2 睪丸支持細胞形態學檢測結果

圖3 支持細胞-胰島復合物采用不同染色檢測結果(×100)
2.4移植后模型大鼠血糖檢測結果 移植后3 d血糖恢復正常,其保持正常血糖水平均超過30 d;僅接受胰島移植(經過生物反應器培養)的模型SD大鼠,在移植后4 d血糖水平也達到正常,但僅保持10 d后,血糖水平又逐漸升高,并出現SD大鼠相繼死亡的現象。移植新鮮胰島的模型SD大鼠,2~3 d內血糖恢復正常,但維持在正常血糖水平僅4 d。接受睪丸支持細胞移植的模型SD大鼠,移植后未出現血糖下降,大鼠因高血糖而相繼死亡。未接受移植的模型SD大鼠血糖水平始終較高,且模型大鼠相繼死亡較快。移植睪丸支持細胞-胰島細胞復合物的正常SD大鼠,移植前后大鼠血糖水平無顯著變化,且沒有出現低血糖水平。從血糖水平結果總結,微重力環境下共培養睪丸支持細胞-胰島細胞復合物能夠提高胰島的活性,降低其免疫原性,與接受新鮮胰島移植的SD大鼠相比,復合物移植使模型大鼠保持血糖正常的時間明顯更久。見圖4。
2.5移植物HE染色及免疫組化染色結果 大鼠解剖后,摘取腎臟組織,HE染色可見睪丸支持細胞-胰島細胞復合物移植組模型大鼠腎被膜下有明顯的移植物存在,未發現明顯的淋巴細胞浸潤。胰島素免疫染色和Fas-L染色均可見陽性細胞的存在。僅接受胰島移植(經過生物反應器培養)的模型SD大鼠的腎被膜被淋巴細胞明顯浸潤。見圖5,圖6。

圖4 移植后模型大鼠血糖檢測結果
2.6移植后SD大鼠葡萄糖耐受實驗 接受睪丸支持細胞-胰島細胞復合物移植后的模型SD大鼠,在基本保持正常血糖水平均超過30 d后,進行葡萄糖耐受實驗。移植睪丸支持細胞-胰島細胞復合物的模型大鼠體內胰島對葡萄糖仍保持明顯的敏感性,與正常組大鼠葡萄糖的耐受能力相比,復合物移植組大鼠平均血糖基本在2 h內可以恢復正常,與正常檢測結果接近。見圖7。

圖6 移植有睪丸支持細胞-胰島細胞復合物的腎組織免疫組化檢測結果(×200)
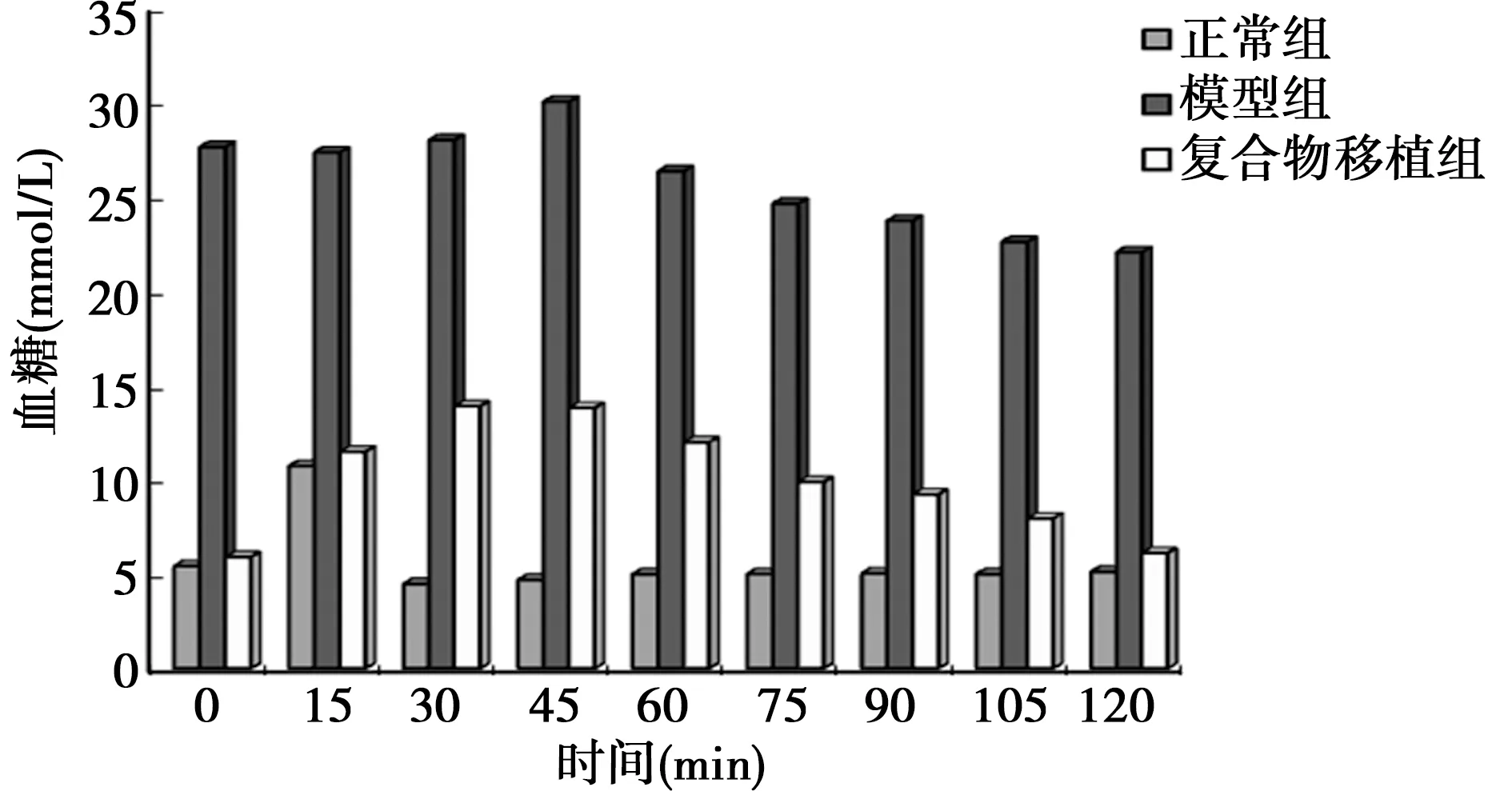
圖7 葡萄糖耐受實驗檢測不同時間點血糖水平(mmol/L)
3 討 論
獲得高純度的胰島是胰島移植治療成果的關鍵。分離、純化胰島的方法有很多,但都有各自的優缺點,如機械剪切分離法、膠原酶消化法、自動機械分離法等〔7~10〕。睪丸支持細胞是生殖系統的重要組成部分。離體的胰島細胞團只有在一定的微環境下才能保證其正常功能狀態。可與胰島細胞團共培養的細胞有很多,如小腸黏膜細胞、神經膠質細胞等,但都對胰島細胞的 存活有一定的促進作用〔11,12〕。本研究胰島與辜丸支持細胞接種后共培養,結果顯示共培養的胰島生長狀態相對較好。葡萄糖耐受實驗顯示,移植睪丸支持細胞-胰島細胞復合物的模型大鼠體內胰島對葡萄糖仍保持明顯的敏感性。實驗結果提示:微重力環境下培養睪丸支持細胞-胰島細胞可以提高胰島在移植體內的活性,降低其免疫原性,同時保持良好的胰島素分泌功能及對葡萄糖的敏感性,并且存活時間保持較長。
1徐 剛,袁敏生.胰島細胞移植的現狀與前景〔J〕.中國糖尿病雜志,2001;9(1):49-51.
2金 光,路 中,戚 麗.胰島移植進展〔J〕.國外醫學·內分泌學分冊,2004;24(1):70-1.
3Rieordi C,Strom TB.Clinieal islet transplantation:advances and immunological challenges〔J〕.Nature Rev,2004;4(4):259-68.
4Sassa M,Fukuda K,Fujimoto S,etal.A single transplantation of the islets can produce glycemic stability and reduction of basal insulin requirement〔J〕.Diabetes Res Clin Pract,2006;73(3):235-40.
5中華人民共和國科學技術部.關于善待實驗動物的指導性意見〔S〕.2006-09-30.
6Kaza AK,Wamala I,Friehs I,etal.Myocardial rescue with autologous mitochondrial transplantation in a porcine model of ischemia/reperfusion〔J〕.J Thor Cardiovasc Surg,2017;153(4):934-43.
7張 梅,楊金奎,陳家偉.胰島移植治療Ⅰ型糖尿病的研究進展〔J〕.國外醫學·內分泌分冊,2002;22(4):204-6.
8孫俊州,李 敏,程寶鶯.動物細胞培養技術〔M〕.廣州:華南理工大學出版社,2002:103-31.
9薛慶善.體外培養的原理與技術〔M〕.北京:科學出版社,2001:90.
10賈 秀,保庭毅.大鼠胰島分離與純化的實驗研究〔J〕.第四軍醫大學學報,2001;22(4):383.
11Chen Q,Gauger P,Stafne M,etal.Pathogenicity and pathogenesis of a United States porcine deltacoronavirus cell culture isolate in 5-day-old neonatal piglets〔J〕.Virology,2015;482(1):51-9.
12王立芹.星形膠質細胞與神經干細胞共培養對神經干細胞分化影響的實驗研究〔D〕.沈陽:中國醫科大學,2010.

