NiMoAl2O3上H2還原脫除煙氣中SO2和NO探索
張春城,薛 峰,武傳朋,郭大為
(1.中國石化石油化工科學研究院,北京 100083;2.北京茵泰德科技有限公司)
煙氣中的硫氧化物(簡稱SOx,為SO3和SO2的總稱)或氮氧化物(簡稱NOx,指NO,NO2,N2O等)是主要的大氣污染物,嚴重危害人體健康和生態環境。近年來,世界各國對SOx和NOx的排放限制越來越嚴格,這當然也包括對煉油工業中流化催化裂化裝置(FCCU)再生煙氣的排放限制。
目前國內外關于脫除FCCU再生煙氣中的SOx和NOx的技術主要有2種:一是干式選擇性還原法脫NOx單元(SCR)連接濕法脫SOx單元,再連接后處理單元;二是濕法脫SOx單元連接濕式低溫氧化法脫NOx單元(LoTOx),再連接后處理單元[1]。這樣的過程很難避免氣液固相的二次污染,而且低溫煙氣夾帶或次生的顆粒物是大氣中霧霾加重的重要因素之一。現在也有干式脫SO2的技術,如基于流化床的吸附-再生ESR工藝[1],但未見工業化的報道。中國石化石油化工科學研究院開發的干式回收法同時脫硫脫硝技術(RESN)[2]已在中國石化中原油田分公司完成了工業側線試驗,目前正在籌備工業示范。
針對已有技術雖然工藝成熟、脫硫脫硝率穩定,但是存在易產生二次污染、設備腐蝕和工藝復雜等問題,還原法處理煙氣中的SOx及NOx成為一個可選方向。煙氣直接還原脫硫脫硝技術是利用還原劑將煙道氣中的SOx和NOx分別選擇性催化還原成單質硫和N2。該方法可采用多類催化劑,如Sn與Ti的氧化物或硫化物、Al2O3負載的過渡金屬(Co,Mo,CoMo,FeMo)硫化物、稀土氧化物催化劑、鈣鈦礦型催化劑LaMO3(M為Cr,Mn,Fe,Co,Ni)等。按照所采用的還原劑可大致分為H2還原法、C還原法、CH4還原法、NH3還原法和CO還原法5大類。催化還原法的優勢在于:①將SO2催化還原為單質硫的工藝過程不產生廢氣和廢渣,唯一產品是單質硫;②反應過程一步完成,工藝簡單,操作簡便;③可同時達到脫除SO2和NOx的雙重效果[3]。
CoMo、NiW和NiMo催化劑是石油化工領域常用的高效加氫催化劑,有研究表明以H2為還原劑、在無氧條件下,CoMo、NiW加氫催化劑具有良好的還原SO2[4]或NO[5]以及能夠同時還原SO2和NO的性能[6-7],專利文獻中也指出了NiMoAl2O3等催化劑在還原法脫除煙氣中的SOx和NOx的應用[8-9]。
1 實 驗
1.1 實驗裝置
采用連續流動式固定床實驗裝置,其工藝流程如圖1所示。裝置主要包括配氣系統、反應器、硫磺收集器、冷凝器、尾氣處理罐等。實驗氣體按需配制,經混合罐混合、預熱后進入反應器,氣體產物依次經過硫磺回收罐和冷凝器收集單質硫和水蒸氣,尾氣經處理后放空。
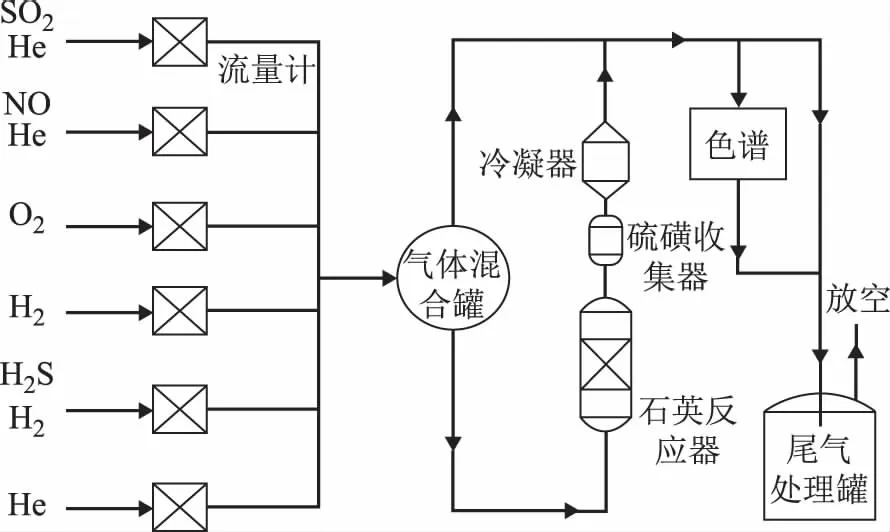
圖1 連續固定床實驗裝置的工藝流程
1.2 實驗原料
以氦氣為稀釋氣分別配制SO2,NO,H2S,H2的標準氣,4種標準氣中標準物的體積分數分別為10%,10%,14%,86%。用作稀釋氣的氦氣由北京兆格氣體科技有限公司生產,純度(φ)不低于99.999%。氧氣:純度(φ)不低于99.995%,由北京海譜北分氣體工業有限公司生產。氫氣:純度(φ)不低于99.999%,由北京龍輝京城氣體有限公司生產。
1.3 催化劑及預硫化方法

表1 催化劑RS-1100的主要物化性質[10]
采用干法原位方式對催化劑進行預硫化:從常溫開始,以5 ℃min的速率升溫至360 ℃,恒溫30 min,再以2 ℃min的速率升溫至400 ℃,恒溫120 min,硫化結束后改用氦氣吹掃反應器降到室溫。
1.4 反應性能評價方法
評價采用石英材質反應器,內徑為20 mm,高度為500 mm,反應器置于可控加熱爐中加熱。選取20~40目的催化劑,裝填量為5 g,反應壓力為常壓。
采用Agilent 3000A氣相色譜儀分析反應前后混合氣體的組成。由于色譜對氣體中的NOx分析不準,考慮到還原NO過程的目標產物為N2,因此著重對N2的生成率進行考察。
脫硫轉化率、單質硫選擇性以及產物N2生成率按下式計算:
x(SO2)=[1-F1n(SO2)F0n0(SO2)]×100%
(1)
s(S)={1-F1[n(H2S)+n(SO3)][F0n0(SO2)-F1n(SO2)]}×100%
(2)
y(N2)=[F1×2×n(N2)F0n(NO)]×100%
(3)
式中:x(SO2)為SO2轉化率,%;s(S)為單質硫選擇性,%;y(N2)為N2生成率,%;F1為反應后體系的體積流量,mLmin;F0為反應前體系的體積流量,mLmin;n為反應后某物質的摩爾分數;n0為反應前某物質的摩爾分數。
關于此類體系中SO3的生成問題,班志輝等[11]對含氧條件下H2催化還原SO2進行了研究,結果表明O2組分的主要作用是耗氫,而未發現有SO3的生成,因此本實驗暫不計量SO3。
2 結果與討論
H2與SO2、NO的化學反應方程式為:
SO2+2H2=S+2H2O
(4)
2NO+2H2=N2+2H2O
(5)
式(4)和式(5)所示化學反應的化學計量比是考慮原料配比時的基準性數據。
2.1 無催化劑時H2單獨脫硫脫硝
在反應器入口氣體組成為φ(H2)∶φ(SO2)∶φ(He)=4∶2∶94、體積流量(標準狀態)為500 mLmin、溫度為100~650 ℃的條件下,于無催化劑的情況下考察 SO2轉化率、單質硫選擇性隨反應溫度的變化,結果見表2。由表2可見:不使用催化劑時,SO2的轉化比較困難,起始反應溫度需要500 ℃,到650 ℃的高溫時SO2轉化率也僅有11.0%;SO2還原生成單質硫的選擇性也很低,在600 ℃時僅為65%左右。
將反應氣體組成調整為φ(H2)∶φ(NO)∶φ(He)=2∶2∶96,于反應溫度100~600 ℃、其條件不變的情況下,考察無催化劑存在時NO還原生成N2的生成率隨反應溫度的變化,結果見表3。
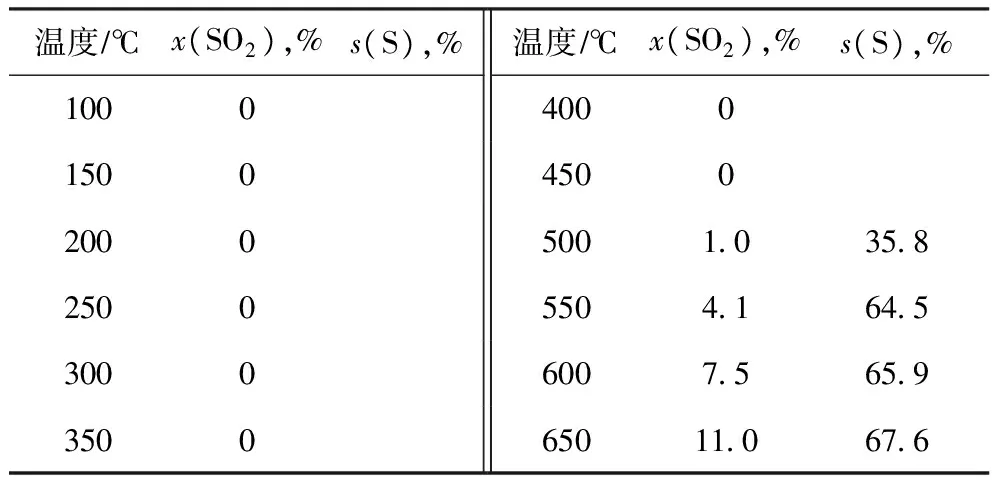
表2 無催化劑時H2還原SO2的反應性能
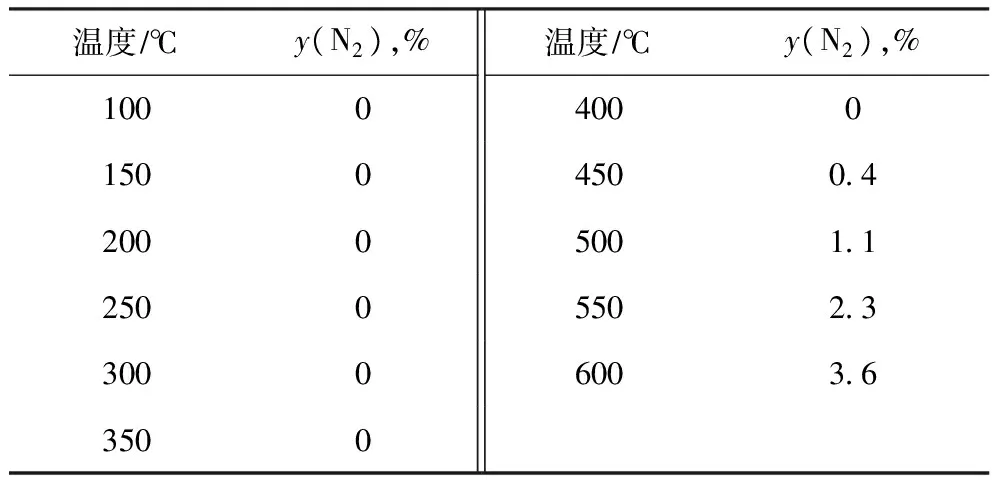
表3 無催化劑時H2還原NO的反應性能
由表3可以看出,不使用催化劑時,H2與NO按照化學計量比反應比較困難,600 ℃時NO轉化為N2的生成率僅為3.6%。文獻[12]報道,當H2體積分數超過NO理論耗氫量的8倍時,氣相中NO完全轉化的溫度為450 ℃左右。
由于不使用催化劑時H2與SO2、NO按照化學計量比反應比較困難,要實現SO2、NO的完全轉化,必須采用過量的H2,這會導致生成H2S,而非理想產物單質硫。因此,采用催化劑來克服反應動力學上的能壘很有必要。本文此后的研究均是在使用催化劑的條件下進行。
2.2 無氧與含氧條件下H2催化還原脫硫
由表4可見:不同于非催化脫硫反應,使用催化劑后反應(4)發生的傾向明顯增強,兩種氣氛下SO2轉化率均隨反應溫度的升高而增加;反應溫度低于250 ℃時,含氧條件下的SO2轉化率高于無氧條件下的SO2轉化率;反應溫度達到250 ℃之后,無氧條件下SO2的轉化率高于含氧條件下的SO2轉化率。
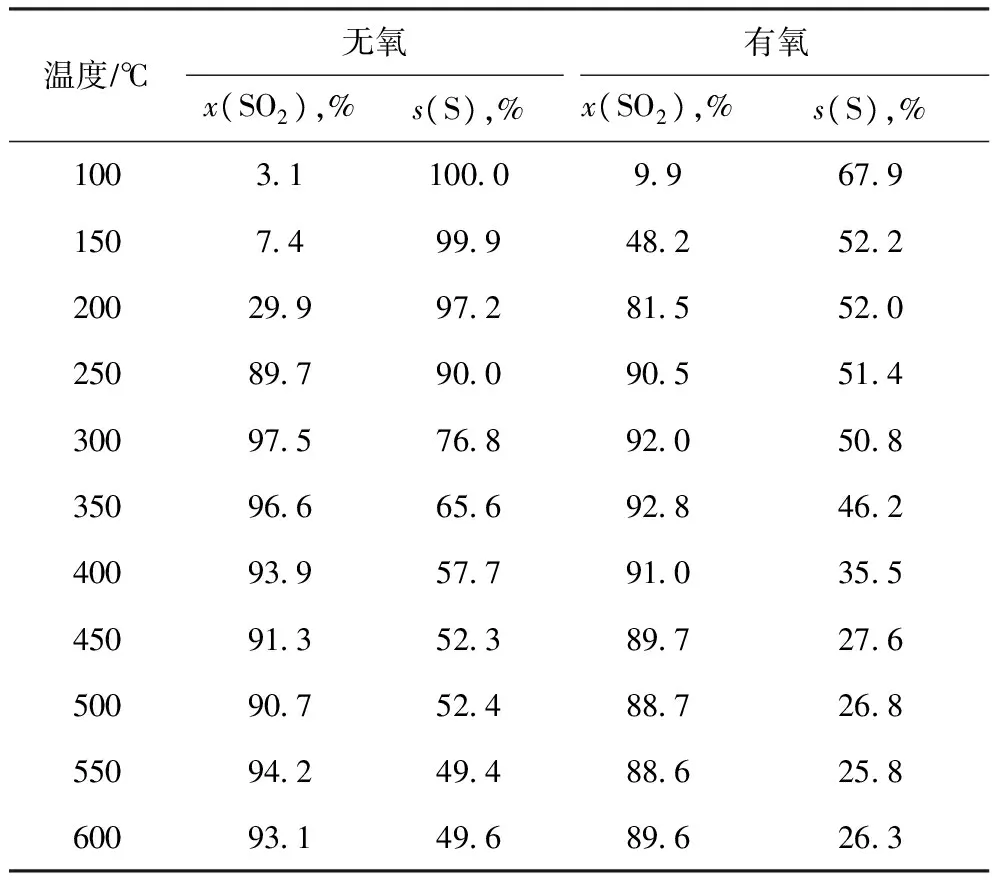
表4 無氧與有氧條件下H2脫除SO2性能對比
由表4還可以看出:兩種條件下單質硫選擇性均隨反應溫度的升高而下降;含氧條件下的單質硫選擇性明顯低于無氧條件下的單質硫選擇性。
張登峰、利鋒等[13-14]認為,使用催化劑時,H2還原SO2生成單質硫的反應由下面反應組成:
金屬硫化物表面:
SO2+3H2=H2S+2H2O
(6)
Al2O3表面:
SO2+2H2S=3S+2H2O
(7)
總反應為式(4)。
通過熱力學計算證明,式(6)是不可逆的吸熱反應,反應溫度在25~1 000 ℃的平衡常數為1×1015~1×1025。式(7)所示為Claus反應,是一個可逆的放熱反應。反應溫度升高,有利于式(6)所示SO2的轉化,但不利于式(7)所示的Claus反應。因此隨著反應溫度的升高,SO2轉化率增高,單質硫選擇性降低。
含氧條件下進行催化還原脫硫時,H2與O2發生強放熱燃燒反應,反應器內催化劑床層有較大溫升(實驗觀察有30~50 ℃溫升),加之低溫下SO2轉化反應對溫度更敏感,所以反應溫度低于250 ℃時,含氧條件下的SO2轉化率高于無氧條件下的SO2轉化率;當反應溫度高于250 ℃時,SO2轉化反應對溫度不敏感,所以無氧和含氧條件下的SO2轉化率比較接近;由于 H2與O2反應生成的水蒸氣不利于SO2還原反應向生成單質硫的方向進行,使得含氧條件下的SO2轉化率低于無氧條件下的SO2轉化率。
含氧條件下,H2與O2的燃燒反應是造成單質硫選擇性顯著下降的主要原因。一方面,H2和O2反應放出大量的熱導致催化劑床層的溫升,不利于有放熱效應的Claus反應的進行;另一方面,H2和O2的燃燒反應有水蒸氣的生成,促進了Claus反應的逆向進行。
2.3 無氧與含氧條件下H2催化還原脫硝
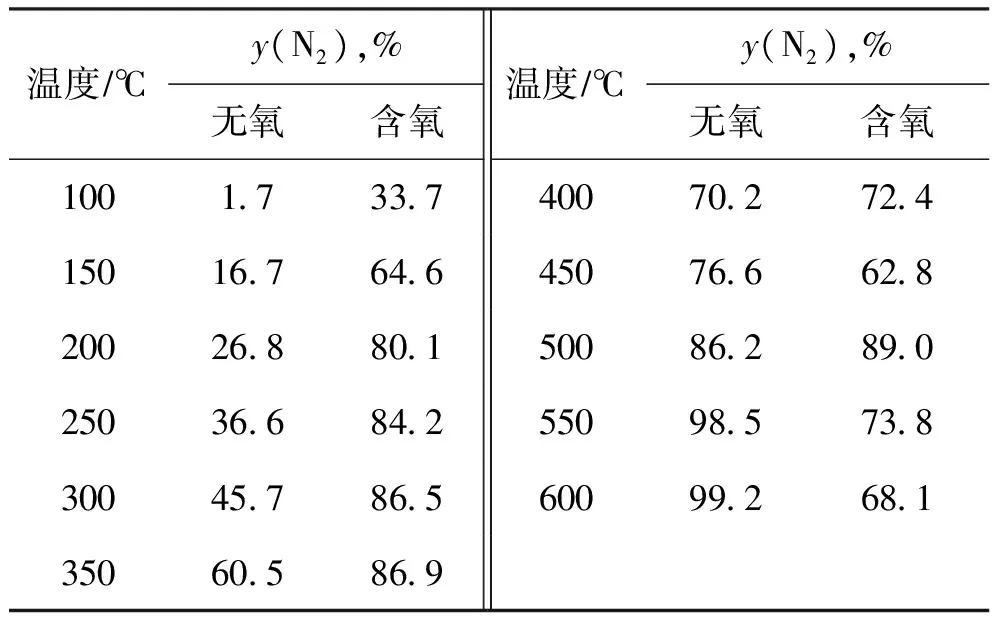
表5 不同條件下N2生成率隨反應溫度的變化
由表5可以看出,相對非催化脫硝反應,使用催化劑后反應(5)發生的傾向明顯增強,說明經過預硫化后的NiMo加氫催化劑具有了良好的脫硝性能。由表5還可以看出,無氧條件下N2生成率隨著溫度的升高而增加,含氧條件下N2生成率隨著溫度的升高而高低波動。
朱鵬等[6]認為預硫化后的加氫催化劑中生成了金屬硫化物,金屬硫化物中的晶格硫構成了加氫脫硝反應的活性中心,因而使用催化劑后顯著促進了反應(5)的進行。
造成無氧和含氧條件下NO還原反應的N2生成率差別比較大的原因,有如下幾個方面:①含氧條件下,H2與O2燃燒反應導致催化劑床層溫升,使得低溫時含氧條件下催化還原脫硝的N2生成率較高;②無氧和含氧條件下催化還原脫硝時,催化劑表面的硫化物都會被氧化,造成晶格硫的流失,但無氧條件下晶格硫流失速率慢,少量晶格硫的流失對反應活性沒有造成影響,而含氧條件下晶格硫流失速率相對較快,隨著反應的進行,高溫時N2生成率快速減小;③含氧條件下催化還原脫硝時,O2的存在導致晶格硫的大量流失以及催化劑表面較多硫酸鹽的生成,反應溫度高于450 ℃時,催化劑表面硫酸鹽被H2還原分解使得脫硝活性升高。
2.4 無氧與含氧條件下H2同時催化還原脫硫脫硝
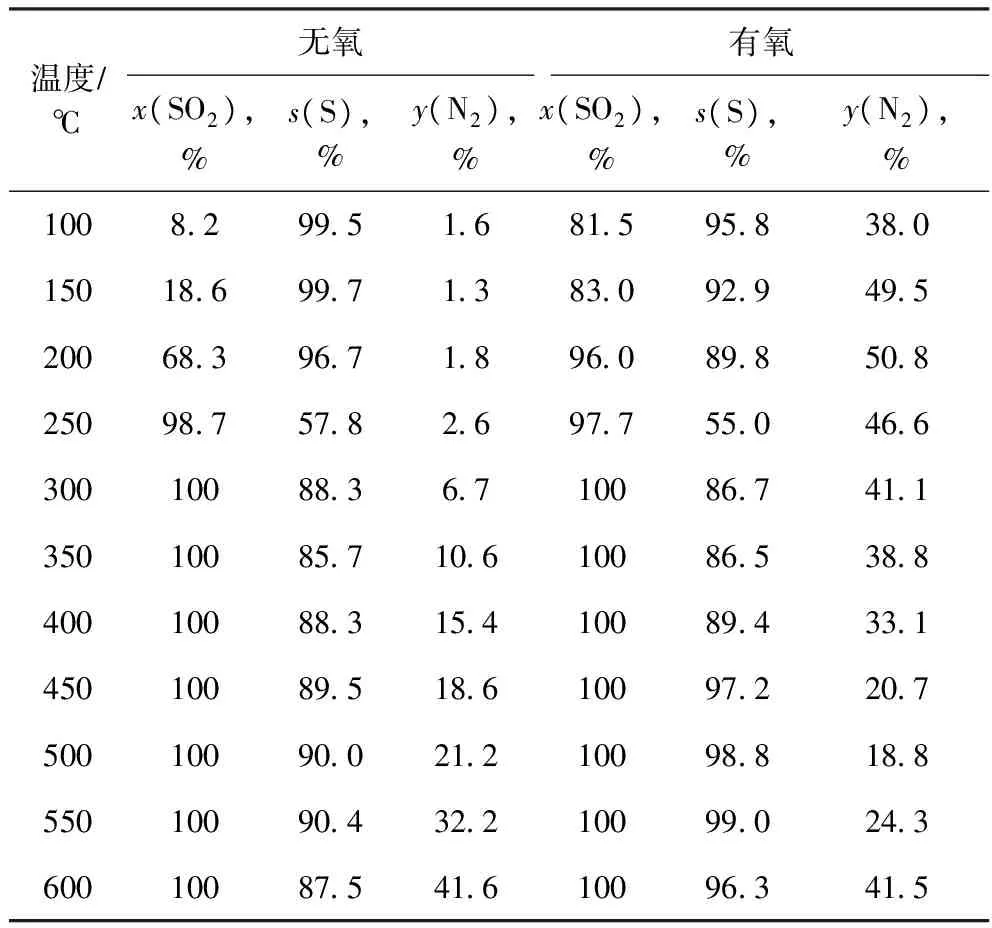
表6 不同條件下H2同時催化還原脫硫脫硝結果
由表6可見:兩種條件下同時催化脫硫脫硝的反應中,SO2轉化率隨反應溫度升高而增加,直至達到100%;生成單質硫的選擇性和N2的生成率隨著反應溫度的升高而上下波動。

同時脫硫脫硝過程中單質硫選擇性隨反應溫度的升高呈現先減小后增大、最后趨于穩定的變化規律。反應溫度升高,單質硫選擇性增大,很可能是由于高溫下NO分解產生的催化劑表面吸附的氧Oad與生成的H2S進一步反應生成了單質S所致[6],反應式為:

(8)
因此也正是由于NO產生的協助作用,單質硫選擇性隨之增大。
反應溫度高于400 ℃時,含氧條件下的單質硫選擇性大于無氧條件下的單質硫選擇性,是因為含氧條件下的催化劑床層溫度高于無氧條件,這更有利于NO的解離,解離生成的Oad與O2都能與H2S反應生成單質硫,從而提高了單質硫的選擇性。
盡管同時脫硫脫硝反應時,N2生成率仍然隨著溫度升高而增加,但遠低于單獨脫硝時,這說明SO2的存在對于NO的脫除是不利的。SO2和NO具有共同的吸附活性位,即金屬原子的陰離子空位。朱鵬等[16]研究SO2和NO在硫化型CoMoAl2O3上的共吸附行為時,發現NO的存在對SO2的吸附沒有抑制作用,而SO2的存在對NO吸附有很強的抑制作用。同時NO的存在能促進SO2在催化劑L堿位上吸附氧化生成硫酸鹽,而實驗中發現催化劑表面硫酸鹽的存在對NO還原反應是不利的。
氣氛的差異,使得同時催化脫硫脫硝過程中N2的生成率隨溫度的變化有很大差別;無氧條件下,N2的生成率隨反應溫度的升高緩慢增加。含氧條件下,反應溫度低于500 ℃時,N2的生成率隨反應溫度升高先增大后減小,這是催化劑表面硫酸鹽的生成所致;反應溫度高于500 ℃時,N2的生成率隨反應溫度的升高而增大,推斷此時催化劑表面的硫酸鹽被H2還原分解,使得NO還原反應活性提高,NO轉化為N2的幾率增加。
整體而言,用H2同時脫硫脫硝時,含氧條件下的N2生成率大于無氧條件下的N2生成率,主要因為含氧氣氛下H2與O2反應放出的熱造成催化劑床層的溫升,反應溫度在脫硝過程中占主導作用。
2.5 同時脫硫脫硝反應前后催化劑表面物相分析
采用XRD對催化劑表面物相進行分析表征。圖2給出了NiMoAl2O3催化劑在預硫化前、預硫化后、無氧條件下同時脫硫脫硝反應后以及含氧條件下同時脫硫脫硝反應后4個階段的XRD圖譜。

圖2 不同階段NiMoAl2O3加氫催化劑的XRD圖譜 A—預硫化前; B—預硫化后; C—無氧同時脫硫脫硝反應后; D—含氧同時脫硫脫硝反應后。 ●—Al2O3; □—MoS2
由圖2還可以看出,無氧和含氧條件下同時脫硫脫硝反應后催化劑的MoS2衍射峰強度都有所增強,表明在無氧和含氧條件下催化劑的硫化程度都有所提高。
在無氧和含氧條件下同時脫硫脫硝過程中,NO的存在導致催化劑表面晶格硫的流失,但同時反應過程中生成的大量單質硫可對催化劑表面晶格硫進行不斷的補充。在流失和補充的動態平衡中,催化劑活性得以維持,最終催化劑表面的活性硫化物被進一步硫化,催化劑的硫化程度得到提高。這些結果從一個側面支持了此前對不同氣氛中NiMo催化劑同時脫硫脫硝結果的解釋。
3 結 論
(1)單獨脫硫時,隨反應溫度的升高,SO2轉化率增高,單質硫選擇性降低,其中含氧條件下的單質硫選擇性明顯低于無氧條件下的單質硫選擇性。
(2)單獨脫硝時,無氧條件下N2生成率隨反應溫度升高而增高,含氧條件下N2生成率隨反應溫度升高而上下波動。
(3)同時催化脫硫脫硝時,隨反應溫度的升高,SO2轉化率增加,直至達到100%;單質硫的選擇性先降低后增高。無氧條件下的N2生成率隨反應溫度的升高而增高;含氧條件下N2生成率隨反應溫度的升高而高低波動。含氧條件下同時脫硫脫硝時的SO2轉化率、單質硫選擇性、N2生成率整體優于無氧條件下同時脫硫脫硝時的結果。
(4)同時催化脫硫脫硝時的SO2轉化率、單質硫選擇均高于單獨脫硫和脫硝時的數值,但N2生成率低于單獨脫硝時的數值。
致謝:感謝中國石化石油化工科學研究院王錦業、陳西巖、王曉剛同志對本課題的協助和支持!
[1] 劉峰,陳慶嶺.FCC再生煙氣脫硫脫氮技術進展[J].化工中間體,2009(8):24-30
[2] 郭大為,張久順,龍軍,等.脫除煙氣中硫氧化物和或氮氧化物的方法及烴油裂化方法:中國,CN101209391[P].2011-06-15
[3] 梁勇,馬智,潘志爽.催化還原煙氣中SO2到單質硫的研究進展[J].工業催化,2007,15(5):55-59
[4] Paik S C,Chung J S.Selective catalytic reduction of sulfur dioxide with hydrogen to elemental sulfur over Co-MoAl2O3[J].Applied Catalysis B:Environmental,1995,5(3):233-243
[5] 彭江杰,張文華,馬運生,等.硫化CoMoAl2O3催化劑上H2同時催化還原SO2和NO的研究:Ⅰ.H2還原NO反應[J].催化學報,2002,23(3):262-266
[6] 朱鵬,李雪輝,王芙蓉,等.硫化CoMoAl2O3催化劑上H2同時催化還原SO2和NO:Ⅰ.催化劑的制備、表征及性能[J].無機化學學報,2008,24(11):1837-1845
[7] 朱鵬,李雪輝,徐建昌,等.硫化NiWAl2O3催化劑上H2同時催化還原SO2和NO: Ⅱ.SO2和NO的同時還原[J].催化學報,2005,26(10):905-910
[8] 郭大為,張久順,毛安國,等.同時脫除煙氣中硫氧化物、氮氧化物和一氧化碳的方法:中國,CN102895873A[P].2014-10-29
[9] 郭大為,張久順,毛安國,等.一種脫除催化裂化再生煙氣中的硫氧化物、氮氧化物的方法:中國,CN102895872A[P].2014-12-03
[10] 徐艷龍,艾中秋.RS-1100催化劑在柴油加氫裝置上的工業應用[J].石油煉制與化工,2013,44(10):49-52
[11] 班志輝,王樹東,吳迪鏞.在RuAl2O3催化劑上用H2對SO2選擇性催化還原的研究[J].環境污染治理技術與設備,2001,2(3):36-43
[12] 郭大為,李倩,陳西巖,等.煙氣脫硫、脫氮吸附劑再生過程的考察[J].石油煉制與化工,2012,43(2):9-14
[13] 張登峰.煙氣同時脫硫脫氮技術[J].環境科學與管理,2007,32(7):110-114
[14] 利鋒.電子束照射法脫硫脫氮技術工藝[J].環境保護科學,2004,30(3):4-6
[15] Lowell P S,Schwitzgebel K,Parsons T B,et al.Selection of metal oxides for removing SO2from flue gas[J].Ind Eng Chem Process Des Dev,1971,10(3):384-390
[16] 朱鵬,李雪輝,王芙蓉,等.硫化CoMoAl2O3催化劑上H2同時催化還原SO2和NO:Ⅱ.催化反應活性相及機理探討[J].無機化學學報,2008,24(12):1975-1982
[17] 辛勤,羅孟飛.現代催化研究方法[M].北京:科學出版社,2009:201

