氟比洛芬淀粉酯的酶促合成
段春影,王金龍,于志超
(齊齊哈爾工程學院 管理工程系,黑龍江 齊齊哈爾 150030)
氟比洛芬是新一代的非甾體抗炎藥,具有消炎、止痛和退熱功能,臨床上多用于治療肌肉、骨骼和關節的疼痛[1-2]。氟比洛芬的物理性質主要表現為白色或類白色結晶性粉末,不溶于水,易溶于有機溶劑,熔點為114~117 ℃[3]。氟比洛芬通過抑制身體內某種酶的活性,從而達到鎮痛的作用。目前,氟比洛芬緩釋膠囊劑已在日本上市,該藥口服有效、耐受性好,長期使用不會對身體代謝造成傷害。此外,還有栓劑、親水凝膠骨架片、固體分散體等制劑正在研究中。氟比洛芬分子中有一個氟原子,氟原子的獨特性能使其在同類藥物中作用較強,治療劑量小,副作用較低[4]。
氟比洛芬酯是非甾體抗炎藥氟比洛芬的酯類前體藥物,對癌癥性疼痛和術后疼痛的臨床療效明顯。超前鎮痛,指在中樞神經系統敏感化之前,通過使用藥物,消除或減輕術后疼痛[5]。非甾體抗炎藥的作用機理主要是通過抑制環氧合酶,使外周和中樞前列腺素的含量降低,從而抑制外周和中樞的活性,進而減輕有害刺激引起的疼痛反應[6]。有研究報道:在甲狀腺切除手術中,氟比洛芬酯的超前鎮痛作用能夠顯著減少麻醉藥品的使用量[7]。
本研究通過單因素實驗和正交試驗,確定制備氟比洛芬淀粉酯的最佳工藝條件,為接下來的相關研究提供一定的科學依據。
1 材料與方法
1.1 材料與試劑
玉米淀粉,黑龍江龍鳳玉米開發有限公司;氟比洛芬,太倉運通生物化工有限公司;Novozym 435,諾維信公司;異辛烷,山東樺超化工有限公司;無水乙醇,天津市天力化學試劑有限公司。
1.2 儀器與設備
BSA220S-CW精密天平,Sartorius公司;BSA224S-CW分析天平,Sartorius公司;EMS-8C恒溫磁力攪拌器,天津歐諾儀器儀表有限公司;DHG-9053A電熱恒溫干燥箱,上海一恒科學儀器有限公司;2-16k高速冷凍離心機,Sigma公司;JJ-1精密定式電動攪拌器,江蘇榮華儀器制造有限公司;旋光儀;紫外高效液相色譜儀。
1.3 方法
1.3.1 玉米淀粉的預處理方法
將質量比為2 ∶1的氫氧化鈉和尿素加入100 mL去離子水,配制成濃度為9%的氫氧化鈉/尿素混合溶液,置于冰箱中冷卻至-12 ℃左右;在快速攪拌下緩慢加入5%的干基玉米淀粉,繼續攪拌至形成透明、均勻的淀粉糊;滴加稀鹽酸至中性,再慢慢滴加無水乙醇使淀粉沉淀析出;用95%乙醇溶液洗滌析出的淀粉數次直至無氯離子,再用無水乙醇洗滌以脫去水分,50 ℃真空干燥12 h,得到預處理淀粉。
1.3.2 氟比洛芬淀粉酯的酶催化合成工藝流程
氟比洛芬淀粉酯的酶催化合成工藝流程見圖1。
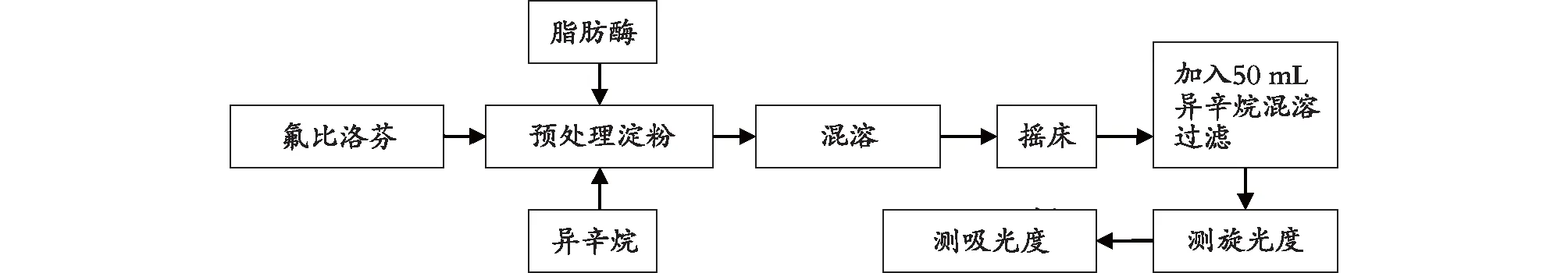
圖1 氟比洛芬淀粉酯的酶催化合成工藝流程
1.3.3 氟比洛芬淀粉酯合成單因素實驗
1.3.3.1 底物質量比對酶促反應的影響
氟比洛芬與預處理淀粉的質量比分別為0.5∶1、1∶1、1∶2、1∶3、2∶1,反應時間為6 d,反應溫度為50 ℃,酶添加量為3%。利用旋光儀和紫外分光光度計對反應產物進行測定,得出不同質量配比條件下的旋光度和吸光度,然后計算反應產物的轉化率和EEp。
1.3.3.2 反應溫度對酶促反應的影響
反應溫度的變化范圍為50~70 ℃,間隔溫度為5 ℃,反應時間為6 d,氟比洛芬與預處理淀粉的質量比為1∶2,酶添加量為3%。利用旋光儀和紫外分光光度計對反應產物進行測定,得出不同反應溫度條件下的旋光度和吸光度,然后計算反應產物的轉化率和EEp。
1.3.3.3 反應時間對酶促反應的影響
反應時間的變化范圍為3~7 d,間隔時間為1 d,反應溫度為50 ℃,氟比洛芬與預處理淀粉的質量比為1∶2,酶添加量為3%。利用旋光儀和紫外分光光度計對反應產物進行測定,得出不同反應時間條件下的旋光度和吸光度,然后計算反應產物的轉化率和EEp。
1.3.3.4 酶添加量對酶促反應的影響
酶添加量分別為3%、5%、7%、9%,間隔用量為2%,反應溫度為50 ℃,反應時間為6 d,氟比洛芬與預處理淀粉的質量比為1∶2。利用旋光儀和紫外分光光度計對反應產物進行測定,得出不同酶添加量條件下的旋光度和吸光度,然后計算反應產物的轉化率和EEp。
1.3.4 酶促酯化反應工藝條件的優化
在單因素實驗的基礎上,設計L9(34)正交試驗(見表1)。初始水活度控制在0.1,以氟比洛芬的轉化率和產物對映體過量值作為評價指標。
1.3.5 旋光值和吸光度的測定
1.3.5.1 旋光值的測定

表1 正交試驗因素水平表
在反應好的產物中加入47 mL異辛烷,將其徹底溶開,然后將旋光儀打開預熱10 min,選擇1 dm長度的旋光管進行測量,在測量之前注意用異辛烷進行調零。
1.3.5.2 吸光度的測定
用721分光光度計在294 nm處測量每組產物的吸光度,在測量之前用異辛烷進行調零,然后將反應后的樣品倒入比色皿,從而得出實驗數據。
1.3.6 計算方法
首先利用旋光儀測出旋光度,根據公式[α] Dt=αDt/Ld=αDt/Lc進行計算,其中,L是旋光管的長度,c是測定液的濃度;然后利用C%=M剩/M原,計算產物的轉化率;再利用EEs=[α]Dt/77求出EEs;最后根據EEp=EEs×(1-C)/C,得出產物的對映體過量值。
1.3.7 標準曲線的繪制
稱取1g氟比洛芬原料藥置于10 mL容量瓶中,加入適量的pH 7.4磷酸鹽緩沖液,使其充分溶解,以空白灌流液定容配制成質量濃度為1 mg·L-1的標準液。分別精密移取不同體積的氟比洛芬標準液至容量瓶中,以空白灌流液定容配制成質量濃度分別為0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45、0.50 mg/L的氟比洛芬系列標準液,根據氟比洛芬的濃度和吸光度進行線性回歸計算。
1.3.8 數據統計與分析
重復測定3次,取測定數據的平均值,通過SPSS軟件進行數據處理,采用Microsoft Excel 2003軟件制圖。
2 結果與討論
2.1 氟比洛芬標準曲線的繪制
在實驗條件下,以吸光度(Y)為縱坐標、氟比洛芬的濃度(X)為橫坐標,繪制標準工作曲線。氟比洛芬標準液的濃度范圍在0.05~0.50 mg/L。由圖2可以看出,吸光度與氟比洛芬的濃度呈良好的線性關系,相關系數均大于0.99。氟比洛芬的標準曲線方程是y=7.04x+0.172,R2=0.997。
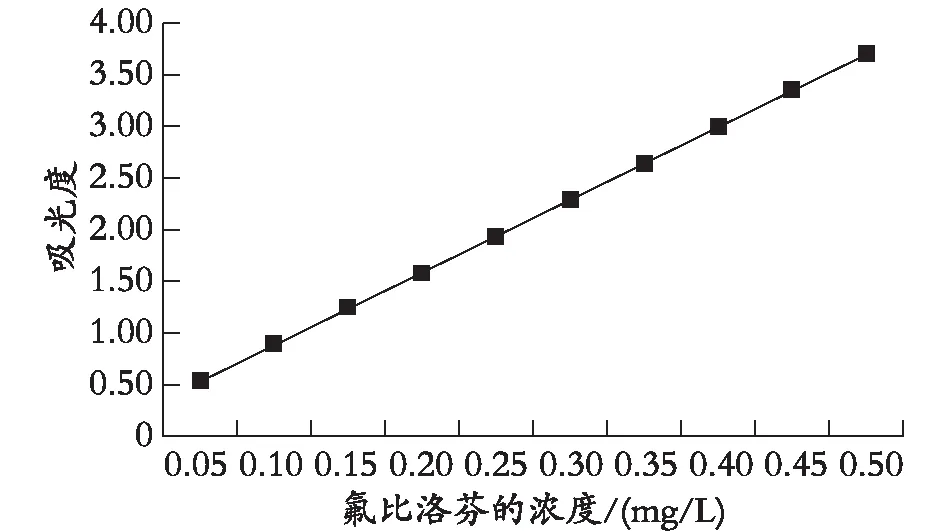
圖2 氟比洛芬的標準曲線
2.2 氟比洛芬淀粉酯合成單因素實驗結果
2.2.1 底物質量比對酶促反應的影響
由圖3可知,當底物質量比為0.5 ∶1時,EEp最高,但是產物轉化率僅為13%;當底物質量比為1∶2時,產物轉化率和EEp分別為25.6%和40.2%。綜合考慮,在底物質量比為1∶2的條件下,氟比洛芬淀粉酯的轉化率和EEp為最佳。
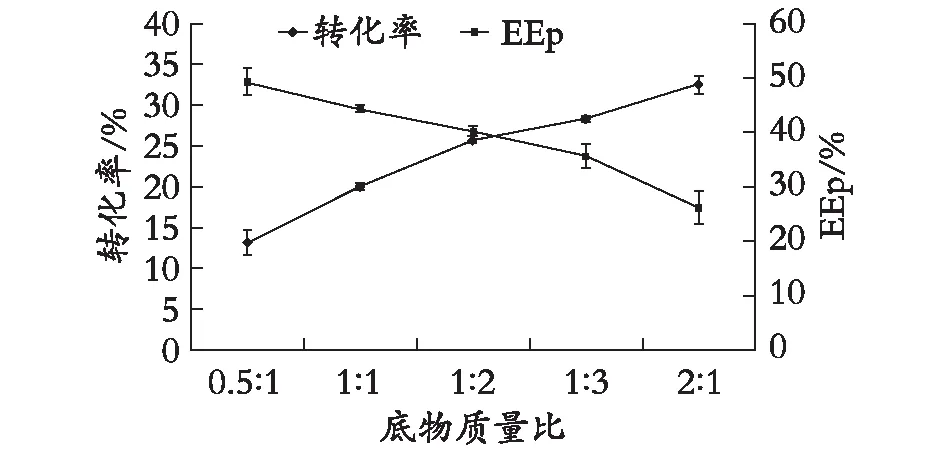
圖3 底物質量比對酶促反應的影響
2.2.2 反應溫度對酶促反應的影響
在酶添加量、反應時間及底物質量比不變的條件下,反應溫度對氟比洛芬淀粉酯的轉化率及EEp的影響見圖4。在反應溫度為60 ℃時,氟比洛芬淀粉酯的轉化率為28.3%,對映體過量值EEp為35.4%。轉化率隨著溫度的升高而不斷增長,但是當溫度過高時,酶的活性受到影響,所以增長趨勢逐漸減緩。對映體過量值隨著溫度的升高呈下降趨勢。綜合考慮,當反應溫度為60 ℃時,產物轉化率和對映體過量值EEp為最佳。
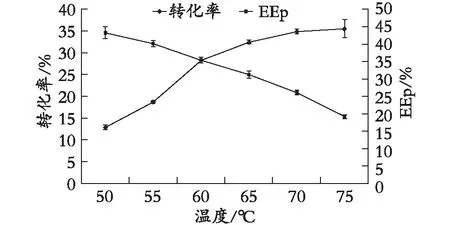
圖4 反應溫度對酶促反應的影響
2.2.3 反應時間對酶促反應的影響
在其他反應條件不變的情況下,反應時間對氟比洛芬淀粉酯的轉化率及EEp的影響見圖5。隨著時間的延長,氟比洛芬淀粉酯轉化率從12.3%增長到29.7%,而對映體過量值EEp從35.6%降到26.5%。在反應時間為4 d時,轉化率和EEp分別為22.3%和33.4%。綜合考慮,當反應時間為4 d時,產物轉化率和對映體過量值EEp為最佳。
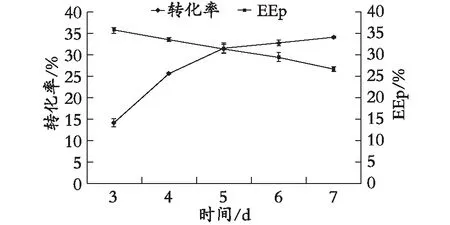
圖5 反應時間對酶促反應的影響
2.2.4 酶添加量對酶促反應的影響
在其他反應條件不變的情況下,酶添加量對氟比洛芬淀粉酯的轉化率及EEp的影響見圖6。當酶添加量為5%時,產物轉化率和EEp分別為15.6%和34.8%。隨著酶添加量的增加,產物轉化率也相應提高,但對映體過量值隨著酶添加量的增加呈下降趨勢。綜合考慮,當酶添加量為5%時,產物轉化率和對映體過量值EEp為最佳。
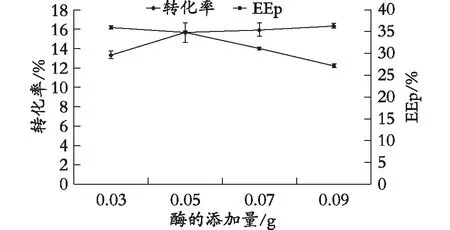
圖6 酶添加量對酶促反應的影響
2.3 氟比洛芬淀粉酯合成正交試驗結果
從表2可以看出,氟比洛芬淀粉酯極差R值的變動范圍在0.028~0.204時,酶添加量的影響最大,反應溫度的影響最小。通過正交試驗,確定制備氟比洛芬淀粉酯的最佳工藝條件為A2B1C2D2,即酶添加量5%、反應時間4 d、底物比1∶2、反應溫度60 ℃,在此條件下,產物轉化率為35%,對映體過量值EEp為55.45%。
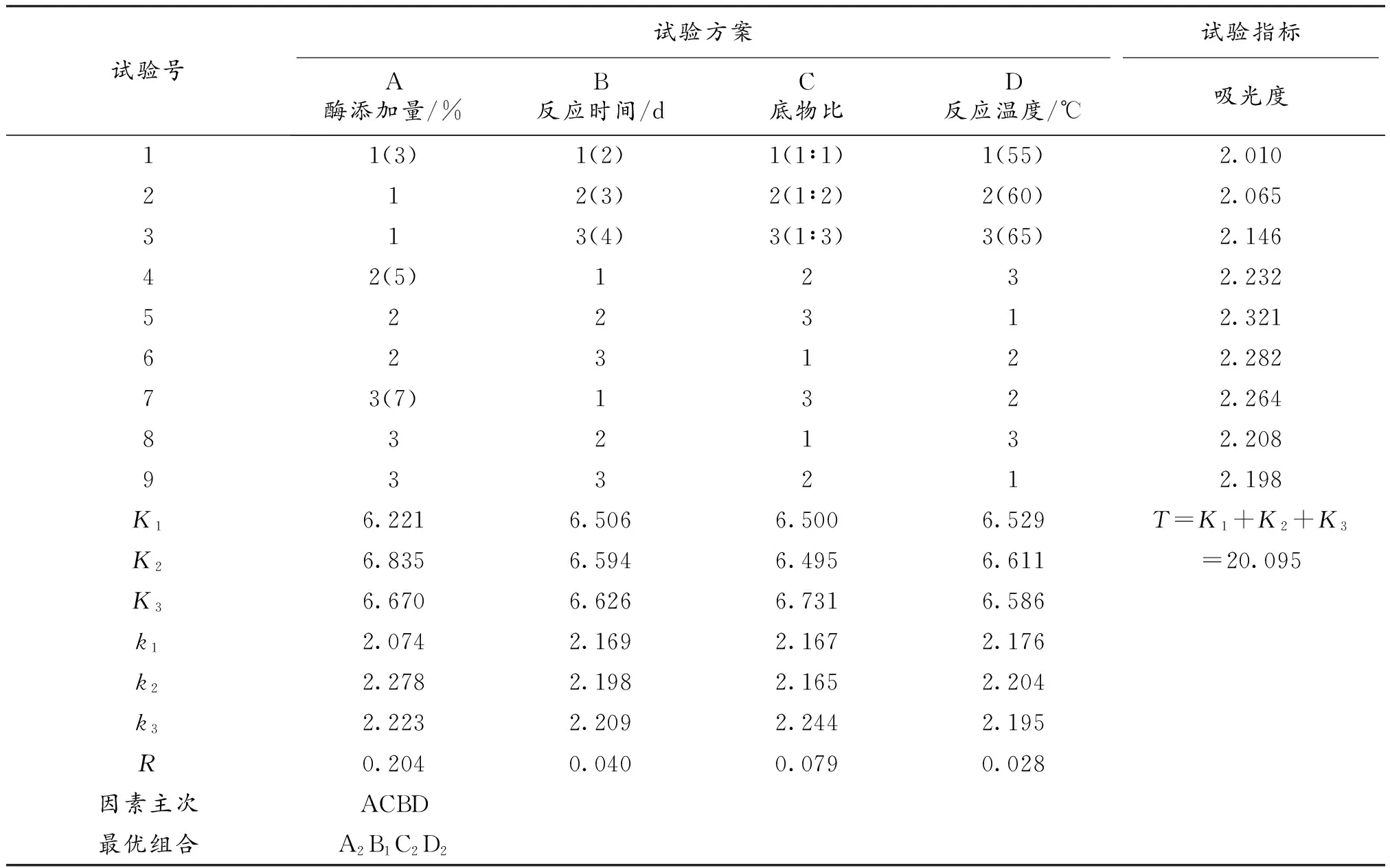
表2 正交試驗結果
3 結論
外消旋體的拆分方法包括物理、化學、生物、色譜、萃取和分子印跡等拆分法。物理拆分法[8-9]主要是利用一定溫度下某一旋光異構體的溶解度比外消旋體小的原理,通過加入單一的旋光異構體,使其析出異構體的結晶,最終獲得單一對映體。它是最原始、最經濟的方法,但是該方法的收率低,過程煩瑣,對于工業化生產并不適用。目前,最常用的是化學拆分法[10],主要是通過結晶和重結晶的方法對某種對映體進行提純分離。
一般采用脂酶催化酯交換的方法獲得R-2-苯氧基丙酸衍生物時,可以通過加入甲醇鈉,在加熱的條件下對無效的 S-2-苯氧基丙酸衍生物進行不斷的消旋化[11],進而使分子達到最大程度的拆分。廖本仁等[12]以取代水楊醛為消旋催化劑,在扁桃酸手性助劑作用下實現了苯甘氨酰胺的動態動力學拆分,其單程收率超過82%,光學純度達99%。
隨著固定化酶技術的不斷發展,酶拆分技術在手性拆分中有著良好的前景。生物拆分法現已廣泛應用于手性醇[13]、胺類藥物[14]、氨基酸[15-16]等的手性拆分中。徐剛等[17]對不同來源的酶進行篩選,選出兩種選擇性較強的酶用于拆分2-氯-1-(2-噻吩)-乙醇,其對映體過量值高達98.5%。由于氟比洛芬有R、S兩種構型,而435脂肪酶只對R型有專一作用,因此可以將氟比洛芬酯化拆分,從而得到在醫療方面更有用的R型。在酯化過程中,淀粉主要起到緩釋作用,減輕藥物對腸胃的副作用。
本文通過單因素實驗和正交試驗,確定制備氟比洛芬淀粉酯的最佳工藝條件:酶添加量5%、反應時間4 d、底物比1∶2、反應溫度60 ℃。在此條件下,產物轉化率為35%,對映體過量值EEp為55.45%。
[1]BLENAU W,BAUMANN A. Molecular and pharmacological properties of insect biogenic amine receptors: lessons from drosophila melanogaster and apis mellifera [J].Archives of insect biochemistry and physiology,2001(1):13-38.
[2]石勁敏,鄧巧林,李端.2-芳基丙酸類藥物的立體選擇性藥效學及藥動學[J].中國藥理學通報,2003(4):379-383.
[3]LIU Z H,LIU K X. The transporters of intestinal tract and their study methods [J].Acta pharmaceutica sinica,2011(4):370-376.
[4]樊德厚,王永利.中國藥物大全:西藥卷[M].3版.北京:人民衛生出版社,2005.
[5]俞衛鋒.麻醉與復蘇新論[M].上海:上海第二軍醫大學出版社,2001.
[6]米勒.米勒麻醉學[M].7版.曾因明,鄧小明,譯.北京:北京大學醫學出版社,2006.
[7]ZHANG Z,ZHAO H,WANG C,et al. Lack of preemptive analgesia by intravenous flurbiprofen in thyroid gland surgery: a randomized, double-blind and placebo-controlled clinical trial [J].International journal of medical sciences,2011(8):433-438.
[8]黃蓓,楊立榮,吳堅平.手性拆分技術的工業應用[J].化工進展,2002(6):375-380.
[9]尤田耙.手性化合物的現代研究方法[M].合肥:中國科學技術大學出版社,1993.
[10]戴震,王大慧.概述手性藥物的研究與制備[J].江蘇藥學與臨床研究,2003(5):24-27.
[11]ROGER A SHELDON,鄭雪珠.純對映體藥物的工業合成[J].藥學進展,1991(3):148-154.
[12]廖本仁,安國成,竹俊如,等.苯甘氨酰胺結晶誘導的動態動力學拆分[J].有機化學,2011(9):1495-1498.
[13]VAKHLU J,JOHRI S,VERMA V. Purification and properties of enantioselective ester hydrolase from a strain of trichosporon species [J].Enzyme and microbial technology,2005(3):330-339.
[14]KOSJEK B,TELLERS D M,BIBA M,et al. Biocatalytic and chemocatalytic approaches to the highly stereoselective 1,2-reduction of an α,β-unsaturated ketone [J].Tetrahedron: asymmetry,2006(19):2798-2803.
[15]ZIMMERMANN V,BELLER M,KRAGL U. Modelling the reaction course of a dynamic kinetic resolution of amino acid derivatives: identifying and overcoming bottlenecks [J].Organic process research & development,2006(3):622-627.
[16]丁國鈺,彭佳敏,郭婷婷,等.利用色氨酸酶酶法拆分D,L-絲氨酸制備D-絲氨酸[J].精細化工,2012(10):947-951.
[17]徐剛,程詠梅,吳堅平,等.有機相酶催化拆分制備(S)-2-氯-1-(2-噻吩)-乙醇[J].有機化學,2007(7):857-861.

