紫外輻射對兩種海洋微藻生長及培養體系碳流的影響
廖健祖, 郭亞娟, 袁翔城, 周偉華, *, 黃暉
?
紫外輻射對兩種海洋微藻生長及培養體系碳流的影響
廖健祖1, 2, 3, 4, 郭亞娟1, 3, 4, 袁翔城1, 3, 周偉華1, 3, *, 黃暉1, 3
1. 中國科學院南海海洋研究所, 中國科學院熱帶海洋生物資源與生態重點實驗室, 廣州 510301 2. 中國科學院南海海洋研究所, 中國科學院熱帶海洋環境國家重點實驗室, 廣州 510301 3. 中國科學院海南熱帶海洋生物實驗站, 三亞 572000 4. 中國科學院大學, 北京 100049
以硅藻威氏海鏈藻()和甲藻錐狀斯氏藻()為實驗材料, 通過室內模擬華南地區秋季晴天紫外輻照強度, 研究兩種不同波段的紫外輻射(Ultraviolet radiation, UVR)對兩種微藻生長以及培養體系碳流的影響。結果表明: UV-A對兩種微藻的生長有顯著的促進作用, 而UV-B則表現為抑制作用。錐狀斯氏藻對UV-B的耐受性更強。在UV-A的作用下, 培養體系中溶解無機碳(Dissolved inorganic carbon, DIC)的凈消耗量低于對照組, 但釋放出更多的溶解有機碳(Dissolved organic carbon, DOC)。對照組的有色溶解有機物(Chromophoric dissolved organic matter, CDOM)含量顯著升高, 表明浮游植物生長過程是CDOM的來源之一。然而, 在UV-A的作用下, 兩種微藻培養體系的CDOM濃度變化呈現相反趨勢, 說明不同藻種的CDOM產物受光漂白和光腐殖化的影響不同。在UV-B的作用下, 微藻碎屑的分解使水體DIC和DOC濃度輕微升高。總體上, 錐狀斯氏藻比威氏海鏈藻凈釋放出更多的DOC和CDOM。
威氏海鏈藻; 錐狀斯氏藻; 紫外輻射; 碳流
1 前言
紫外輻射(Ultraviolet radiation, UVR)根據波長不同分為: UV-A(315—400 nm)、UV-B(280—315 nm)和UV-C(200—280 nm), 其中UV-C被大氣中的臭氧層全部吸收, UV-B大部分被吸收, 而波長較長的UV-A基本不受影響。工業革命以來, 受人類活動的影響, 臭氧層被削薄使更多的UVR能達到地球的表面。由于太陽輻射在熱帶和亞熱帶地區比高緯度地區有更高的輻照量, 南海浮游植物常暴露于高劑量的UVR下[1]。
浮游植物是海洋中最主要的初級生產者。盡管與陸生植物相比, 它們的生物量非常低, 僅占全球植物碳含量的1—2%, 卻固定了全球約40%的碳[2]。它們在海洋中分布極其廣泛, 是海洋生物泵的驅動者, 在全球尺度上影響著氣候變化以及海洋中的碳循環。硅藻是海洋浮游植物的主要組成部分, 其初級生產力占海洋總初級生產力的40%以上[3]。近年來, 在人類活動和氣候變化的影響下, 海洋中的赤潮肇事種出現由硅藻向甲藻演替的趨勢[4]。
在真光層, 除了可見光(Photosynthetically active radia-tion, PAR), UVR亦可穿透一定的深度[5]。UVR對浮游植物的生長通常被認為是一種負面效應, 如: 抑制光合和生長速率、損傷結構蛋白和DNA分子等[6–7]。然而, UVR也有正面效應的研究報道, 特別是UV-A波段, 在一定程度上可以促進浮游植物的固碳作用[8–9], 以及修復UV-B輻射所導致的損傷[10–11]。同時, UVR對微藻生長和生理的影響也在一定程度上導致水體碳循環的改變[12]。盡管目前已有不少關于UVR對微藻生理生態影響的研究, 然而這些研究大多采用短期或強烈的紫外照射培養方式[13–14]。而UVR對微藻的中長期培養, 以及對培養體系碳循環變化的研究依然缺乏。本實驗擬通過室內模擬華南地區秋季紫外輻照強度, 以海區代表性硅藻—威氏海鏈藻()和甲藻—錐狀斯氏藻()為實驗材料, 研究UV-A和UV-B輻射分別對其生長, 以及培養體系的溶解無機碳(Dissolved inorganic carbon, DIC)、溶解有機碳(Dissolved organic carbon, DOC)和有色溶解有機物(Chromophoric dissolved organic matter, CDOM)等的影響, 以期為分析UVR對浮游植物產量以及海洋碳流途徑的影響提供參考。
2 材料與方法
2.1 實驗材料
實驗所用的威氏海鏈藻和錐狀斯氏藻均由中國科學院南海海洋研究所提供。
2.2 培養方法和條件
將藻種接種于2 L三角瓶中, 采用f/2培養基[15],基礎介質為過濾大洋海水, 在光照培養箱中培養。培養溫度為(25±1)°?, 以日光燈管作為光源, PAR為800—1200 μw·cm-2, 光周期為12 h:12 h, 每天定時晃動4次。待藻細胞生長到指數生長期, 收集細胞進行紫外輻射實驗。
2.3 太陽輻射測定
用北京師范大學生產的FZ-A輻照計、UV-A和UV-B型紫外輻照計測定輻射強度。實驗測定2015年11月23日的太陽輻射情況。測定地點為廣東省廣州市南海海洋研究所(23.1 °N, 113.3 °E)實驗樓樓頂。
2.4 紫外輻射處理
將處于指數生長期的藻細胞分裝于燒杯中, 采用f/2培養基培養, 培養液體積約為3 L, 用聚乙烯薄膜包裹燒杯口從而減少外界CO2的影響, 其它培養條件和方法與實驗前一致。威氏海鏈藻的接種密度為2.37×104個·mL-1, 錐狀斯氏藻為2.88×103個·mL-1。用日本三共株式會社生產的UV-A燈(6 W, 中心波長為352 nm)和UV-B燈(6 W, 中心波長為306 nm)作為添加光源[16], UV-A和UV-B的輻射強度設置約為華南地區秋季晴天正午強度的50%(UV-A: 1200—1400 μw·cm-2, UV-B: 45—55 μw·cm-2) (圖1)。以無UVR為對照組, 每個處理組均設置3個平行樣。整個實驗培養時間為19 d, 每天紫外照射時間為9 h。
2.5 藻類豐度和水體化學指標測定
2.5.1 藻細胞密度的測定
取1 mL藻液于塑料杯中, 加入19 mL稀釋液, 緩緩顛倒數次以搖勻后, 用Beckman細胞計數儀測定, 每個樣品測定三次取平均值。根據公式(1)計算細胞平均生長速率(104個·mL-1·d-1):
平均生長速率=(N—N)/(t—t) (1)
式中:和分別為和時的細胞數量。
2.5.2 活體熒光值和葉綠素a(Chlorophyll, Chl)濃度的測定
用熒光計(Turner Designs TD-700)直接測定活體熒光。Chl濃度的測定采用熒光法, 于90%丙酮中萃取, 冰箱中避光萃取12—24 h, 離心后的上清液用熒光計測定[17]。兩種微藻的生物碳含量按照經驗值50 mg C·(mg Chl)-1進行轉換[18]。
2.5.3 DIC濃度的測定
DIC用AS-C3型DIC分析儀(Apollo SciTech)測定, 通過將定量的海水樣品酸化使其轉化為CO2, 用N2將其吹出送入Li-7000非色散紅外檢測器中進行測定[19]。
2.5.4 DOC濃度的測定和CDOM光譜吸收系數的計算
取經Whatman GF/F濾膜(450 °?灼燒5 h)過濾后水樣約20 mL酸化(pH<2), 冷凍保存, 用島津(SHIMADZU)TOC-VCPH型總有機碳分析儀測定DOC含量。取經0.2 μm的Millipore聚碳酸酯膜過濾后的水樣, 冷凍保存, 用島津(SHIMADZU) UV-2600紫外-可見分光光度計測定CDOM吸收光譜, 以355 nm處的吸收系數(355)表示CDOM 的相對濃度[20]。根據式(2)計算吸收系數:
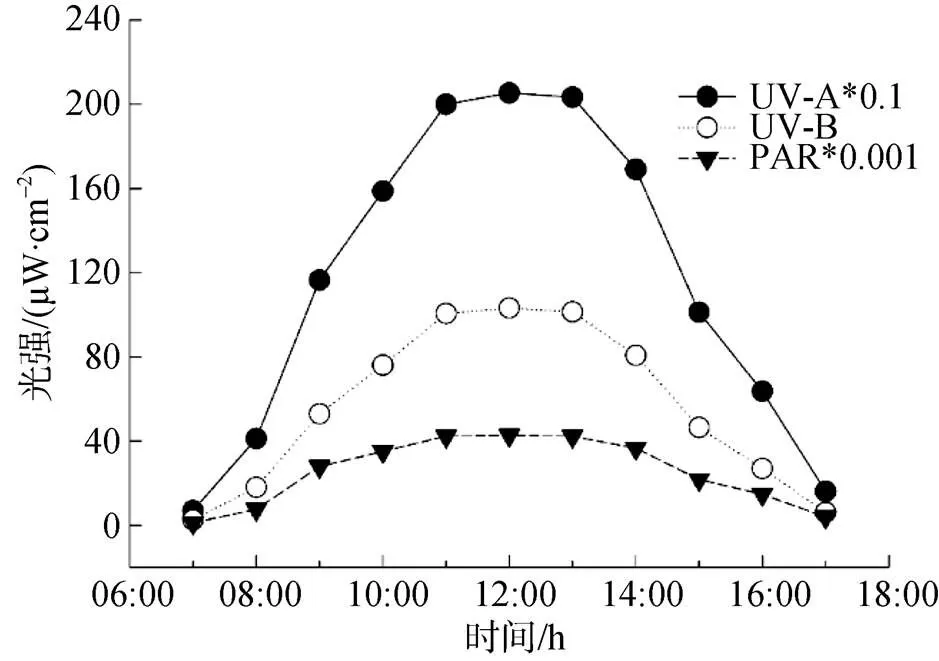
圖1 2015年11月23日的太陽光日輻射強度
=2.303/(2)
式中:為波長的吸收系數(m-1),為吸光度,為光程路徑(m)。
2.6 UV-B對藻細胞密度、活體熒光值和Chl a抑制率的計算
抑制率(%)=(對照組—UV-B組)/對照組 (3)
2.7 數據分析
圖件用Sigmaplot 11.0軟件繪制, 實驗數據采用SPSS 18.0 One-way ANOVA分析, 顯著水平設為<0.05。
3 結果
3.1 不同波段UVR對兩種微藻生長的影響
從兩種微藻的生長曲線(圖2A、B)可以看出, 在不同的UVR處理下, 其總體生長趨勢相同。在UV-A或無UVR(對照組)的作用下, 兩種微藻細胞數量呈逐漸升高趨勢, 培養初期的增長速度較快。在UV-A的作用下, 兩種微藻平均生長速率略有提高, 細胞數量顯著高于對照組(<0.05)。就整個培養階段而言, UV-A組的威氏海鏈藻平均生長速率約為對照組的1.5倍, 錐狀斯氏藻為1.4倍。此外, 與對照組相比, UV-A致使威氏海鏈藻細胞數量最終提高約47%, 錐狀斯氏藻提高35%。在UV-B處理下, 兩種微藻細胞數量顯著快速下降(<0.05)。
兩種微藻在不同UVR處理下的活體熒光值與其細胞密度變化相一致。UV-A處理下的微藻活體熒光值高于對照組, 9 d后顯著升高(圖2C、D)。然而, 在UV-B的培養條件下, 藻細胞活體熒光值在4 d后接近于0。
兩種微藻Chl濃度變化趨勢與其它生長參數相似(圖2E、F)。威氏海鏈藻Chl濃度的最大值比細胞數量的最大值提前出現。在UV-A處理下, 錐狀斯氏藻的Chl濃度始終呈現增長趨勢, 對照組的Chl濃度則在4 d后趨向穩定并維持在15—20 mg·m-3。
從UV-B對兩種微藻生長的抑制率(表1)可以看出, 隨著暴露時間的增加, 其抑制率不斷上升, 培養至4 d時, 抑制率基本高達90%以上。錐狀斯氏藻前3 d的抑制率低于威氏海鏈藻, 表現最為明顯的是活體熒光值, 其次為藻細胞密度和Chl。
3.2 不同波段UVR處理下的兩種微藻培養體系化學參數的變化
兩種微藻培養體系DIC的變化趨勢基本一致(圖3A、B)。對照組DIC濃度下降最快, 培養結束時, 威氏海鏈藻培養體系DIC濃度降低45.6%, 錐狀斯氏藻培養體系降低32.6%。而UV-A組的DIC濃度呈現先下降后上升的趨勢, UV-B組的DIC則表現為緩慢上升。
在不同UVR處理下, 兩種微藻培養水體的DOC濃度均呈上升趨勢(圖3C、D)。在威氏海鏈藻培養水體中, 9 d時各實驗組的DOC濃度接近, 約為3.5 mg·L-1, 此后, UV-A組DOC顯著升高。兩種微藻培養水體的DOC變化趨勢相似, 但錐狀斯氏藻培養水體的DOC增量更高。然而, 對DOC的凈釋放速率進行生物量(Chl濃度)的歸一化分析(表2), 可以看出UV-A致使錐狀斯氏藻DOC的凈釋放速率顯著降低(<0.05), 但對威氏海鏈藻沒有明顯的影響。在培養中期(9 d), 錐狀斯氏藻對照組的DOC凈釋放速率約為威氏海鏈藻的40倍。在培養后期(19 d), 威氏海鏈藻的DOC凈釋放速率有顯著提高。
兩種微藻培養水體的CDOM含量大致呈現先下降后上升的趨勢。在威氏海鏈藻培養水體中, 對照組的CDOM含量>UV-B組>UV-A組。而在錐狀斯氏藻培養水體中, UV-A組的CDOM含量則最高, 而且其對照組和UV-A組CDOM增量均高于威氏海鏈藻(圖3E、F)。
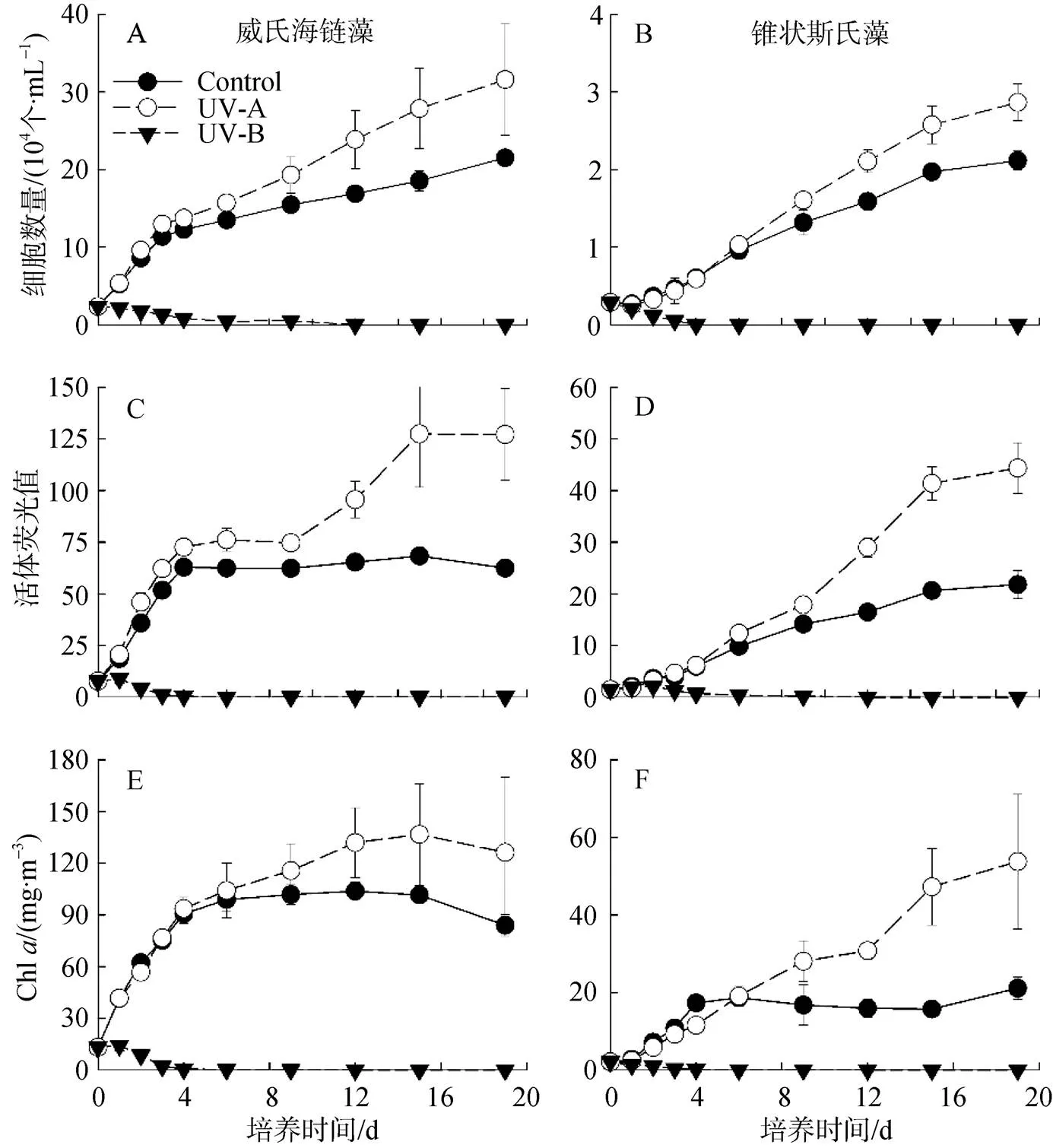
圖2 不同波段紫外輻射對威氏海鏈藻(A, C, E)和錐狀斯氏藻(B, D, F)細胞數量、活體熒光值和葉綠素a的影響
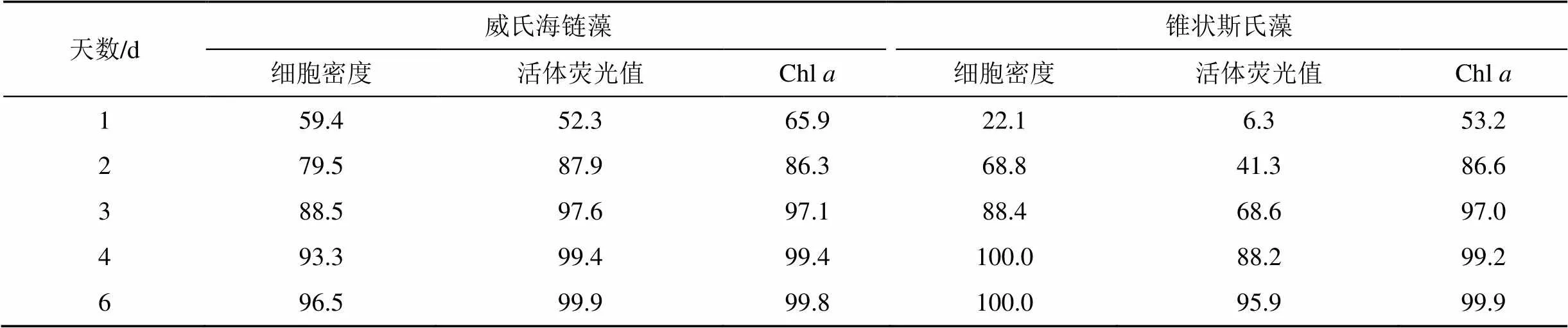
表1 UV-B對威氏海鏈藻和錐狀斯氏藻生長參數的抑制率(%)
注: 培養至6 d時, UV-B對兩種微藻的抑制率均達到95%以上
4 討論
4.1 UVR對微藻生長的影響
一般來說, UVR可抑制海洋微藻的生長和光合作用, 然而低強度的UVR和UV-A也有正面效應的報道。我們的研究發現, 相對于對照組, UV-A顯著地促進了兩種微藻的生長, 而UV-B處理下的微藻在短時間內便出現細胞死亡的現象。
相對于UV-B, UV-A的波長更長, 所含的能量更少, 穿透能力更強, 且光譜更接近可被用于微藻光合作用的藍光。有研究指出, UV-B最短波長(280 nm)對南海浮游植物的單位光能抑制率是UV-A的100萬倍以上[21]。Chl在UV-A波段有較高的吸收峰, 表明Chl可以直接吸收利用UV-A。Gao等[22]認為UV-A是熱帶海洋微藻光合作用的能量來源之一, 特別是在低PAR強度下, UV-A可作為補充光能, 促進其光合固碳和生長。在大型海藻的研究中, Xu等[23]發現UV-A可以促進藻體的光合作用, 并證實了與PAR相似的光利用途徑。然而, 在實驗室模擬實驗中也有報道UV-A可對微藻的生長和光合產生抑制作用, 可能是微藻從室內轉移到室外時, 暴露在室外較高的PAR和UV-A下, 產生了“光氧化”現象, 而在本研究中, PAR輻射強度較低, UV-A起到了促進作用。在南海近岸海域的研究也觀察到UV-A促進微藻光合作用的現象[24]。
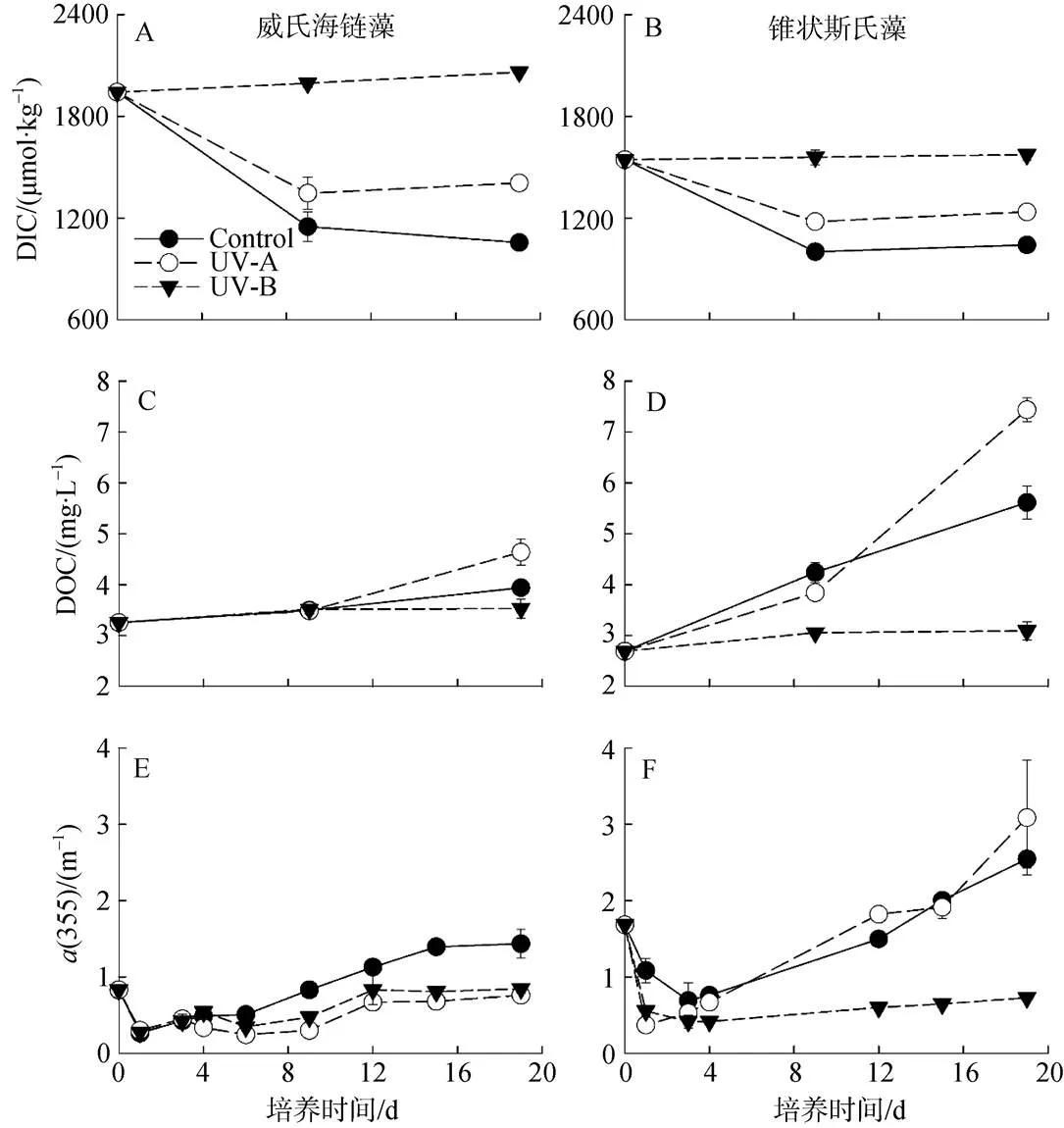
圖3 不同波段紫外輻射對威氏海鏈藻(A、C、E)和錐狀斯氏藻(B、D、F)培養體系溶解無機碳、溶解有機碳和吸收系數a(355)的影響
微藻對UV-B的耐受性可能與細胞大小相關[7]。Karentz等[11]用D37來表示微藻對UV-B的耐受性, 即每殺死一個細胞所需要的輻射劑量。他們發現細胞較小的藻類, 由于具有高的表面積/體積, 其D37值相對低, 因而對UV-B較為敏感。此外, 較大個體的藻細胞能更有效地利用吸光物質作為其光保護機制[25]。威氏海鏈藻的細胞體積(長12—18 μm,寬10—16 μm)比錐狀斯氏藻(長18—30 μm, 寬15—26 μm)小, UVR可能更容易對其造成損傷。影響微藻對UVR耐受性強弱的因素還包括藻細胞壁的厚度和組分、保護機制和自身代謝等因素[26]。Wu等[27]發現與其它兩種海鏈藻相比, 威氏海鏈藻有更高UVR穿透度, 在較高強度的UVR下輻照60 min, 其光化產量抑制率約10%。有學者對錐狀斯氏藻進行長時間的UVR照射培養發現, 錐狀斯氏藻在培養后期可適應在室外太陽光下生長, 并且證實其具有較高的紫外吸收物質的合成速率和D1蛋白的修復速率[28]。本研究通過對比UV-B對兩種微藻生物量參數抑制率(表1)發現, 甲藻錐狀斯氏藻比硅藻威氏海鏈藻耐受性更強。然而, 在靜置培養的條件下, 由于錐狀斯氏藻具有鞭毛, 運動能力比威氏海鏈藻要強, 更有利于其通過主動遷移躲避UV-B, 對實驗結果產生一定的誤差。在自然條件下, 這種有效的躲避機制有助于提高甲藻在種間競爭中的優勢。微藻對UVR的耐受性也與光環境相關, 如熱帶海區的微藻比極地的更耐受, 位于躍層上方的微藻比下方的更耐受[29–30]。此外, 高UVR劑量導致微藻大量死亡的研究也有過相關報道[31]。本研究中受UV-B輻射的藻類在培養過程中全部死亡, 可能的原因有: (1)藻種已在實驗室長期馴化, 很少接受UVR的照射, 實驗中較高的輻射強度容易對其生長產生較強的光抑制[32]; (2)實驗中藻類于固定燒杯中培養, 整個水體均接受較強UV-B輻射, 無法通過垂直遷移等方式來躲避輻射[33]。雖然本實驗不能以偏概全地認為甲藻比硅藻更耐受UVR, 但是甲藻的抗逆性強, 已經成為甲藻赤潮增多的重要原因之一[34]。近年來, 我國近海甲藻類赤潮的發生比例逐漸上升, 已占到赤潮發生總數的一半, UVR的增強可能成為另一個促使甲藻赤潮增多的因素, 具體機理尚需進一步論證[4]。
4.2 UVR對培養體系碳流的影響
培養過程的DIC主要是以微藻光合作用的形式被吸收。在自然條件的海水中, 由于低的CO2濃度以及其在海水中較慢的擴散速度, 海洋微藻形成了一種CO2的濃縮機制(CO2concentrating mechanisms, CCM)[35]。微藻通過該機制使其既能利用CO2, 又能利用HCO3-作為其外源碳源進行固碳作用。而DIC的釋放主要通過呼吸作用, 當光合作用大于呼吸作用時, 水體的DIC減少; 當光合作用小于呼吸作用時, DIC增多。兩種微藻在UV-A的作用下, DIC的凈消耗量均比對照組少, 表明UV-A減少了微藻光合作用對DIC的利用(圖4)。而在UV-B組, 微藻細胞死亡后, 有機碳被分解轉化為無機碳, 使pH降低, DIC升高。
初級生產者通過分泌代謝產物和死亡后產生碎屑等不斷向海水中注入有機物質。研究表明, 微藻DOC的釋放量與營養鹽水平[36]、藻細胞體積[37]以及UVR[12, 38]等相關。UVR對微藻釋放DOC有促進作用, 但高強度的UVR會產生抑制作用[12, 38]。一般認為, 低的光照條件下, 高分子化合物合成速率減弱, 碳被更多地合成容易釋放的小分子代謝物; 在稍高的光強下, 藻類光呼吸作用旺盛, 造成大量乙醇酸的釋放, 因而高DOC釋放量一般出現在近表層和真光層底部[39]; 然而高光強會嚴重損傷藻細胞, 并擾亂細胞正常代謝, 導致DOC釋放量的顯著下降[38]。在本研究中, 對照組和UV-A組的水體DOC含量呈現不斷升高的趨勢, 而UV-B組的DOC也有緩慢上升的趨勢, 說明浮游植物是水體DOC的重要貢獻者。在UV-A處理下, 微藻培養體系的DOC含量顯著升高, 與其高生物量一致。然而, 對DOC的凈釋放速率進行歸一化分析(表2), 可以看出UV-A對錐狀斯氏藻DOC的凈釋放速率有顯著的抑制作用(<0.05), 說明UV-A促使水體DOC含量升高的主要原因是其有效地促進了微藻的生長, 提高了生物量。此外, 不同種類微藻在不同生長期的DOC凈釋放速率也不一樣(表2)。Romera-Castillo等[40]的研究也發現了不同藻類之間DOC釋放率的巨大差異。從UV-B組看出, 兩種微藻細胞碎屑在分解過程中使培養水體DOC濃度略有上升。國內也有開展過相關的研究, 付強等[41]對不同磷濃度培養條件下, 甲藻DOC的釋放量的變化進行了研究, 而劉誠剛[42]在黃海的現場調查表明, 甲藻釋放的DOC比硅藻多, 我們的結果與之相符。
假設微藻光合生產的顆粒有機碳(Particulate organic carbon, POC)除了自身生物量部分, 其余的POC均釋放到水體環境中。對培養9 d的兩種微藻在有無UV-A照射下的碳流進行分析(圖4), 可以看出, 在UV-A的作用下, DIC更多地被分配到藻生物量上, POC的凈釋放減少, 而DOC則無顯著變化。一方面, 在UV-A的作用下, 微藻生長得到促進, 生物量的提高使DOC的生產得到保證。另一方面, UV-A可促進有機碳的分解, 為微藻的生長提供碳源[43]。因此, UV-A對水體的碳流的分配有重要影響。
有色溶解有機物(Chromophoric dissolved organic matter, CDOM)是海洋重要的有機碳組成部分, 可吸收PAR和UVR從而影響光在水層中的穿透能力[44]。一方面, CDOM發色團在吸收光(主要是UVR)的過程中, 會引起其吸光度損失, 該過程稱為光漂白。另一方面, 部分有機物(如: 脂肪酸和甘油三酯)可以在太陽光的作用下轉化成腐殖質, 從而提高了CDOM的含量, 該過程稱為光腐殖化[45]。我們的結果發現, 兩種微藻對照組的CDOM含量升高, 表明浮游植物的生長過程是CDOM的來源之一。然而, 在UV-A的作用下, 兩種微藻培養水體的CDOM濃度變化相反, 可能是不同微藻的CDOM產物受光漂白和光腐殖化的影響不同[46]。UV-B組的CDOM也有升高的趨勢, 可能是由于微藻碎屑降解而產生[47]。總的來說, UVR比PAR對CDOM的光漂白更顯著。然而, 在實驗室模擬實驗過程中很少有考慮到UVR的作用, 使得測量的CDOM值與自然條件下相比偏高。
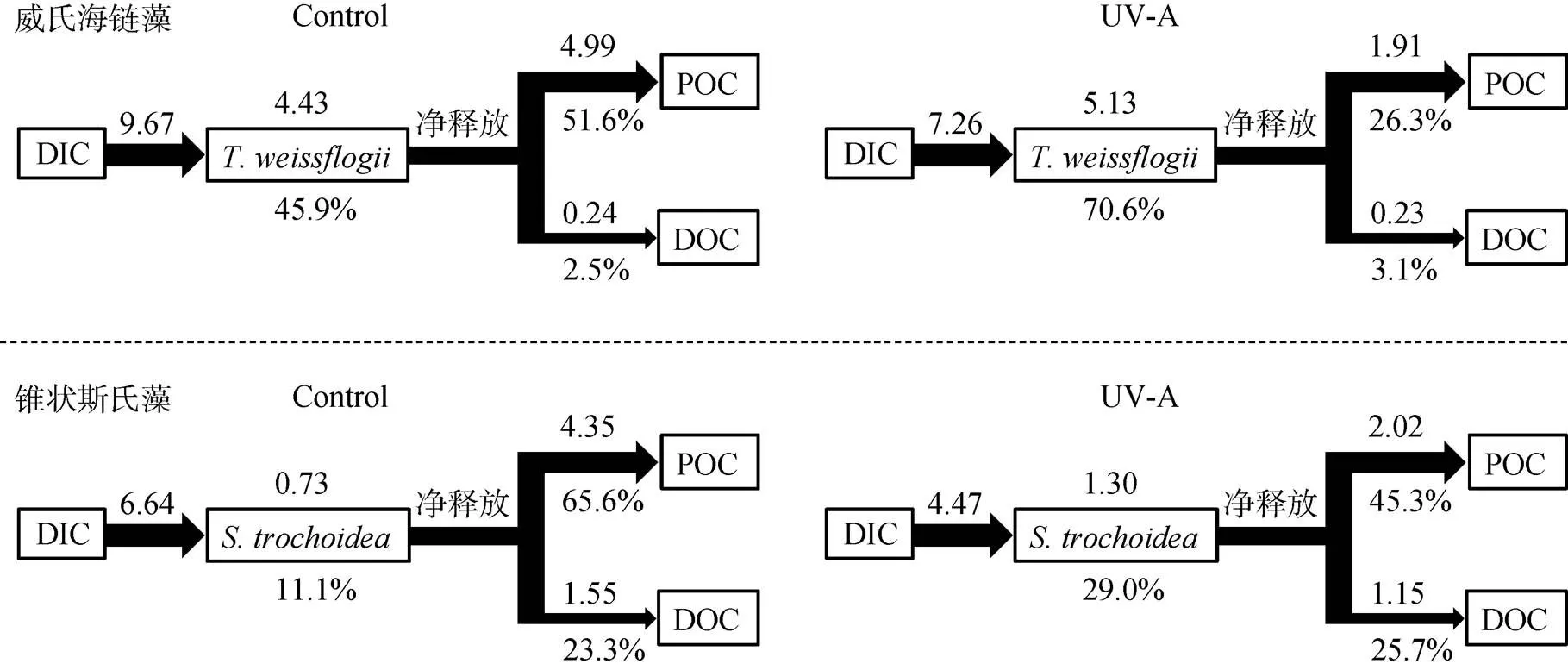
圖4 UV-A作用下的威氏海鏈藻和錐狀斯氏藻在培養至9 d時的碳流(mg C·L-1)
UVR的增強對初級生產者的生長和光合固碳起到了雙刃劍的作用, 對處于表層的初級生產者來說, UVR無疑是一種環境壓力, 初級生產者在應對高強度的UVR時, 提高了其光呼吸作用, 造成初級生產的下降。相對UV-B, UV-A在水層中有更高的穿透力, 在開闊的大洋, 10%的表層UV-A可達30 m以上[48]。因而, UV-A有可能是真光層初級生產者光合作用的光能來源之一。
5 結論
本文通過室內模擬培養實驗, 探討了不同波段UVR對兩種微藻(威氏海鏈藻和錐狀斯氏藻)的生長和培養體系碳流的影響, 主要的結論有:
1) 在低PAR的條件下, UV-A(1200—1400 μw·cm-2)顯著地促進兩種微藻的生長, 然而UV-B(45—55 μw·cm-2)顯示明顯的抑制作用。甲藻錐狀斯氏藻對UV-B的耐受性強于硅藻威氏海鏈藻。
2) 不同UVR和藻種對培養體系碳流的影響存在顯著差異。在UV-A作用下, 微藻對水體DIC的利用減少, 但釋放出更多的DOC, 從而影響水體的碳流過程。在UV-B的作用下, 微藻碎屑分解過程中使培養水體DIC和DOC濃度略有升高。總體上, 錐狀斯氏藻DOC和CDOM的凈釋放量高于威氏海鏈藻。
[1] MADRONICH S. The atmosphere and UV-B radiation at ground level[M]// YOUNG A R, MOAN J, BJ?RN L O, et al. Environmental UV Photobiology[M]. New York: Plenum Press,1993: 1–39.
[2] FALKOWSKI P G. The Role of phytoplankton photos-ynthesis in global biogeochemical cycles[J]. Photosynthesis Research, 1994, 39(3): 235–258.
[3] ROUSSEAUX C S, GREGG W W. Interannual variation in phytoplankton primary production at a global scale[J]. Remote Sensing, 2014, 6(1): 1–19.
[4] 郭皓, 丁德文, 林鳳翱, 等. 近20a我國近海赤潮特點與發生規律[J]. 海洋科學進展, 2015, 33(4): 547–558.
[5] BOOTH C R, MORROW J H. The penetration of UV into natural waters[J]. Photochemistry and Photobiology, 1997, 65(2): 254–257.
[6] H?DER D P, KUMAR H D, SMITH R C, et al. Effects on aquatic ecosystems[J]. Journal of Photochemistry and Photobiology B: Biology, 1998, 46: 53–68.
[7] BOELEN P, DE BOER M K, KRAAY G W, et al. UVBR-induced DNA damage in natural marine picoplankton assemblages in the tropical Atlantic Ocean[J]. Marine Ecology Progress Series, 2000, 193: 1–9.
[8] BARBIERI E S, VILLAFA?E V E, HELBLING E W. Experimental assessment of UV effects on temperate marine phytoplankton when exposed to variable radiation regimes[J]. Limnology and Oceanography, 2002, 47(6): 1648–1655.
[9] HELBLING E W, GAO K S, GON?ALVES R J, et al. Utilization of solar UV radiation by coastal phytoplankton assemblages off SE China when exposed to fast mixing[J]. Marine Ecology Progress Series, 2003, 259(8): 59–66.
[10] QUESADA A, MOUGET J L, VINCENT W F. Growth of Antarctic cyanobacteria under ultraviolet radiation: UVA counteracts UVB inhibition[J]. Journal of Phycology, 1995, 31(2): 242–248.
[11] KARENTZ D, CLEAVER J E, MITCHELL D L. Cell survival characteristics and molecular responses of Antarctic phytoplankton to ultraviolet-B radiation[J]. Journal of Phycology, 1999, 35(27): 326–341.
[12] CARRILLO P, MEDINA-SáNCHEZ J M, VILLAR-ARGAIZ M. The interaction of phytoplankton and bacteria in a high mountain lake: Importance of the spectral composition of solar radiation[J]. Limnology and Oceanography, 2002, 47(5): 1294–1306.
[13] WU H Y, GAO K S. Ultraviolet radiation stimulated activity of extracellular carbonic anhydrase in the marine diatom[J]. Functional Plant Biology, 2009, 36(2): 137–143.
[14] 彭小偉, 何劍鋒, 羅瑋, 等. UV-B短期照射對北極冰川小球藻sp.的生物學效應[J]. 極地研究, 2010, 22(2): 164–173.
[15] ANDERSEN R A. Algal Culturing Techniques[M]. London: Elsevier Acadenmic Press, 2005: 507.
[16] ZHOU W H, YIN K D, YUAN X C, et al. Comparison of the effects of short-term UVB radiation exposure on phytoplankton photosynthesis in the temperate Changjiang and subtropical Zhujiang Estuaries of China[J]. Journal of Oceanography, 2009, 65(5): 627–638.
[17] PARSONS T R, MAITA Y, LALLI C M. A manual of chemical and biological methods for seawater analysis[M]. New York: Pergamon Press, 1984: 475–490.
[18] BARLOW R G, MANTOURA R F C, Cummings D G, et al. Evolution of phytoplankton pigments in mesocosm experiments[J]. Estuarine Coastal and Shelf Science, 1998, 46(Supplement A): 15–22.
[19] 王聰. 差分非色散紅外法測量不同鹽度海水樣品的總溶解無機碳研究[J]. 海洋技術學報, 2014, 33(3): 80–84.
[20] GUO W D, STEDMON C A, HAN Y C, et al. The cones-rvative and non-conservative behavior of chromophoric dissolved organic matter in Chinese estuarine waters[J]. Marine Chemistry, 2007, 107(3): 357–366.
[21] 吳亞平, 高坤山. 夏季南海浮游植物光合固碳對不同波長陽光紫外輻射的響應[J]. 海洋學報, 2011, 33(5): 146–151.
[22] GAO K S, WU Y P, LI G, et al. Solar UV radiation drives CO2fixation in marine phytoplankton: A double-edged sword[J]. Plant Physiology, 2007, 144(1): 54–59.
[23] XU J T, GAO K S. Use of UV-A energy for photosynthesis in the red macroalga[J]. Photochemistry and Photobiology, 2010, 86(3): 580–585.
[24] LI G, GAO K S. Cell size-dependent effects of solar UV radiation on primary production in coastal waters of the South China Sea[J]. Estuaries and Coasts, 2013, 36(4): 728–736.
[25] GARCIA-PICHEL F. A model for internal self‐shading in planktonic organisms and its implications for the usefulness of ultraviolet sunscreens[J]. Limnology and Oceanography, 1994, 39(7): 1704–1717.
[26] 王悠, 楊震, 唐學璽, 等. 7種海洋微藻對UV-B輻射的敏感性差異分析[J]. 環境科學學報, 2002, 22(2): 225–230.
[27] WU Y P, LI Z Z, DU W J, et al. Physiological response of marine centric diatoms to ultraviolet radiation, with special reference to cell size[J]. Journal of Photochemistry and Photobiology B: Biology, 2015, 153: 1–6.
[28] GUAN W C, LU S H. The short- and long-term response of(Pyrrophyta) to solar ultraviolet radiation[J]. Photosynthetica, 2010, 48(2): 287–293.
[29] HELBLING E W, VILLAFA?E V, FERRARIO M, et al. Impact of natural ultraviolet radiation on rates of photosynthesis and on specific marine phytoplankton species[J]. Marine Ecology Progress Series, 1992, 80(1): 89–100.
[30] HELBLING E W, VILLAFA?E V, BUMA A, et al. DNA damage and photosynthetic inhibition induced by solar UVR in tropical phytoplankton (Lake Titicaca, Bolivia)[J]. European Journal of Phycology, 2001, 36(2): 157–166.
[31] 齊雨藻, 黃長江, 應浙鴻, 等. 紫外光對有毒甲藻塔瑪亞歷山大藻的生態學效應[J]. 海洋與湖沼, 1997, 28(2): 113–120.
[32] 金文育, 關萬春, 李平, 等. 三種甲藻對陽光紫外輻射響應機制的種間差異[J]. 水生生物學報, 2015, 39(2): 419–425.
[33] BEBOUT B M, GARCIA-PICHEL F. UV B-induced vertical migrations of cyanobacteria in a microbial mat[J]. Applied and Environmental Microbiology, 1995, 61(12): 4215–4222.
[34] 周名江, 朱明遠. “我國近海有害赤潮發生的生態學、海洋學機制及預測防治”研究進展[J]. 地球科學進展, 2006, 21(7): 673–679.
[35] GIORDANO M, BEARDALL J, RAVEN J A. CO2concentrating mechanisms in algae: Mechanisms, environmental modulation, and evolution[J]. Annual Review of Plant Biology, 2005, 56: 99–131.
[36] HASEGAWA T, KASAI H, ONO T, et al. Dynamics of dissolved and particulate organic matter during the spring bloom in the Oyashio region of the western subarctic Pacific Ocean[J]. Aquatic Microbial Ecology, 2010, 60(2): 127–138.
[37] TEIRA E, SERRET P, FERNáNDEZ E. Phytoplankton size-structure, particulate and dissolved organic carbon production and oxygen fluxes through microbial commu-nities in the NW Iberian coastal transition zone[J]. Marine Ecology Progress Series, 2001, 219(219): 65–83.
[38] FUENTES-LEMA A, SOBRINO C, GONZáLEZ N, et al. Effect of solar UVR on the production of particulate and dissolved organic carbon from phytoplankton assemblages in the Indian Ocean[J]. Marine Ecology Progress Series, 2015, 535: 47–61.
[39] 劉誠剛, 寧修仁, 郝鏘, 等. 海洋浮游植物溶解有機碳釋放研究進展[J]. 地球科學進展, 2010, 25(2): 123–132.
[40] ROMERA-CASTILLO C, SARMENTO H, áLVAREZ- SALGADO X A, et al. Production of chromo-phoric dissolved organic matter by marine phytoplankton[J]. Limnology and Oceanography, 2010, 55(1): 446–454.
[41] 付強, 譚麗菊, 王江濤. 甲藻生長對水體中溶解有機碳(DOC)含量影響[J]. 青島海洋大學學報(自然科學版), 1999, (S1): 191–196.
[42] 劉誠剛. 中國近海浮游植物光合溶解有機碳生產研究[D]. 青島: 中國海洋大學, 2012: 12–87.
[43] WANG X J, LOU T, XIE H X. Photochemical production of dissolved inorganic carbon from suwannee river humic acid[J]. Chinese Journal of Oceanology and Limnology, 2009, 27(3): 570–573.
[44] ZEPP R G, SHANK G C, STABENAU E, et al. Spatial and temporal variability of solar ultraviolet exposure of coral assemblages in the Florida Keys: Importance of colored dissolved organic matter[J]. Limnology and Oceanography, 2008, 53(5): 1909–1922.
[45] KIEBER R J, HYDRO L H, SEATON P J. Photooxidation of triglycerides and fatty acids in seawater: Implication toward the formation of marine humic substances[J]. Limnology and Oceanography, 1997, 42(6): 1454–1462.
[46] ORTEGA-RETUERTA E, RECHE I, PULIDO-VILLENA E, et al. Distribution and photoreactivity of chromophoric dissolved organic matter in the Antarctic Peninsula (Southern Ocean)[J]. Marine Chemistry, 2010, 118(3–4): 129–139.
[47] ZHANG Y L, VAN DIJK M A, LIU M L, et al. The contribution of phytoplankton degradation to chromophoric dissolved organic matter (CDOM) in eutrophic shallow lakes: Field and experimental evidence[J]. Water Research, 2009, 43(18): 4685–4697.
[48] TEDETTI M, SEMPéRé R. Penetration of ultraviolet radiation in the marine environment. A review[J]. Photochemistry and Photobiology, 2006, 82(2): 389–397.
The effects of UVR on the growth of two marine microalgae and the carbon flow in the culture system
LIAO Jianzu1, 2, 3, 4, GUO Yajuan1, 3, 4, YUAN Xiangcheng1, 3, ZHOU Weihua1, 3, *, HUANG Hui1, 3
1. Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China 2. State Key Laboratory of Tropical Oceanography, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China 3. Tropical Marine Biological Research Station in Hainan, Chinese Academy of Sciences, Sanya 572000, China 4. University of Chinese Academy of Sciences, Beijing 100049, China
The effects of two different wavelengths of ultraviolet radiation (UVR) on the growth of two species of marine microalgae, i.e.(diatom) and(dinoflagellate), and the carbon flow in their culture systems were examined. The intensity of simulated UVR in this study was set according to sunny doses in fine day of autumn in southern China. The results showed that UV-A caused a positive effect on the growth ofand, while UV-B obtained an opposite pattern. In general,was much tolerant to UV-B than. Compared to the control, net consumption of dissolved inorganic carbon (DIC) decreased under UV-A exposure. In addition, more dissolved organic carbon (DOC) was released in the culture media under UV-A exposure. The level of chromophoric dissolved organic matter (CDOM) was significantly higher in the control, indicating that microalgae could be an important source for CDOM. However, the change of CDOM level during the experiment also showed an opposite pattern between these two microalgae culture media under UV-A, indicating different processes of photobleaching and photohumification. Under the UV-B exposure, DIC and DOC increased slightly due to the degradation of microalgae detritus. In summary,might release more DOC and CDOM than.
;; ultraviolet radiation; carbon flow
Q178.1+1
A
1008-8873(2018)01-001-09
10.14108/j.cnki.1008-8873.2018.01.001
2017-03-20;
2017-04-14
國家自然科學基金(31370500, 40806050, 31370499)
廖健祖(1992—), 男, 廣東江門市人, 碩士研究生, 主要從事海洋生態環境研究, E-mail: liaojianzu@126.com
周偉華, 男, 博士, 研究員, 主要從事海洋生態環境研究, E-mail: whzhou@scsio.ac.cn
廖健祖, 郭亞娟, 袁翔城, 等. 紫外輻射對兩種海洋微藻生長及培養體系碳流的影響[J]. 生態科學, 2018, 37(1): 1-9.
LIAO Jianzu, GUO Yajuan, YUAN Xiangcheng, et al. The effects of UVR on the growth of two marine microalgae and the carbon flow in the culture system[J]. Ecological Science, 2018, 37(1): 1-9.

