二甲雙胍丁酸鹽對(duì)人肺腺癌A549細(xì)胞增殖、凋亡與遷移能力的影響
陳晴晴,束 軍,謝慶書, 沈繼龍
雙胍類衍生物二甲雙胍是廣泛用于Ⅱ型糖尿病的降糖藥物,主要通過抑制肝糖原產(chǎn)生和增加肌糖原吸收調(diào)節(jié)體內(nèi)血糖的平衡。2005年Evans et al[1]關(guān)于二甲雙胍可降低糖尿病患者腫瘤發(fā)病率的報(bào)道具有里程碑的意義。陸續(xù)有流行病學(xué)調(diào)查顯示二甲雙胍的治療可以減少多種癌癥如乳腺癌、前列腺癌、結(jié)腸癌、胰腺癌和肺癌的發(fā)病率[2-3]。最近的回顧性研究和Meta分析報(bào)道在服用二甲雙胍的患者中癌癥的發(fā)生率降低了31%[4]。目前,許多學(xué)者關(guān)注其抗癌作用,提出二甲雙胍或者相關(guān)的雙胍類可能具有抗腫瘤活性[5]。盡管流行病學(xué)和臨床前研究[6]顯示二甲雙胍具有抗腫瘤效果,但是只有高濃度的二甲雙胍才具有抗腫瘤活性,然而目前還不確認(rèn)高濃度是否具有副作用,因此有人提出對(duì)二甲雙胍衍生物進(jìn)行設(shè)計(jì)、合成并檢測(cè)[7]。近來有研究[8]表明二甲雙胍衍生物二甲雙胍丁酸鹽(metformin butyrate, MFB),激活腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase, AMPK),抑制哺乳動(dòng)物雷帕霉素靶蛋白(mTOR),使細(xì)胞周期停滯在S和G2/M 期的效果更強(qiáng)。MFB具有較強(qiáng)的抗腫瘤活性[8]。雖然二甲雙胍在腫瘤中應(yīng)用已有研究,但是二甲雙胍衍生物 MFB對(duì)肺腺癌細(xì)胞的影響鮮有報(bào)道。該研究旨在探討不同濃度的MFB作用不同時(shí)間后對(duì)A549細(xì)胞增殖、凋亡和遷移能力的影響,從而為肺癌患者的治療提供幫助。
1 材料與方法
1.1主要試劑與儀器MFB、四甲基偶氮唑鹽(MTT)和二甲基亞砜(DMSO)購自美國Sigma公司;胎牛血清購自杭州四季青生物有限公司;RPMI-1640培養(yǎng)基購自美國HyClone公司;流式試劑盒購自上海貝博公司;胰酶購自上海碧云天生物技術(shù)有限公司。CO2細(xì)胞培養(yǎng)箱購自德國Heraeus公司;ELX800UV酶標(biāo)儀購自美國Bio-Tek公司;流式細(xì)胞儀購自美國Beckman公司;超凈工作臺(tái)購自蘇州安泰空氣技術(shù)有限公司;電熱恒溫水浴鍋購自上海天平儀器廠。
1.2方法
1.2.1細(xì)胞培養(yǎng) 人肺腺癌細(xì)胞株A549細(xì)胞由中國科學(xué)技術(shù)大學(xué)惠贈(zèng),用含10%的胎牛血清在37 ℃、5% CO2培養(yǎng)箱內(nèi)常規(guī)傳代培養(yǎng)。細(xì)胞生長到80%時(shí)棄去原有培養(yǎng)基,PBS沖洗,胰酶消化,顯微鏡下觀察當(dāng)細(xì)胞回縮變圓時(shí)終止消化,用移液器吹打,待細(xì)胞分散成單個(gè)細(xì)胞時(shí)離心,重懸,1 ∶3傳代。當(dāng)細(xì)胞處于對(duì)數(shù)生長期時(shí)用于實(shí)驗(yàn)。
1.2.2MTT法檢測(cè)MFB對(duì)肺腺癌細(xì)胞A549增殖的影響 復(fù)蘇的細(xì)胞傳3代之后處于對(duì)數(shù)生長期時(shí),用胰酶消化后加培養(yǎng)基終止消化,4 ℃時(shí)800 r/min下離心5 min。棄上清液,加培養(yǎng)基重懸,細(xì)胞計(jì)數(shù),調(diào)整細(xì)胞濃度,每孔加100 μl使細(xì)胞最終以3×104個(gè)/ml的密度接種到96孔板,邊緣用無菌PBS填充,放于37 ℃、5% CO2孵箱過夜。實(shí)驗(yàn)組加入濃度梯度的MFB(0.5、1、2、4、8 mmol/L),對(duì)照組加入等體積的培養(yǎng)基,每組有6個(gè)復(fù)孔。作用24、48 h后每孔加入20 μl的MTT溶液,繼續(xù)培養(yǎng)4 h,終止培養(yǎng),小心吸去孔內(nèi)培養(yǎng)液。每孔加入150 μl的DMSO,在搖床上低速震蕩10 min,酶標(biāo)儀490 nm處測(cè)量各孔的吸光值。計(jì)算MFB對(duì)細(xì)胞增殖的抑制率,抑制率(%)=[1-實(shí)驗(yàn)組吸光度(optical delnsity,OD)值]/對(duì)照組OD值×100%,實(shí)驗(yàn)重復(fù)3次。
1.2.3流式細(xì)胞術(shù)檢測(cè)MFB對(duì)A549細(xì)胞凋亡的影響 將處于對(duì)數(shù)生長期的A549細(xì)胞(1×105/ml)接種于6孔板,培養(yǎng)24 h后棄去孔內(nèi)的培養(yǎng)基,實(shí)驗(yàn)組加入用培養(yǎng)基稀釋的不同濃度MFB(0.5、1、2、4、8 mmol/L),對(duì)照組加入等體積培養(yǎng)基,置于37 ℃、5% CO2培養(yǎng)箱培養(yǎng),分別于加藥24、48 h后,用胰酶和預(yù)冷的PBS 消化、離心(800 r/min離心4 min)、洗滌、收集細(xì)胞,按試劑盒說明書操作:向流式管中加入5 μl AnnexinV, FITC結(jié)合物,再加入5 μl的PI,室溫下避光培養(yǎng)15 min。加入400 μl的Annexin V Binding buffer,1 h內(nèi)在流式儀上檢測(cè)凋亡情況。實(shí)驗(yàn)重復(fù)3次。
1.2.4劃痕實(shí)驗(yàn)測(cè)MFB對(duì)A549細(xì)胞遷移能力的影響 復(fù)蘇的細(xì)胞傳3代之后處于對(duì)數(shù)生長期時(shí),接種于6孔板(接種前用記號(hào)筆在背面均勻化橫線,間隔0.5~1 cm,每孔至少穿過5條線),待細(xì)胞貼壁長滿時(shí)用藍(lán)色槍頭畫垂直于6孔板背面平行線的直線,槍頭盡量垂直。去除培養(yǎng)基,加PBS清洗3~5次,去除劃下的細(xì)胞,加無血清的培養(yǎng)基,在顯微鏡下拍照,為0 h的劃痕寬度,棄去培養(yǎng)基,加入用培養(yǎng)基稀釋的藥物,使其濃度為2、4、8 mmol/L,對(duì)照組加入等體積的培養(yǎng)基,于24 h在顯微鏡下觀察拍照。然后用Image-pro plus 6.0軟件計(jì)算劃痕的寬度,則細(xì)胞遷移的距離=0 h距離-24 h距離。
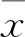
2 結(jié)果
2.1MFB對(duì)A549細(xì)胞增殖的影響A549細(xì)胞在濃度梯度的MFB干預(yù)后,MTT法測(cè)量的OD值如圖1,細(xì)胞生長抑制率如表1。比較5個(gè)濃度的實(shí)驗(yàn)組與對(duì)照組抑制率,差異均有統(tǒng)計(jì)學(xué)意義(P<0.05)。單因素方差分析顯示在同一時(shí)間段,隨著MFB濃度的增加,MFB對(duì)A549細(xì)胞增殖的抑制率增加,差異有統(tǒng)計(jì)學(xué)意義(P<0.05),雙因素方差分析結(jié)果顯示在同一給藥濃度下,MFB對(duì)A549細(xì)胞的增殖抑制率48 h高于24 h,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。
圖1 MTT法檢測(cè)MFB對(duì)A549細(xì)胞增殖的影響

組別OD490值24h48h抑制率(%)24h48h對(duì)照(0mmol/L)0.940±0.0200.940±0.0256.4±22.36.5±2.8實(shí)驗(yàn)(mmol/L) 0.50.872±0.0210.804±0.07213.8±2.5*21.0±8.0* 1.00.790±0.0250.723±0.03022.4±3.1*#29.6±8.1*#▼ 2.00.717±0.0300.635±0.05030.2±3.8*△39.3±6.4*△▼ 4.00.642±0.0500.542±0.05438.1±6.0*▲48.9±7.0*▲▼ 8.00.544±0.0250.456±0.02248.6±5.6*▽58.0±3.8*▽▼
與對(duì)照組比較:*P<0.05;與0.5 mmol/L比較:#P<0.05;與1.0 mmol/L比較:△P<0.05;與2.0 mmol/L比較:▲P<0.05;與4 mmol/L比較:▽P<0.05;與24 h比較:▼P<0.05
24 h時(shí),線性趨勢(shì)檢驗(yàn)F=84.83,P<0.05;48 h時(shí),線性趨勢(shì)檢驗(yàn)F=102.52,P<0.05。綜上可以得出,MFB對(duì)A549細(xì)胞的增殖抑制作用具有一定的濃度依賴性且48 h的作用強(qiáng)度大于24 h。
2.2MFB對(duì)A549細(xì)胞凋亡的影響流式細(xì)胞術(shù)結(jié)果顯示,不同濃度的MFB干預(yù)24 h細(xì)胞凋亡率分別為15.87%、22.79%、27.91%、30.77%、40.65%。 48 h后凋亡率為 22.54%、22.93%、29.73%、49.82%、50.49 %。對(duì)照組為0%、10.45%。實(shí)驗(yàn)組凋亡率高于對(duì)照組,并且相同濃度的MFB 48 h的凋亡率高于24 h。此外還顯示,MFB對(duì)A549細(xì)胞的促凋亡主要表現(xiàn)在晚期。各實(shí)驗(yàn)組與對(duì)照組相比差異均有統(tǒng)計(jì)學(xué)意義(P<0.05),不同濃度的MFB干預(yù)組間差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。見圖2、3。
2.3MFB對(duì)A549細(xì)胞遷移力的影響對(duì)照組細(xì)胞遷移的距離為 (58.37±2.55) μm,實(shí)驗(yàn)組(2、4、8 mmol/L)遷移的距離分別為(52.47±6.21)、(31.87 ±4.65)、(21.53±4.57) μm,不同濃度MFB作用于細(xì)胞后細(xì)胞的遷移能力不同,實(shí)驗(yàn)組遷移的距離小于對(duì)照組,高濃度干預(yù)組細(xì)胞的遷移距離小于低濃度組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。見圖4。
3 討論
眾所周知,癌癥威脅人類健康,肺癌是全球范圍內(nèi)癌癥相關(guān)死亡的主要原因之一,占世界范圍內(nèi)癌癥死亡的31%,盡管診斷和治療方法的完善,5年生存率仍低于15%[6]。復(fù)發(fā)、轉(zhuǎn)移、耐藥、毒副反應(yīng)至今仍是治療的難點(diǎn),此外,一些治療方法雖然效果相對(duì)較好,但是價(jià)格昂貴,給患者帶來較重的經(jīng)濟(jì)負(fù)擔(dān)。因此,尋找新的性價(jià)比高的治療藥物迫在眉睫。小分子化學(xué)藥物對(duì)于腫瘤靶向治療和個(gè)體化治療具有重要意義。然而,小分子新藥的開發(fā),從基礎(chǔ)實(shí)驗(yàn)研究到臨床試驗(yàn)到最終應(yīng)用到臨床實(shí)踐,無疑是一個(gè)漫長的過程,需要消耗大量的時(shí)間、精力和成本。大多數(shù)藥物從實(shí)驗(yàn)室研發(fā)到證實(shí)其有效性和安全性至少需要5年時(shí)間[9]。較之開發(fā)新藥,挖掘傳統(tǒng)非腫瘤藥物的抗腫瘤功能可能是一個(gè)捷徑[5,10]。二甲雙胍因治療糖尿病而被熟知,最近,細(xì)胞實(shí)驗(yàn)和動(dòng)物研究[11-12]均表明二甲雙胍還具有抗癌作用。但是其衍生物MFB的研究較少,其抗癌作用僅在乳腺癌中得到驗(yàn)證[8]。在肺癌中的研究目前未見報(bào)道。從本研究的上述結(jié)果可以顯示低濃度的MFB可以明顯抑制A549細(xì)胞的增殖、遷移,促進(jìn)凋亡,且作用強(qiáng)度存在MFB的濃度依賴性。本課題組前期研究[13]顯示高濃度的葡萄糖可以促進(jìn)肺腺癌細(xì)胞的增殖、遷移。已有研究[6]顯示盡管二甲雙胍可以抑制肺腺癌細(xì)胞的生長,但只有高濃度時(shí)有效果,但此時(shí)濃度之高已超出人體耐受范圍,因此有研究[8]提出,可以對(duì)二甲雙胍結(jié)構(gòu)進(jìn)行改造以達(dá)到使人體可以耐受的程度。MFB的抗腫瘤作用主要通過激活LKB1/AMPK途徑、誘導(dǎo)細(xì)胞周期抑制和(或者)凋亡、抑制蛋白質(zhì)的合成這三條途徑抑制腫瘤的生長。目前二甲雙胍主要通過激活A(yù)MPK、通過調(diào)節(jié)E鈣粘素和基質(zhì)金屬蛋白酶9、基質(zhì)金屬蛋白酶2、血管內(nèi)皮生長因子的表達(dá)來抑制人癌細(xì)胞的遷移和侵襲等[14-17],因此可能對(duì)肺腺癌細(xì)胞具有較好的效果。目前的研究顯示MFB可以有效抑制A549細(xì)胞的增長,促進(jìn)凋亡,抑制遷移。然而本實(shí)驗(yàn)只局限于一種細(xì)胞,在動(dòng)物水平和臨床上的應(yīng)用還有待于進(jìn)一步驗(yàn)證。
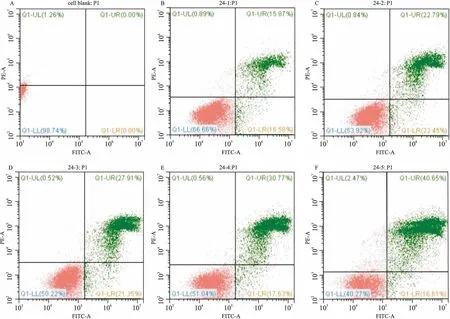
圖2 流式細(xì)胞術(shù)檢測(cè)MFB作用24 h后對(duì)A549細(xì)胞凋亡的影響

圖3 流式細(xì)胞術(shù)檢測(cè)MFB作用48 h后對(duì)A549細(xì)胞凋亡的影響

圖4 MFB對(duì)A549細(xì)胞遷移力的影響 ×100
[1] Evans J M, Donnelly L A, Emslie-Smith A M, et al. Metformin and reduced risk of cancer in diabetic patients[J]. BMJ, 2005,330(7503):1304-5.
[2] Shi W Y, Xiao D, Wang L, et al. Therapeutic metformin/ampk activation blocked lymphoma cell growthviainhibition of mtor pathway and induction of autophagy[J]. Cell Death Dis, 2012,3:e275.
[3] Tsai M J, Yang C J, Kung Y T, et al. Metformin decreases lung cancer risk in diabetic patients in a dose-dependent manner[J]. Lung Cancer, 2014,86(2):137-43.
[4] Gandini S, Puntoni M, Heckman-Stoddard B M, et al. Metformin and cancer risk and mortality: a systematic review and meta-analysis taking into account biases and confounders[J]. Cancer Prev Res (Phila), 2014,7(9):867-85.
[5] Pollak M. Potential applications for biguanides in oncology[J]. J Clin Invest, 2013,123(9):3693-700.
[6] Wang J, Gao Q, Wang D, et al. Metformin inhibits growth of lung adenocarcinoma cells by inducing apoptosisviathe mitochondria-mediated pathway[J]. Oncol Lett, 2015,10(3):1343-9.
[7] Dowling R J, Niraula S, Stambolic V, et al. Metformin in cancer: translational challenges[J]. J Mol Endocrinol, 2012,48(3):R31-43.
[8] Lee K M, Lee M, Lee J, et al. Enhanced anti-tumor activity and cytotoxic effect on cancer stem cell population of metformin-butyrate compared with metformin HCl in breast cancer[J]. Oncotarget, 2016,7(25):38500-12.
[9] 李金平, 寧志豐, 劉復(fù)興, 等. 老藥新用,小分子藥物二甲雙胍的抗腫瘤研究進(jìn)展[J]. 中國生化藥物雜志, 2016, 36(8):16-21.
[10] Kourelis T V, Siegel R D. Metformin and cancer: new applications for an old drug[J]. Med Oncol, 2012,29(2):1314-27.
[11] Anisimov V N, Berstein L M, Egormin P A, et al. Effect of metformin on life span and on the development of spontaneous mammary tumors in her-2/neu transgenic mice[J]. Exp Gerontol, 2005,40(8-9):685-93.
[12] Zakikhani M, Dowling R, Fantus I G, et al. Metformin is an amp kinase-dependent growth inhibitor for breast cancer cells[J]. Cancer Res, 2006,66(21):10269-73.
[13] 李曉峰, 束 軍, 程 宇, 等. 高濃度葡萄糖對(duì)肺腺癌a549細(xì)胞生長及vegf、mmp-2表達(dá)的影響[J]. 安徽醫(yī)科大學(xué)學(xué)報(bào), 2016, 51(3):363-8.
[14] Sun X J, Zhang P, Li H H, et al. Cisplatin combined with metformin inhibits migration and invasion of human nasopharyngeal carcinoma cells by regulating E-cadherin and MMP-9[J]. Asian Pac J Cancer Prev, 2014,15(9):4019-23.
[15] Fang Z, Xu X, Zhou Z, et al. Effect of metformin on apoptosis, cell cycle arrest migration and invasion of a498 cells[J]. Mol Med Rep, 2014,9(6):2251-6.
[16] Laskov I, Abou-Nader P, Amin O, et al. Metformin increases e-cadherin in tumors of diabetic patients with endometrial cancer and suppresses epithelial-mesenchymal transition in endometrial cancer cell lines[J]. Int J Gynecol Cancer, 2016,26(7):1213-21.
[17] Liang G, Ding M, Lu H, et al. Metformin upregulates E-cadherin and inhibits b16f10 cell motility, invasion and migration[J]. Oncol Lett, 2015,10(3):1527-32.

