DNA倍體分析和HPV E6/E7檢測診斷宮頸ASCUS的價值
, ,,,,,,
(1.青島大學附屬威海市立第二醫院病理科;2.理療科;3.兒童保健科 山東 威海 264200)
宮頸癌的發病率是女性生殖系統惡性腫瘤的第一位,而我國宮頸癌的患者數約占世界的1/3以上,其中每年因宮頸癌導致死亡的人數達5萬人,且宮頸癌人群日趨年輕化。因此臨床上對宮頸癌的早期篩查顯得尤為重要。未明確診斷意義的不典型鱗狀上皮細胞(atypical squamous cells of undetermined significance,ASCUS)作為伯塞斯達系統(the Bethesda system,TBS)分類法異常結果報告中最常見的細胞學異常,其在病理組織學上具有診斷及分類的多樣性。據估計ASCUS 婦女中有5%~10%隱匿有嚴重的宮頸癌前病變[1-2],且治療不及時往往可以發展成為宮頸癌。故有關ASCUS的處理是臨床宮頸病變診治的爭論點,且有關其分流處理一直以來是宮頸病變診治中存在的難點。目前宮頸疾病最常用的篩查方法是宮頸細胞學檢查及人乳頭瘤病毒(human papilloma virus,HPV)檢測,但令人遺憾的是無論是傳統的巴氏涂片還是薄層液基細胞學檢查(thinprep cytologic examination,TCT),單一的宮頸細胞學檢查對于宮頸癌前病變及宮頸癌篩查來說,其敏感性均較低[3]。盡管HPV DNA檢測可早期發現HPV感染,但HPV感染大多是一過性的,因此其檢測的敏感性并不高。本研究選取980例ASCUS患者,進行DNA倍體分析聯合HPV E6/E7mRNA檢測,探究兩者對診斷宮頸ASCUS的價值。
1對象和方法
1.1研究對象
選取2015年1月至2017年3月在青島大學附屬威海市立第二醫院婦科門診及住院部就診的TCT結果為ASCUS的患者980例。平均年齡為38.9(20~66)歲。排除標準:妊娠,未婚,子宮切除手術史或宮頸手術史,在行化療或曾經行過化療及盆腔放療者,取標本前3天內有陰道沖洗放藥或性生活史。本研究中所有受檢者均知情同意并簽署同意書,本研究獲得青島大學附屬威海市立第二醫院倫理委員會審核通過。
1.2研究方法
1.2.1標本采集及TCT檢測
所有受試檢者統一由一位有經驗的婦科醫師于經期結束3~10天內以窺陰器暴露子宮頸后擦凈子宮頸口分泌物,采用TCT專用刷在宮頸口順時針旋轉3圈,停留10s取材,標本放入TCT專用保存管保存行TCT常規檢測,剩余標本于-25℃下保存。診斷標準依照癌癥協會推薦的TBS分類標準,其結果描述為:高度鱗狀上皮內病變(high-grade squamous intraepithelial lesions,HSILs);低度鱗狀上皮內病變(low-grade squamous intraepithelial lesions,LSILs);不排除高度上皮內病變的不典型鱗狀細胞(atypical squamouscells-cannot exclude HIS,ASC-H);ASCUS;未見上皮內病變或惡性病變(No intraepithelial lesions or malignant lesions,NILM)。
1.2.2細胞DNA倍體分析
采用DNA-ICM系統對細胞進行掃描分析,以細胞核DNA指數(DI)為判讀標準[(DI=全部被測細胞的DNAIOD值/正常細胞DNA(Go/G1)的IOD平均值)],其中異常倍體細胞包括DI≥2.5為異倍體細胞、非整倍體細胞或4倍體細胞增加≥10%、出現非整倍體細胞峰。而DI:2.2~2.5為非整倍體細胞;DI:1.2~1.8為出現非整倍體細胞。0.8≤DI<1.2為2倍體細胞即2c細胞,1.8≤DI<2.2為4倍體細胞即4c細胞。本研究主要檢測DI>1.25的細胞,包括非整倍體細胞、4c細胞、異倍體細胞。
1.2.3 HPV E6/E7 mRNA檢測
采用科蒂亞生物技術有限公司的Quanti VirusTM診斷試劑盒及Quanti VirusTM冷光儀進行E6/E7 mRNA表達的檢測。將檢測結果通過計算機轉換為拷貝數,以拷貝數≥1copies/mL為陽性,<1copy/mL為陰性。
1.2.4陰道鏡及病理學檢查
對部分細胞學和(或)DNA倍體異常和(或)HPV E6/E7 mRNA檢測陽性的婦女于陰道鏡下行宮頸活組織檢查。其病理學檢查結果包括:宮頸癌、宮頸鱗狀上皮內瘤變(CIN1、CIN2、CIN3/CIS)及正常或良性。
1.3統計學方法
數據分析采用統計軟件SPSS 19.0,率的比較采用卡方檢驗或Fisher精確概率檢驗。以P<0.05為檢驗水準。
2結果
2.1 DNA倍體分析及組織病理學結果
980例經陰道鏡下宮頸活檢的ASCUS患者,CINⅠ及以上病變者458例。DNA倍體正常者369例,其中組織病理學診斷為CIN Ⅰ及以上病變者168例(45.5%);伴1~3個DNA異倍體細胞者143例,CINⅠ及以上病變者38例(26.6%);有>3個DNA異倍體細胞者468例, CIN Ⅰ及以上病變者216例(46.1%)。統計學分析發現,與DNA正常組相比,ASCUS伴DNA異倍體1~3個組發生CIN Ⅰ及以上病變者顯著降低(χ12=15.399,P1=0.000);而ASCUS伴DNA異倍體1~3個組發生CIN Ⅰ及以上病變者低于SCUS伴DNA異倍體>3個組比較,差異具有統計學意義(χ32=17.288,P3=0.000),見表1。DNA倍體分析檢測結果的靈敏度為84.1%,特異性為43.4%。
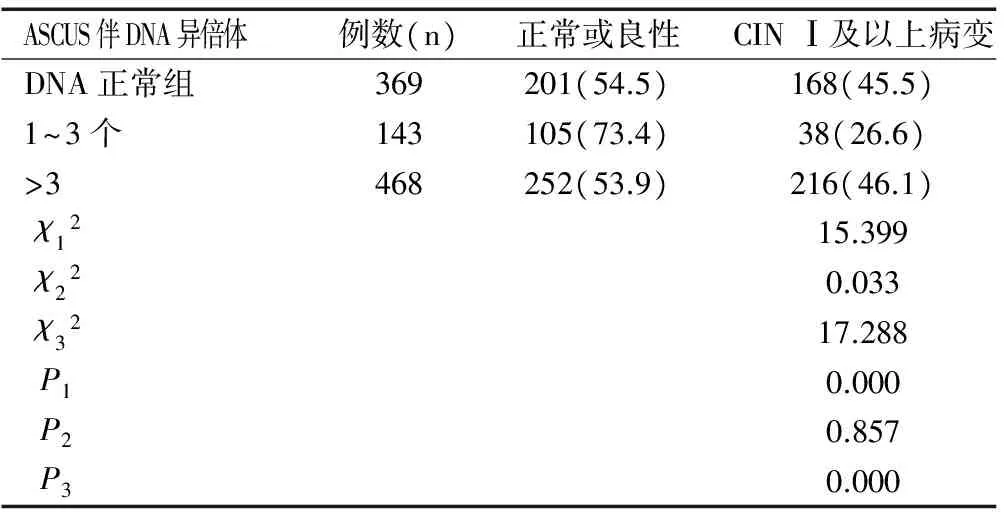
表1 980例ASCUS患者DNA倍體分析與宮頸病變之間的關系[n(%)]Table 1 Relationship between DNA ploidy analysis and cervical lesions in 980 patients with ASCUS[n (%)]
注:χ12、P1表示ASCUS伴DNA異倍體1~3個與DNA正常組相比;χ22、P2表示ASCUS伴DNA異倍體>3個與DNA正常組相比;χ32、P3表示ASCUS伴DNA異倍體1~3個與ASCUS伴DNA異倍體>3個相比。
2.2 HPV E6/E7 mRNA表達及病理檢查結果
各組間的HPV E6/E7 mRNA陽性率有差異,其中CINⅠ及以上的HPV E6/E7 mRNA陽性率顯著高于正常或良性組,差異具有統計學意義(χ2值分別為13.221,35.302,23.894,18.439,均P=0.000),詳見表2。HPV E6/E7mRNA表達檢查結果的靈敏度為90.3%,特異性為49.6%。
2.3 DNA倍體分析聯合HPV E6/E7 mRNA
DNA倍體分析聯合HPV E6/E7 mRNA對CINⅡ及以上病變的檢測結果的靈敏度為92.4%,特異性為32.7%,陽性預測值為41.0%,陰性預測值為89.5%,見表3。
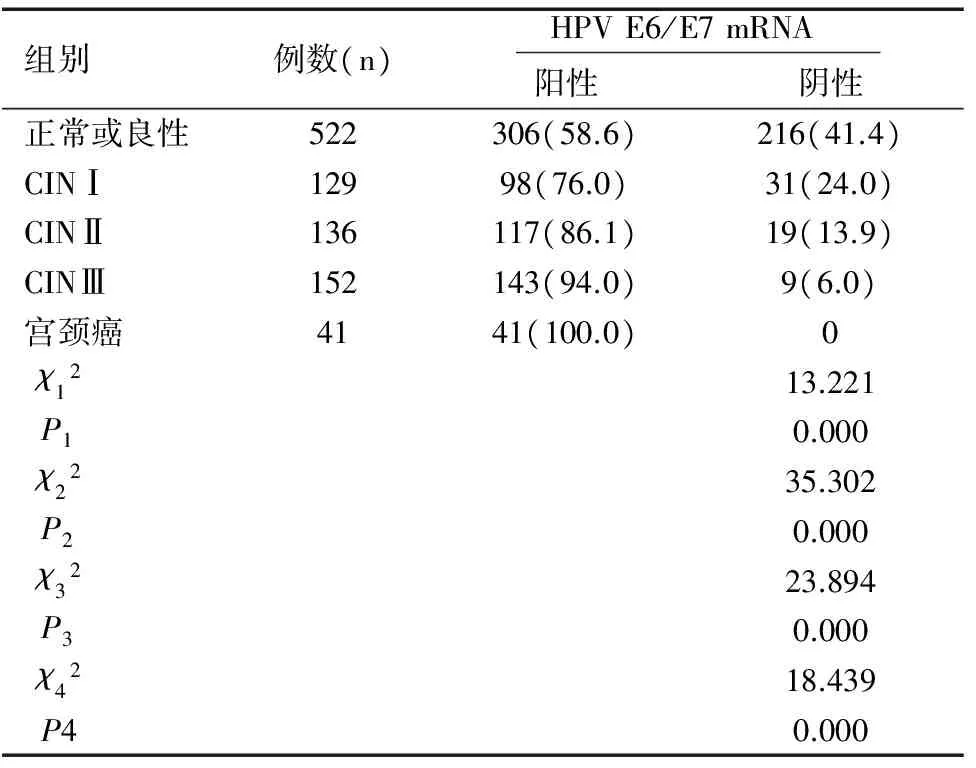
表2 ASCUS患者HPV E6/E7 mRNA表達與宮頸病變之間的關系[n(%)]Table 2 Relationship between HPV E6/E7 mRNA expression and cervical lesions in ASCUS patients[n (%)]
注:χ12、P1表示CINⅠ與正常或良性相比;χ22、P2表示CINⅡ與正常或良性相比;χ32、P3表示CINⅢ與正常或良性相比,χ42、P4表示宮頸癌與正常或良性相比。
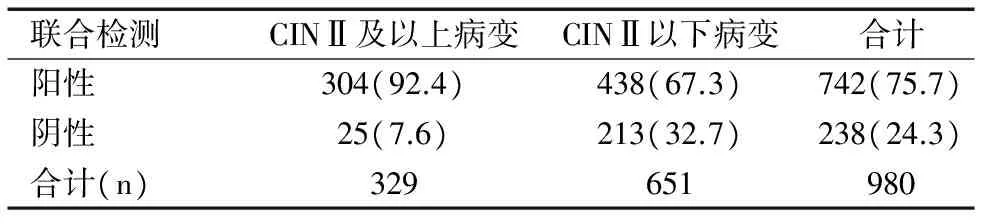
表3 DNA倍體分析聯合HPV E6/E7 mRNA對CINⅡ及以上病變的檢測結果[n(%)]Table 3 Detection results of DNA ploidy analysis combined with HPV E6/E7 mRNA for CIN II and above lesions[n (%)]
3討論
目前推薦的有關宮頸癌的診斷是三階梯的診斷程序,即細胞學-陰道鏡-病理學。其中得益于細胞學檢查的推廣,近幾十年來宮頸癌的發生率在全世界范圍內都表現一個下降的趨勢。盡管如此,但其特異性、敏感性及假陰性率都會使得可疑患者遭受不必要的痛苦。而且并非所有的癌前病變都會進展為浸潤癌,國內學者研究顯示低級別的病變可維持不變或自動逆轉,僅約1/3未經治療的高級別病變可能會在10年內發展成癌[4]。而ASCUS這一術語,它不僅包括與HPV 感染無關的宮頸上皮的良性改變,而且包括與HPV 感染密切相關的CIN 及宮頸癌,即細胞學報告為ASCUS時,其陰道鏡下活檢結果可以是正常宮頸,也可以是早期浸潤癌[5],227例TCT結果為ASCUS患者中CIN的發生率為29.96%,其中高級別的CIN(CIN2和CIN3)的發生率為13.22%,組織病理結果為炎癥的占70.04%。研究表明,ASCUS可能是發現高級別CIN的最早的信號[6-7]。目前,對ASCUS 的處理尚未形成統一的認識,推薦有三種處理方法:①立即行陰道鏡下活檢檢查;②細胞涂片隨訪觀察;③HPV檢測。但對所有病例進行活不但會增加患者的負擔與痛苦,而且也加大醫師工作量;細胞學涂片隨訪又敏感性差且隨訪時間長;HPV檢測可能導致漏診。因此將DNA倍體分析、HPV E6/E7 mRNA與ASCUS病例結合,探索分流ASCUS患者的最佳方案。
3.1 DNA倍體分析與宮頸活檢結果相比
細胞發生癌變時其細胞核內的DNA結構和含量會產生異常變化,導致DNA倍體狀況發生改變,出現DNA異倍體細胞[8]。本研究在DNA倍體分析中發現,與DNA正常組相比,ASCUS伴DNA異倍體1~3個組發生CIN Ⅰ及以上病變者顯著降低,差異具有統計學意義(P1=0.000);而ASCUS伴DNA異倍體1~3個組發生CIN Ⅰ及以上病變者低于SCUS伴DNA異倍體>3個組比較,差異具有統計學意義(P3=0.000),這與國內其他學者的研究結果相一致[9]。而國外學者所進行的回顧性研究結果認為對HR-HPV和DNA倍體分析均為陰性的患者,CINⅠ及以上病變可以1年后隨訪;而對于異倍體細胞為>5c細胞的患者則必須再次行細胞學檢查和(或)陰道鏡檢查[10]。因此,建議經TCT診斷為ASCUS患者可行DAN倍體分析,若DNA倍體正常或為1~3個的患者可定隨訪或先行HPV檢測,無需活檢。但對于DNA倍體>3個者應立即行宮頸活檢。
3.2 HPV E6/E7 mRNA與宮頸活檢結果相比
HPV感染作為宮頸癌發生的主要危險因素,幾乎所有的高級別CIN及宮頸癌都合并有HPV感染[11]。227例宮頸ASCUS患者中,HPV陽性組CIN的檢出率高于HPV陰性組[6]。因此近年來,人們試圖將HPV DNA檢測用于ASCUS的分流處理。但HPV DNA檢測存在一定的局限性,如不能區分宮頸進行性發展的HPV感染、退行性HPV感染及持續性HPV感染,且在凋亡細胞及細胞碎屑中也會出現陽性結果從而增加患者對宮頸癌的精神心理負擔,甚至使得患者接受了過度治療[12]。宮頸上皮細胞感染HR-HPV后,病毒癌基因,即HPV早期編碼區中E6、E7基因的mRNA發生轉錄,生成兩種癌蛋白E6、E7蛋白。E6、E7蛋白可與宿主細胞的抑癌基因p53和Rb蛋白等相結合,從而導致細胞周期的失常,進而使得宿主細胞惡性轉化,導致癌變的發生[13-14]。因此HPV E6/E7 mRNA的檢測能在宮頸組織中表現出癌基因活性[15]。對HPV E6/E7 mRNA進行檢測不僅排除可疑或低度病變的能力強,而且對ASCUS患者的高級別病變具有較高辨別能力,能更好地篩選出高危人群,為臨床醫生提供比DNA檢測更具有預測價值的檢測結果[16]。故HPV E6/E7 mRNA檢測應作為重點研究對象于2006年歐洲生殖器感染和腫瘤研究組織中取得共識[17]。因此,本研究采用HPV E6/E7 mRNA檢測對ASCUS進行分流,結果顯示CINⅠ及以上的HPV E6/E7 mRNA陽性率顯著高于正常或良性組,差異具有統計學意義,這與國外學者Bello等[14]的結論相一致,他們研究發現對于高級別CIN,HPV E6/E7 mRNA檢測具有有更好的特異性。但國內有研究發現HPV E6/E7 mRNA檢測較HR-HPV DNA檢測具有更高的特異性,但它們之間在CIN Ⅰ及以上級別的靈敏度上差異無統計學[18]。國內學者王華等[19]研究顯示,宮頸病變程度越高,HPV E6/E7 mRNA的表達水平也越高,細胞學病變級別不同其CIN的mRNA表達也存在統計學差異。此外,本研究還發現對于CIN Ⅰ以下的病變者,HPV E6/E7 mRNA的陽性率低于CIN Ⅰ及以上病變者,因此認為HPV E6/E7 mRNA檢測對于鑒別宮頸病變是短暫的宮頸異常還是將進一步發展有很大意義。
3.3細胞DNA倍體分析聯合HPV E6/E7 mRNA與宮頸活檢結果相比
本研究發現DNA倍體分析聯合HPV E6/E7 mRNA對CINⅡ及以上病變檢測結果的靈敏度為92.4%,特異性為32.7%。與兩者單獨檢測相比較,兩者聯合的靈敏度有所提高。該理論尚需進一步的驗證。
綜上所述,對于ASCUS患者,臨床醫師需采取更為有效的檢測方案用于ASCUS的分流處理,從而為避免對低風險人群的過度檢查和治療。其中DNA倍體分析及HPV E6/E7 mRNA的檢測可協助臨床醫師減少對ASCUS患者的漏診,同時也能避免給患者帶來過度的檢查及治療,減少患者的痛苦及精神負擔。
[1]Norman I,Hjerpe A,Andersson S.High-risk HPV L1 capsid protein as a marker of cervical intraepithelial neoplasia in high-risk HPV-positive women with minor cytological abnormalities[J].Oncol Rep,2013,30(2):695-700.
[2]Sias C, Garbuglia A R, Piselli P,etal. Comparison of the abbott realtime high risk HPV with genomica HPV clinical array for the detection of human papillomavirus DNA[J]. APMIS,2013,121(11):1054-1063.
[3]Koliopoulos G, Nyaga V N, Santesso N,etal. Cytology versus HPV testing for cervical cancer screening in the general population[J].Cochrane Database Syst Rev,2017,8:CD008587.
[4]尹晶,林月麗.子宮頸癌發病年輕化的臨床分析[J].中國衛生產業,2014,11(4):135-136.
[5]Rey-Ares L, Ciapponi A, Pichon-Riviere A. Efficacy and safety of human papilloma virus vaccine in cervical cancer prevention: systematic review and meta-analysis[J].Arch Argent Pediatr,2012,110(6):483-489.
[6]楊莉,吳江平.227例宮頸細胞學檢查為Ascus的臨床診斷結果分析[J].中國婦產科臨床雜志,2015,16(1):59-60.
[7]van der Heijden E,Lopes A D,Bryant A,etal.Follow-up strategies after treatment (large loop excision of the transformation zone (LLETZ)) for cervical intraepithelial neoplasia (CIN): impact of human papillomavirus (HPV) test[J].Cochrane Database Syst Rev,2015,1:CD010757.
[8]鄭啟忠,丁華野,張清萍,等.細胞DNA定量分析技術在宮頸癌篩查中的應用價值[J].診斷病理學雜志,2015,22(8):496-499.
[9]梅金紅,徐姍,韓永良,等.不能明確意義的不典型鱗狀細胞伴DNA倍體異常在宮預早期病變篩查中的意義[J].中華病理學雜志,2013,42(12):829-832.
[10]Garner D.Clinical application of DNA ploidy to cervical cancer screening: a review[J]. World J Clin Oncol,2014,5(5):931-965.
[11]Dogan N U, Salman M C, Yuce K. The role of HPV DNA testing in the follow-up of cervical intraepithelial neoplasia after loop electrosurgical excision procedure[J]. Arch Gynecol Obstet,2011,283(4):871-877.
[12]Finnigan J P Jr,Sikora A G.Counseling the patient with potentially HPV-related newly diagnosed head and neck cancer[J].Curr Oncol Rep,2014,16(3):375.
[13]Harden M E,Prasad N,Griffiths A,etal.Modulation of microRNA-mRNA target pairs by human papillomavirus 16 oncoproteins[J].MBio,2017,8(1):e02170-16.
[14]Bello J O,Nieva L O,Paredes A C,etal.Regulation of the Wnt/β-Catenin Signaling Pathway by Human Papillomavirus E6 and E7 Oncoproteins[J].Viruses,2015,7(8):4734-4755.
[15]Faridi R,Zahra A,Khan K,etal.Oncogenic potential of human Papillomavirus (HPV) and its relation with cervical cancer[J].Virol J,2011,8:269.
[16]黃凌霄,潘瓊慧,鄭建瓊,等.HPV E6/E7 mRNA在CINⅡ及以上病變中的診斷價值[J].溫州醫科大學學報,2015,45(8):583-587.
[17]Catarino R,Petignat P,Dongui G,etal.Cervical cancer screening in developing countries at a crossroad: emerging technologies and policy choices[J]. World J Clin Oncol,2015,6(6):281-290.
[18]潘嬙微,陳育梅,潘嘉佳, 等. HPV E6/E7 mRNA檢測用于ASCUS患者診斷分流的臨床研究[J].中國計劃生育學雜志,2015,23(7):471-473.
[19]王華,陳亞寶,葉麗華,等.應用支鏈DNA技術檢測人乳頭瘤病毒E6/E7mRNA在宮頸疾病篩查中的價值[J].中華臨床醫師雜志(電子版),2011,5(15):4362-4366.
[專業責任編輯:安瑞芳]

