蘋果紫色酸性磷酸酶相關(guān)基因MdPAP10的克隆及功能鑒定
李睿,安建平,由春香,王小非,郝玉金
(山東農(nóng)業(yè)大學(xué)園藝科學(xué)與工程學(xué)院/作物生物學(xué)國(guó)家重點(diǎn)實(shí)驗(yàn)室/農(nóng)業(yè)部黃淮地區(qū)園藝作物生物學(xué)與種質(zhì)創(chuàng)制重點(diǎn)實(shí)驗(yàn)室,山東泰安 271018)
0 引言
【研究意義】磷是植物生長(zhǎng)發(fā)育過(guò)程中必需的營(yíng)養(yǎng)元素,其不僅參與植物體內(nèi)重要化合物(磷脂、ATP和核酸等)的形成[1],而且在植物生命活動(dòng)過(guò)程(光合作用、呼吸作用和信號(hào)轉(zhuǎn)導(dǎo)等)中發(fā)揮著重要作用[2]。然而,多數(shù)土壤中磷元素分布不均,并且多以植物難以利用的有機(jī)磷形式存在,植物因此常常受低磷脅迫影響[3]。在生產(chǎn)中,人們通過(guò)施用磷肥來(lái)改善土壤有效磷含量不足的狀況提高作物產(chǎn)量,但卻導(dǎo)致了一系列環(huán)境污染問(wèn)題[4]。因此,通過(guò)分子生物學(xué)手段發(fā)掘優(yōu)質(zhì)基因,通過(guò)轉(zhuǎn)基因手段提高作物磷吸收能力對(duì)減少化肥使用具有重要意義。【前人研究進(jìn)展】紫色酸性磷酸酶(purple acid phosphatases,PAP)主要由植物在低磷條件下分泌產(chǎn)生,能夠在有機(jī)磷底物上水解磷酸基團(tuán),產(chǎn)生有效磷供植物吸收利用[5-6]。目前,許多植物的PAP已被鑒定出來(lái),如擬南芥[7]、煙草[8]、番茄[9]、玉米[10]、水稻[11]、和大豆[12]等,并且許多PAP的轉(zhuǎn)錄與翻譯明顯受低磷條件的誘導(dǎo)。在擬南芥中,一共發(fā)現(xiàn) 29個(gè)AtPAP,在多個(gè)方面影響擬南芥的生長(zhǎng)發(fā)育,其中AtPAP10是根表面最主要的酸性磷酸酶,并且atpap10突變體對(duì)磷的吸收明顯受到抑制,長(zhǎng)勢(shì)弱于野生型[13];AtPAP15在種子和花粉萌發(fā)時(shí)期磷酸鹽的利用過(guò)程發(fā)揮重要作用[14];AtPAP23在花器官中明顯積累,可能參與了花器官的發(fā)育[15];atpap26突變體葉片衰老延遲,可能參與植物體內(nèi)磷元素的回收利用過(guò)程[16]。在水稻中,存在26個(gè)OsPAP,可分為3個(gè)家族和7個(gè)亞家族,其中有4個(gè)基因(OsPAP10a、OsPAP10b、OsPAP10c和OsPAP10d)與AtPAP10同源性最高。OsPAP10a和OsPAP10c明顯受低磷誘導(dǎo),并且在轉(zhuǎn)錄水平上均受OsPHR2、OsPHO2和OsSPXI的調(diào)控。進(jìn)一步研究表明,過(guò)表達(dá)OsPAP10a和OsPAP10c增加水稻的分蘗數(shù),并且提高水稻在低磷條件下的磷含量[17]。而OsPAP26在蛋白水平受缺磷誘導(dǎo)和衰老調(diào)控,但在轉(zhuǎn)錄水平對(duì)缺磷沒(méi)有響應(yīng)[18]。【本研究切入點(diǎn)】蘋果作為多年生木本果樹(shù),磷元素的豐缺對(duì)果樹(shù)生長(zhǎng)和產(chǎn)量具有重要影響。雖然目前關(guān)于紫色酸性磷酸酶(PAP)已有大量研究,但主要集中在擬南芥和水稻等草本植物,而 PAP在蘋果中的研究尚未見(jiàn)報(bào)道。【擬解決的關(guān)鍵問(wèn)題】本研究以‘嘎啦’蘋果(Malus×domestica‘Royal Gala’)為材料,通過(guò)基因克隆獲得蘋果紫色酸性磷酸酶基因MdPAP10,并對(duì)其表達(dá)模式及基因功能進(jìn)行研究,運(yùn)用分子生物學(xué)手段驗(yàn)證 MdPAP10在蘋果響應(yīng)低磷過(guò)程中所起到的重要作用。
1 材料與方法
1.1 材料收集與處理
本試驗(yàn)所用到的植物材料有‘嘎啦’(Malus×domestica‘Royal Gala’),蘋果‘王林’(‘Orin’)愈傷組織。11年生自根‘嘎啦’蘋果種植在山東果樹(shù)科學(xué)研究所的果樹(shù)試驗(yàn)田(山東泰安)。于2016年5月開(kāi)始,分別對(duì)‘嘎啦’蘋果當(dāng)年新生根、幼莖、新生葉、初花時(shí)的花和花后30 d的幼果取樣,取樣后迅速放入液氮中,于-80℃保存。
‘王林’蘋果葉片誘導(dǎo)的愈傷組織用來(lái)進(jìn)行遺傳轉(zhuǎn)化。愈傷組織放置在繼代培養(yǎng)基(MS 培養(yǎng)基+1.0 mg·L-12,4-D+1.0 mg·L-16-BA)室溫(24℃)暗培養(yǎng)。并且每隔15 d繼代一次。
‘嘎啦’組培苗生長(zhǎng)于繼代培養(yǎng)基(MS 培養(yǎng)基+0.2 mg·L-1IAA+0.8 mg·L-16-BA),其生長(zhǎng)條件為14 h光照/10 h黑暗,溫度24℃。選擇繼代20 d長(zhǎng)勢(shì)一致的‘嘎啦’蘋果組培苗,轉(zhuǎn)移到生根培養(yǎng)基(1/2MS培養(yǎng)基+1 mg·L-1IAA)進(jìn)行生根處理。30 d后選擇生根一致的10棵蘋果苗進(jìn)行低磷脅迫處理。將5棵蘋果苗置于低磷營(yíng)養(yǎng)液(50 μmol·L-1Pi)中,分別于 0、3、6、12和48 h取樣;另外5棵蘋果苗作為對(duì)照置于正常磷含量(1.25 mmol·L-1Pi)營(yíng)養(yǎng)液中,分別于0、3、6、12和48 h取樣。
正常磷含量營(yíng)養(yǎng)液(+Pi):MS營(yíng)養(yǎng)液[19];
低磷營(yíng)養(yǎng)液(-Pi):KH2PO4含量為正常 MS營(yíng)養(yǎng)液的1/25,另加入0.6 mmol·L-1K2SO4,其他成分含量不變[20]。
1.2 MdPAP10的克隆、蛋白質(zhì)結(jié)構(gòu)域分析和同源性分析
以擬南芥AtPAP10氨基酸序列在蘋果基因組數(shù)據(jù)庫(kù)中進(jìn)行序列比對(duì),獲得同源性最高的基因(MDP0000272096)。根據(jù)檢索到的基因序列設(shè)計(jì)引物,以‘嘎拉’組培苗的cDNA[21]為模板進(jìn)行PCR擴(kuò)增。PCR擴(kuò)增反應(yīng)條件:95℃預(yù)變性10 min;95℃變性30 s,58℃退火30 s,72℃延伸2 min,35次循環(huán);72℃延伸10 min。PCR產(chǎn)物采用1.5%的瓊脂糖凝膠進(jìn)行電泳,回收目的條帶后連接到 pMD18-T克隆載體上進(jìn)行測(cè)序。以MDP0000272096的氨基酸序列在NCBI數(shù)據(jù)庫(kù)(http://www.ncbi. nlm. nih. gov/)中進(jìn)行檢索和蛋白質(zhì)結(jié)構(gòu)預(yù)測(cè),下載對(duì)應(yīng)的其他物種的氨基酸序列。通過(guò)MEGA5.0軟件構(gòu)建Neighbor-Joining系統(tǒng)進(jìn)化樹(shù)。
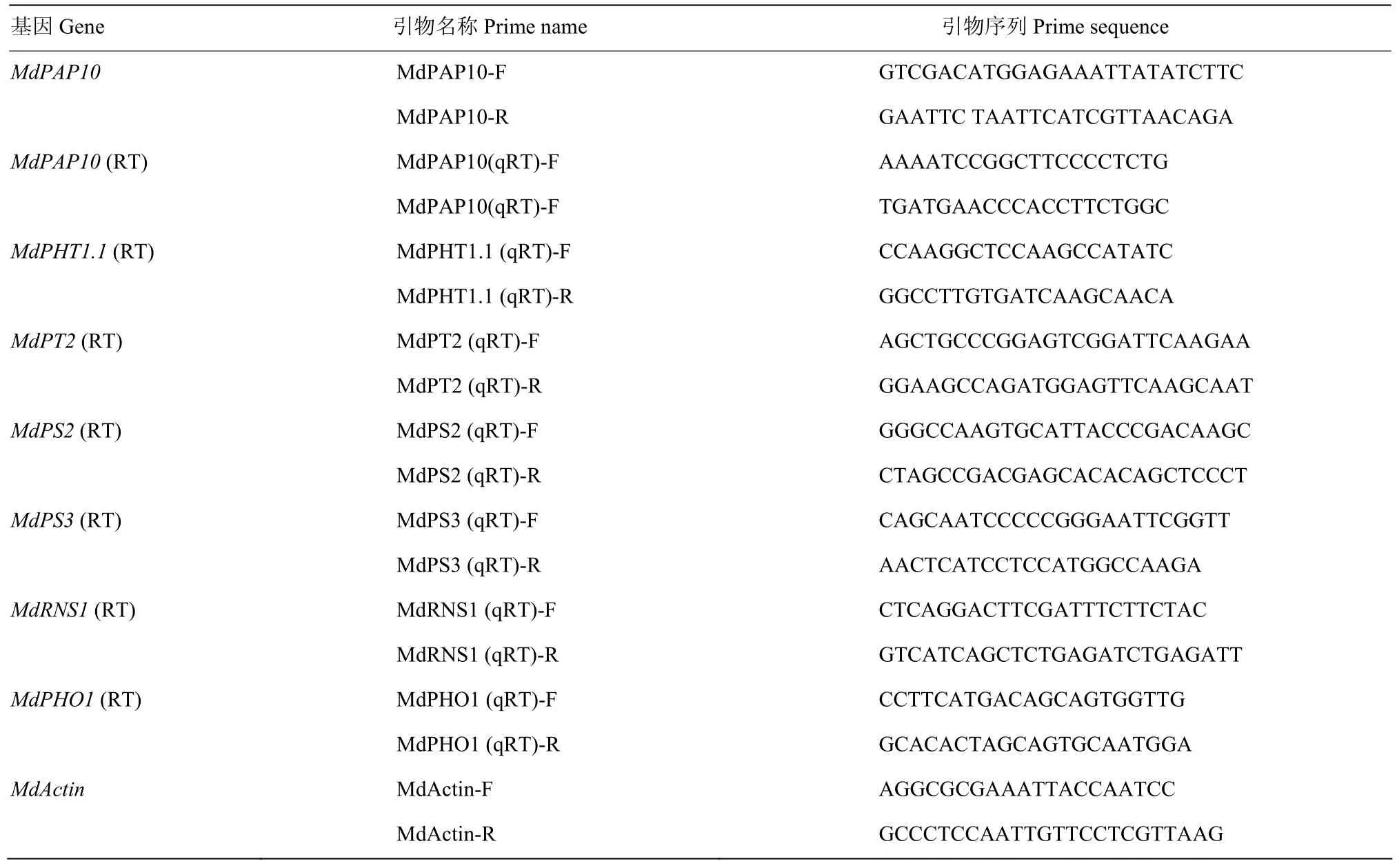
表1 本研究中所用的引物Table 1 Primers used in this study
1.3 總RNA的提取及實(shí)時(shí)熒光定量PCR分析
試驗(yàn)材料的 RNA提取采用康為世紀(jì)科技有限公司的全能型植物RNA提取試劑盒(DNase I)。反轉(zhuǎn)錄采用連寶生物公司 PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)試劑盒。選取MdActin(GenBank accession number CN938024)為內(nèi)參基因。使用Ultra SYBR Mixture(with ROX)試劑盒(康為世紀(jì))進(jìn)行實(shí)時(shí)熒光定量PCR分析。熒光定量PCR儀器型號(hào)為BIO-RAD IQ5,所有PCR反應(yīng)都設(shè)3次生物學(xué)重復(fù)。PCR反應(yīng)體系為:2×UltraSYBR Mixture 10.0 μL,上游引物(10 μmol·L-1)1.0 μL,下游引物(10 μmol·L-1)1.0 μL,cDNA 1.0 μL,ddH2O 7.0 μL。PCR反應(yīng)程序?yàn)椋?4℃預(yù)變性10 min,94℃變性15 s,56℃退火15 s,65℃延伸10 s,40個(gè)循環(huán);每次循環(huán)第2步進(jìn)行熒光采集。試驗(yàn)結(jié)果采用2-??CT法對(duì)數(shù)據(jù)進(jìn)行分析。
1.4 載體構(gòu)建及蘋果愈傷轉(zhuǎn)化和鑒定
通過(guò)限制性內(nèi)切酶分別對(duì) pBI121表達(dá)載體和pMD18-T中間載體進(jìn)行酶切反應(yīng),將酶切產(chǎn)物回收后在16℃進(jìn)行連接反應(yīng)。連接產(chǎn)物轉(zhuǎn)化大腸桿菌感受態(tài)細(xì)胞。成功篩選到陽(yáng)性克隆,獲得 MdPAP10-pBI121植物過(guò)表達(dá)載體。
將構(gòu)建的 MdPAP10過(guò)表達(dá)載體轉(zhuǎn)化農(nóng)桿菌LBA4404,然后用篩選到的陽(yáng)性農(nóng)桿菌侵染繼代10 d左右處于指數(shù)生長(zhǎng)期的蘋果‘王林’愈傷組織。浸泡15 min后過(guò)濾掉菌液,并用無(wú)菌水清洗2—3次。將愈傷組織轉(zhuǎn)移至固體繼代培養(yǎng)基上暗培養(yǎng)2 d,再轉(zhuǎn)移至含300 mg·L-1頭孢霉素和30 mg·L-1卡那霉素的繼代培養(yǎng)基篩選一個(gè)月以上,獲得具有抗性的愈傷組織,并在抗性培養(yǎng)基上繼代多次獲得穩(wěn)定的抗性愈傷組織,提取DNA,用于PCR鑒定。
1.5 BCIP染色及愈傷表面酸性磷酸酶活性檢測(cè)
低磷條件會(huì)誘導(dǎo)植物分泌酸性磷酸酶。附著在植物材料表面的酸性磷酸酶可以與 BCIP反應(yīng),并生成藍(lán)色產(chǎn)物。可以依據(jù)產(chǎn)物顏色的深淺判斷酸性磷酸酶活性的高低[22]。
選取生長(zhǎng)狀態(tài)一致的野生型和過(guò)表達(dá) MdPAP10的轉(zhuǎn)基因愈傷,分別平鋪在正常磷含量培養(yǎng)基和低磷培養(yǎng)基上,培養(yǎng)7 d。將BCIP溶液(含有0.01% BCIP(w/v)和0.5%瓊脂(w/v))放入微波爐中加熱,沸騰數(shù)次后冷卻至45—50℃[23]。將冷卻的BCIP溶液均勻覆蓋正常和低磷培養(yǎng)的愈傷組織,1 h后觀察拍照。將染色后的愈傷組織取出,放入1.5 mL離心管中,加入1 mL DMSO,震蕩混勻,12 000 r/min離心2 min取上清,測(cè)定A635[24]。
正常磷含量培養(yǎng)基(+Pi):MS培養(yǎng)基+1.0 mg·L-16-BA+1.0 mg·L-12,4-D;低磷培養(yǎng)基(-Pi):KH2PO4含量為正常MS培養(yǎng)基的1/25,其他成分含量不變,添加 0.6 mmol·L-1K2SO4、1.0 mg·L-16-BA、1.0 mg·L-12,4-D。
1.6 愈傷組織磷含量測(cè)定
稱取1 g左右愈傷組織,在液氮中充分研磨,加入100 μL磷提取液混勻,轉(zhuǎn)入1.5 mL離心管中。再加入900 μL 1%冰乙酸,上下顛倒混勻,于42℃反應(yīng)30 min。12 000 r/min離心5 min,吸取300 μL上清提取液到700 μL顯色液中,上下顛倒混勻,于42℃反應(yīng)30 min后測(cè)定A820。依據(jù)標(biāo)準(zhǔn)曲線計(jì)算磷含量[25]。
磷提取液(1 L):1 mol·L-1Tris-HCl(pH 8.0)10 mL,0.5 mol·L-1EDTA(pH 8.0)2 mL,NaCl 5.844 g,P-巰基乙醇 700 μL,100 mmol·L-1PMSF(現(xiàn)用現(xiàn)加)10 mL。
顯色液(100 mL):(NH4)6Mo7O2·4H2O 0.35 g,98%硫酸2.339 mL,抗壞血酸1.4 g,滴定水定容到100 mL。
1.7 數(shù)據(jù)分析
使用DPS 7.05數(shù)據(jù)分析軟件,進(jìn)行顯著性分析。不同小寫字母表示不同處理間差異顯著(P<0.05)。所有試驗(yàn)均重復(fù)3次。
2 結(jié)果
2.1 MdPAP10的克隆、蛋白質(zhì)結(jié)構(gòu)域分析、基因結(jié)構(gòu)分析和同源性分析
以‘嘎拉’組培苗的cDNA為模板,克隆得到一條約1 300 bp的條帶,與預(yù)期結(jié)果一致。對(duì)克隆到的片段進(jìn)行回收測(cè)序分析。結(jié)果表明,目的基因片段含有完整的開(kāi)放閱讀框,長(zhǎng)度為1 332 bp,編碼443個(gè)氨基酸和一個(gè)終止子,命名為MdPAP10。結(jié)構(gòu)域分析表明,MdPAP10包含有一個(gè)信號(hào)肽和一個(gè)磷酸酶結(jié)構(gòu)域,與擬南芥中的AtPAP10結(jié)構(gòu)相似(圖1-A),證明 MdPAP10屬于磷酸酶基因家族。基因結(jié)構(gòu)分析顯示,MdPAP10包含5個(gè)外顯子和4個(gè)內(nèi)含子(圖1-B)。
將蘋果 MdPAP10的氨基酸序列與白梨、桃、草莓和擬南芥等10種不同植物的MdPAP10氨基酸序列進(jìn)行比對(duì),構(gòu)建 Neighbor-Joining系統(tǒng)進(jìn)化樹(shù)。進(jìn)化樹(shù)分析結(jié)果表明,蘋果MdPAP10與白梨PbPAP10的同源性最高,親緣關(guān)系最近(圖1-C)。
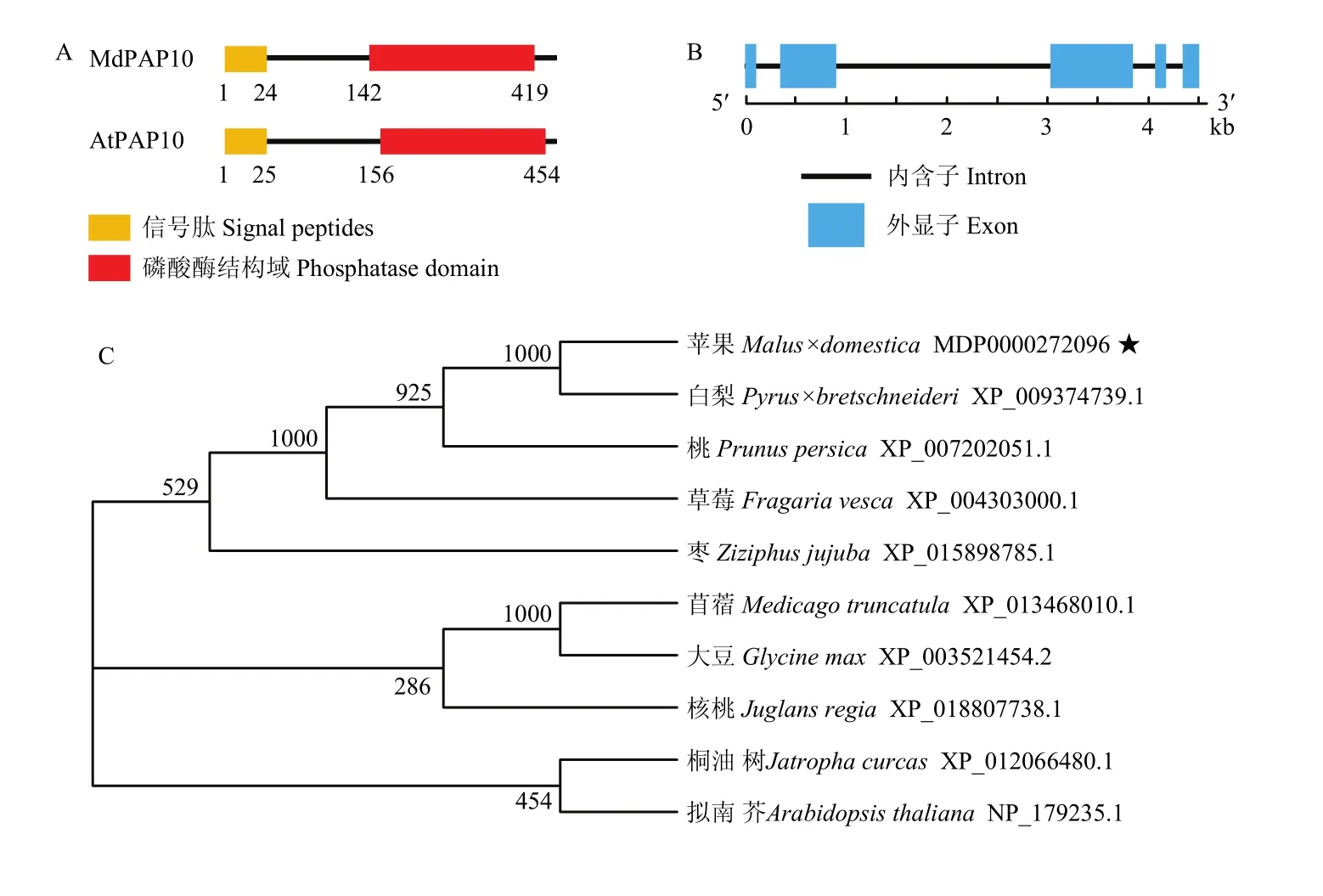
圖1 MdPAP10蛋白質(zhì)結(jié)構(gòu)域分析(A)、基因結(jié)構(gòu)分析(B)及進(jìn)化樹(shù)分析(C)Fig. 1 MdPAP10 functional domain analysis (A) , gene structure analysis (B) and phylogenetic tree analysis (C)
2.2 蘋果MdPAP10基因的分析
采用qRT-PCR分析MdPAP10在11年生自根‘嘎啦’蘋果不同器官中的表達(dá)情況。結(jié)果表明,MdPAP10在蘋果根中的表達(dá)量最高,在葉中的表達(dá)量次之,在果實(shí)中的表達(dá)量最低(圖2-A)。分別在正常和低磷條件下,處理長(zhǎng)勢(shì)一致的‘嘎啦’蘋果苗,檢測(cè)MdPAP10在蘋果根和葉中的表達(dá)情況。結(jié)果表明,MdPAP10在根中隨低磷處理時(shí)間的延長(zhǎng)表達(dá)量逐漸升高,在6 h的時(shí)候達(dá)到最高值,而后逐漸下降(圖2-B)。在低磷條件下,MdPAP10在葉中表達(dá)量明顯低于正常條件,但表達(dá)量比較穩(wěn)定,沒(méi)有明顯波動(dòng)(圖2-C)。
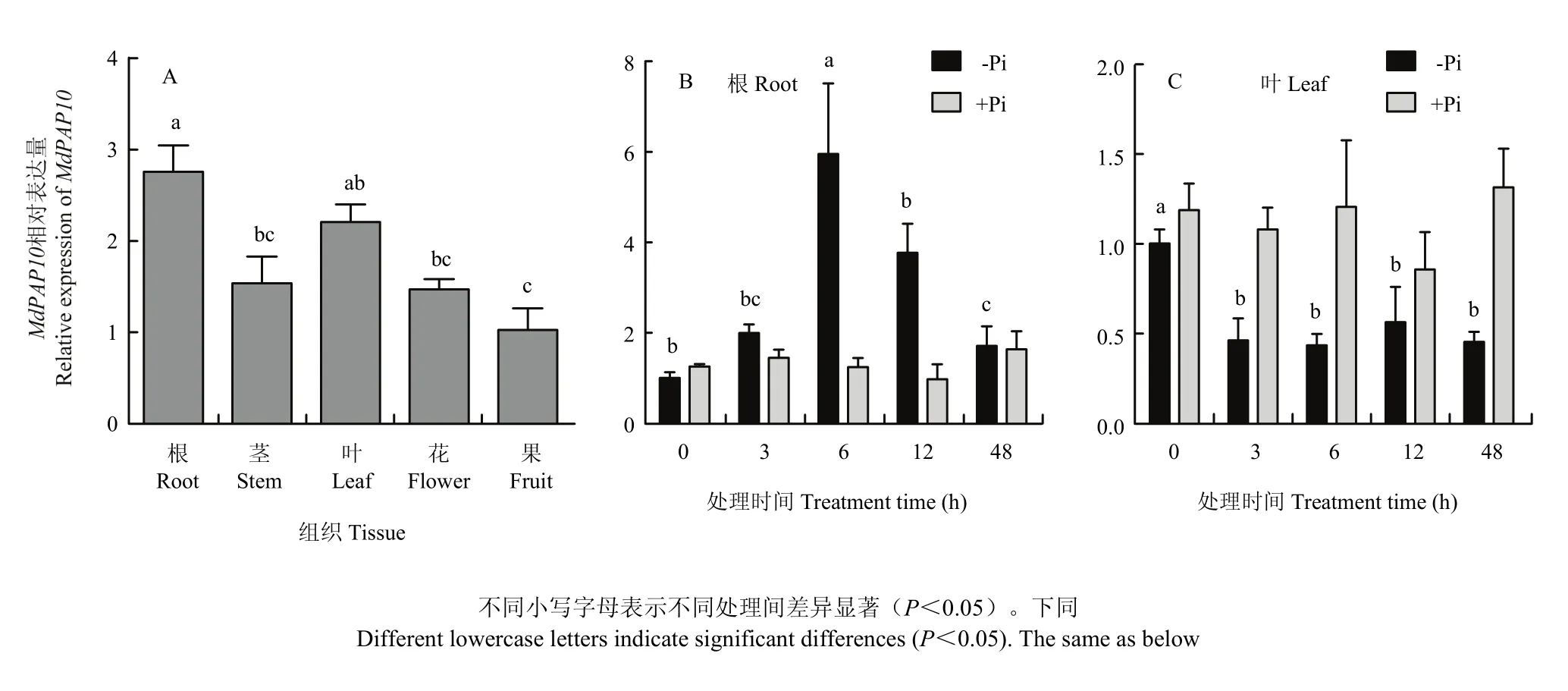
圖2 MdPAP10在蘋果不同器官(A)、不同磷條件下根(B)和葉(C)中的相對(duì)表達(dá)量Fig. 2 Relative expression of MdPAP10 in different organs, root (B) and leaf (C) under different phosphorus condition of apple
2.3 載體構(gòu)建與轉(zhuǎn)基因蘋果愈傷鑒定
通過(guò)限制性內(nèi)切酶分別對(duì)pBI121表達(dá)載體和pMD18-T中間載體進(jìn)行酶切反應(yīng),將酶切產(chǎn)物回收后進(jìn)行連接,隨后將連接產(chǎn)物轉(zhuǎn)化大腸桿菌感受態(tài)細(xì)胞,篩選陽(yáng)性克隆,獲得MdPAP10-pBI121植物過(guò)表達(dá)載體(圖 3-A)。將構(gòu)建的 MdPAP10-pBI121過(guò)表達(dá)載體轉(zhuǎn)化農(nóng)桿菌LBA4404后,侵染蘋果愈傷組織。通過(guò)35S啟動(dòng)子和MdPAP10的篩選引物PCR鑒定得到MdPAP10轉(zhuǎn)基因蘋果愈傷(L1和L2)(圖3-B),進(jìn)而通過(guò)qRT-PCR檢測(cè)MdPAP10在轉(zhuǎn)基因蘋果愈傷中的表達(dá)水平(圖 3-C),結(jié)果表明轉(zhuǎn)基因愈傷MdPAP10表達(dá)量高于野生型。
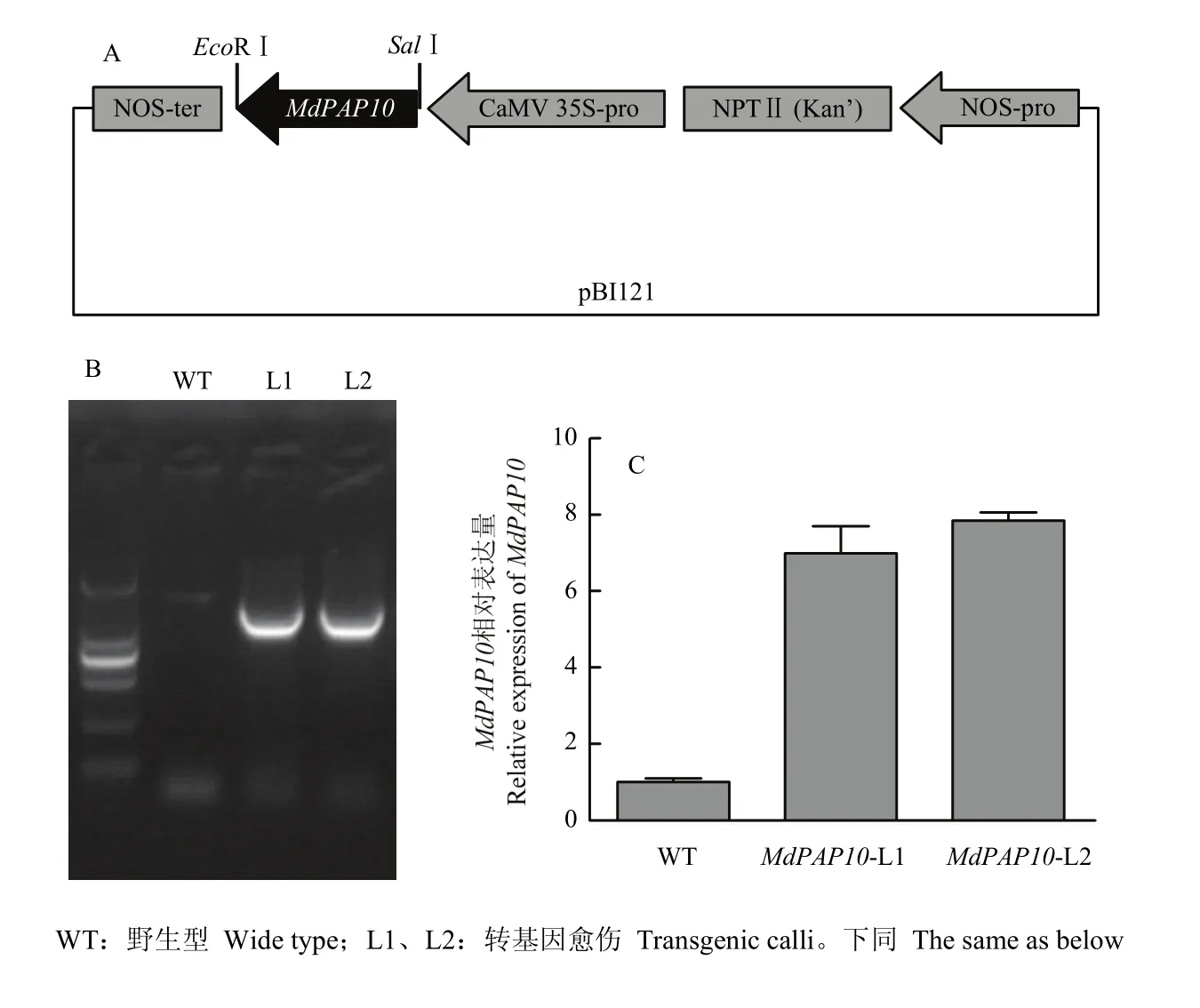
圖3 MdPAP10-pBI121結(jié)構(gòu)示意圖(A)、轉(zhuǎn)基因蘋果愈傷鑒定(B)和MdPAP10表達(dá)水平檢測(cè)(C)Fig. 3 Schematic diagram of the MdPAP10-pBI121 structure (A), identification of transgenic apple calli (B) and detection of MdPAP10 expression in transgenic apple calli (C)

圖4 野生型和轉(zhuǎn)基因蘋果愈傷BCIP染色(A)和酸性磷酸酶活性測(cè)定(B)Fig. 4 BCIP staining (A) and the measurement on acid phosphatase activity of wild type and transgenic apple calli
2.4 過(guò)量表達(dá) MdPAP10促進(jìn)了蘋果愈傷酸性磷酸酶在低磷條件下的分泌
將生長(zhǎng)狀態(tài)一致的野生型蘋果愈傷與 MdPAP10轉(zhuǎn)基因愈傷同時(shí)放于正常磷含量(+Pi)和低磷含量(-Pi)的培養(yǎng)基中培養(yǎng)7 d,之后用BCIP溶液進(jìn)行染色。結(jié)果表明,在正常磷含量條件下 MdPAP10轉(zhuǎn)基因愈傷有少量染色痕跡(圖 4-A),存在少量酸性磷酸酶的分泌;而在低磷條件下,MdPAP10轉(zhuǎn)基因愈傷相比于野生型著色更深(圖4-A),酸性磷酸酶活性更高(圖4-B)。說(shuō)明在低磷條件下,過(guò)表達(dá)MdPAP10能夠促進(jìn)酸性磷酸酶的分泌。
2.5 過(guò)量表達(dá) MdPAP10促進(jìn)蘋果愈傷對(duì)低磷脅迫的耐受性
既然 MdPAP10能夠促進(jìn)蘋果在低磷條件下酸性磷酸酶的分泌,為驗(yàn)證MdPAP10是否能夠提高蘋果對(duì)低磷脅迫的耐受性,將MdPAP10過(guò)表達(dá)愈傷與野生型愈傷放置于正常磷含量(+Pi)和低磷含量(-Pi)的培養(yǎng)基中長(zhǎng)時(shí)間培養(yǎng)20 d,觀察愈傷組織的生長(zhǎng)狀況。結(jié)果表明,在正常條件下,轉(zhuǎn)基因愈傷與野生型相比并無(wú)明顯差異;而在低磷條件下,轉(zhuǎn)基因愈傷的生長(zhǎng)量明顯大于野生型(圖5-A、B)。進(jìn)一步檢測(cè)愈傷組織中的磷含量,發(fā)現(xiàn) MdPAP10轉(zhuǎn)基因愈傷能夠在低磷條件下明顯促進(jìn)磷吸收(圖5-C)。
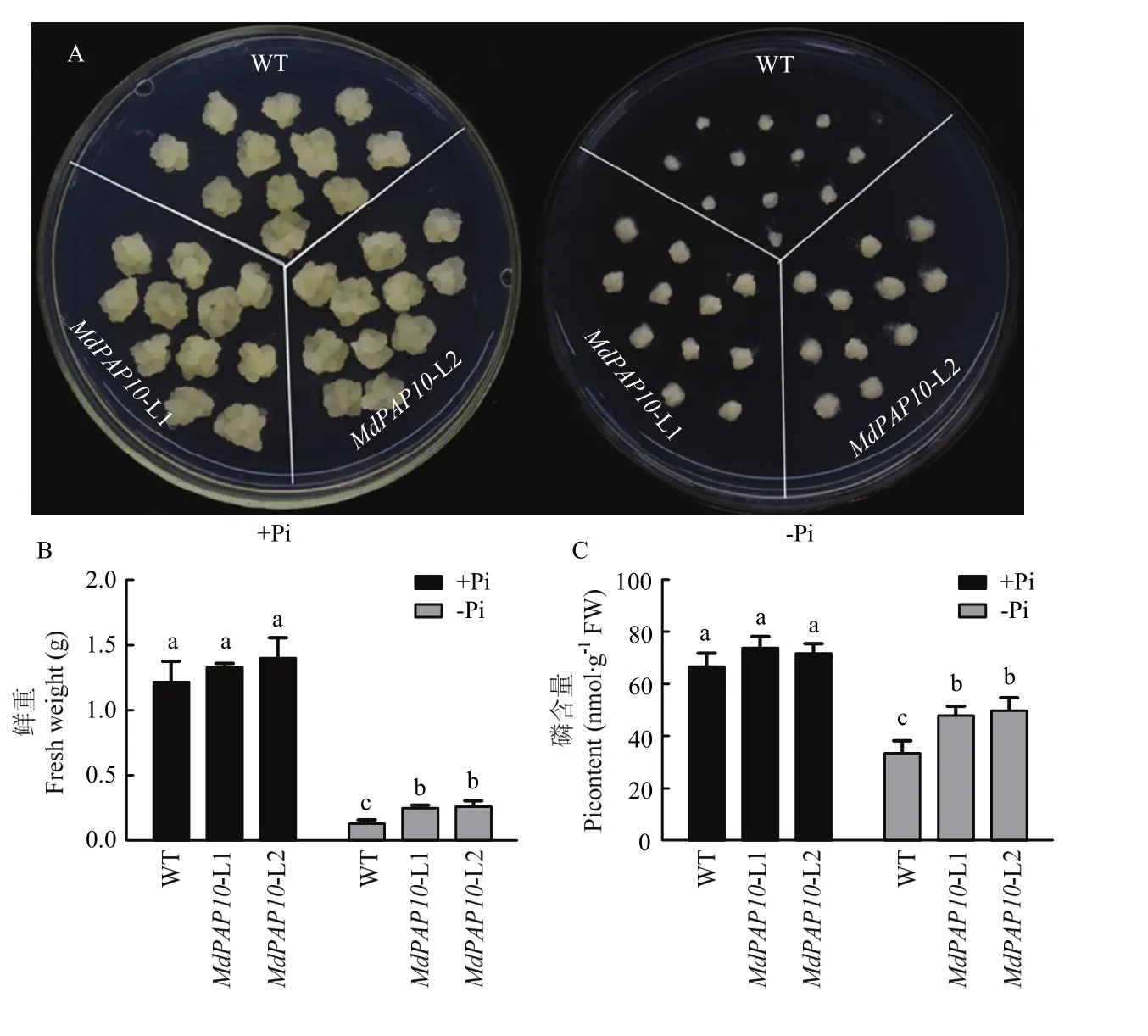
圖5 野生型和轉(zhuǎn)基因蘋果愈傷生長(zhǎng)狀況(A)、鮮重(B)和磷含量測(cè)定(C)Fig. 5 Growth status (A) and the measurement on fresh weight (B) and Pi content (C) of wild type and transgenic apple calli
2.6 過(guò)量表達(dá) MdPAP10促進(jìn)蘋果愈傷中磷相關(guān)基因的表達(dá)
為進(jìn)一步深入研究MdPAP10促進(jìn)磷吸收的分子機(jī)理,通過(guò)qRT-PCR檢測(cè)低磷條件下MdPAP10轉(zhuǎn)基因蘋果愈傷中磷相關(guān)基因(MdPHT1.1、MdPT2、MdPS2、MdPS3、MdRNS1和MdPHO1)的表達(dá)情況。結(jié)果表明,這些磷相關(guān)基因的表達(dá)量均明顯上調(diào)(圖6)。說(shuō)明低磷條件下 MdPAP10可能通過(guò)影響磷相關(guān)基因的表達(dá),促進(jìn)蘋果對(duì)磷的吸收。
3 討論
磷是植物生長(zhǎng)發(fā)育所必須的大量元素,而土壤中有效磷的缺乏常常成為影響植物生長(zhǎng)的限制因素[3,26]。而紫色酸性磷酸酶作為一類植物吸收磷所依賴的關(guān)鍵酶,在植物響應(yīng)低磷和信號(hào)轉(zhuǎn)導(dǎo)過(guò)程中發(fā)揮了重要調(diào)控作用[27-29]。隨著分子生物學(xué)的進(jìn)步和基因組數(shù)據(jù)庫(kù)的不斷豐富,越來(lái)越多的PAP,被不斷的發(fā)現(xiàn)和鑒定,但各PAP的功能并不完全相同。在擬南芥的29個(gè)AtPAP中,明顯受低磷誘導(dǎo)的只有 AtPAP10、AtPAP11、AtPAP12、AtPAP17、AtPAP25和AtPAP26[21]。研究顯示,將AtPAP12和AtPAP26突變后,擬南芥酸性磷酸酶活性明顯下調(diào),說(shuō)明AtPAP12和AtPAP26對(duì)植物吸收利用外界有機(jī)磷至關(guān)重要[30]。而AtPAP17不僅受低磷誘導(dǎo),而且還受鹽脅迫和ABA的誘導(dǎo);推測(cè)AtPAP17可能在磷脅迫與逆境脅迫的信號(hào)轉(zhuǎn)導(dǎo)過(guò)程中起著重要作用[31]。目前,許多PAP具體功能仍不清晰,是否通過(guò)其他途徑影響磷的代謝與吸收仍需要進(jìn)一步研究。對(duì)于已鑒定的 PAP研究多集中在功能鑒定方面,只有 AtPAP10研究相對(duì)深入一些。目前研究表明,局部信號(hào)調(diào)控低磷誘導(dǎo) AtPAP10蛋白的積累和分泌,并且乙烯信號(hào)和糖信號(hào)可能通過(guò)不同途徑影響 AtPAP10的活性。進(jìn)一步研究顯示,AtMYB2、miR399過(guò)表達(dá)植株和AtPHO2突變體均能正調(diào)控根表面酸性磷酸酶的積累,并且能夠調(diào)控AtPAP10的轉(zhuǎn)錄;說(shuō)明AtPAP10可能參與到經(jīng)典的 AtMYB2-miR399-AtPHO2信號(hào)通路過(guò)程,并且位于AtPHO2下游[13]。但是,AtPHO2影響AtPAP10的分子機(jī)制仍不清楚。SUN等[32]研究表明,AtPAP10啟動(dòng)子中包含有多個(gè)P1BS元件,植物低磷響應(yīng)的關(guān)鍵轉(zhuǎn)錄因子 PHR1及其同源基因AtPHLs能夠結(jié)合到AtPAP10啟動(dòng)子上調(diào)控AtPAP10的轉(zhuǎn)錄。
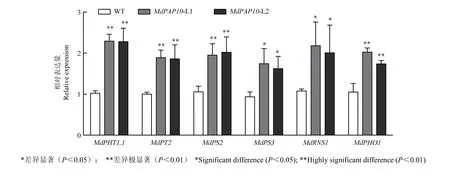
圖6 磷相關(guān)基因表達(dá)水平檢測(cè)Fig. 6 Detection of phosphorus related gene expression
本研究結(jié)果表明,MdPAP10在根部明顯受低磷條件的誘導(dǎo),而低磷條件下 MdPAP10在葉中表達(dá)量較低,說(shuō)明MdPAP10對(duì)低磷脅迫有明顯響應(yīng)。MdPAP10轉(zhuǎn)基因愈傷組織在正常條件下能夠分泌少量酸性磷酸酶,而在低磷條件下,能夠顯著促進(jìn)酸性磷酸酶的分泌,并且促進(jìn)磷吸收,進(jìn)而提高了蘋果‘王林’愈傷組織對(duì)低磷脅迫的耐受性。說(shuō)明 MdPAP10很可能存在翻譯后水平的調(diào)控。在低磷條件下,可能存在其他酸性磷酸酶相關(guān)基因與 MdPAP10共同調(diào)控植物對(duì)低磷的響應(yīng)過(guò)程。本研究證明在木本植物中PAP與草本植物的PAP具有相似的功能,都能夠促進(jìn)低磷條件下酸性磷酸酶的分泌;但本文只研究了 MdPAP10對(duì)低磷的響應(yīng),MdPAP10是否參與了其他逆境響應(yīng),是否影響到其他營(yíng)養(yǎng)元素的吸收與利用仍需要進(jìn)一步研究。另一方面,MdPAP10促進(jìn)磷吸收的分子機(jī)制仍然不清楚;MdPHR1在蘋果中尚未被鑒定,MdPHR1是否能夠結(jié)合MdPAP10的啟動(dòng)子直接調(diào)控MdPAP10的轉(zhuǎn)錄;是否影響到其他MdPAPs的表達(dá)仍需要細(xì)致而深入的研究。
4 結(jié)論
克隆獲得 MdPAP10,該基因編碼 443個(gè)氨基酸。MdPAP10包含有一個(gè)信號(hào)肽和一個(gè)磷酸酶結(jié)構(gòu)域;基因結(jié)構(gòu)分析表明,MdPAP10包含5個(gè)外顯子和 4個(gè)內(nèi)含子。進(jìn)化樹(shù)分析顯示 MdPAP10與白梨PbPAP10親緣關(guān)系最近。MdPAP10在根中表達(dá)量最高,并且對(duì)低磷條件有明顯響應(yīng)。MdPAP10轉(zhuǎn)基因愈傷在低磷條件下能夠分泌更多酸性磷酸酶,促進(jìn)磷吸收和磷相關(guān)基因的表達(dá),提高對(duì)低磷的耐受性。說(shuō)明 MdPAP10在響應(yīng)低磷脅迫過(guò)程中發(fā)揮著重要的正調(diào)控作用。
[1]WARD D N, GRIFFIN A C. Phosphorus incorporation into nucleic acids and proteins of liver nuclei of normal and azo dye-fed rats.Cancer Research, 1955, 15: 456.
[2]TENG Z Q, XU D L, HAN H G, ZHANG C P, HUA F U. Effects of land use patterns on soil phosphorus fractions in the Longzhong part of the Loess Plateau. Acta Prataculturae Sinica, 2013, 22(2): 30-37.
[3]VANCE C P, UHDESTONE C, ALLAN D L. Phosphorus acquistion and use: Critical adaptations by plants for securing a nonrenewable resource. New Phytologist, 2003,157: 423-447.
[4]JIAO W, CHEN W, CHANG A C, PAGE A L. Environmental risks of trace elements associated with long-term phosphate fertilizers applications: A review. Environmental Pollution, 2012, 168: 44-53.
[5]WASAKI J, YAMAMURA T, SHINANO T, OSAKI M. Secreted acid phosphatase is expressed in cluster roots of lupin in response to phosphorus deficiency. Plant & Soil, 2003, 248: 129-136.
[6]黃宇, 張海偉, 徐芳森. 植物酸性磷酸酶的研究進(jìn)展. 華中農(nóng)業(yè)大學(xué)學(xué)報(bào), 2008, 27(1): 148-154.HUANG Y, ZHANG H W, XU F S. Research progress of acid phosphatase in plants. Journal of Huazhong Agricultural University,2008, 27(1): 148-154. (in Chinese)
[7]LI D, ZHU H, LIU K, LIU X, LEGGEWIE G, UDVARDI M, WANG D. Purple acid phosphatases of Arabidopsis thaliana. Comparative analysis and differential regulation by phosphate deprivation. Journal of Biological Chemistry, 2002, 277: 27772-27781.
[8]LUNG S C, LEUNG A, KUANG R, WANG Y, LEUNG P, LIM B L.Phytase activity in tobacco (Nicotiana tabacum) root exudates is exhibited by a purple acid phosphatase. Phytochemistry, 2008, 69:365-373.
[9]BOZZO G G, DUNN E L, PLAXTON W C. Differential synthesis of phosphate-starvation inducible purple acid phosphatase isozymes in tomato (Lycopersicon esculentum) suspension cells and seedlings.Plant Cell & Environment, 2006, 29: 303-313.
[10]易雙, 聶治, 張嘯, 羅博文, 任志勇, 吳玲, 劉丹, 高世斌. 玉米紫色酸性磷酸酶(PAPs)基因家族的鑒定與低磷響應(yīng)特征. 農(nóng)業(yè)生物技術(shù)學(xué)報(bào), 2015, 23(3): 281-290.YI S, NIE Z, ZHANG X, LUO B W, REN Z Y, WU L, LIU D, GAO S B. Identification of maize (Zea mays) purple acid phosphatase (PAPs)genes family and their characterization responses to phosphorus starvation. Journal of Agricultural Biotechnology, 2015, 23: 281-290.(in Chinese)
[11]ZHANG Q, WANG C, TIAN J, LI K, SHOU H. Identification of rice purple acid phosphatases related to posphate starvation signalling.Plant Biology, 2011, 13: 7-15.
[12]LI C, GUI S, YANG T, WALK T, WANG X, LIAO H. Identification of soybean purple acid phosphatase genes and their expression responses to phosphorus availability and symbiosis. Annals of Botany,2012, 109: 275.
[13]ZHANG Y, WANG X, LU S, LIU D. A major root-associated acid phosphatase in Arabidopsis, AtPAP10, is regulated by both local and systemic signals under phosphate starvation. Journal of Experimental Botany, 2014, 65: 6577-6588.
[14]WANG X, WANG Y, TIAN J, LIM BL, YAN X, LIAO H.Overexpressing AtPAP15 enhances phosphorus efficiency in soybean.Plant Physiology, 2009, 151: 233-240.
[15]ZHU H, QIAN W, LU X, LI D, LIU X, LIU K, WANG D. Expression patterns of purple acid phosphatase genes in Arabidopsis organs and functional analysis of AtPAP23 predominantly transcribed in flower.Plant Molecular Biology, 2005, 59: 581-594.
[16]ROBINSON W D, CARSON I, YING S, ELLIS K, PLAXTON W C.Eliminating the purple acid phosphatase AtPAP26 in Arabidopsis thaliana delays leaf senescence and impairs phosphorus remobilization.New Phytologist, 2012, 196: 1024-1029.
[17]田璟鸞. 水稻紫色酸性磷酸酶Ia亞家族基因的功能研究[D]. 杭州:浙江大學(xué), 2013.TIAN J L. Functional analysis of genes in rice purple acid phosphatase Ia subgroup [D]. Hangzhou: Zhejiang University, 2013. (in Chinese)
[18]GAO W, LU L, QIU W, WANG C, SHOU H. OsPAP26 encodes a major purple acid phosphatase and regulates phosphate remobilization in rice. Plant & Cell Physiology, 2017, 58: 885.
[19]MAYAK S, TIROSH T, GLICK B R. Stimulation of the growth of tomato, pepper and mung bean plants by the plant growth-promoting bacterium enterobacter cloacae CAL3. Biological Agriculture &Horticulture, 2001, 19(3): 261-274.
[20]DEVAIAH B N, MADHUVANTHI R, KARTHIKEYAN A S,RAGHOTHAMA K G. Phosphate starvation responses and gibberellic acid biosynthesis are regulated by the MYB62 transcription factor in Arabidopsis. Molecular Plant, 2009, 2: 43-58.
[21]李慧峰, 冉昆, 程來(lái)亮, 王海波, 何平, 常源升, 李林光. 蘋果磷酸烯醇式丙酮酸羧化激酶基因(PEPCKs)的克隆與表達(dá)分析. 中國(guó)農(nóng)業(yè)科學(xué), 2016, 49(7): 1417-1428.LI H F, RAN K, CHENG L L, WANG H B, HE P, CHANG Y S, LI L G. Cloning sequence and expression analysis of phosphoenolpyruvate carboxykinase genes (PEPCKs) in apple. Scientia Agricultura Sinica,2016, 49(7): 1417-1428. (in Chinese)
[22]LLOYD J C, ZAKHLENIUK O V, RAINES C A. Identification of mutants in phosphorus metabolism. Annals of Applied Biology, 2010,138: 111-115.
[23]孫麗超. 擬南芥 PHL2和 PHR1共同調(diào)控對(duì)低磷脅迫的轉(zhuǎn)錄響應(yīng)[D]. 北京: 清華大學(xué), 2015.SUN L C. Arabidopsis transcription factors PHL2 and PHR1 regulate the transcriptional responses to phosphate starvation [D]. Beijing:Tsinghua University, 2015. (in Chinese)
[24]張燁. 低磷脅迫誘導(dǎo)植物酸性磷酸酶的分子調(diào)控機(jī)制[D]. 北京:清華大學(xué), 2014.ZHANG Y. Molecular regulation of phosphate starvation-induced acid phosphatase activity [D]. Beijing: Tsinghua University, 2014. (in Chinese)
[25]王慧. 擬南芥 WRKY45轉(zhuǎn)錄因子參與響應(yīng)低磷脅迫的實(shí)驗(yàn)證據(jù)[D]. 北京: 中國(guó)農(nóng)業(yè)大學(xué), 2014.WANG H. Experimental evidences of Arabidopsis WRKY45 transcription factor in responses to low-phosphate stress [D]. Beijing:China Agricultural University, 2014. (in Chinese)
[26]MARSCHNER H. Mineral nutrition of higher plants. Journal of Ecology, 1988, 76: 1250.
[27]LI C, LI C, ZHANG H, LIAO H, WANG X. The purple acid phosphatase GmPAP21 enhances internal phosphorus utilization and possibly plays a role in symbiosis with rhizobia in soybean.Physiologia Plantarum, 2016, 159(2): 215-227.
[28]MEHRA P, PANDEY B K, GIRI J. Improvement of phosphate acquisition and utilization by a secretory purple acid phosphatase(OsPAP21b) in rice. Plant Biotechnology Journal, 2017, 15(8):1054-1067.
[29]ZHANG W, GRUSZEWSKI H A, CHEVONE B I, NESSLER C L.An Arabidopsis purple acid phosphatase with phytase activity increases foliar ascorbate. Plant Physiology, 2008, 146: 431-440.
[30]TRAN H T, HURLEY B A, PLAXTON W C. Feeding hungry plants:The role of purple acid phosphatases in phosphate nutrition. Plant Science, 2010, 179: 14-27.
[31]DEL POZO J C, ALLONA I, RUBIO V, LEYVA A, DE L P,ARAGONCILLO C, PAZ-ARES J. A type 5 acid phosphatase gene from Arabidopsis thaliana is induced by phosphate starvation and by some other types of phosphate mobilising/oxidative stress conditions.The Plant Journal: for Cell and Molecular Biology, 1999, 19:579-589.
[32]SUN L, SONG L, ZHANG Y, ZHENG Z, LIU D. Arabidopsis PHL2 and PHR1 act redundantly as the key components of the central regulatory system controlling transcriptional responses to phosphate starvation. Plant Physiology, 2016, 170: 499.

