以亞甲基藍為雜交指示劑的電化學適配體鼠傷寒沙門氏菌傳感技術
徐連應,彭海霞,邵玉宇,王畢妮,張富新
(陜西師范大學食品工程與營養科學學院,西安 710119)
0 引言
【研究意義】長久以來,沙門氏菌一直是食品加工貯藏中污染最為嚴重的致病菌之一[1]。消費者食用了被沙門氏菌污染的食物后會出現腹痛、惡心、嘔吐、發燒等癥狀,嚴重者甚至會導致死亡[2],這對人體健康造成了極大的威脅,而鼠傷寒沙門氏菌在沙門氏菌感染中常居首位。因此,如何實現對鼠傷寒沙門氏菌的快速靈敏檢測一直是食品安全領域的熱門研究方向。【前人研究進展】最傳統的食源性致病菌檢測法為平板計數法(SPC),但由于其耗時過長且準確度低,故實用性較差。近年來建立的酶聯免疫法(ELISA)、聚合酶鏈式反應法(PCR)以及膠體金免疫層析法(GICA)在食源性致病菌的檢測上實現了重大突破,但仍存在部分缺陷。ELISA法通常要對抗原或抗體進行酶標記,存在成本較高、耗時較長且表征復雜等弊端;PCR法通過對細菌特定序列進行指數倍的擴增使其變得易于檢測,然而這種技術常會出現錯檢和漏檢的問題[3];GICA法依靠固相載體纖維的毛細管作用,使待測物沿膜表面前移與檢測區膠體金標記物結合顯色,它先將抗體固定在硝酸纖維素(NC)膜上,膜上有控制線和顯示結果的測試線,當樣品中抗原與抗體特異性結合,著色物膠體金使該區域顯色,通過對比測試線與控制線顏色實現目標物的快速檢測。該方法憑借其操作簡便、檢測迅速、肉眼直觀可見等優勢在食源性致病菌檢測中也較為常用,但由于細菌的體積較大,會受到 NC膜的孔徑限制,使得免疫層析法的檢測靈敏度較差,另外細菌易團聚,使得紙層析受阻,從而影響試紙條的靈敏度[4-5]。電化學傳感器可以監測反應體系中由組分變化而導致的電信號變化來完成檢測,它具有高度的檢測靈敏性與特異性,并且操作便捷、成本較低[6]。在各類電化學傳感器中,電化學生物傳感器有著不可替代的優勢,在實際生產中應用最廣的為酶傳感器、適體傳感器與免疫傳感器3大類[7]。核酸適配體通常是一段由指數富集配體系統進化(SELEX)技術篩選獲得的長度為15—40個堿基長的DNA或RNA寡核苷酸片段[8]。這些核酸序列類似抗體,可以緊密且特異地與目標分子結合,但又具備抗體所不具有的易于修飾、合成迅速、穩定、成本低廉等優勢。由于適配體的空間三維構象易折疊形成一些如螺旋、發卡、莖環、凸環、三葉草和假結等穩定的三環空間結構,使其能夠依靠范德華力、氫鍵和疏水作用等方式與目標物緊密結合,并可以區分結構類似的物質[9-10]。此外,適配體的靶標分子種類豐富,既可以捕獲包括蛋白質、小分子、離子、核酸等多種靶目標,也可以與完整的細胞結合[11-12]。因此,適配體傳感器非常適宜用于食品加工貯藏中致病菌的檢測。亞甲基藍(MB)作為一種電活性有機染料,其能夠嵌入核酸雙鏈中。近年來,亞甲基藍作為一種無標的電化學指示劑被廣泛應用于電化學適配體傳感器中[13-14]。還原氧化石墨烯(rGO)是對石墨烯進行一系列氧化還原反應后,制得的可用于提高電子傳輸的新型納米材料[15]。【本研究切入點】筆者課題組在以往的研究中,曾成功構建出一種基于復合納米材料和酶切信號放大的沙門氏菌適配體傳感器,最低檢測限為200 cfu/mL[16],其檢測性能仍有待提升。目前國內外關于應用電化學適配體傳感器檢測食源性致病菌的文獻已不罕見,且多數研究取得了令人滿意的成果,但成功用于鼠傷寒沙門氏菌定量檢測的電化學適配體傳感器的報道非常少。【擬解決的關鍵問題】本研究以MB為電化學活性物質,利用Apt與鼠傷寒沙門氏菌的高特異性結合實現MB的定量脫落,同時引入rGO和AuNPs兩種納米材料以及 Exo I協助電信號的放大,通過監測電極表面的電信號變化情況來完成鼠傷寒沙門氏菌的定量檢測,為食品工業中鼠傷寒沙門氏菌的現場快速定量檢測提供一種高效便捷、靈敏準確的新型檢測方法。
1 材料與方法
試驗于2016年9月至2017年3月在陜西師范大學食品工程與營養科學學院畜產品加工實驗室進行。
1.1 菌株和DNA序列
鼠傷寒沙門氏菌CMCC 50115、大腸桿菌ATCC 25922、金黃色葡萄球菌ATCC 25923、福氏志賀氏菌CMCC 51572、單核增生李斯特菌ATCC 19115、副溶血性弧菌ATCC 17802均購自北納創聯生物技術有限公司,-40℃保存備用。
鼠傷寒沙門氏菌適配體:
(Apt,5′-GAGTTAATCAATACAAGGCGGGAA CATCCTTGGCGGTGC-3′);
鼠傷寒沙門氏菌適配體互補鏈:
(S,5′-HS-(CH)6-ATCATTGCACCGCCAAGTAT GTTCCCACCTTGTATTCATTAACTC-3′)。
上述 DNA序列均由上海生工生物工程有限公司合成,-20℃保存備用。
1.2 儀器和試劑
本研究全部電化學試驗操作均于 CHI660C型電化學工作站(上海辰華儀器有限公司)上進行。試驗均為三電極系統,其中工作電極:裸玻碳電極(GCE)或修飾后的玻碳電極;對電極:鉑絲;參比電極:銀/氯化銀(飽和氯化鉀)電極。KQ-100V型超聲波清洗器(上海京工實業有限公司),HJ-1型磁力攪拌器(江蘇省金壇市精達儀器制造廠),漩渦振蕩器(北京中西遠大科技有限公司),離心機(HERMLE),恒溫恒濕培養箱(賽福實驗儀器公司),真空干燥箱(南京蘇恩瑞干燥設備有限公司)。
核酸外切酶I(Exo I),紐英倫生物技術(北京)有限公司;氯金酸(HAuCl4)、亞甲基藍(MB)、6-巰基-1-己醇(97%,MCH),美國 Sigma Aldrich公司;鐵氰化鉀(K3[Fe(CN)6])、亞鐵氰化鉀(K4Fe(CN)6·3H2O)、磷酸氫二鈉(Na2HPO4)、磷酸二氫鈉(NaH2P04)、氯化鉀(KCl)、檸檬酸三鈉(Na3C6H5O7·2H20)、濃硫酸(98% H2SO4)、無水乙醇(C2H6O)等,西安三浦化學試劑有限公司;石墨烯(Gra),南京吉倉納米科技有限公司;其余所用試劑均為分析純;試驗用水為蒸餾水。
1.3 溶液的配制
鼠傷寒沙門氏菌適配體、鼠傷寒沙門氏菌適配體互補鏈均于12 000 r/min下離心30—60 s后加入無菌水稀釋到 2 μmmol·L-1,震蕩均勻后于-20℃凍藏。
核酸外切酶I反應緩沖液:將隨酶提供的10×外切酶 I反應緩沖液用無菌水稀釋到 1×核酸外切酶 I反應緩沖液,-20℃保存備用。
各濃度菌液均以 0.1 mol·L-1PBS緩沖溶液(pH 7.0)配制,4℃保存。
亞甲基藍以0.1 mol·L-1PBS緩沖溶液(pH 7.0)配制成 120 μmmol·L-1的溶液,4℃保存。
巰基乙醇以去離子水稀釋為2 mmol·L-1的溶液,4℃保存。
1.4 樣品處理
參照GB4789.17—2003《食品微生物學檢驗 肉與肉制品檢驗》對豬肉樣品進行處理。新鮮豬肉首先進行表面消毒處理(沸水燙3—5 s),然后于超凈臺中以無菌剪刀取深層肌肉20 g,剪碎,置于無菌研缽中搗碎,加入無菌水180 mL混勻后制得1∶10樣品稀釋液。在豬肉樣品稀釋液中加入不同濃度的鼠傷寒沙門氏菌,混勻,于4℃保存。
1.5 金納米粒子的制備
根據Turkevich-Frens法[17-18],以檸檬酸三鈉還原氯金酸的方法制備。
1.6 氧化石墨烯的制備
采用傳統的Hummers方法[19-20]。
1.7 電化學適體傳感器的構建
整個構建過程如圖1所示。
首先進行還原氧化石墨烯-納米金粒子復合電極的制備,取制得的氧化石墨烯1 mg溶于1 mL PBS溶液中,500 W下超聲30 min混勻后用移液器滴加10 μL于打磨好的玻碳電極表面,室溫下風干。為了得到還原氧化石墨烯,將電極于PBS溶液中進行電化學還原。工作參數如下:循環伏安法(CV),工作電壓為-0.2—0.6 V,掃速為100 mV·s-1,圈數為100圈。然后將電極于 1%的氯金酸中進行恒電位沉積,以將納米金修飾于電極表面。工作參數如下:計時電流法(CA),工作電壓為-200 mV,工作時間為20 s。將電極晾干,不用時置于4℃ PBS緩沖液中保存。
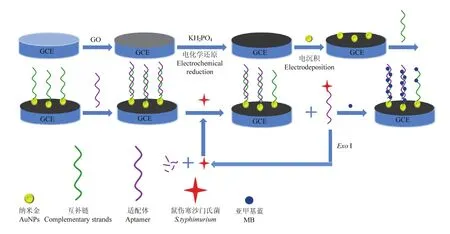
圖1 電化學適配體傳感器檢測沙門氏菌原理圖Fig. 1 Principle of the electrochemical aptasensor of detection of Salmonella typhimurium
在完成還原氧化石墨烯-納米金粒子復合電極的制備后,將 10 μL 2 μmol·L-1的互補鏈(S)均勻滴在復合電極上,室溫下完成孵育,以PBS緩沖液沖洗,再將10 μL 2 mmol·L-1的巰基己醇均勻滴在電極表面反應 1 h 完成電極的封閉[21]。然后將 10 μL 2 μmol·L-1的適體鏈(Apt)均勻滴在電極表面,一段時間后用PBS緩沖液沖洗。隨后將電極浸入含不同濃度鼠傷寒沙門氏菌和一定濃度核酸外切酶I(Exo I)中37℃下孵育30 min后,用PBS緩沖液沖洗。最后將修飾好的電極浸入120 μmol·L-1亞甲基藍(MB)溶液中1 h,充分反應后用PBS緩沖液反復沖洗。通過循環伏安法(CV)和電化學阻抗法(EIS)記錄復合電極上 MB的電化學信號,以實現鼠傷寒沙門氏菌的定量檢測。
1.8 電化學測試方法
循環伏安(CV)、差分脈沖伏安(DPV)和電化學阻抗(EIS)檢測均為三電極系統,裸玻碳電極(GCE)或修飾后的玻碳電極為工作電極,Ag/AgCl電極為參比電極,鉑電極為對電極。具體檢測環境與參數參照徐連應等[16]的研究。
2 結果
2.1 還原氧化石墨烯-納米金粒子復合電極的電化學表征
以循環伏安法(CV)來驗證復合電極制備構程中的每一步修飾情況,如圖 2-A所示。檢測環境為K3[Fe(CN)6]/K4[Fe(CN)6]溶液,當電極電勢在-0.2—0.6 V反復掃描時,[Fe(CN)6]3-被還原為[Fe(CN)6]4-,[Fe(CN)6]4-被氧化為[Fe(CN)6]3-,致使電極表面氧化還原反應得以不間斷進行,產生一組相互對稱的氧化還原峰,如裸玻碳電極曲線a所示。當在裸玻碳電極上修飾了一層氧化石墨烯后,由于帶負電性的含氧官能團的引入,使電極表面的電活性位點被大量占據,不利于電子的傳遞[22],導致峰電流顯著降低,如曲線 b所示。將氧化石墨烯用電化學還原的方法去掉含氧官能團后,導電性能得到部分恢復,峰電流升高,如曲線c所示,生成的還原氧化石墨烯與石墨烯的結構和性質相似。最后用電沉積法在電極表面修飾一層納米金,峰電流大幅度升高,如曲線d所示,這是因為納米金具有良好的電催化活性,且表面帶有大量的負電荷,電子密度極高。同時采用電化學阻抗法(EIS)進行進一步的驗證,如圖2-B所示,曲線的半圓直徑越大,電阻越大,通過觀察圓弧半徑的大小即可得出電阻的變化。通過觀察可知,EIS法所得結果與CV法保持一致,說明復合電極制備的每一步均得到了準確的修飾。
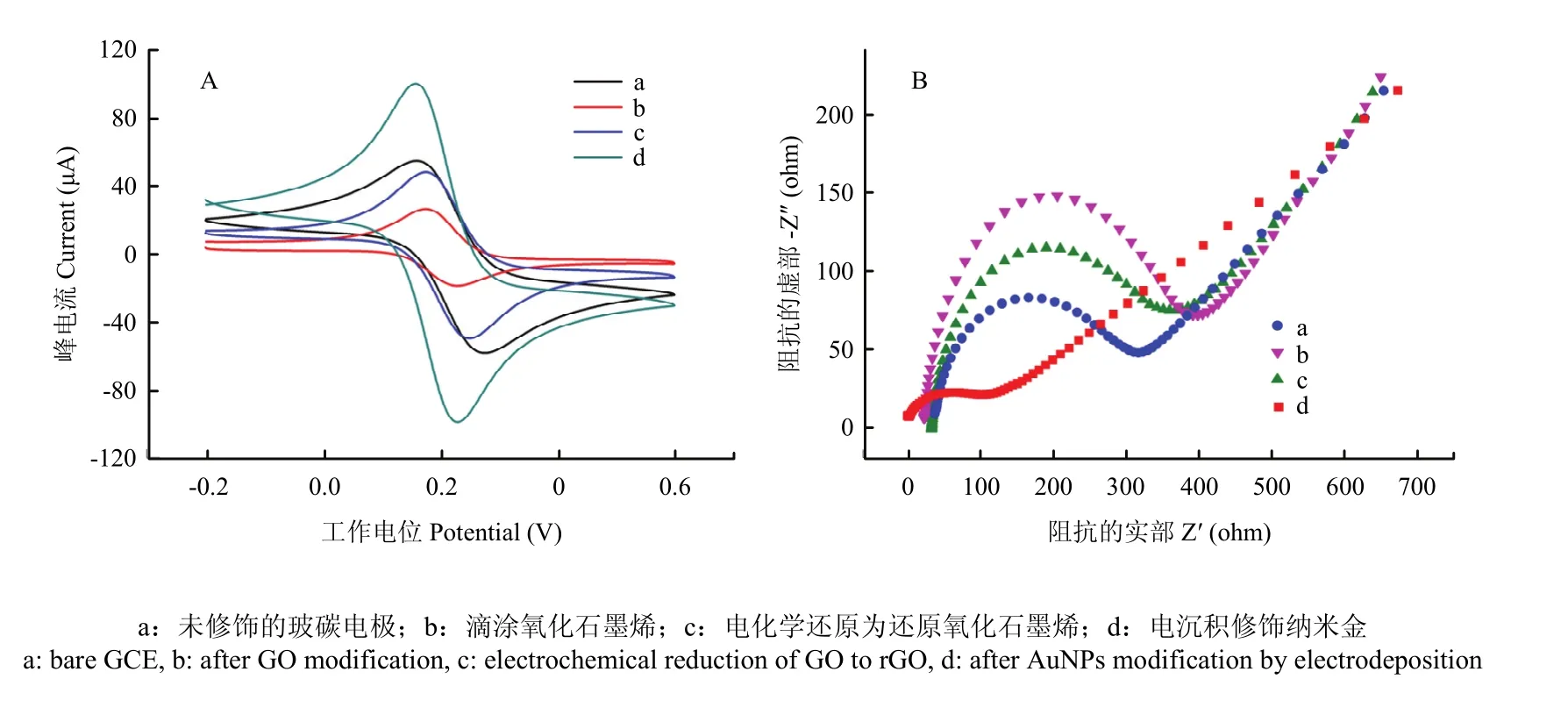
圖2 在鐵氰化鉀溶液中電極的表征圖CV(A)和EIS(B)Fig. 2 CV(A) and EIS(B) at different electrodes in Fe(CN)63-/4-
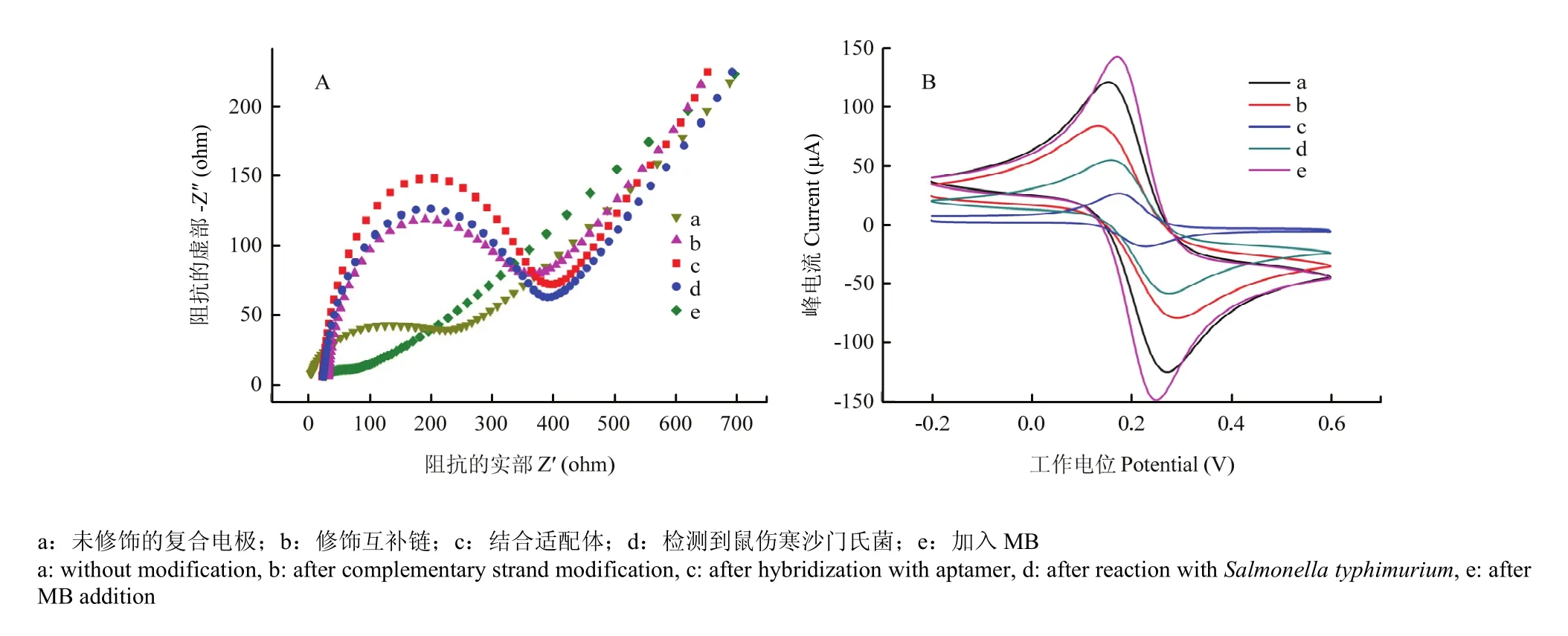
圖3 在鐵氰化鉀溶液中傳感器的表征圖EIS(A)和CV(B)Fig. 3 EIS and CV of aptasensor at different conditions in Fe(CN)63-/4-
2.2 適配體傳感器的電化學表征
采用電化學阻抗法(EIS)對本研究所構建的適配體傳感器進行檢測。[Fe(CN)6]3-/4-耦合作為氧化還原探針,電荷轉移所受到的阻力(Ret)由阻抗圖譜來判斷,半圓直徑越大,電阻越大。如圖3-A所示,曲線a還原氧化石墨烯-納米金復合電極在初始狀態下的半圓很小,因為此時電子可以自由移動。當互補鏈自組裝到復合電極表面后,DNA鏈上顯負電性的磷酸鹽骨架對電子在電極和[Fe(CN)6]3-/4-緩沖液中的轉移起到阻礙作用,導致Ret增大(曲線b)。當滴加適配體后,其與其互補鏈雜交成雙鏈 DNA結構,復合電極上負電荷的增加會導致 Ret再次增加(曲線 c)。當鼠傷寒沙門氏菌被檢測到后,由于鼠傷寒沙門氏菌與適配體的高度特異性結合將適配體帶離復合電極表面,此時電極上負電荷減少,對電子移動的空間阻力Ret減小(曲線d),同時,Exo I將適配體不斷剪切從而釋放鼠傷寒沙門氏菌循環作用,帶離電極上更多的適配體。加入甲苯胺藍(MB)后,由于 MB是一種電化學活性物質,可以促進電子的傳遞,故半圓直徑明顯減小(曲線e)。同時用循環伏安法(CV)進行驗證,結果如圖3-B所示,由圖可知CV法與EIS法所得結論保持一致,說明該傳感器已成功構建。
2.3 Exo I對傳感器的信號放大效能
在本研究中,Exo I能作用于鼠傷寒沙門氏菌適配體,使其沿著3′到5′的方向水解為單個核苷酸,導致與適配體緊密結合的鼠傷寒沙門氏菌被釋放后循環作用于電極,帶離更多的適配體,從而實現響應信號的放大。為了驗證Exo I的效能,在還原氧化石墨烯-納米金復合電極上修飾鼠傷寒沙門氏菌互補鏈與適配體后,直接浸入亞甲基藍(MB)溶液中,用差分脈沖伏安法(DPV)來記錄響應值,如圖4曲線a所示。隨后再取兩根經上述步驟處理后的電極,一根浸入2×107cfu/mL的鼠傷寒沙門氏菌菌液中,另外一根浸入2×107cfu/mL的鼠傷寒沙門氏菌菌液與0.8 U·mL-1的Exo I的混合液中,用DPV法記錄下響應值。如圖4中曲線b與曲線c可知,加入Exo I與未加Exo I相比,加入Exo I后DPV響應值明顯降低,說明Exo I的加入使本研究所構建的傳感器在鼠傷寒沙門氏菌檢測上的靈敏度得到了大幅提升。
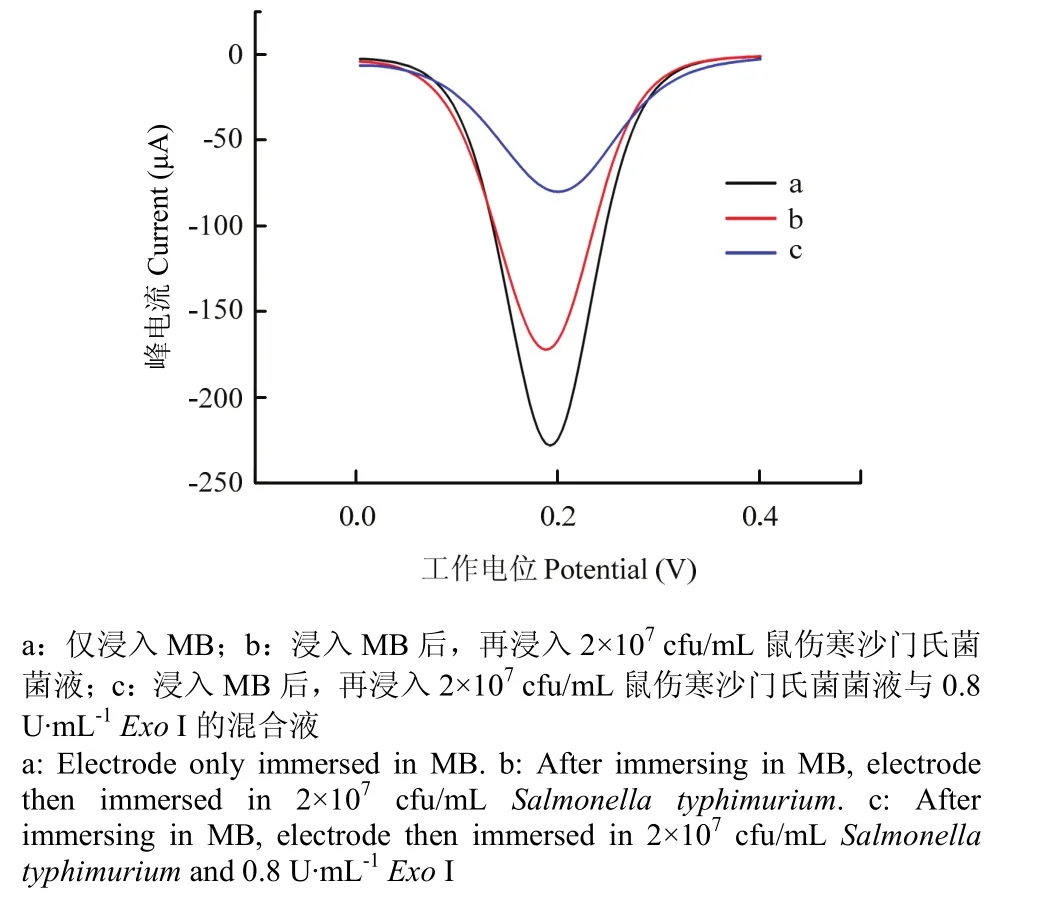
圖4 不同狀態下電極對亞甲基藍的差分脈沖伏安響應Fig. 4 DPV signals of MB for different conditions of electrode in PBS
2.4 條件優化
圖5-A可以得出電化學信號與鼠傷寒沙門氏菌孵育時間的關系,可知電化學信號隨著孵育時間的增加不斷減小,但當孵育時間超過40 min后,電化學信號的變化趨于平穩,說明40 min足夠讓鼠傷寒沙門氏菌將適配體帶離,因此40 min即為最優孵育時間。由圖5-B可知在Exo I濃度達到0.8 U·μL-1時,電信號下降到最低,因此選擇0.8 U·μL-1作為最適酶濃度。
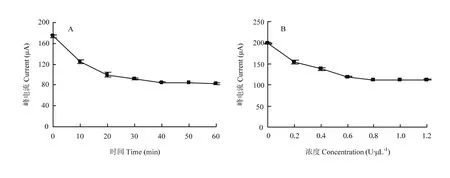
圖5 試驗條件的優化:(A)孵育時間(B)Exo I濃度Fig. 5 The optimization of experimental conditions: (A) incubation time (B) Exo I concentration
2.5 傳感器檢測分析性能的考察
當傳感器電極在不同濃度的鼠傷寒沙門氏菌菌液中孵育40 min后,所得到的差分脈沖伏安(DPV)曲線圖如圖6-A所示。當菌液濃度增大,峰電流隨之逐漸減小,并且在菌液濃度為 2×102—2×107cfu/mL,傳感器DPV曲線的峰電流值與菌液濃度的對數保持良好的線性關系,線性方程為 I(μA)=-30.422x+302.49(R2=0.9975),檢測限為 67 cfu/mL(S/N=3)(圖6-B)。
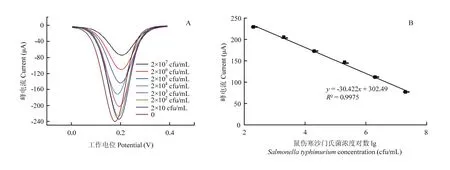
圖6 不同濃度的鼠傷寒沙門氏菌(0—2×107 cfu/mL)下的DPV曲線(A)及DPV峰電流值與鼠傷寒沙門氏菌濃度的校正曲線(B)Fig. 6 The DPV curves obtained when detecting Salmonella typhimurium in different concentrations(0—2×107 cfu/mL) and the calibration curve
為了驗證該傳感器的特異性,在相同的條件下對另外5種細菌(大腸桿菌、金黃色葡萄球菌、志賀氏菌、單增李斯特菌以及副溶血弧菌)進行了檢測。由圖7可知,5種非目標菌的電化學響應信號接近于空白信號,且明顯高于鼠傷寒沙門氏菌的電化學響應信號,表明所構建的傳感器特異性良好。
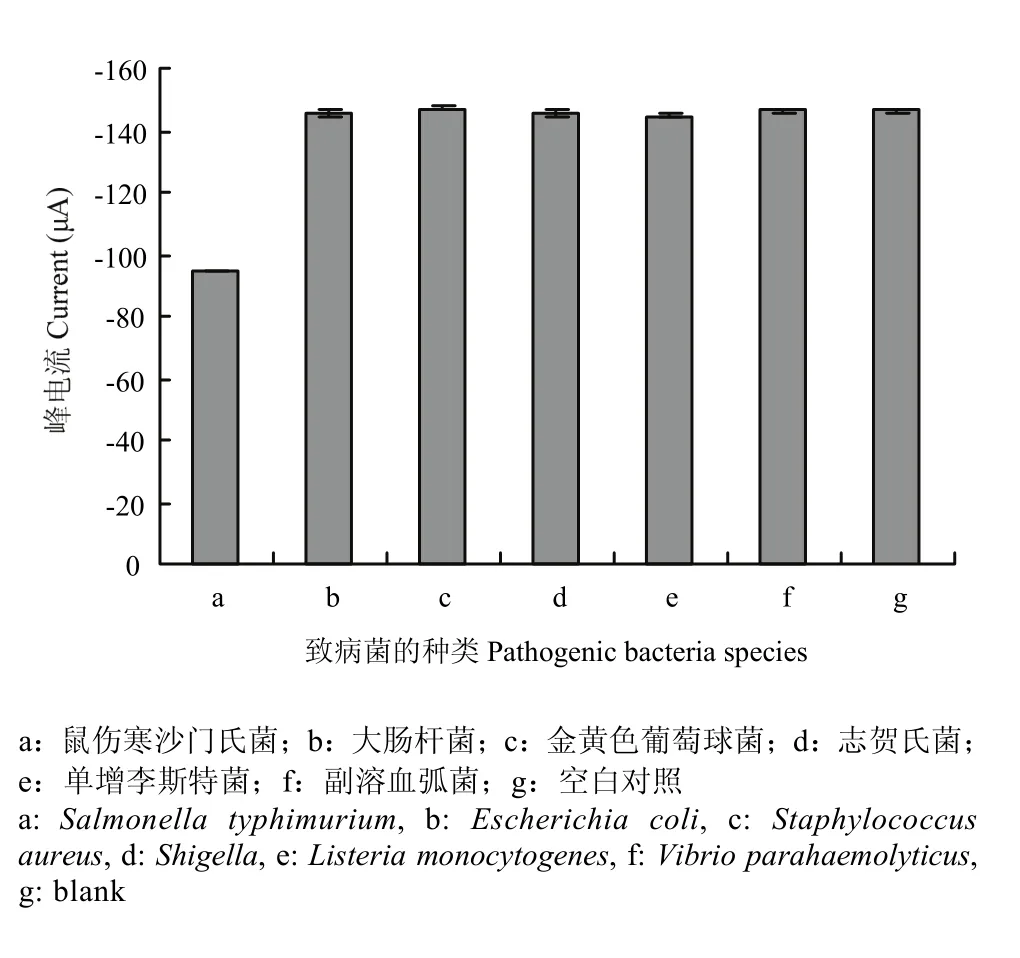
圖7 不同細菌的電化學信號柱狀圖Fig. 7 Comparison of DPV peak currents after reaction with different target bacteria
本研究以相同的方法制備同批次的 7根工作電極,進行了一組平行試驗,以驗證該傳感器的重復性。將工作電極在2×102cfu/mL的鼠傷寒沙門氏菌菌液中孵育40 min,隨后測量各峰電流值,得RSD為4.0%(n=7),證明所構建的傳感器重復性良好。
2.6 實際樣本測定和加標回收試驗
以1.4中預處理的含不同濃度鼠傷寒沙門氏菌的豬肉樣品作為待檢測的實際樣本,利用本研究構建的傳感器進行檢測,所得結果與平板計數法作對比,求回收率。由表1可知本方法回收率為97.3%—106.7%,與平板計數法檢測結果高度吻合。證明所構建的傳感器檢測鼠傷寒沙門氏菌準確性高,可以應用于實際樣本的檢測。
3 討論
近年來,納米材料在傳感器構建中起到了關鍵性作用。LABIB等[23]于2012年成功構建首個可以用于特異性檢測鼠傷寒沙門氏菌活菌的核酸適體阻抗傳感器。該傳感器直接將鼠傷寒沙門氏菌DNA適體鏈固定到納米金修飾絲網印刷電極上,鼠傷寒沙門氏菌在適體鏈上結合量的對數與電極阻抗呈現良好的線性關系,由此可以實現定量檢測。該傳感器的最低檢測限為600 cfu/mL,在食品檢測領域其性能仍需進一步提升。MA等[24]于2014年將滴涂在玻碳電極上的氧化石墨烯(GO)進行電化學還原,于電極上修飾了一層石墨烯納米片,構建了基于復合納米材料的沙門氏菌適體傳感器。石墨烯納米材料的引入大大增強了電極對于捕獲探針沙門氏菌適配體鏈的固定作用,同時也增強了電子在電極處的轉移能力。該傳感器的最低檢測限可以達到3 cfu/mL,但檢測時間需要 90 min,且檢測范圍較窄,最高僅為 2.4×103cfu/mL。
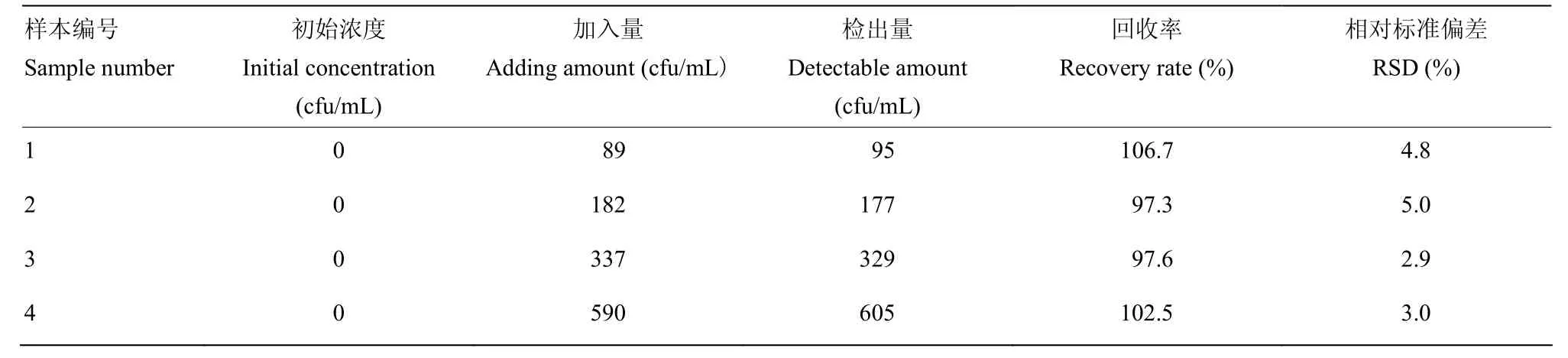
表1 豬肉樣品中鼠傷寒沙門氏菌的檢測回收率Table 1 The recovery of Salmonella typhimurium detection in pork
為了進一步優化傳感器的性能,本研究在應用還原氧化石墨烯和納米金兩種納米材料的同時,引入了核酸外切酶I與電化學指示劑亞甲基藍。在裸玻碳電極(GCE)上修飾還原氧化石墨烯(rGO)和納米金(AuNPs)后,將巰基化的鼠傷寒沙門氏菌適配體互補鏈及適配體先后固定在rGO-AuNPs復合電極上,隨后復合電極被置于滴加了核酸外切酶I的鼠傷寒沙門氏菌菌液中孵育,并于孵育完成后加入電化學指示劑亞甲基藍,最后通過監測電極表面的電信號變化完成對鼠傷寒沙門氏菌的定量檢測。作為一種吩噻嗪類有機染料,亞甲基藍在電化學傳感器研究領域經常被用作雜交反應指示劑[25-26]。亞甲基藍與DNA的作用包括插入作用與靜電作用模式,可以插入雙鏈DNA中[27-29]。在本研究中,鼠傷寒沙門氏菌帶離電極表面的鼠傷寒沙門氏菌適配體鏈,導致電極上雙鏈DNA結構部分轉變為單鏈,可通過監測嵌入雙鏈的 MB電化學信號的強弱來測定鼠傷寒沙門氏菌的含量。MB的加入大大提高了傳感器的檢測性能,作為一種電化學活性物質,MB可以明顯放大響應電流,這使檢測更加便利,同時也減小了測量誤差。核酸外切酶 I(Exo I)的引入也使傳感器的性能得到了提升。作為一種僅作用于單鏈的3′—5′核酸外切酶,Exo I能沿著3′-OH末端將其剪切為單個核苷酸,且不依賴特定的核酸序列[30-31]。在本研究中,當鼠傷寒沙門氏菌進入到檢測體系后,由于其與適體鏈間的高度特異性結合作用,鼠傷寒沙門氏菌會將適體鏈從電極上帶離,此時 Exo I能迅速作用于適體鏈,將其分解成單個核苷酸,同時鼠傷寒沙門氏菌被從適體鏈上釋放,得以循環作用于電極上的適配體,將更多的適配體帶離,這樣即便是微量的鼠傷寒沙門氏菌也可以通過循環作用產生較大的電信號,保證了傳感器的靈敏度,且整個過程快速高效。
4 結論
本研究以電化學活性物質亞甲基藍為信號探針,通過在玻碳電極上修飾還原氧化石墨烯與納米金以提高電極的性能,并引入核酸外切酶I進一步實現信號的放大,成功構建一種新型的用于鼠傷寒沙門氏菌定量檢測的電化學適配體傳感器。該傳感器最低檢測限為67 cfu/mL,檢測范圍在2×102—2×107cfu/mL,檢測時間為 40 min,綜合性能良好。在鼠傷寒沙門氏菌定量檢測上,該傳感器表現出較高的靈敏度、特異性以及重復性,加上操作簡便、檢測迅速,有望推廣應用于食品工業中鼠傷寒沙門氏菌的快速檢測和有效防控。
[1]SHIM W B, SONG J E, MUN H, CHUNG D H, KIM M G. Rapid colorimetric detection of Salmonella typhimurium using a selective filtration technique combined with antibody-magnetic nanoparticle nanocomposites. Analytical and Bioanalytical Chemistry, 2014,406(3): 859-866.
[2]李慶德, 原志偉, 沈巍. 沙門氏菌的危害及其快速檢測方法的研究進展. 湖北畜牧獸醫, 2010(1): 10-12.LI D Q, YUAN Z W, SHEN W. Progress in the hazards of Salmonella and its rapid detection methods. Hubei Journal of Animal and Veterinary Science, 2010(1): 10-12. (in Chinese)
[3]WANG Z P, XU H, WU J, YE J, YANG Z. Sensitive detection of Salmonella with fluorescent bioconjugated nanoparticles probe. Food Chemistry, 2011, 125(2): 779-784.
[4]NIU K L, ZHENG X P, HUANG C S, XU K, ZHI Y, SHEN H B, JIA N Q. A colloidal gold nanoparticle-based immunochromatographic test strip for rapid and convenient detection of Staphylococcus aureus. Journal of Nanoscience and Nanotechnology, 2014, 14(7):5151-5156.
[5]牛凱莉. 基于膠體金免疫層析法的食源性致病菌檢測技術的研究[D]. 上海: 上海師范大學, 2013.NIU K L. The research of detecting methods of for the food-borne pathogenic bacteria based on the Colloidal gold immunochromatography assay [D]. Shanghai: Shanghai Normal University, 2013. (in Chinese)
[6]戶桂濤, 范云場, 董興, 李云, 繆娟. 電化學傳感器在食品分析中的應用進展. 材料導報, 2015, 19: 40-45.HU G T, FAN Y C, DONG X, LI Y, MIAO J. Progress in application of electrochemical sensors in food analysis. Materials Review, 2015,19: 40-45. (in Chinese)
[7]張義紅, 許文靜, 楊坤. 電化學生物傳感器的研究進展. 集成技術,2014, 3(5): 19-27.ZHANG Y H, XU W J, YANG K. Progress in electrochemical biosensors. Journal of Integration Technology, 2014, 3(5): 19-27. (in Chinese)
[8]XU Y, CHENG G F, HE P G, FANG Y Z. A review: Electrochemical aptasensors with various detection strategies. Electroanalysis, 2009,21(11): 1251-1259.
[9]GILBERT S D, STODDARD C D, WISE S J, BATEY R T.Thermodynamic and kinetic characterization of ligand binding to the purine riboswitch aptamer domain. Journal of Molecular Biology,2006, 359(3): 754-768.
[10]PADMANABHAN K, PADMANABHAN K P, FERRARA J D,SADLER J E, TULINSKY A. The structure of alpha-thrombin inhibited by a 15-mer single-stranded DNA aptamer. The Journal of Biological Chemistry, 1993, 268(24): 17651-17654.
[11]FANG Z Y, WU W, LU X W, ZENG L W. Lateral flow biosensor for DNA extraction-free detection of Salmonella based on aptamer mediated strand displacement amplification. Biosensors and Bioelectronics,2014, 56: 192-197.
[12]FLOREA A, TALEAT Z, CRISTEA C, MAZLOUM-ARDAKANI M,S?NDULESCU R. Label free MUC1 aptasensors based on electrodeposition of gold nanoparticles on screen printed electrodes.Electrochemistry Communications, 2013, 33: 127-130.
[13]WANG J L, WANG F A, DONG S J. Methylene blue as an indicator for sensitive electrochemical detection of adenosine based on aptamer switch. Journal of Electroanalytical Chemistry, 2009,626(1/2): 1-5.
[14]DU Y, LI B L, WANG F, DONG S J. Au nanoparticles grafted sandwich platform used amplified small molecule electrochemical aptasensor. Biosensors and Bioelectronics, 2009, 24(7): 1979-1983.
[15]GEIM A K, NOVOSELOV K S. The rise of grapheme. Nature Materials, 2007, 6(3): 183-191.
[16]徐連應, 王畢妮, 張富新. 基于復合納米材料和酶切信號放大電化學適體傳感器檢測沙門氏菌. 中國農業科學, 2017, 50(21):4208-4217.XU L Y, WANG B N, ZHANG F X. An electrochemical aptasensor for detection of Salmonella based on composite nanomaterial and enzymatic recycling for amplification. Scientia Agricultura Sinica,2017, 50(21): 4208-4217. (in Chinese)
[17]FRENS G. Controlled nucleation for regulation of particle-size in monodisperse gold suspensions. Nature Physical Science, 1973,241(105): 20-22.
[18]TURKEVICH J, STEVENSON P C, HILLIER J. A study of the nucleation and growth processes in the synthesis of colloidal gold.Discussion of the Faraday Society, 1951, 11: 55-75.
[19]HUMMERS W S, OFFEMAN R E. Preparation of graphitic oxide.Journal of the American Chemical Society, 1958, 80(6): 1339-1340.
[20]AIIEN M J, TUNG V C, KANER R B. Honeycomb carbon: a review of graphene. Chemical Reviews, 2010, 110(1): 132-145.
[21]CHEN J R, JIAO X X, LUO H Q, LI N B. Probe-label-free electrochemical aptasensor based on methylene blue-znchored grapheme oxide amplification. Journal of Materials Chemistry B, 2013, 1:861-864.
[22]CHEN D, FENG H B, LI J H. Graphene oxide: Preparation,functionalization, and electrochemical applications. Chemical Reviews,2012, 112(11): 6027-6053.
[23]LABIB M, ZAMAY A S, KOLOVSKAYA O S, RESHETNEVA I T,ZAMAY G S, KIBBEE R J, SATTAR S A, ZAMAY T N,BEREZOVSKI M V. Aptamer-based viability impedimetric sensor for bacteria. Analytical Chemistry, 2012, 84(21): 8966-8969.
[24]MA X, JIANG Y, JIA F, YU Y, CHEN J, WANG Z. An aptamerbased electrochemical biosensor for the detection of Salmonella.Journal of Microbiological Methods, 2014, 98: 94-98.
[25]KARA P, KERMAN K, OZKAN D, MERIC B, ERDEM A, OZKAN Z, OZSOZ M. Electrochemical genosensor for the detection of interaction between methylene blue and DNA. Electrochemistry Communications, 2002, 4(9): 705-709.
[26]ERDEM A, KERMAN K, MERIC B, OZSOZ M. Methylene blue as a novel electrochemical hybridization indicator. Electroanalysis, 2001,13(3): 219-223.
[27]ROHS R, SKLENAR H, LAVERY R, RODER B. Methylene blue binding to DNA with alternating GC base sequence: A modeling study.Journal of American Chemical Society, 2000, 122(12): 2860-2866.
[28]ZHAO G C, ZHU J J, CHEN H Y. Spectroscopic studies of the interactive model of methylene blue with DNA by means of β-cyclodextrin. Spectrochimca Acta. Part A: Molecular and Biomolecular Spectroscopy, 1999, 55(5): 1109-1117.
[29]OZKAN D, KARA P, KERMAN K, MERIC B, ERDEM A, JELEN F,NIELSEN P E, OZSOZ M. DNA and PNA sensing on mercury and carbon electrode by using methylene blue as an electrochemical label.Bioelectrochemistry, 2002, 58(1): 119-126.
[30]JIANG B Y, WANG M, LI C, XIE J Q. Label-free and amplified aptasensor for thrombin detection based on background reduction and direct electron transfer of hemin. Biosensors and Bioelectronics,2013, 43: 289-292.
[31]ZHENG D M, ZOU R X, LOU X H. Label-free fluorescent detection of ions, proteins, and small molecules using structure-switching aptamers, SYBR Gold, and exonuclease I. Analytical chemistry, 2012,84(8): 3554-3560.

