白屈菜對低溫脅迫應答的生理學研究及分子機制解析
趙 露,楊雪梅,李 俊,劉 霞,許永華
(吉林農業大學中藥材學院,吉林 長春 130118)
白屈菜(ChelidoniummajusL.)是罌粟科白屈菜屬多年生草本植物,全草入藥,富含多種生物堿,有止咳、抗炎、止痛等多方面藥理作用,[1-6]是止咳、胃腸消炎及止痛類中藥制劑的重要原料[7].在對白屈菜馴化栽培的研究中發現,白屈菜對生態環境有比較廣泛的適應性,對土壤酸堿性、強光和蔭蔽環境、干旱及溫度變化的適應性較強,特別是抗寒凍性極強,在冬季氣溫-50℃以下的地區(如內蒙古根河市),其蓮座狀叢生葉及當年種子萌發的幼苗可以自然越冬,并在翌年初春冰雪尚未完全融化時,葉片由水漬狀回復成正常狀態開始生長,是冬性植物.白屈菜極強的耐寒凍特性機理目前在國內外尚未見報道.
植物抗寒性研究表明,環境因素和物種生物學特性是影響植物抗寒凍性的關鍵因素,環境因素主要是溫度、光周期、水分狀況[8];物種生物學特性主要由植物遺傳背景、發育和生長時期以及植物對低溫脅迫的保護機制所決定[9].植物在適應寒凍脅迫過程中,啟動抗寒凍機制以減少低溫造成的損傷,出現一些顯著的生理生化變化:保護性物質增多,調節細胞滲透性并降低冰點溫度[10-15];含水量下降,呼吸代謝減弱[16];激素調控系統發生變化,如內源激素中IAA、GA濃度下降,ABA濃度升高,以抑制生長促進休眠[17];細胞質膜氧化性發生變化等[17-19].目前,對植物感知低溫信號的研究表明,組蛋白H2A.Z可能參與擬南芥的溫度感知;三磷酸肌醇(IP3)介導的Ca2+信號轉導途徑可能在低溫信號轉導中起決定作用;磷脂酶D、脂肪酸去飽和代謝關鍵酶以及肌醇多磷酸磷酸酶基因FRY1等與低溫信號感知有關.[17]對低溫脅迫應答的分子機制研究表明,C-復制-結合因子/脫水反應元素結合因子(CBF/DREB1,C-repeat binding factor/dehydration responsive element binding factor1)調控途徑具有保守性,在多種雙子葉和單子葉植物中均發現了該關鍵基因參與的調控,[17]揭示在單子葉植物中存在類似于擬南芥的CBF/DREB1 調控機制[20].此外,植物中還存在其他的低溫信號傳遞通路[17].
迄今,有關白屈菜抗寒凍性的研究未見報道,其應答低溫脅迫的生理生化反應以及低溫應答分子機制尚不清楚,因此,本文對此開展了相關研究,以探究其超強抗凍性的生理基礎和分子機制.
1 材料與方法
1.1 實驗材料
1.1.1采樣
野生白屈菜采自吉林農業大學校園內野生白屈菜1號觀測樣地,樣地的地理位置為北緯43°48′33″、東經125°24′21″,海拔230 m;夏季林間郁閉度在85%左右,木本植物有銀中楊、紅皮云杉,草本植物有紫花地丁、早開堇菜.8月初白屈菜莖枯萎、根盤萌發新的基生葉,待基生葉長到8 cm左右開始采樣,持續到12月末氣溫降至-20℃以下.夏秋季采樣溫度范圍10℃~28℃,林下日照時間8~12 h,采樣時間為當日14:00,即日間溫度最高時段.秋冬季采樣溫度范圍-25℃~10℃,林下日照時間0~8 h(積雪覆蓋后越冬苗日照時間為0 h),以每日最低溫連續3 d達到采樣低溫時開始采樣,采樣低溫設定為5℃,0℃,-5℃,-10℃,-15℃,-20℃,采樣時間為當日8:00.分別從3株植株采集葉片.
1.1.2控制降溫條件下的實驗材料
控制條件下生長的白屈菜,是將上述1號觀測樣地的白屈菜苗及根際周圍土壤一起移植到營養缽中,放入人工氣候箱,25℃、16 h光照8 h黑暗適應培養1周后,將培養溫度分別設定為25℃,20℃,15℃,10℃,5℃,0℃,每一溫度點維持3 d,在各溫度點采樣.-5℃,-10℃處理在冰箱中進行,全黑暗,每個溫度點維持3 d.采樣時分別從3株植株取葉片.
1.1.3轉錄組測序及基因驗證材料
材料來源及采樣方法同1.1.1,采樣溫度為0℃,-10℃,-20℃,分別命名為A、B、C三組,每組分別從3株野生白屈菜植株上取葉片.基因驗證用測序的3份平行材料.
1.2 實驗方法
1.2.1主要生理指標測定
細胞膜滲透性——相對電導法;游離脯氨酸——酸性茚三酮比色法;丙二醛——硫代巴比妥酸法(TCA法);可溶性糖——蒽酮乙酸乙酯比色法;可溶性蛋白——考馬斯亮藍法;葉綠素含量——比色法.每份樣品取白屈菜葉片0.3 g,3次重復.采用IBM SPSS Statistics22軟件對生理實驗數據進行差異性分析.
1.2.2轉錄組測序
委托上海歐易生物醫學科技有限公司進行測序及數據庫比對.測序平臺:IlluminaHiSeqTM 2500測序儀,文庫質檢:Agilent 2100分析儀;每樣本數據量為6 G,數據解析包括非冗余數據庫(NR,non-redundant)、真核生物同源蛋白數據庫(KOG)、蛋白質數據庫(SWISSPROT)、基因數據庫(GO,gene ontology)、基因與基因數據庫(KEGG,Kyoto encyclopedia of genes and genomes)等5個數據庫比對及差異表達基因篩選.
1.2.3基因表達驗證
采用實時定量PCR法進行基因表達驗證.RNA逆轉錄試劑采用Vazyme公司生產的試劑盒(產品代碼R223-01),熒光定量PCR試劑采用Qiagen公司生產的定量PCR試劑盒(QuantiFast? SYBR? Green PCR Kit);儀器:LightCycler? 480 ⅡPCR儀(Roche).
2 結果與分析
2.1 野生白屈菜低溫應答過程中主要生理指標變化趨勢
植物感受低溫刺激啟動生理應答,細胞內抗寒凍性物質脯氨酸、可溶性糖(蔗糖、葡萄糖)、可溶性蛋白含量增加,細胞滲透性改變、葉綠素含量降低[21].測定秋冬季野生白屈菜應答低溫的主要生理指標、各化合物含量以及電導率的變化可反映在降溫過程中白屈菜的生理狀況.
野生白屈菜在降溫過程中,與低溫應答相關的主要生理指標的變化趨勢見圖1.其中,細胞內抗寒凍性物質,如脯氨酸、可溶性糖、可溶性蛋白等,在5℃~0℃寒害發生時含量開始升高;在0℃~-5℃時,脯氨酸、可溶性糖、可溶性蛋白含量急劇升高,-5℃時幾乎達到最大值.與此同時,由于脯氨酸、可溶性糖、可溶性蛋白含量增加,細胞內自由水含量降低,細胞的相對電導率顯著降低,在-5℃時達到最低值,即細胞滲透性最低,表明細胞已經完成低溫馴化,獲得了抗凍性.在-5℃~-20℃時,植物代謝水平降低,脯氨酸和可溶性糖含量降低,細胞內溶液濃度降低,相對電導率呈上升趨勢,細胞滲透性增大,提示可能由于細胞內或細胞間隙冰晶形成造成膜損傷,導致電導率升高.在-5℃~-20℃時,細胞中可溶性蛋白含量升高,達到12 mg/g,推測可能是0℃以下低溫誘導產生的抗凍蛋白.
丙二醛是逆境脅迫時植物細胞膜脂被活性氧氧化的產物,其含量高低反映細胞膜脂過氧化以及細胞膜損傷的程度.丙二醛能引起細胞膜功能紊亂,破壞細胞中酶、蛋白質以及核酸等分子結構.白屈菜在25℃~0℃的降溫過程中,丙二醛含量顯著提高,25℃時丙二醛含量是0.002 μmol/g,而0℃時是0.020 μmol/g,是前者的10倍.在-5℃和-15℃時,丙二醛含量分別是0.020 0和0.017 9 μmol/g,表明白屈菜低溫應答過程中細胞膜氧化程度顯著提高.而-20℃時,丙二醛含量顯著下降,推測可能與抗凍蛋白增加有關.
葉綠素含量降低是植物應答低溫的普遍規律.白屈菜在25℃~-20℃的降溫過程中,葉綠素含量呈下降趨勢,反映出光合色素分解、光合作用減弱直至停止的生理狀態.
以正常生長溫度25℃樣本組為對照,對各溫度組野生白屈菜的生理指標進行了差異顯著性分析,結果表明,脯氨酸含量25℃組與其他各溫度組有極顯著差異,25℃組以外的各溫度組間沒有極顯著差異.可溶性糖含量25℃組與0℃,-5℃,和-10℃組間存在極顯著差異;0℃組與-5℃,-10℃組間也存在極顯著差異,說明0℃以下的低溫對可溶性糖的積累影響顯著.可溶性蛋白含量25℃組與-5℃,-10℃,-15℃,-20℃組間均存在極顯著差異.細胞相對電導率5℃組與-5℃,-10℃,-15℃組間存在極顯著差異.丙二醛含量25℃組與0℃,-5℃,-10℃,-15℃組間均有極顯著差異.葉綠素含量25℃組與-20℃組間有極顯著差異.

圖1 低溫應答時野生白屈菜主要生理指標變化趨勢
2.2 白屈菜應答低溫生理反應的實驗驗證
在固定光照強度、光照時間的人工氣候箱中,控制降溫,測定白屈菜在此過程中主要生理指標的變化情況,并與野生白屈菜在降溫過程中生理指標的變化進行比較分析,以確定白屈菜低溫應答過程的生理狀態,結果見圖2.
在15℃~0℃的低溫馴化階段,人工控制栽培的白屈菜抗寒凍性物質脯氨酸、可溶性糖、可溶性蛋白含量開始增加(見圖2(a)—(c)),但增加幅度較小,如可溶性糖增加幅度小于野生白屈菜在這一溫度區間的變化值.在0℃~-5℃時,栽培白屈菜脯氨酸、可溶性糖、可溶性蛋白含量變化趨勢與野生白屈菜相同,-5℃時幾乎均達到最大值,分別是0.721 5,49.043 1,3.648 9 mg/g,但絕對值小于野生白屈菜.-5℃~-10℃時,脯氨酸和可溶性蛋白含量呈下降趨勢,而可溶性糖含量略有升高,在這一區間,脯氨酸的變化趨勢與野生白屈菜相同,可溶性糖和可溶性蛋白的變化趨勢與野生白屈菜相反.
栽培白屈菜相對電導率在25℃~5℃降溫階段變化比較平穩,變化范圍在6.920 8%~3.183%之間(見圖2d),與脯氨酸的變化趨勢相關,反應在這一溫度區間滲透調節物質脯氨酸對相對電導率的影響較大.0℃時,相對電導率升高到8.978 7%,此時脯氨酸雖略有升高但可溶性糖含量較之前顯著下降,表明隨著溫度降低白屈菜的光合作用減弱甚至停止,糖分積累減少,顯著影響細胞質濃度,導致相對電導率升高.-5℃~-10℃階段,處于周期性光照、無保護的葉片受到冷凍損傷,細胞相對電導率急劇升高,達到31.990 9%,此時滲透調節物質脯氨酸和抗凍蛋白含量升高,但可溶性蛋白含量顯著小于無光照條件下的野生白屈菜,提示光照可能影響0℃以下低溫對抗凍蛋白的誘導表達.
在固定的光周期和控制降溫條件下,丙二醛在15℃~-10℃降溫階段含量變化范圍為0.007 708~0.011 692 μmol/g,是正常生長溫度時的1.5~2.0倍,表明細胞膜氧化性提高.控制降溫過程中,盡管維持一定的光照周期,但隨著溫度降低,葉綠素含量呈下降趨勢,這種變化與野生白屈菜相同.
以25℃組樣本做對照,對各溫度組白屈菜的生理指標做差異顯著性分析,結果表明,在完全控制的降溫過程中,脯氨酸含量25℃組與-5℃,-10℃組間存在極顯著差異.可溶性糖含量25℃組與10℃,5℃,-10℃組間存在極顯著差異.可溶性蛋白含量,20℃組與其他溫度組間均存在極顯著差異,而其他各溫度組之間沒有顯著差異.相對電導率-5℃,-10℃組分別與0℃以上(含0℃組)各溫度組間存在極顯著差異.丙二醛含量25℃組與5℃,-10℃組間有極顯著差異.葉綠素含量25℃組與15℃以下(包括15℃組)各組間存在極顯著差異.
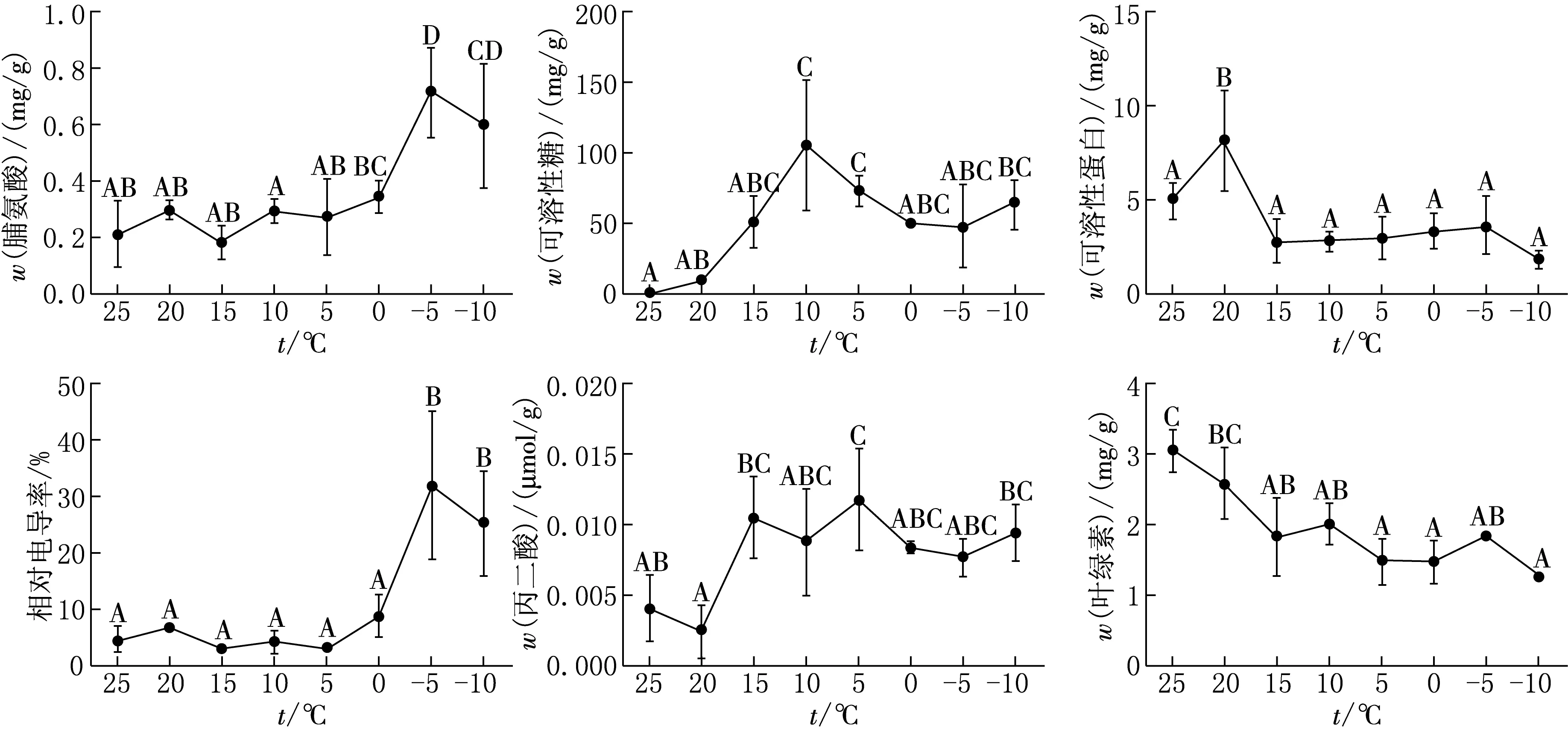
圖2 控制栽培白屈菜應答低溫時主要生理指標變化趨勢
2.3 白屈菜低溫應答分子機制分析
如1.1.3方法所述取樣,每個溫度點設3個生物學重復,進行轉錄組測序,數據經質量分析及篩選、數據庫比對,共獲得長度300 bp以上的基因序列(Unigene,universal gene)113 504個,平均每組有9 586 個Unigene顯示為差異表達基因,包括上調表達基因4 509個、下調表達基因5 077個.與NR、SWISS-PROT、KOG、 KEGG和GO等數據庫進行比對,被注釋的Unigene分別為58 302,41 251,34 296,14 031和36 490個,注釋比例分別為51.37%,36.34%,30.22%,12.36%和32.15%.
與GO數據庫比對后,注釋基因分組如圖3所示(圖3為轉錄組數據分析系統自動生成).Unigene被大量注釋到生物過程類別的“細胞過程”“代謝過程”“生物過程的調控”,細胞組分類別的“細胞組分”“細胞膜組分”及“細胞器組分”,分子功能類別的“催化活性”“分子結合功能”及“轉運活性”.
樣本間差異表達基因分組中“細胞過程”“代謝過程”“生物過程的調控”變化與生理指標脯氨酸、可溶性糖、可溶性蛋白含量變化趨勢相吻合,“細胞組分”變化與凍害發生時可溶性蛋白含量變化趨勢相吻合.“細胞膜組分”中重要生理指標丙二醛也發生顯著性變化.
圖3 GO注釋統計圖
對A(0℃)、B(-10℃)、C(-20℃)3組樣本間差異表達基因進行GO富集分析,結果見圖4(圖4為轉錄組數據分析系統自動生成).由圖4可見,圖4(a)表達差異顯著的前5類基因分別是質外體、細胞壁、質膜、膜的錨定組分、質膜的錨定組分;圖4(b)兩樣本間差異顯著的前5類基因分別是質外體、細胞壁、質膜、胞外基質、胞外區;圖4(c)表達差異顯著的前5類基因分別是葉綠體類囊體膜、葉綠體、類囊體、葉綠體類囊體、葉綠體基粒.
樣本B與樣本A比較(見圖4(a)),主要在膜成分上出現差異,提示膜的滲透性、氧化性發生變化,與生理測定的相對電導率、丙二醛等物質的變化趨勢一致;樣本C與樣本A比較(見圖4(b))可見,細胞外基質和細胞外區域發生顯著變化,與電導率變化趨勢一致,提示植物在凍害脅迫時,可能由于膜損傷細胞內容物滲出導致細胞外部出現變化.樣本C與樣本B比對(見圖4(c))可見,變化全部顯示在葉綠體及類囊體上,提示凍害脅迫時葉綠體受到損傷,與生理實驗中葉綠素的變化趨勢一致.
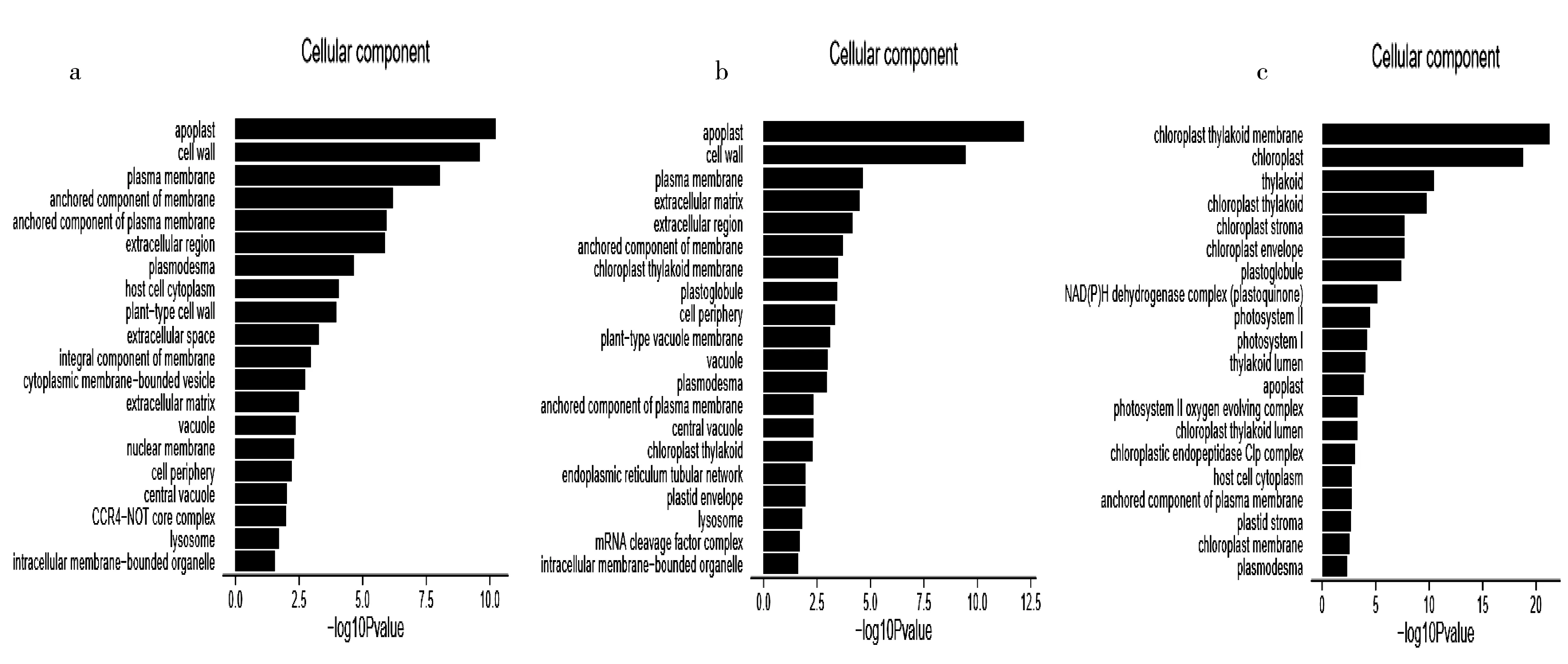
(a)樣本B與樣本A的比對結果;(b)樣本C與樣本A的比對結果;(c)樣本C與樣本B的比對結果
2.4 野生白屈菜低溫應答相關基因的表達驗證
從樣本間差異表達基因中選取7個與脯氨酸合成代謝有關的基因、7個與低溫響應相關的轉錄因子基因進行基因表達量的再次驗證,以檢驗轉錄組測序結果的準確性及生理生化指標變化趨勢的準確性.篩選的目標基因見表1.
基因相對表達量驗證結果如圖5所示.圖5結果顯示,與脯氨酸合成及代謝相關的基因在A(0℃)組樣本中表達量高,在B(-10℃)組樣本中多數表現為下降,在C(-20℃)組樣本中除脯氨酸脫氫酶和鳥氨酸-氧合酸轉氨酶基因外,其他基因表達量相似或較B組降低,表明脯氨酸作為滲透調節物質,主要在低溫脅迫前期發揮作用.轉錄因子CBF4/DREB1d、MYB44、ZAT10等在0℃時表達量較高,在-10℃,-20℃時表達量降低,表明其在低溫脅迫早期起調控作用,而ERF5(ethylene responsive factor 5)、ICE1(inducer ofCBFexpression 1)、WRKY40等在-20℃組表達量顯著上升,表明其在凍害脅迫時作用活躍,可能與抗凍蛋白的合成密切相關.
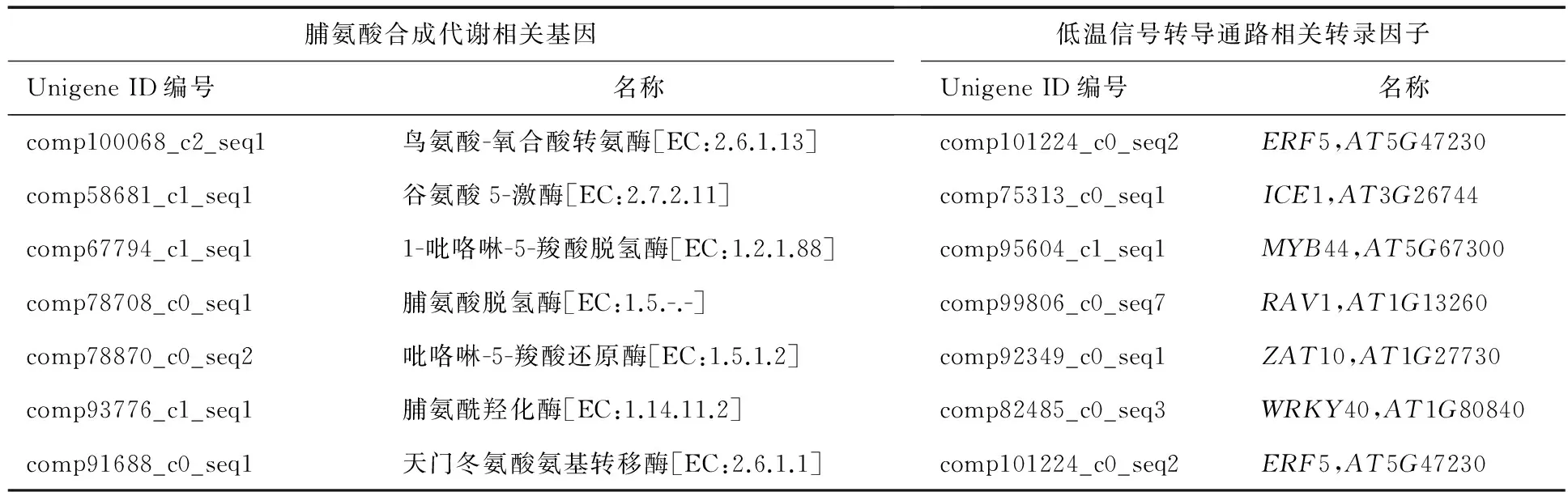
表1 目標基因名稱及基因庫ID編號
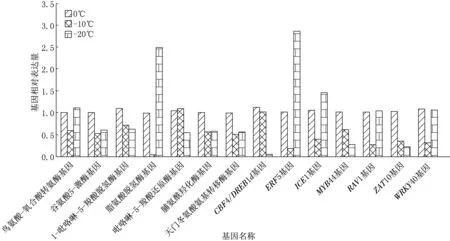
圖5 脯氨酸合成代謝相關基因、低溫應答轉錄因子基因相對表達量驗證
3 討論
植物抗寒性的獲得與溫度、光周期密切相關[22].野生白屈菜在秋冬季來臨時,林下光照時間逐漸縮短,氣溫在5℃~0℃時,光照時間不足12 h;0℃~-10℃時,光照時間為9~10 h;氣溫降至-15℃~-20℃時,光照時間僅8~9 h,或由于積雪覆蓋,植株完全得不到光照,因此,野生白屈菜在低溫和光周期雙重作用下,較早地啟動低溫應答反應,滲透調節物質及抗凍物質等主要生理指標較早發生變化.而在人工控制條件下生長的白屈菜,盡管溫度不斷下降,但光照周期始終保持在12 h光照、12 h黑暗,且光照強度保持1 500 lx不變.恒定的光照周期及光照強度一定程度上延遲了白屈菜對低溫的響應反應,與低溫應答相關的主要生理指標較野生白屈菜變化要晚.我們的實驗結果顯示,野生白屈菜大約在5℃即開始啟動抗寒凍機制,生理指標變化顯著,比控制生長的白屈菜啟動應答溫度要高,在同樣的溫度條件下,脯氨酸、可溶性糖、可溶性蛋白的含量高于人工氣候箱中生長的白屈菜.這一結果也證明,在相同的溫度條件下,光照降低了植物的抗寒性,短日照導致植物抗寒能力增強.對其他植物的相關研究也證明,人為改變短日照為長日照的處理會影響抗凍鍛煉效果,植物抗凍能力下降.-5℃時兩種材料的相對電導率值也證明光照影響植物抗凍性的獲得,造成細胞損傷.
在控制降溫條件下生長的白屈菜丙二醛含量小于野生白屈菜的,說明在光照條件下,低溫馴化效果被部分消除,葉綠體功能得到恢復,活性氧被消除,使膜脂過氧化產物丙二醛含量降低.控制條件下生長的白屈菜葉綠素含量范圍高于野生白屈菜,這也可以證明葉綠體沒有完全損傷,功能依然存在.
基因表達驗證結果表明,7個與脯氨酸合成及代謝有關的基因在低溫脅迫的早期及寒害發生時作用活躍,細胞組分中脯氨酸含量升高,這一變化趨勢與生理指標的測定結果相吻合.在-20℃時,與低溫應答相關的轉錄因子如ERF5、ICE1、WRKY40及RAV1的表達量顯著升高,這些轉錄因子在抗凍蛋白的合成中發揮直接或間接的調控作用,促進抗凍蛋白的誘導合成,這一結果與凍害脅迫時細胞中可溶性蛋白含量升高相吻合.因此,實驗從分子機制上初步闡明了白屈菜抗寒凍性的生理基礎.
本文首次報道了白屈菜的抗寒性和應答低溫脅迫的生理生化基礎,并首次基于白屈菜應答低溫的轉錄組數據,分析、驗證并初步揭示了其低溫應答過程的分子機制,為今后發現并利用有價值的抗寒基因奠定了基礎.
[參考文獻]
[1]COLOMBO M L,BOSISIO E.Pharmacological activities ofChelidoniummajusL.(Papaveraceae)[J].Pharmacological Research,1996,33(2):127-134.
[2]PARK J E,CUONG T D,HUNG T M,et al.Alkaloids fromChelidoniummajusand their inhibitory effects on LPS-induced NO production in RAW264.7 cells[J].Bioorganic & Medicinal Chemistry Letters,2011,21(23):6960-6963.
[3]YANG G,LEE K,LEE M H,et al.Inhibitory effects ofChelidoniummajusextract on atopic dermatitis-like skin lesions in NC/Nga mice[J].Journal of Ethnopharmacology,2011,138(2):398-403.
[4]MENG F,ZUO G,HAO X,et al.Antifungal activity of the benzo phenanthridine alkaloids fromChelidoniummajusLinn against resistant clinical yeast isolates[J].Journal of Ethnopharmacology,2009,125(3):494-496.
[5]CAPISTRANO I R,WOUTERS A,LARDON F,et al.In vitro and in vivo investigations on the antitumour activity ofChelidoniummajus[J].Phytomedicine,2015,22(14):1279-1287.
[6]韋祖巧,鄒翔,曲中原,等.白屈菜化學成分和藥理作用的研究進展[J].中草藥,2009,8(1):38-40.
[7]國家藥典委員會.中華人民共和國藥典.1部[M].北京:中國醫藥科技出版社,2015:109.
[8]徐呈祥.提高植物抗寒性的機理研究進展[J].生態學報,2012,32(24):7966-7980.
[9]彭亞蘭.紅樹植物對低溫脅迫響應的生理生化特征及其分子生態學機制[D].北京:中國科學院大學,2013.
[10]周瑞蓮,趙哈林.春季高寒山區牧草低溫保護物質變化與其脫凍適應間關系研究[J].西北植物學報,2004,10(2):199-204.
[11]王楠,康俊梅,楊青川,等.植物低溫脅迫蛋白質組學研究進展[J].草業科學,2008,25(12):93-98.
[12]SAMI F,YUSUF M,FAIZAN M,et al.Role of sugars under abiotic stress[J].Plant Physiology and Biochemistry,2016,109(2):54-61.
[13]LABUSCHAGNE M T,MOLOI J,VAN BILJON A.Abiotic stress induced changes in protein quality and quantity of two bread wheat cultivars[J].Journal of Cereal Science,2016,69(2):59-63.
[14]SASAKI H,ICHIMURA K,OKADA K,et al.Freezing tolerance and soluble sugar contents affected by water stress during cold-acclimation and de-acclimation in cabbage seedlings[J].Scientia Horticulturae,1998,76(3/4):161-169.
[15]FOLGADO R,SERGEANT K,RENAUT J,et al.Changes in sugar content and proteome of potato in response to cold and dehydration stress and their implications for cryopreservation[J].Journal of Proteomics,2014,98(9):99-111.
[16]郭子武,李憲利,高東升,等.植物低溫脅迫響應的生化與分子生物學機制研究進展[J].中國生態農業學報,2004,12(2):54-57.
[17]陳曉亞,薛紅衛.植物生理與分子生物學[M].北京:高等教育出版社,2012.
[18]賴靜,楊偉,龔榮高,等.低溫脅迫下枇杷幼果種子膜脂過氧化、保護酶活性及顯微結構的變化[J].廣西植物,2015,35(5):663-667.
[19]PEPPINO MARGUTTI M,REYNA M,MERINGER M V,et al.Lipid signalling mediated by PLD/PA modulates proline and H2O2levels in barley seedlings exposed to short-and long-term chilling stress[J].Plant Physiology and Biochemistry,2017,113(1):49-60.
[20]ZHU J K.Abiotic stress signaling and responses in plants[J].Cell,2016,167(2):313-3124.
[21]鄧仁菊,范建新,王永清,等.火龍果幼苗對低溫脅迫的生理響應及其抗寒性綜合評價[J].植物生理學報,2014,10(4):1529-1534.
[22]邸葆,孟昱,張鋼,等.不同光周期和溫度對楸樹電阻抗參數的影響[J].河北農業大學學報,2013,36(5):54-59.

