NRG-1對缺氧復氧心肌細胞凋亡及氧化損傷的影響*
王 軍 范粉靈 張松林 王星燁 薛建穎
(西安交通大學第一附屬醫院結構性心臟病科,西安 710061)
急性心肌梗死是一種嚴重危害人類健康的常見心血管疾病,且近年在我國有增加趨勢。盡早恢復冠脈血流是急性心肌梗死救治的關鍵,目前靜脈溶栓術、冠狀動脈介入治療是急性心肌梗死早期再灌注治療的有效手段[1]。但在心肌缺血后恢復血液流通也會導致心肌出現不可逆的損傷,稱為心肌缺血再灌注損傷[2]。心肌缺血再灌注損傷的發生與氧化應激、鈣超載、心肌細胞凋亡等有關,尋找有效的方法降低心肌缺血再灌注損傷是目前研究的重點[3]。神經調節蛋白1(Neuregulin-1,NRG-1)屬于表皮生長因子,在心臟發育過程中發揮促進作用[4]。NRG-1基因突變的小鼠心臟發育緩慢,并且在胚胎發育的第10天死亡[5]。有研究報道NRG-1在小鼠心力衰竭、心肌肥厚、糖尿病心肌病、心肌缺血再灌注等發病過程中均發揮調控作用[6-8]。本研究以缺氧復氧心肌細胞為研究對象,在體外用NRG-1蛋白處理細胞,探討NRG-1對缺氧復氧心肌細胞凋亡及氧化損傷的作用,以期為治療心肌缺血再灌注損傷提供新思路。
1 材料與方法
1.1材料 人心肌細胞系HCM購自上海博谷生物細胞庫;NRG-1為西安交通大學第一附屬醫院心內實驗室合成并保存;DMEM-F12培養基、胰蛋白酶均為美國Sigma公司產品;胎牛血清為美國Gibco公司產品;黃嘌呤氧化法超氧化物歧化酶(Superoxide dismutase,SOD)活性檢測試劑盒為上海索萊寶生物科技有限公司產品;硫代巴比妥酸比色法丙二醛(Malonaldehyde,MDA)含量檢測試劑盒為北京百奧萊博公司產品;二硝基苯肼顯色法乳酸脫氫酶(Lactate dehydrogenase,LDH)含量試劑盒為上海紀寧實業公司產品;活性氧簇(Reactive oxygen species,ROS)含量檢測試劑盒為上海翊圣公司產品;抗蛋白激酶B(protein kinase B,Akt)多克隆抗體、抗磷酸化Akt(p-AktThr308)多克隆抗體、抗cleaved caspase-3多克隆抗體、辣根過氧化物酶標記的Ⅱ抗均為美國Abcam公司產品。
1.2方法
1.2.1細胞培養 HCM細胞用含有10%胎牛血清的DMEM-F12細胞培養液,于37℃、5%CO2培養箱中培養。細胞融合度達到90%時,倒掉細胞培養液,用0.125%的胰蛋白酶消化細胞后,1 000 r/min離心10 min,用細胞培養液懸浮細胞,接種到細胞培養瓶中繼續培養,根據實驗要求確定接種比例。
1.2.2細胞分組及處理 心肌細胞缺氧復氧模型的構建參照文獻[9]。HCM細胞融合度超過60%時,將細胞培養液更換為不含有胎牛血清的DMEM-F12培養液,放在95%N2、5%CO2培養箱中孵育4 h。將細胞培養液更換為完全細胞培養液(含有胎牛血清),放在95%空氣、5%CO2培養箱中孵育6 h,即為缺氧復氧心肌細胞模型。HCM細胞分為Control組、H/R組、NRG-1組,H/R組、NRG-1組進行缺氧復氧處理,NRG-1組細胞在缺氧處理前加入0.8 mg/L的NRG-1。Control組細胞不做處理。
1.2.3細胞活力檢測 HCM細胞培養至對數期后,細胞接種到96孔細胞培養板中,細胞培養液中含有的細胞個數為1×106個/ml,每孔接種100 μl細胞。分別按照1.2.2中處理Control組、H/R組、NRG-1組的細胞,每組設置5個復孔。缺氧處理后,在每孔中加入噻唑藍(Methylthiazolyldiphenyl-tetrazolium bromide,MTT)溶液20 μl(5 g/L)。在37℃孵育反應4 h。棄上清液,加入100 μl的二甲基亞砜溶液,酶標儀檢測490 nm每孔的吸光度(A)值。
1.2.4細胞凋亡檢測 Control組、H/R組、NRG-1組的細胞按照1.2.2中方法處理后,收集各組細胞,加入磷酸鹽緩沖液(Phosphate buffered saline,PBS),調整細胞濃度為1×105個/ml。混合均勻后,取1 ml的細胞懸浮液,1 000 r/min離心10 min,去除上清,收集細胞,加入碘化丙啶(Propidium iodide,PI)和膜聯蛋白 V-FITC(Annexin V-FITC)各5 μl,充分混合,放在室溫環境下孵育反應15 min。用流式細胞術檢測細胞凋亡情況。
1.2.5LDH水平檢測Control組、H/R組、NRG-1組細胞按照1.2.2中方法處理后,收集各組細胞培養液,按照LDH含量檢測試劑盒檢測培養液上清中LDH水平,步驟參照LDH含量檢測試劑盒(二硝基苯肼顯色法)。
1.2.6ROS、MDA、SOD水平的檢測Control組、H/R組、NRG-1組的細胞按照1.2.2中方法處理后,收集各組細胞,按照ROS含量檢測試劑盒檢測ROS水平,步驟參照ROS含量檢測試劑盒(DCFH-DA法)。同時檢測MDA、SOD水平,步驟分別參照MDA含量檢測試劑盒(硫代巴比妥酸比色法)和SOD含量檢測試劑盒(黃嘌呤氧化法)。
1.2.7Western blot檢測Akt、p-Akt、cleaved caspa-se-3的蛋白水平Control組、H/R組、NRG-1組的細胞按照1.2.2中方法處理后,加入含有苯甲基磺酰氟(Phenylmethylsulfonyl fluoride,PMSF)的裂解液,放在冰上裂解反應30 min。12 000 r/min,4℃離心20 min,吸取蛋白上清液至EP管中。二喹啉甲酸(Bicinchoninic acid,BCA)蛋白定量試劑盒檢測提取的蛋白濃度。將蛋白樣品與2×loading buffer(2∶1)充分混合后,放在100 ℃煮沸5 min。蛋白凝膠上樣孔中每孔加入50 μl的變性蛋白樣品,80 V電壓電泳30 min 后,120 V電壓電泳至結束。蛋白凝膠在4℃,100 V電壓轉印至硝酸纖維素膜上,用5%牛血清白蛋白封閉(37℃孵育90 min)后,依次與抗Akt、p-AktThr308、cleaved caspase-3的Ⅰ抗(800倍稀釋,4℃孵育過夜)、辣根過氧化物酶標記的Ⅱ抗(1 000倍稀釋,37 ℃孵育90 min)結合后,轉移至暗室中,滴加顯色液,顯影,定影后,曝光,分析p-Akt/Akt水平和cleaved caspase-3/GAPDH水平。

2 結果
2.1NRG-1拮抗缺氧復氧對細胞活力的抑制作用 結果見圖1和表1所示,Control組、H/R組、NRG-1組的細胞活力3組間比較差異具有統計學意義(P<0.01),H/R組、NRG-1組細胞的A值均明顯低于Control組,差異具有統計學意義(P<0.01)。NRG-1組細胞的A值明顯高于H/R組,差異具有統計學意義(P<0.05)。
2.2NRG-1抑制缺氧復氧誘導的細胞凋亡 結果見圖2和表2所示,Control組、H/R組、NRG-1組的細胞凋亡率經單因素方差分析,3組間比較差異具有統計學意義(P<0.01),H/R組、NRG-1組的細胞凋亡率均明顯高于Control組,差異具有統計學意義(P<0.01)。NRG-1組的細胞凋亡率明顯低于H/R組,差異具有統計學意義(P<0.01)。Cleaved caspase-3/GAPDH的蛋白水平經單因素方差分析,3組間比較差異具有統計學意義(P<0.01),NRG-1組細胞cleaved caspase-3水平明顯高于Control組,差異具有統計學意義(P<0.01)。NRG-1組細胞的cleaved caspase-3水平明顯低于H/R組,差異具有統計學意義(P<0.01)。
2.3NRG-1降低缺氧復氧后的細胞培養液上清中LDH水平 結果見圖3和表3所示,Control組、H/R組、NRG-1組LDH水平經單因素方差分析,3組間比較差異具有統計學意義(P<0.01),H/R組、NRG-1組的LDH水平均明顯高于Control組,差異具有統計學意義(P<0.01)。NRG-1組LDH水平明顯低于H/R組,差異具有統計學意義(P<0.01)。
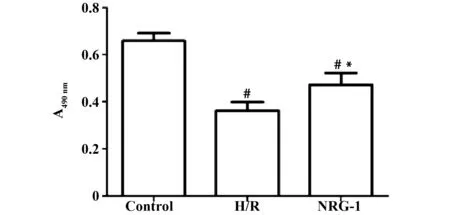
圖1 NRG-1對心肌細胞活力的影響Fig.1 Effect of NRG-1 on viability of myocardial HCM cellsNote: Mean±SD.n=3.#.P<0.01 vs Control group;*.P<0.05 vs H/R group.
2.4NRG-1降低缺氧復氧后細胞中ROS水平 結果如圖4和表4所示,細胞中熒光強度越高,ROS水平越高。Control組、H/R組、NRG-1組熒光強度經單因素方差分析,3組間比較差異具有統計學意義(P<0.01),H/R組、NRG-1組ROS水平均明顯高于Control組,差異具有統計學意義(P<0.01)。NRG-1組ROS水平明顯低于H/R組,差異具有統計學意義(P<0.01)。
2.5NRG-1降低缺氧復氧后細胞中MDA水平,增加細胞中SOD水平 結果見圖5和表5所示,Control組、 H/R組、 NRG-1組的MDA水平和SOD水平經單因素方差分析,3組間差異的比較均具有統計學意義(P<0.01)。H/R組、NRG-1組的MDA水平均明顯高于Control組,而SOD水平均明顯低于Control組,差異具有統計學意義(P<0.05)。NRG-1組的MDA水平明顯低于H/R組,而SOD水平明顯高于H/R組,差異具有統計學意義(P<0.01)。



GroupsSampleCellviabilityControl30.66±0.05H/R30.36±0.031)NRG-130.47±0.041)2)F41.460
Note:1)P<0.01 vs Control;2)P<0.01 vs H/R.

圖2 NRG-1對心肌細胞凋亡的影響Fig.2 Effect of NRG-1 on cardiomyocyte apoptosisNote: A. The images of flow cytometry for analyzing the apoptosis of cardiomyocytes;B.The apoptotic rate was quantitatively analyzed;C.The quantitative analysis of the protein levels of cleaved caspase-3.Mean±SD.n=3.#.P<0.01 vs Control group;*.P<0.01 vs H/R group.
2.6NRG-1增加缺氧復氧后細胞中p-AktThr308/Akt水平 結果見圖6和表6所示,Control組、H/R組、NRG-1組的p-AktThr308/Akt水平經單因素方差分析,3組間比較差異具有統計學意義(F=30.179,P<0.01)。H/R組、NRG-1組的p-AktThr308/Akt水平均組,差異具有統計學意義(P<0.05)。



GroupsnApoptosisrate(%)CleavedCaspase-3/GAPDHControl34.62±0.970.25±0.02H/R329.07±3.431)0.49±0.031)NRG-1319.76±3.411)2)0.35±0.011)2)F56.32393.429
Note:1)P<0.01 vs Control;2)P<0.01 vs H/R.

圖3 NRG-1對LDH水平的影響Fig.3 Effect of NRG-1 on LDH levels in cardiomyocytesNote: Mean±SD.n=3.#.P<0.01 vs Control group;*.P<0.01vs H/R group.



GroupsnLDH(U/L)Control320.63±4.05H/R395.47±6.091)NRG-1344.28±5.041)2)F166.951
Note:1)P<0.01 vs Control;2)P<0.01 vs H/R.
明顯低于Control組,差異具有統計學意義(P<0.01)。NRG-1組的p-Akt/Akt水平明顯高于H/R
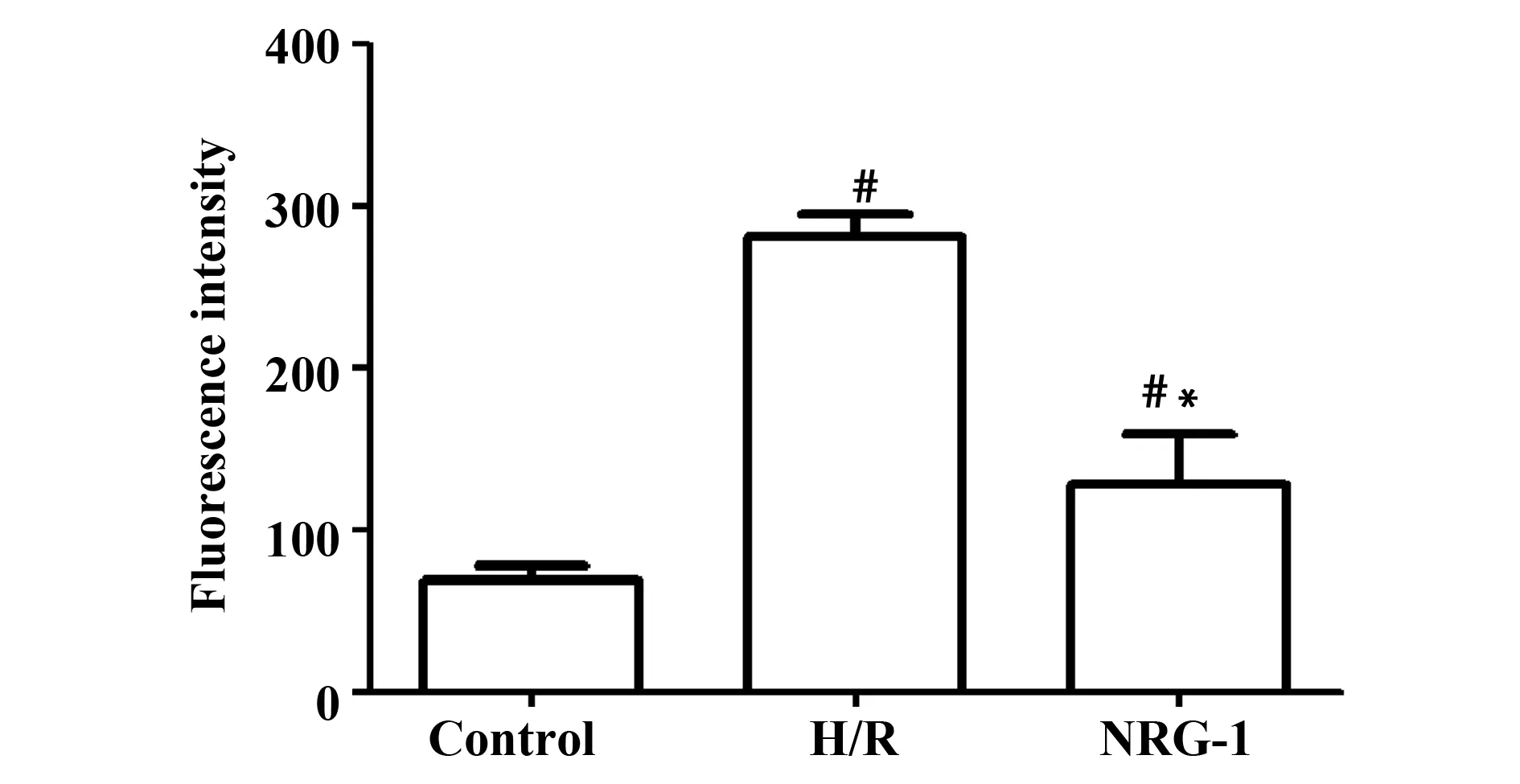
圖4 NRG-1對心肌細胞ROS水平的影響Fig.4 Effect of NRG-1 on ROS levels in cardiomyocytesNote: Mean±SD.n=3.#.P<0.01 vs Control group;*.P<0.01 vs H/R group.


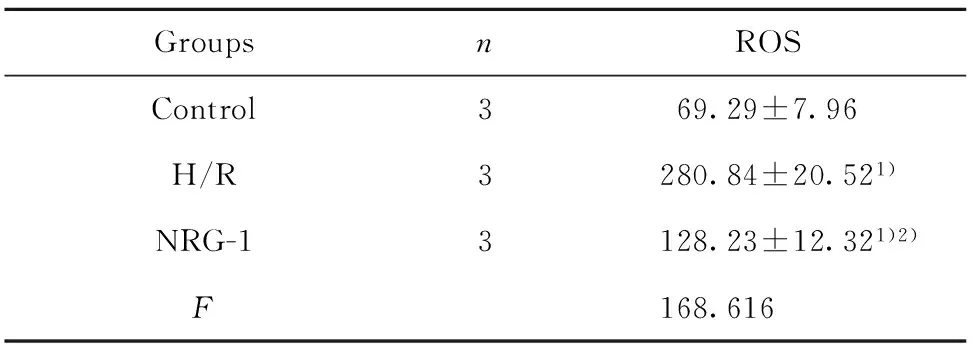
GroupsnROSControl369.29±7.96H/R3280.84±20.521)NRG-13128.23±12.321)2)F168.616
Note:1)P<0.01 vs Control;2)P<0.01 vs H/R.

圖5 NRG-1對心肌細胞MDA、SOD水平的影響Fig.5 Effect of NRG-1 on MDA and SOD levels in cardiomyocytesNote: A.MDA level;B.SOD level.Mean±SD.n=3.#.P<0.01 vs Control group;*.P<0.05 vs H/R group.

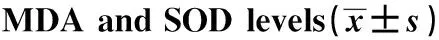

GroupsSampleMDA(nmol/mg)SOD(U/ml)Control30.97±0.08187.85±12.58H/R32.29±0.191)124.39±8.751)NRG-131.47±0.131)2) 160.31±11.011)2)F67.29325.598
Note:1)P<0.01 vs Control;2)P<0.01 vs H/R.



GroupsSamplep-AktThr308/AktControl30.54±0.09H/R30.12±0.021)NRG-130.28±0.071)2)F30.179
Note:1)P<0.01 vs Control;2)P<0.01 vs H/R.

圖6 NRG-1對心肌細胞Akt、p-AktThr308蛋白水平的影響Fig.6 Effect of NRG-1 on protein levels of Akt and p-AktThr308 in cardiomyocytesNote: Mean±SD.n=3.#.P<0.01 vs Control group;*.P<0.05 vs H/R group.
3 討論
研究表明,心肌缺血后恢復血流通不僅不能及時恢復心臟正常功能,而且會加重心肌組織的損傷,引起心肌細胞凋亡,擴大心肌梗死面積[10]。對于心肌缺血再灌注損傷的發病機制研究較多,大致可以總結為:氧自由基生成過多、心肌細胞大量凋亡、鈣超載等,但是其具體的發病機制目前尚不十分清楚[11-15]。NRGs蛋白家族含有4個成員,這4個成員都含有表皮生長因子結構域、免疫球蛋白結構域,能夠特異性地激活酪氨酸激酶受體[16]。NRG-1是目前已經證實的與心臟發育有關的NRGs蛋白家族成員,在胎兒心臟發育過程中由心內膜內皮細胞產生[17]。NRG-1能夠影響心肌細胞生長和存活,調節肌節組織結構發育[18]。Lemmens等[19]的研究表明,在心肌缺血再灌注后,冠狀動脈血管內皮細胞能夠大量產生NRG-1從而減輕心肌缺血再灌注損傷。
心肌缺血再灌注損傷與心肌細胞凋亡發生有關。心肌組織缺血后,細胞內的鈣離子大量聚集,同時缺血再灌注期間細胞內會有ROS大量產生,這會引起細胞膜通透性發生改變,促進細胞凋亡發生[20-24]。LDH是一種存在于細胞漿內的蛋白酶,心肌缺血再灌注發生后,細胞內的脂質過氧化生成MDA,而細胞內脂質過氧化后,細胞膜通透性發生改變,細胞內LDH大量外泄,檢測細胞外LDH水平可以間接反映細胞膜的完整性及細胞氧化損傷程度[25]。SOD是細胞內氧自由基的清除劑,具有維持細胞內氧化平衡狀態的功能[26]。有研究表明,NRG-1重組蛋白可以減少心肌細胞凋亡[27]。本研究結果顯示,心肌細胞缺氧復氧后細胞凋亡率升高,細胞活力下降,而NRG-1處理后心肌細胞凋亡率有所下降,細胞活力部分恢復。這提示,NRG-1能夠抑制缺氧復氧誘導的心肌細胞凋亡。
Akt信號通路在心臟組織中廣泛表達,是NRG-1調控的下游信號通路之一,具有廣泛的生物學功能,與組織生長、疾病發生等有關,棄激活后能夠抑制心肌細胞凋亡的發生,促進心肌細胞生長[28]。有研究表明,Akt信號通路與細胞內線粒體呼吸有關,參與細胞攝取葡萄糖過程,在NRG-1調控心肌細胞凋亡過程中發揮重要作用[29]。之前的研究報道顯示,NRG-1可以通過調控Akt信號通路在體外降低衣霉素和二硫蘇糖醇作用后的心肌細胞內質網應激標志蛋白的表達水平,降低內質網應激,減少心肌細胞損傷,還可以在體內減輕心肌缺血再灌注損傷,降低心臟的內質網應激[30]。本研究結果顯示,心肌細胞缺氧復氧后細胞中p-AktThr308/Akt水平降低,而NRG-1處理后心肌細胞p-AktThr308/Akt水平升高,NRG-1通過影響Akt信號通路抑制缺氧復氧心肌細胞凋亡。本研究結果與之前的報道同時說明了NRG-1在心肌缺血再灌注損傷中具有保護作用,并且NRG-1對心肌缺血再灌注損傷的保護作用可能是多方面的,除了與心肌細胞內質網應激有關,還與心肌細胞凋亡和氧化損傷有關。綜上所述,NRG-1能夠部分逆轉缺氧復氧誘導的心肌細胞凋亡及氧化損傷,升高p-AktThr308/Akt表達水平。本研究為NRG-1治療心肌缺血再灌注損傷提供了理論基礎,為后續探討心肌缺血再灌注損傷的發病機制奠定了基礎。本研究存在一定的局限性,在以后的實驗中會對NRG-1在心肌缺血再灌注損傷心肌細胞凋亡與Akt信號通路的相互作用進行進一步驗證,同時會繼續探討心肌缺血再灌注損傷中NRG-1與其他相關信號通路的關系。
參考文獻:
[1] Sharp WW,Fang YH,Han M,etal.Dynamin-related protein 1 (Drp1)-mediated diastolic dysfunction in myocardial ischemia-reperfusion injury: therapeutic benefits of Drp1 inhibition to reduce mitochondrial fission[J].FASEB J,2014,28(1):316-326.
[2] Fernández-Jiménez R,García-Prieto J,Sánchez-González J,etal.Pathophysiology underlying the bimodal edema phenomenon after myocardial ischemia/reperfusion[J].J Am Coll Cardiol,2015,66(7):816-828.
[3] Hocher B,Sharkovska Y,Mark M,etal.The novel DPP-4 inhibitors linagliptin and BI 14361 reduce infarct size after myocardial ischemia/reperfusion in rats[J].Int J Cardiol,2013,167(1):87-93.
[4] Sun Y,Ikrar T,Davis MF,etal.Neuregulin-1/ErbB4 signaling regulates visual cortical plasticity[J].Neuron,2016,92(1):160-173.
[5] Rentschler S,Zander J,Meyers K,etal.Neuregulin-1 promotes formation of the murine cardiac conduction system[J].Proc Natl Acad Sci USA,2002,99(16): 10464-10469.
[6] Gao R,Zhang J,Cheng L,etal.A Phase II,randomized,double-blind,multicenter,based on standard therapy,placebo-controlled study of the efficacy and safety of recombinant human neuregulin-1 in patients with chronic heart failure[J].J Am Coll Cardiol,2010,55(18):1907-1914.
UV-1800分光光度計,島津;D-3752冷凍離心機(Thermo Fisher Scientific);XMTD-6000型數顯恒溫水浴鍋,余姚金電儀表有限公司;DYY-6D型電泳儀,北京市六一儀器廠;德國IKA A11 basic分析研磨機,上海川翔生物科技有限公司;PCR儀,德國耶拿分析儀器股份公司;Nano Drop 2000微量分光光度計,北京科譽興業科技發展有限公司;凝膠成像儀,上海創萌生物科技有限公司;Light Cycler 480Ⅱ實時熒光定量PCR系統。
[7] Matsukawa R,Hirooka Y,Ito K,etal.Central neuregulin-1/ErbB signaling modulates cardiac function via sympathetic activity in pressure overload-induced heart failure[J].J Hypertens,2014,32(4):817-825.
[8] Zhou F,Xia Z,Liu K,etal.Exogenous neuregulin-1 attenuates STZ-induced diabetic peripheral neuropathic pain in rats[J].Acta Cir Bras,2017,32(1): 28-37.
[9] Boccalini G,Sassoli C,Formigli L,etal.Relaxin protects cardiac muscle cells from hypoxia/reoxygenation injury: involvement of the Notch-1 pathway[J].FASEB J,2015,29(1):239-249.
[11] Savchenko AS,Borissoff JI,Martinod K,etal.VWF-mediated leukocyte recruitment with chromatin decondensation by PAD4 increases myocardial ischemia/reperfusion injury in mice[J].Blood,2014,123(1):141-148.
[12] 李 強,郭壯波,伍光穎,等.阿托伐他汀對急性心肌梗死大鼠內皮微顆粒及心肌細胞凋亡的影響[J].中國病理生理雜志,2015,31(2):359-363.
Li Q,GuO ZB,Wu GY,etal.Effects of atorvastatin on release of endothelial microparticles and myocardial apoptosis in rats with acute myocardial infarction[J].Chin J Pathophysiol,2015,31(2):359-363.
[13] Ling H,Gray CBB,Zambon AC,etal.Ca2+/Calmodulin-dependent protein kinase II δ mediates myocardial ischemia/reperfusion injury through nuclear factor-κBNovelty and significance[J].Circ Res,2013,112(6):935-944.
[14] Yu L,Liang H,Dong X,etal.Reduced silent information regulator 1 signaling exacerbates myocardial ischemia-reperfusion injury in type 2 diabetic rats and the protective effect of melatonin[J].J Pineal Res,2015,59(3):376-390.
[15] Wang JX,Zhang XJ,Li Q,etal.MicroRNA-103/107 regulate programmed necrosis and myocardial ischemia/reperfusion injury through targeting FADD [J].Circ Res,2015,117(4):352-363.
[16] Bartus K,Galino J,James ND,etal.Neuregulin-1 controls an endogenous repair mechanism after spinal cord injury[J].Brain,2016,139(5):1394-1416.
[17] Fukazawa R,Miller TA,Kuramochi Y,etal.Neuregulin-1 protects ventricular myocytes from anthracycline-induced apoptosis via erbB4-dependent activation of PI3-kinase/Akt[J].J Mol Cell Cardiol,2003,35(12):1473-1479.
[18] Mendes-Ferreira P,De Keulenaer GW,Leite-Moreira AF,etal.Therapeutic potential of neuregulin-1 in cardiovascular disease[J].Drug Discov Today,2013,18(17):836-842.
[19] Lemmens K,Segers VFM,Demolder M,etal.Role of neuregulin-1/ErbB2 signaling in endothelium-cardiomyocyte cross-talk[J].J Biol Chem,2006,281(28):19469-19477.
[20] Ma S,Wang Y,Chen Y,etal.The role of the autophagy in myocardial ischemia/reperfusion injury[J].Biochim Biophys Acta,2015,1852(2):271-276.
[21] Wei B,Li WW,Ji J,etal.The cardioprotective effect of sodium tanshinone IIA sulfonate and the optimizing of therapeutic time window in myocardial ischemia/reperfusion injury in rats[J].Atherosclerosis,2014,235(2):318-327.
[22] Song L,Yang H,Wang HX,etal.Inhibition of 12/15 lipoxyg-enase by baicalein reduces myocardial ischemia/reperfusion injury via modulation of multiple signaling pathways[J].Apoptosis,2014,19(4):567-580.
[23] Zhu L,Wei T,Gao J,etal.The cardioprotective effect of salidroside against myocardial ischemia reperfusion injury in rats by inhibiting apoptosis and inflammation[J].Apoptosis,2015,20(11):1433-1443.
[24] Koshinuma S,Miyamae M,Kaneda K,etal.Combination of necroptosis and apoptosis inhibition enhances cardioprotection against myocardial ischemia-reperfusion injury[J].J Anesth,2014,28(2):235-241.
[25] Arslan F,Lai RC,Smeets MB,etal.Mesenchymal stem cell-derived exosomes increase ATP levels,decrease oxidative stress and activate PI3K/Akt pathway to enhance myocardial viability and prevent adverse remodeling after myocardial ischemia/reperfusion injury[J].Stem Cell Res,2013,10(3):301-312.
[26] 程勇軍,壽張飛,王文龍,等.硫辛酸對腹膜透析患者氧化應激,炎癥及營養狀況的影響[J].中國免疫學雜志,2015,31(4): 541-544.
Cheng YJ,Shou ZF,Wang WL,etal.Effect of lipoic acid on oxidative stress,inflammation and nutritional status in peritoneal dialysis patients[J].Chin J Immunol,2015,31(4): 541-544.
[27] Liu X,Gu X,Li Z,etal.Neuregulin-1/erbB-activation improves cardiac function and survival in models of ischemic,dilated,and viral cardiomyopathy[J].J Am Coll Cardiol,2006,48(7):1438-1447.
[28] 陳立強,徐振宇,韓搖曦,等.生長激素釋放肽6 對心衰模型大鼠心肌細胞PI3K/Akt/Caspase-9信號通路蛋白表達的影響[J].中國老年學雜志,2015,35(21):6005-6007.
Chen LQ,Xu ZY,Han X,etal.The effects of GHRP-6 on PI3K/Akt/Caspase-9 signaling pathway in myocardial cells of heart failure rats[J].Chin J Gerontol,2015,35(21):6005-6007.
[29] Timolati F,Ott D,Pentassuglia L,etal.Neuregulin-1 beta attenuates doxorubicin-induced alterations of excitation-contraction coupling and reduces oxidative stress in adult rat cardiomyocytes[J].J Mol Cell Cardiol,2006,41(5): 845-854.
[30] Fang SJ,Li PY,Wang CM,etal.Inhibition of endoplasmic reticulum stress by neuregulin-1 protects against myocardial ischemia/reperfusion injury[J].Peptides,2017,88(2): 196-207.