肺巖寧方通過RANK-RANKL途徑調節肺癌骨轉移中破骨細胞活化機制的研究*
張程程,季 青,楊 越,欽敬茹,謝 瑜,王中奇△
1.上海中醫藥大學附屬龍華醫院(上海 200032),2.上海中醫藥大學附屬曙光醫院(上海 201203)
肺癌是最常見的惡性腫瘤,發病率呈逐年上升趨勢[1],骨轉移是肺癌常見的轉移部位,約30%~40%的進展期肺癌出現骨轉移[2],其發生發展與溶骨性骨質破壞有關。中醫認為,肺腎兩虛,絡脈痹阻是肺癌骨轉移的主要病機[3]。益氣養精,通絡解毒的肺巖寧方在臨床抗骨轉移治療中取得了較好療效[4],其作用機制可能與RANK/RANKL途徑有關。本文采用人肺腺癌A549細胞懸液骨髓腔注射建立肺癌骨轉移模型,檢測肺巖寧方干預治療對肺癌骨轉移過程中骨破壞情況及骨組織TRAP陽性細胞的表達情況,探討肺癌骨轉移過程中RANK/RANKL途徑與溶骨性骨質破壞的關系。
材料與方法
1 動物和瘤株 BALB/c裸鼠40只,雌性,6周齡,體重(20±2) g,SPF級,購于上海斯萊克實驗動物有限責任公司,動物許可證號為:SYXK(滬) 2014-0008。飼養于上海中醫藥大學動物房,室溫(25±2)℃,自由攝食和飲水;人肺腺癌A549細胞株,購自中科院上海細胞庫。
2 實驗藥物 肺巖寧方組成:生黃芪、仙靈脾、黃精、靈芝各30 g,女貞子、七葉一枝花、山萸肉各15 g,白術、蜂房、干蟾皮各9 g,以上藥物均由龍華醫院中藥房提供。水煎濃縮至生藥含量為2.0 g/ml,4℃保存備用;唑來膦酸注射液:4 mg/支,國藥準字H20041346,正大天晴藥業。
3 試劑及耗材 雙抗、胎牛血清,美國GIBCO公司;RPMI-1640培養基,美國Hyclone公司;戊巴比妥鈉,美國Sigma公司;TRAP染色液,南京森貝伽生物科技有限公司;蘇木素染液、中性樹膠,南京建成有限公司;二甲苯、切片石蠟,4%多聚甲醛,國藥集團化學試劑有限公司; Leica一次性刀片,德國Leica公司。
4 實驗儀器 CO2培養箱,臺式低速離心機,美國Thermo 公司;熒光倒置顯微鏡,日本OLMYPUS 公司;垂直流超凈工作臺,新加坡ESCO公司;高通量組織研磨儀,上海必橫生物有限公司;石蠟切片機,湖北徠克醫療儀器有限公司;攤片烤片機、石蠟包埋機,金華市益迪醫療器械有限公司;微量X射線斷層掃描儀(Micro-CT),上海鈺森生物技術有限公司。
5 實驗方法
5.1 A549細胞株培養:人肺腺癌A549細胞株,將其培養于含10%胎牛血清及青霉素、鏈霉素各100 μg/ml的RPMI-1640培養基中,37 ℃、5%CO2飽和濕度環境條件下連續培養,按1∶3比例傳代培養。取對數生長期的A549細胞,經消化并計數細胞數目后,用無血清1640培養液調整細胞濃度至1×108個/ml。
5.2 肺癌骨轉移動物模型構建:參照趙凌燕等[5]造模方法,腹腔注射濃度為1%的戊巴比妥鈉(60 mg/kg)麻醉小鼠后,將小鼠右腿膝關節彎曲成90度角,手術刀片切開右側脛骨上部的皮膚和肌肉,行膝內側縱切口約4 mm,顯露脛骨上端;于脛骨結節內上方用26G針頭穿刺,延脛骨髓腔縱軸進針約3~4 mm,遇到阻力后即停止進針,改用依次吸有2 μl明膠海綿、1 μl空氣和10 μl上述1×108個/ml濃度腫瘤細胞懸液的25 μl微量注射器注入脛骨骨髓腔內并縫合皮膚,上述過程于1 h內完成。
5.3 動物分組及給藥:小鼠按體重分層隨機分成模型組,唑來膦酸組,肺巖寧組,每組10只。空白組10只,不予造模,其余各組均以前述造模方法予以造模。造模當天開始給藥,給藥劑量按人鼠體表面積折算法計算[6]。空白組及模型組給予生理鹽水灌胃(15 ml/kg),1次/d,連續灌胃28 d;唑來膦酸組于造模后每5日1次尾靜脈注射濃度為0.1 g/ml的唑來膦酸(0.6 mg/kg),共5次;肺巖寧組予濃度為2 g/ml的肺巖寧方灌胃(15 ml/kg),1次/d,連續灌胃28 d。
6 觀察指標和檢測方法
6.1 小鼠體重和生存狀態:造模及用藥前后,每7 d觀察記錄小鼠體重及生存狀態。
6.2 小鼠骨組織Mirco-CT表現:治療結束后,分別取各組小鼠右側脛骨及少許軟組織,用4%多聚甲醛液固定,采用Mirco-CT骨骼二維平面掃描及三維重建,對掃描好的樣品中局部骨密度(BMD)、骨小梁厚度(Tb.Th)、骨體積分數(BV/TV)、骨表面體積比(BS/BV)等數據進行分析。
6.3 蘇木素-伊紅(Hematoxylin and eosin,HE)染色:治療結束后,取各組小鼠右側脛骨及少許軟組織,先用4%多聚甲醛液固定48 h后,清水浸泡,流水洗凈,在4 ℃條件下浸入10%EDTA脫鈣液中脫鈣2周,常規石蠟包埋,取包埋后的小鼠右脛骨組織,進行H&E染色,顯微鏡下選取合適視野,觀察骨組織形態。
6.4 抗酒石酸的酸性磷酸酶(Tartrate-resistant acid phosphatase,TRAP)染色:治療結束后,取經固定、清洗、脫鈣、常規石蠟包埋后的小鼠右脛骨組織,進行TRAP染色,計算TRAP(+)細胞數及體積,觀察和鑒定生成的破骨細胞。
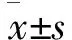
結 果
1 肺巖寧方對小鼠體重及生存狀態的影響 造模后,與空白組小鼠相比,其余各組小鼠體重均有不同程度的降低,模型組下降較為明顯(P<0.05),唑來膦酸組、肺巖寧組體重下降程度明顯減輕,但唑來膦酸組、肺巖寧組小鼠體重差異無統計學意義(P>0.05),見圖1;第2周時,除空白組外各組小鼠均出現活動度下降;第3周時,唑來膦酸組、肺巖寧組小鼠活動度較前下降明顯,但仍高于模型組;第4周時,模型組小鼠出現明顯跛行及惡病質,而唑來膦酸組、肺巖寧組小鼠僅見輕微跛行。
2 各組小鼠脛骨Mirco-CT掃描平面表現 模型組存在明顯的骨質破壞,骨皮質模糊、變薄,在脛骨平臺尤為明顯,部分骨小梁消失,呈蟲蝕樣表現,與臨床上肺癌骨轉移的表現是一致的;唑來膦酸組可見骨皮質輕度破壞,脛骨上端穿鑿狀小斑點破壞區,骨小梁厚度減少,平臺輕微破壞塌陷;肺巖寧組骨破壞程度明顯減輕,原有骨組織結構基本保持,僅在局部有少量的骨質破壞,見圖2。
3 各組小鼠脛骨Mirco-CT掃描3D重建表現 空白組小鼠骨密度正常,骨小梁走向一致,粗細均勻,形狀規則,排列密集,有一定的厚度;模型組小鼠的骨質特征為骨密度降低,骨量丟失,骨小梁結構發生了改變,骨強度下降,表現為骨質疏松樣改變;唑來膦酸組及肺巖寧組較模型組相比,骨密度增高,骨小梁間距變小,網狀結構保留,排列相對規則,見圖3。
圖1 肺巖寧對各組小鼠體重的影響 圖2 小鼠右側脛骨Micro-CT平面結果

圖3 小鼠脛骨端Micro-CT 3D重建圖像
4 各組小鼠脛骨Mirco-CT掃描數據分析 與空白組相比,模型組小鼠骨密度(BMD)、骨小梁厚度(Tb.Th)、骨體積分數(BV/TV)均降低,骨表面體積比(BS/BV)增高,差異有統計學意義(P<0.01);與模型組相比,唑來膦酸組及肺巖寧組小鼠骨密度、骨小梁厚度、骨體積分數升高(P<0.05),骨表面體積比下降(P<0.01),但唑來膦酸組與肺巖寧組小鼠比較差異無統計學意義(P>0.05),見圖4。
5 各組小鼠骨組織HE染色結果 與空白組相比,模型組小鼠有明顯的骨腫瘤灶,腫瘤細胞密集,在腫瘤組織與骨組織交界面的位置可見多個“梭形”多核細胞,細胞體積巨大,胞漿顏色相對較深,多個藍染的胞核分布于胞漿內;唑來膦酸組、肺巖寧組小鼠骨組織腫瘤細胞密度明顯降低,見圖5。
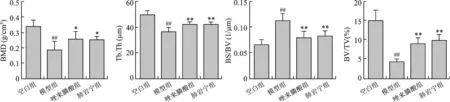
注:與空白組比較,# P<0.05;## P<0.01;與模型組比較,* P<0.05;** P<0.01
6 各組小鼠骨組織TRAP染色結果 模型組TRAP(+)細胞數及體積顯著高于空白組,且生成體積巨大的多核破骨細胞(TRAP陽性多核細胞為破骨細胞);唑來膦酸組及肺巖寧組TRAP(+)細胞數及體積顯著低于模型組,且未見多核破骨細胞形成,見圖6。
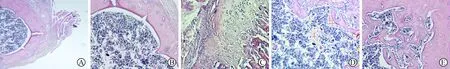
注:A為空白組;B為模型組;C為唑來膦酸組;D、E為肺巖寧組

注:A為空白組;B為模型組;C為唑來膦酸組;D、E為肺巖寧組
討 論
肺癌骨轉移是目前臨床治療的難點之一,骨轉移的類型包括溶骨性、成骨性和混合性骨轉移,大多數表現為溶骨性骨轉移[7]。80%骨轉移患者以骨質破壞引起的疼痛為首發癥狀[8]。腫瘤細胞實現局部骨吸收,是通過刺激破骨細胞活化實現的[9]。在溶骨性骨破壞過程中,NF-κB受體激活劑(RANK)/RANK配體(RANKL)的調節起主要作用,RANKL綁定其特異性受體RANK之后可以促進破骨細胞前體成熟,形成破骨細胞,發揮骨質溶解作用[10]。分化成熟的破骨細胞形態上表現為多核聚集,并且分泌TRAP。因此破骨細胞的成熟由骨微環境中的RANK和RANKL調節,決定著局部骨溶解的平衡,RANKL過多可增加骨吸收,RANKL減少則抑制骨吸收。
中醫藥在治療肺癌骨轉移方面有一定的作用,中醫學認為肺癌骨轉移的發生是多種因素作用的結果,內因臟腑虧損,腎氣不足,筋骨失養,脈絡不暢,外因癌毒聚結、痰凝瘀阻筋骨,腐蝕骨骼,聚結成瘤。因此治療應補腎養精,解毒散結通絡[11]。肺巖寧方為來源于臨床的經驗方藥,以補腎抗癌為基本原則,有研究表明補腎抗癌的中藥能夠抑制骨轉移灶生長,緩解患者骨性疼痛,改善患者骨轉移相關癥狀[12];基礎研究也顯示肺巖寧方具有減少腫瘤微環境血管新生,抑制肺癌侵襲轉移的作用[13]。
本實驗研究也提示肺巖寧方對改善肺癌骨轉移小鼠體重及生存狀態有一定作用,本研究通過骨組織HE染色和micro-CT攝片分析,檢測各組小鼠骨質破壞程度,發現模型組腫瘤細胞活性強,骨組織破壞嚴重;而唑來膦酸組、肺巖寧組腫瘤細胞活性較低,骨組織破壞程度亦相應較輕。且唑來膦酸組和肺巖寧組骨組織破壞程度基本一致,提示唑來膦酸與肺巖寧方均有抗肺癌骨轉移及減輕骨質破壞作用,其作用機制可能是通過抑制腫瘤細胞增殖,從而抑制溶骨性骨吸收實現的。
此外,骨組織TRAP染色發現,唑來膦酸組、肺巖寧組小鼠骨腫瘤的TRAP(+)細胞數均顯著降低,與模型組比較差異均有統計學意義,TRAP染色提示中藥復方肺巖寧方有抑制RANKL表達,減少TRAP分泌的作用,通過由骨微環境中的RANKL調節破骨細胞的成熟,促進局部骨溶解的平衡。
綜上所述,RANK-RANKL途徑是肺癌骨轉移過程中介導溶骨性骨質破壞的重要環節。因此,我們推論,肺巖寧方可能通過調控RANK/RANKL信號的表達抑制肺癌骨轉移的發生發展,進一步研究肺巖寧與抑制破骨細胞生成及溶骨性骨破壞的關系,有望為臨床防治肺癌骨轉移提供新的治療思路及靶點。
[1] Chen WQ,Zheng RS,Zeng HM,etal. Annual report on status of cancer in China[J]. Chin J Cancer Res,2015,27(1):2-12.
[2] McErlean A, Ginsberg M S. Epidemiology of lung cancer[J].Semin Roentgenol,2011,46(3):173-177.
[3] 鄭 展.徐振曄治療肺癌骨轉移經驗[J].中醫雜志,2007,48(1):24-25.
[4] 徐振曄,金長娟,沈德義,等.中醫藥分階段結合化療治療晚期非小細胞肺癌的臨床研究[J].中國中西醫結合雜志,2007,27(10):874-878.
[5] 趙凌艷,徐祖紅,李 煒,等.補腎散結方對肺癌骨轉移小鼠PTHrP及TGF-β1表達的影響[J].上海中醫藥大學學報,2015,29(4):38-42.
[6] 陳 奇.中藥藥理研究方法學[M].北京:人民衛生出版社,1994:33-34.
[7] Kosteva J,Langer C. The changing landscape of the medical management of skel et al metastases in nonsmall cell lung cancer[J]. Curr Opin Oncol. 2008,20(2):155-161.
[8] Chiara D’A,Antonio P B. Bone and brain metastasis in lung cancer:recent advances in therapeutic strategies[J]. Ther Adv Med Oncol,2014,6(3) :101-114.
[9] Lewis M,Hendrickson A,Moynihan T. Oncologic emergencies:pathophysiology,presentation,diagnosis,and treatment[J]. CA Cancer J Clin,2011,61:287-314.
[10] Chen YC,Sosnoski DM,Mastro AM. Breast cancer metastasis to the bone:mechanisms of bone loss[J]. Breast Cancer Res,2011,(12):215.
[11] 王中奇,徐振曄. 肺癌從腎論治[J]. 四川中醫, 2011, 29(6):28-30.
[12] 張 煒,趙凌艷,徐祖紅,等.補腎散結方聯合唑來膦酸治療肺癌骨轉移的臨床療效[J]. 世界中西醫結合雜志.2015; 10(6):791-794.
[13] 王中奇,鄧海濱,吳 繼,等.肺巖寧方組分對小鼠腫瘤血管生成與MMP-2、MMP-9關系研究[J]. 中國中西醫結合雜志. 2011,31(9):1229-1233.

